За последние три десятилетия моноклональные антитела (MAТ) совершили поразительное превращение из научных инструментов в мощные терапевтические средства, широко применяемые в клинической практике [1].
Моноклональные антитела вырабатываются клональной клеточной линией, то есть потомками одной-единственной клетки. Это отличает их от поликлональных антител, встречающихся в живых организмах, которые синтезируются разными клонами B-клеток. Моноклональные антитела обладают постоянной аминокислотной последовательностью. Большинство моноклональных антител получены методами генной инженерии, поэтому при их «проектировании» возможно изменять аффинность, которая характеризует силу связывания с антигеном, их специфичность — способность связываться с необходимой мишенью с достаточной силой, а также селективность антител — способность связываться только с определенной мишенью, а не со всеми антигенами. Кроме того, если клетку-продуцент генетически модифицировать, например, повлиять на посттрансляционные модификации (реакции ацетилирования, гликозилирования и другие), то можно снизить иммуногенность получаемых антител и предотвратить синтез «антител к антителам». Возможно и изменение активности антител: они могут просто «пометить» объект, с которым связались (клетку, бактерию, вирус или белок), для последующего фагоцитоза, запускать работу системы комплемента для уничтожения помеченной клетки или просто блокировать взаимодействие с тем или иным рецептором или с растворенным белком.
Современные методы биотехнологии позволяют получать моноклональные антитела для диагностики, научных исследований и терапевтического применения в промышленных масштабах. Для терапевтического применения моноклональных антител давно накоплена достаточная методологическая и доказательная база [2].
МАТ — важный инструмент для исследований в области молекулярной иммунологии [3], а также ключевой компонент во многих клинико-лабораторных диагностических тестах [4]. Кроме того, МАТ применяются для терапии и профилактики онкологических, аутоиммунных и инфекционных заболеваний различного генеза. Их широкое применение в значительной степени обусловлено исключительной специфичностью этих уникальных белков.
Терапия вирусных заболеваний с помощью МАТ основана на способности антител связываться с белками на поверхности вирусной частицы. За счет этого МАТ либо инактивируют вирусную частицу, что препятствует связыванию белков на поверхности вируса с рецепторами на поверхности клеток, либо «помечают» ее для захвата клетками макрофагальной системы. Если вирусные белки оказываются «заякоренными» на внешней стороне мембраны инфицированных клеток, то работает альтернативный механизм противовирусного действия моноклональных антител — активация системы комплемента запускает сборку мембраноатакующего комплекса, который приводит к последующему лизису инфицированной клетки [5, 6].
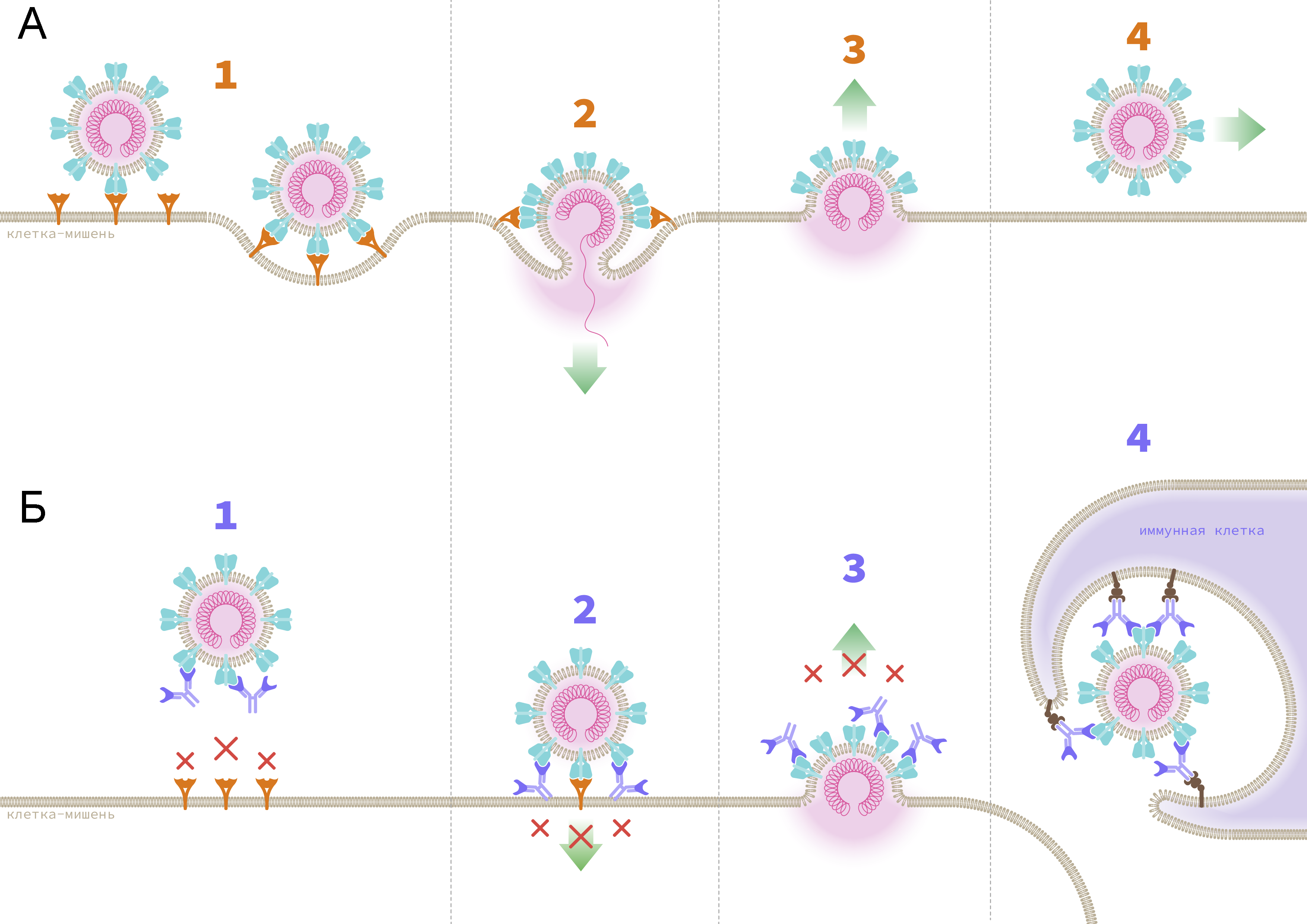
Рисунок 1 | Механизмы репликации коронавируса и взаимодействия с антителамиА. Репликация оболочечных вирусов на примере SARS-CoV-2:
1 — вирус взаимодействует с клетками-мишенями при помощи S-белка, который связывается с рецепторами ангиотензин-превращающего фермента 2 (АПФ2) на поверхности клетки; 2 — слияние мембраны клетки-мишени и вирусной мембраны. Генетический материал вируса проникает в клетку, запускается процесс репликации и сборки новых вирусных частиц; 3 — новые вирусные частицы покидают клетку, захватывая часть клеточной мембраны, которая становится вирусной оболочкой; 4 — полноценные новые вирусы распространяются по организму и инфицируют новые клетки, а процесс запускается заново.
Б. Противовирусная активность антител:
1 — антитела блокируют вирусные белки и мешают им связаться с клеточными рецепторами; 2 — в случае успешного связывания вируса с антителом возникает препятствие к слиянию мембран; 3 — антитела блокируют выход вирусных частиц из зараженной клетки; 4 — антитела «помечают» вирусные частицы для последующего захвата и уничтожения иммунными клетками.
Пандемия коронавирусной инфекции 2019 года, вызванная новым коронавирусом SARS-CoV-2, стала серьезной проблемой во всем мире. Врачи и ученые всего мира столкнулись с беспрецедентным вызовом: в кратчайшие сроки им нужно было разработать стратегию и методологию борьбы с COVID-19 и лекарственные препараты для лечения этой новой, быстро распространяющейся инфекции. В таких условиях были предложены и апробированы такие стратегии лечения и профилактики, как вакцинопрофилактика, симптоматическая поддерживающая терапия, новые методы оксигенации крови, терапия малыми молекулами и биологическая терапия [6, 7, 8]. В качестве примера последнего подхода можно привести использование реконвалесцентной плазмы [9].
Реконвалесцентную плазму или гипериммунные иммуноглобулины получают от доноров, переболевших COVID-19. В исследованиях было продемонстрировано, что она применялась в качестве крайней меры для повышения выживаемости пациентов с COVID-19, состояние которых продолжало ухудшаться, несмотря на лечение метилпреднизолоном [4]. Одним из возможных объяснений эффективности терапии реконвалесцентной плазмой является то, что антитела реконвалесцентной плазмы могут подавлять виремию. Использование реконвалесцентной плазмы не ново: в начале 2000-х годов она применялась при пандемии тяжелого острого респираторного синдрома (Severe acute respiratory syndrome, SARS), также известного как «атипичная пневмония», которая тоже была вызвана коронавирусом SARS-CoV, пандемическом гриппе А (H1N1) 2009 года, птичьем гриппе А (H5N1), различных геморрагических лихорадках, таких как лихорадка Эбола, и других вирусных инфекциях [9]. Однако один из серьезных недостатков применения реконвалесцентной плазмы в качестве терапевтического средства — невозможность выявить все потенциально имеющиеся у донора инфекционные заболевания, в особенности протекающие бессимптомно или не входящие в стандартный перечень скрининговых анализов при отборе доноров. Данный фактор делает такой терапевтический подход крайне рискованным. Кроме того, если упоминать соотношение пользы и риска, то при использовании реконвалесцентной плазмы, в отличие от моноклональных антител, невозможна какая-либо стандартизация: антитела, находящиеся в плазме, полученной от разных доноров, будут иметь разную силу связывания с антигеном, или аффинность. Эти факторы делают реконвалесцентную плазму биологическим терапевтическим средством с чрезвычайно высокой batch-to-batch вариабельностью. Этот термин означает невозможность обеспечить постоянство состава и эффективности всех серий заготовленного препарата на протяжении времени [6]. По этим причинам реконвалесцентная плазма проигрывает моноклональным антителам, которые с одной стороны, являются высокоспецифичными, а с другой — стандартизованными при их производстве и обладающими высоким постоянством профилей эффективности и безопасности.
Интересно, что первые опыты по терапии COVID-19 моноклональными антителами были связаны с блокированием фактора роста эндотелия сосудов (Vascular endothelial growth factor, VEGF). VEGF играет важную роль в развитии острого респираторного дистресс-синдрома, и его блокирование такими препаратами, как бевацизумаб, который хорошо известен в офтальмологической и онкологической практике, способствовало улучшению прогноза пациентов с тяжелым течением заболевания [10, 11]. Другими примерами применения моноклональных антител из онкологической практики для лечения COVID-19 являются препараты, связанные с системой иммунных контрольных точек (PD-1), такие как ниволумаб или камрелизумаб [12]. Однако эти препараты не были специфичными по отношению к SARS-CoV-2, и поэтому исследователи со всего мира направили свои усилия на разработку лекарственных средств, нацеленных непосредственно на сам вирус.
Разработка моноклональных антител против SARS-CoV-2 началась в 2020 году, в самый разгар пандемии, охватившей весь мир. Экстраординарность ситуации позволила проводить разработку и регистрацию лекарственных средств в кратчайшие сроки: в частности, в США выдавалось EUA, emergency use authorization — разрешение на применение в случае чрезвычайных ситуаций. К середине 2022 года было разработано, исследовано и выпущено в клиническую практику множество моноклональных нейтрализующих антител, связывающихся с шиповидным S-белком коронавируса, таких как сотровимаб, бамланивимаб и этесевимаб, касиривимаб и имдевимаб и др. [5, 6, 7].
Моноклональные антитела характеризуются длительной циркуляцией в кровотоке вследствие уникальных аминокислотных модификаций, а также позволяют получить потенциальную долговременную иммунную защиту сразу после введения. Помимо этого, их эффект не зависит от иммунного статуса и наличия каких-либо сопутствующих заболеваний у пациента, вследствие чего они могут быть хорошим методом дополнительной защиты для групп риска тяжелого течения COVID-19, например, для пациентов с иммунодефицитными состояниями [5].
В недавнем японском исследовании было подтверждено, что применение терапии моноклональными антителами с использованием системы оценки риска значительно сократило количество госпитализаций и тяжесть заболевания COVID-19 без каких-либо серьезных побочных эффектов и позволило избежать перегрузки всей региональной системы здравоохранения [13]. Было показано, что моноклональные антитела против SARS-CoV-2, которые нацелены на S-белок, имеют клинические преимущества при лечении инфекции SARS-CoV-2: в качестве примера можно привести комбинированный биологический лекарственный препарат, содержащий два моноклональных антитела — тиксагевимаб и цилгавимаб. Это было продемонстрировано в ходе исследования TACKLE, результаты которого были опубликованы в журнале The Lancet Respiratory Medicine [14]. Исследование проводилось на базе 95 медицинских центров по всему миру. В ходе исследования была доказана эффективность однократного внутримышечного введения комбинации тиксагевимаба-цилгавимаба в дозе 600 мг для лечения COVID-19 у непривитых взрослых с легким и среднетяжелым течением заболевания в амбулаторных условиях. До 90% добровольцев, принявших участие в исследовании, входили в группу с высоким риском прогрессирования COVID-19 в тяжелую форму в связи с коморбидными состояниями или возрастом. Препарат формировал статистически и клинически значимую защиту от развития тяжелой формы COVID-19 или летального исхода по сравнению с группой плацебо невакцинированных лиц. Частота нежелательных явлений была сопоставимой в группах исследования и плацебо, причем большинство из них были легкой или средней степеней тяжести. Хотя общая летальность была одинаковой в обеих группах, оказалось, что в терапевтической группе было меньше случаев смерти от COVID-19, чем в группе плацебо.
В настоящее время препарат одобрен в России для доконтактной профилактики и лечения COVID-19 легкой и средней степени тяжести у взрослых пациентов [15]. Кроме того, препарат вошел во Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)», утвержденные Минздравом России [16].
Выводы
Несмотря на значительные успехи в профилактике и терапии COVID-19, которые привели к снижению заболеваемости по всему миру, эта глобальная угроза все еще остается актуальной. В настоящее время в мире зарегистрировано более 600 млн случаев COVID-19 [17]. Однако новые методы лечения, а самое главное — профилактики помогут снизить опасность, исходящую от данного вируса. По всей видимости, нам еще в течение нескольких лет стоит ожидать периодических циклов подъема и спада заболеваемости COVID-19, но вызывающий данное заболевание вирус уже не будет настолько опасным, каким он был на момент своего появления [18, 19]. В том числе потому, что исследователи и клиницисты по всему миру уже накопили достаточный опыт и знания о данном вирусе, а значит, обладают богатым арсеналом для борьбы с ним.