Кальций — это важный элемент, который выполняет множество биологических функций в организме, в том числе обеспечивает минерализацию скелета [1]. Он является основным компонентом костей и отвечает за прочность и структуру скелета. Кость, кроме основной функции, также представляет собой метаболический резервуар, благодаря которому поддерживается внутриклеточный и внеклеточный системные пулы кальция. В частности, как в остеобластах, так и в остеокластах кальциевый сигналинг выступает в качестве регулятора клеточной дифференцировки и активности.
Наиболее заметной метаболической функцией кости является хранение минеральных элементов, в частности кальция и фосфата (99 % кальция в организме сосредоточено в скелете [1]). ~70 % состава кости — это минеральные вещества, а 30 % — органические. Среди минеральных веществ около 95 % составляют гидроксиапатит (высокоорганизованный кристалл кальция и фосфата), а также другие ионы (натрий, магний, фторид и стронций). Напротив, органическая составляющая (также называемая остеоидом) на 98 % состоит из коллагеновых волокон, а также из наиболее широко представленных неколлагеновых элементов костного матрикса, гликопротеинов и протеогликанов [1].
Минерализация скелета
Минерализация скелета — это хорошо регулируемый биологический процесс, который происходит в два этапа. Первый быстрый этап, называемый первичной минерализацией, заключается в отложении аморфных солей кальция и фосфата. В ходе второго медленного этапа, называемого вторичной минерализацией, формируется ~50 % конечного минерального состава костного матрикса, а сутью процесса является прогрессирующее созревание минералов, конечной формой которых является гидроксиапатит [2]. Хотя точный механизм минерализации костей изучен еще не полностью, было высказано предположение, что процесс инициируют везикулы матрикса — небольшие внеклеточные везикулы, возникающие из остеобластов и хондроцитов [3,4]. Неорганический фосфат транспортируется в везикулы матрикса по натрий-зависимым и натрий-независимым путям. По всей видимости, натрий-зависимые пути опосредованы фосфатным транспортером 1 (PiT1, кодируется SLC20A1) и фосфатным транспортером 2 (PiT2, кодируется SLC20A2) [5]. Ионы кальция и фосфата, захваченные везикулами матрикса, образуют кристаллы гидроксиапатита, которые могут распространяться по коллагеновым фибриллам во внеклеточном матриксе. Ткане-неспецифическая щелочная фосфатаза — это фермент на внешней поверхности везикул матрикса, который способствует минерализации скелета путем расщепления пирофосфата (PPi, который ингибирует образование гидроксиапатита), АТФ и связанной с белком формы фосфата, с образованием неорганического фосфата [3,4]. Хотя в ходе исследований, проведенных на мышах, была выявлена другая фосфатаза — PHOSPHO1 [6,7] — ее роль у людей пока не полностью ясна.
У маленьких детей новая кость формируется в двух местах. Моделирование кости происходит за счет присоединения новых слоев костной ткани, например, на внешнем гребне длинных костей для обеспечения роста в толщину. Напротив, ремоделирование кости происходит в полостях, которые образуются внутри минерализованной матрицы, где наблюдается замещение ткани. В ходе исследования 2020 года было показано, что форма и состав минеральных кристаллов не одинаковы в этих двух местах, что является следствием различных молекул-предшественников, участвующих в минерализации. Это может свидетельствовать о большей дистанции для транспортировки минеральных веществ к местам формирования новой кости по сравнению с процессами ремоделирования, где обмен минеральных веществ происходит локально [8].
В костях выделяют две анатомические зоны: компактное вещество, которое образует плотный слой на внешней поверхности большинства костей и на теле длинных костей, и губчатое (трабекулярное вещество), которое имеет внешний вид губки и находится на концах длинных костей и внутри плоских костей и позвонков. Кальцификация этих двух зон различна. Компактное вещество выполняет преимущественно структурную функцию и 80–90 % ее объема кальцинировано, тогда как губчатое вещество выполняет метаболическую функцию и кальцинируется только на 15–25 % [9].
Регуляция концентрации кальция в крови.
Регуляция уровня кальция в крови осуществляется паратгормоном (ПТГ), который секретируется паращитовидными железами. Кальций во внеклеточной жидкости связывается активирует рецепторы-сенсоры (CaSR) на клетках паращитовидных желез, что через сигнальный путь фосфолипазы C повышает уже внутриклеточную концентрацию кальция и быстро сниженает секрецию ПТГ. Напротив, гипокальциемия приводит к тому, что CaSR активируются слабо, а внутриклеточный уровень кальция снижается, что приводит к увеличению секреции ПТГ. ПТГ усиливает реабсорбцию кальция в почках, а также в течение периода времени от нескольких часов до нескольких дней увеличивает остеокластическую резорбцию костей и высвобождение FGF23 из зрелых остеобластов и остеоцитов (рисунок). ПТГ также стимулирует почечную конверсию 25-гидроксивитамина D (25(OH)D) в 1,25(OH)2D (известный как кальцитриол) в течение нескольких часов, что, в свою очередь, приводит к увеличению абсорбции кальция и фосфата в кишечнике [1].
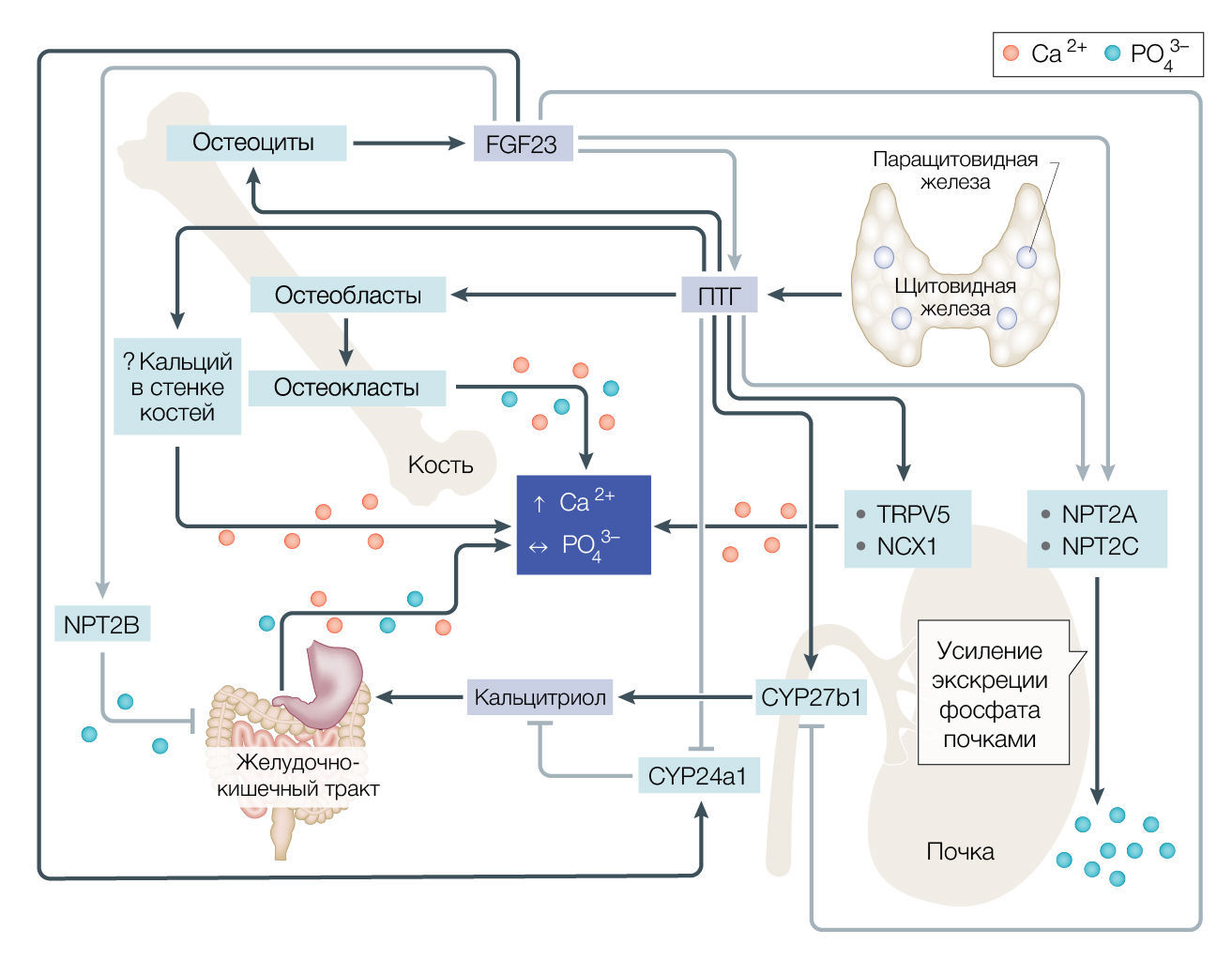
Рисунок | Костная масса и регуляция обмена кальция и фосфатов.Секреция паратиреоидного гормона (ПТГ) из паращитовидных желез увеличивается в ответ на низкие концентрации кальция (Ca2+) в сыворотке. Внутри клеток костей ПТГ стимулирует остеобласты к формированию кости и косвенно стимулирует остеокласты к резорбции кости и вымыванию кальция и фосфата (PO43–) в кровоток, а также действует на остеоциты, стимулируя высвобождение фактора роста фибробластов 23 (FGF23). Внутри почечных канальцев ПТГ увеличивает реабсорбцию кальция и почечную экскрецию фосфата, за последнее также отвечает и FGF23. FGF23 косвенно действует на кишечник, контролируя уровень кальцитриола, но также может влиять и напрямую, регулируя экспрессию натрий-зависимого белка транспорта фосфата 2B (NPT2B). Внутри кишечника кальцитриол увеличивает всасывание кальция и фосфата в кишечнике. Интеграция эффектов этих веществ-регуляторов заключается в том, что ПТГ усиливает высвобождение FGF23 и повышает уровень кальцитриола, тогда как FGF23 оказывает противоположное действие, ингибируя ПТГ и снижая уровень кальцитриола. Темно-синий квадрат в центра схемы — концентрация циркулирующих кальция и фосфатов в крови. Вопросительный знак — процесс, о котором известно недостаточно. Черные стрелки — пути с четким стимулирующим действием, серые стрелки — пути с четким ингибирующим действием. Плоские наконечники стрелок — ингибирующее действие.
Захват кальция клетками
Генетические факторы играют решающую роль в росте и формировании костной массы; однако адекватное потребление питательных веществ имеет ключевое значение для того, чтобы генетический потенциал развития костной ткани раскрылся в полной мере, а также для поддержания состояния костей во взрослом возрасте. Среди различных питательных веществ адекватное потребление кальция и витамина D необходимо для нормального роста и развития костей у детей и подростков, и употребление соответствующих пищевых добавок может замедлить утрату минеральных веществ костями у женщин в постменопаузе. Оптимальное потребление кальция необходимо для здоровья костей на всех этапах онтогенеза [10–12]. Потребление кальция из пищи определяется процессами развития и поддержания физиологии костей, которые происходят на разных уровнях на протяжении всей жизни, достигая максимальной интенсивности в детстве и подростковом возрасте.
У недоношенных младенцев наблюдается склонность к нарушениям минерализации костей, поскольку их кишечник не способен усваивать достаточное количество минеральных веществ, которые в норме поставляются плацентой. Благодаря достижениям в области неонатальной помощи большинство таких новорожденных теперь выживают. Скорость роста скелета плода выше, чем у новорожденного, особенно в течение последнего триместра. В среднем 30 г кальция [13–22] и 20 г фосфата [13,15,20] откладываются в скелете плода к сроку родов, причем 80 % этого прироста наблюдается в течение третьего триместра. Это накопление соответствует общей скорости прироста кальция 100–150 мг/кг в день и скорости прироста фосфата 50–65 мг/кг в день [13,14,16–19,23,24]. Для плода среднего размера скорость прироста кальция увеличивается с 60 мг/сут на 24-й неделе до 300–350 мг/сут между 35 и 40 неделями беременности [13]. Аналогичным образом, прирост фосфата увеличивается с 40 мг/сут на 24-й неделе до 200 мг/сут в течение последних 5 недель беременности [13]. Объем костной ткани в значительной степени увеличивается по мере повышения гестационного возраста из-за ремоделирования костной ткани и увеличения ее образования; скорость утолщения трабекул кости у плода в 240 раз выше, чем у детей, при этом активность остеобластов увеличивается экспоненциально (что включает 80 % накопления минералов) в течение 24–37 недель беременности [25–29].
Основные источники кальция —молочные продукты и зеленые листовые овощи; также нельзя забывать о пищевых добавках, которые часто рекомендуются принимать вместе с витамином D пациентам с остеопорозом [10]. Несмотря на общепризнанную важность кальция для здоровья костей, исследования, в которых изучалось влияние добавок кальция на минеральную плотность костной ткани (МПКТ), продемонстрировали противоречивые результаты [12]. Хотя некоторые из них показали положительное влияние употребления добавок кальция на при зональном исследовании МПКТ (зМПКТ), метаанализ приема добавок кальция среди здоровых детей показал различные эффекты, в зависимости от стадии полового созревания и исследуемой зоны скелета [11]. Было высказано предположение, что добавки кальция могут быть более полезными для тех детей и подростков, которые потребляют недостаточно кальция с пищей, хотя эта гипотеза не была подтверждена. Кроме того, неясно, сохраняются ли какие-либо положительные изменения в физиологии костей после прекращения приема добавок кальция, при этом данные, полученные в особенности у детей, указывают на отсутствие устойчивого эффекта. Убедительных преимуществ приема добавок кальция без адъювантного приема витамина D в контексте риска переломов у лиц пожилого возраста продемонстрировано не было. Кроме того, существуют некоторые опасения относительно возможного сердечно-сосудистого риска, связанного с приемом кальция, хотя эта связь остается неопределенной, и такой риск не был обнаружен при приеме пищевых добавок [10,12].
Необходимы дальнейшие исследования, чтобы установить, может ли добавление кальция быть более полезным для лиц, потребляющих недостаточное количество микроэлемента из пищи. Кроме того, необходимы четкие доказательства относительно того, сохраняется ли какой-либо прирост костной массы после прекращения приема кальция, особенно у детей.





