Образование атеросклеротических бляшек — результат сложного взаимодействия между процессами отложения липидов, воспалением, миграции клеток и повреждением стенки артерий. За последние двадцать лет клинические испытания, в которых были применены инвазивные методики визуализации состояния артерий (к примеру, внутрисосудистое ультразвуковое исследование, ВСУЗИ), продемонстрировали, что снижение содержания до крайне низких значений атерогенных липопротеинов (в первую очередь, сывороточного холестерина липопротеинов низкой плотности, ЛПНП) может благоприятно влиять на процессы образования атеросклеротических бляшек во всей артериальной системе и тормозить дальнейшее формирование уже имеющихся бляшек. Классической рекомендацией для достижения такого исхода является интенсивный прием статинов. С 2016 года появляются данные о том, что новые гиполипидемическте препараты, такие как ингибиторы пропротеин конвертазы субтилизин-кексина 9, оказывают мощное воздействие на регресс атеросклеротических бляшек и снижают риск неблагоприятных клинических событий. Несмотря на значительное снижение содержания ЛПНП в плазме, определенная степень риска наступления неблагоприятных сердечно-сосудистых событий (сердечно-сосудистого (СС) риска) сохраняется у некоторых групп пациентов. Следовательно, свою актуальность не утрачивает изучение терапевтических возможностей решения проблемы остаточного СС риска после снижения титра ЛПНП для обеспечения остановки или же прекращения роста бляшек. Современные визуализационные методики, такие как коронарная КТ-ангиография, позволяют проводить неинвазивную оценку как общей степени выраженности атеросклеротического процесса, так и определять состояние бляшек конкретных локализаций. Такие методики позволят в дальнейшем еще детальнее разобраться в том, как остановить рост бляшек и стимулировать их деградацию уже путем терапевтического вмешательства. Неинвазивная оценка состояния бляшек может также помочь в реализации индивидуализированных стратегий лечения атеросклероза.
Ключевые моменты:
- Внутрисосудистое УЗИ традиционно является предпочтительной визуализационной методикой для оценки количества и морфологии бляшек в клинических исследованиях; в числе новых и многообещающих инвазивных методик следует отметить оптическую когерентную томографию и спектроскопию в ближней инфракрасной области.
- Неинвазивная оценка состояния бляшек возможна с помощью коронарной КТ-ангиографии, которая определяет распределение бляшек по всем коронарным артериям эпикарда, а также выявляет наличие бляшек, связанных с высоким риском.
- Наиболее убедительные доказательства регрессии и стабилизации бляшек были получены в клинических исследованиях, в которых с помощью терапии статинами было достигнуто выраженное снижение уровня холестерина ЛПНП (ХС-ЛПНП) в плазме, а развитие коронарного атеросклероза во времени отслеживалось при помощи внутрисосудистого ультразвукового исследования.
- Согласно недавним данным, снижение уровня холестерина ЛПНП в плазме с помощью ингибиторов пропротеиновой конвертазы субтилизин-кексинового типа 9 приводит к еще более выраженной регрессии бляшек.
- Утверждения о том, что дополнительной регрессии бляшек можно достичь путем воздействия не на ЛПНП и вообще не на липидный спектр противоречивы и менее надежны, по сравнению со снижением уровня ЛПНП.
- В исследованиях будущего должна применяться неинвазивная оценка состояния бляшек с помощью коронарной компьютерной томографии-ангиографии, а усилия должны быть сосредоточены на достижении снижения остаточного риска за счет регрессии и стабилизации бляшек путем воздействия на другие мишени, такие как уровень липопротеина(а) в плазме.
Введение
Образование атеросклеротических бляшек в артериях с точки зрения патофизиологии является ключевым фактором клинически проявляющихся атеросклеротических сердечно-сосудистых заболеваний (АССЗ) — неизменно ведущей причины смертности во всем мире [1]. Формирование атеросклеротических бляшек — это сложный, многофакторный, многоэтапный процесс, который обычно занимает годы или десятилетия [1]. Образование бляшек инициируется адгезией и миграцией моноцитов и лимфоцитов к эндотелиальному интимальному слою с последующим утолщением интимы и образованием пенистых клеток за счет поглощения липидов макрофагами (преимущественно, холестерина ЛПНП, в составе которых присутствует аполипопротеин B-100) [2–6] (рис. 1). В числе этапов, в которые происходит рост бляшек, можно отметить: миграцию гладкомышечных клеток и пролиферацию внеклеточного матрикса, продолжающееся внутриклеточное и внеклеточное накопление липидов, неадекватный эффероцитоз (очистка от мертвых или умирающих клеток), развивающуюся среду модуляторов воспаления и кальцификацию определенных участков бляшек. Как предполагается, признаками «опасной» бляшки являются: некротическое, богатое липидами центральное ядро бляшки и истончение фиброзной капсулы, отделяющей липидное ядро от просвета артерии.
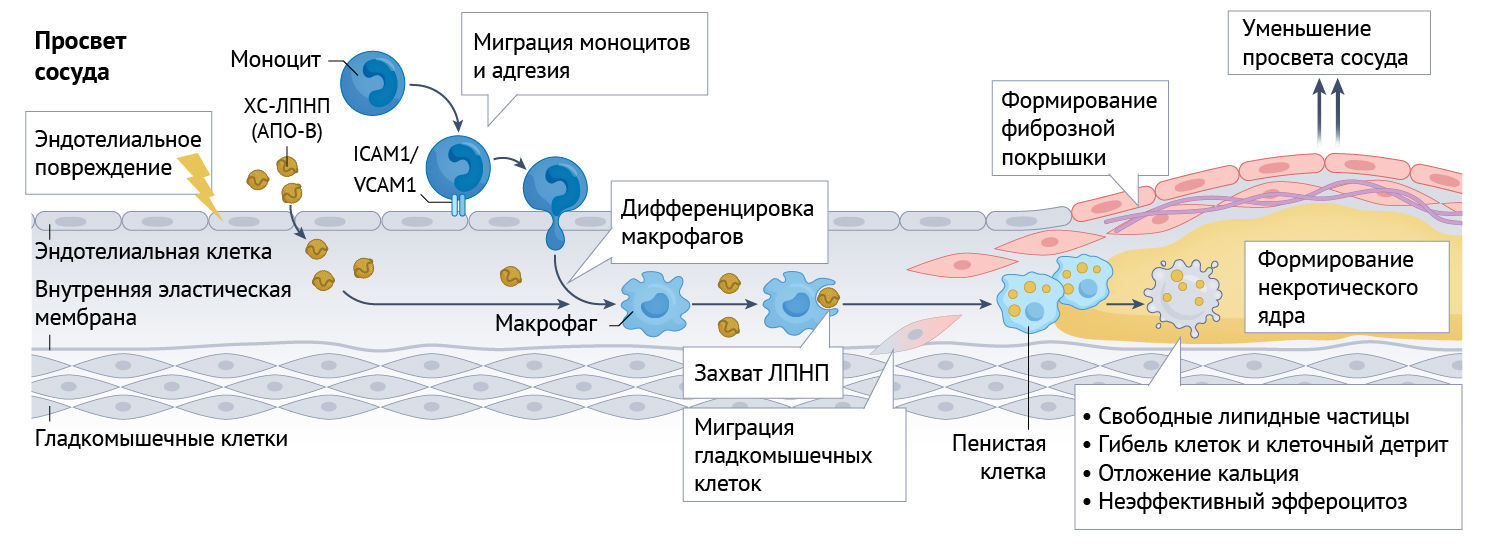
Рис. 1 | Развитие атеросклеротической (фиброзно-жировой) бляшки.Образование атеросклеротической бляшки — это сложный процесс, в ходе которого наблюдается миграция частиц холестерина ЛПНП (ХС-ЛПНП; ключевого переносчика аполипопротеина В-100, apoB), адгезия моноцитов, эндотелиальное повреждение, захват ХС-ЛПНП макрофагами, что приводит к образованию пенистых клеток, миграции гладкомышечных клеток и неэффективному эффероцитозу. Это сопровождается накоплением частиц свободных липидов, клеточного детрита и кальция. Вследствие этого формируется некротическое ядро с фиброзной капсулой.
ICAM1 — молекула внутриклеточной адгезии 1;
VCAM1 — васкулярная молекула клеточной адгезии 1 (белок)
Разрыв бляшки, суть которого в разрыве фиброзной капсулы, приводит к обнажению ядра бляшки в просвет артерии с последующим тромботическим каскадом с образованием тромба в просвете сосуда, который уменьшает кровоток и приводит к сердечно-сосудистым катастрофам, таким как острый коронарный синдром (ОКС) [4]. Эрозия бляшки, характеризующаяся разрушением эндотелиального слоя без разрыва, также может приводить к провоспалительным и протромботическим процессам, способствующим образованию тромбов. Таким образом, предотвращение образования бляшек (первичная профилактика), а также стабилизация и регресс сформировавшихся атеросклеротических бляшек (первичная и вторичная профилактика) являются потенциальными подходами к снижению заболеваемости АССЗ.
Современные диагностические методы (как инвазивные, так и неинвазивные), такие как внутрисосудистое ультразвуковое исследование (ВСУЗИ), оптическая когерентная томография (ОКТ), спектроскопия в ближней инфракрасной области (СБИКО, от англ. near-infrared spectroscopy) и коронарная КТ-ангиография (ККТА), расширили возможности для описания состояния атеросклеротических бляшек [6]. Степень использования ККТА, в частности, выросла за последние несколько лет. Кроме того, терапевтические средства АССЗ, которые снижают частоту сердечно-сосудистых катастроф в клинических исследованиях, связаны с благоприятным воздействием на размер и характеристики атеросклеротических бляшек. Такие результаты сообщаются относительно статинов, а также новых методов лечения, таких как ингибиторы пропротеиновой конвертазы субтилизин-кексин типа 9 (PCSK9), которые все активнее изучаются с 2016 года.
В данном обзоре обсуждаются современные исследования диагностических и терапевтических подходов по стабилизации и регрессии бляшек, а также рассматриваются нерешенные вопросы в этой области, являющиеся приоритетными для будущих исследований.
Степень нагрузки бляшками сосудов и сердечно-сосудистые катастрофы
Степень нагрузки атеросклеротическими бляшками является маркером АССЗ, который поддается визуализации и связан с риском сердечно-сосудистых событий. В исследовании 581 пациента с АССЗ [7] именно количество бляшек, а не их морфология (что было установлено при помощи ВСУЗИ) было связано с неблагоприятными сердечно-сосудистыми событиями. Оценка при помощи ОКТ бляшек (в составе которых много липидов), расположенных в инфаркт-независимых коронарных артериях, свидетельствовала о повышенном риске серьезных неблагоприятных сердечно-сосудистых событий в течение периода наблюдения (в среднем 2 года) у 1474 пациентов, перенесших чрескожное коронарное вмешательство (ЧКВ) [8]. Данные наблюдений показывают прогрессирующую связь между содержанием кальция в коронарной артерии (косвенным маркером количества кальцифицированных коронарных бляшек) и риском сердечно-сосудистых событий [9]. Имеются ограниченные данные о связи между регрессией бляшек и риском сердечно-сосудистых событий. Метарегрессионный анализ клинических исследований, где испытуемыми были в общей сложности 7864 пациентов в основном со стабильным течением АССЗ, показал, что регрессия бляшек (оценивалось при помощи ВСУЗИ) в значительной степени связана со снижением частоты инфаркта миокарда (ИМ) или необходимости реваскуляризации [10].
Методики визуализации атеросклеротических бляшек
Для оценки общего количества и особенностей конкретных бляшек доступны различные инвазивные и неинвазивные методики визуализации (см.информационный бокс 1). ВСУЗИ традиционно считается стандартным методом.
Внутрисосудистое УЗИ
Суть ВСУЗИ заключается в том, что инвазивный катетер, излучающий ультразвук, использует различия в отражении от различных структур внутри артерии для создания изображений поперечного сечения артериальной стенки и просвета сосуда [11–14]. ВСУЗИ может выявить фиброзные и фиброзно-жировые компоненты бляшки, некротическое ядро и отложения кальция с помощью виртуальной гистологии на основе данных об обратном рассеянии радиочастот. Используя относительную эхогенность и внешний вид тканей в качестве косвенных параметров гистологического исследования, ВСУЗИ может дифференцировать бляшки на фиброзные, фиброзно-жировые, кальцинированные и кальцифицированно-некротические подтипы [11]. Фиброатерома с тонкой капсулой (ФАТК) — морфологический тип бляшки, которая обычно считается склонной к разрыву; ее описывают как бляшку с некротическим ядром и макрофагами вблизи просвета артерии с тонкой фиброзной крышкой, размер которой обычно составляет <65 мкм [14, 15]. ВСУЗИ позволяет зафиксировать передний край фиброзной капсулы, но не задний край, и не может измерить ее толщину. Таким образом, этот метод имеет ограниченное разрешение для надежного выявления ФАТК или для детального анализа состава бляшек [14]. Однако ВСУЗИ обеспечивает наиболее точный и воспроизводимый подход к определению общего количества бляшек, включая атероматозную площадь, общий объем атеромы (ООА) и процентный объем атеромы (ПОА). Эти параметры можно определять с течением времени для количественной оценки прогрессирования и регрессии бляшек (рис. 2).
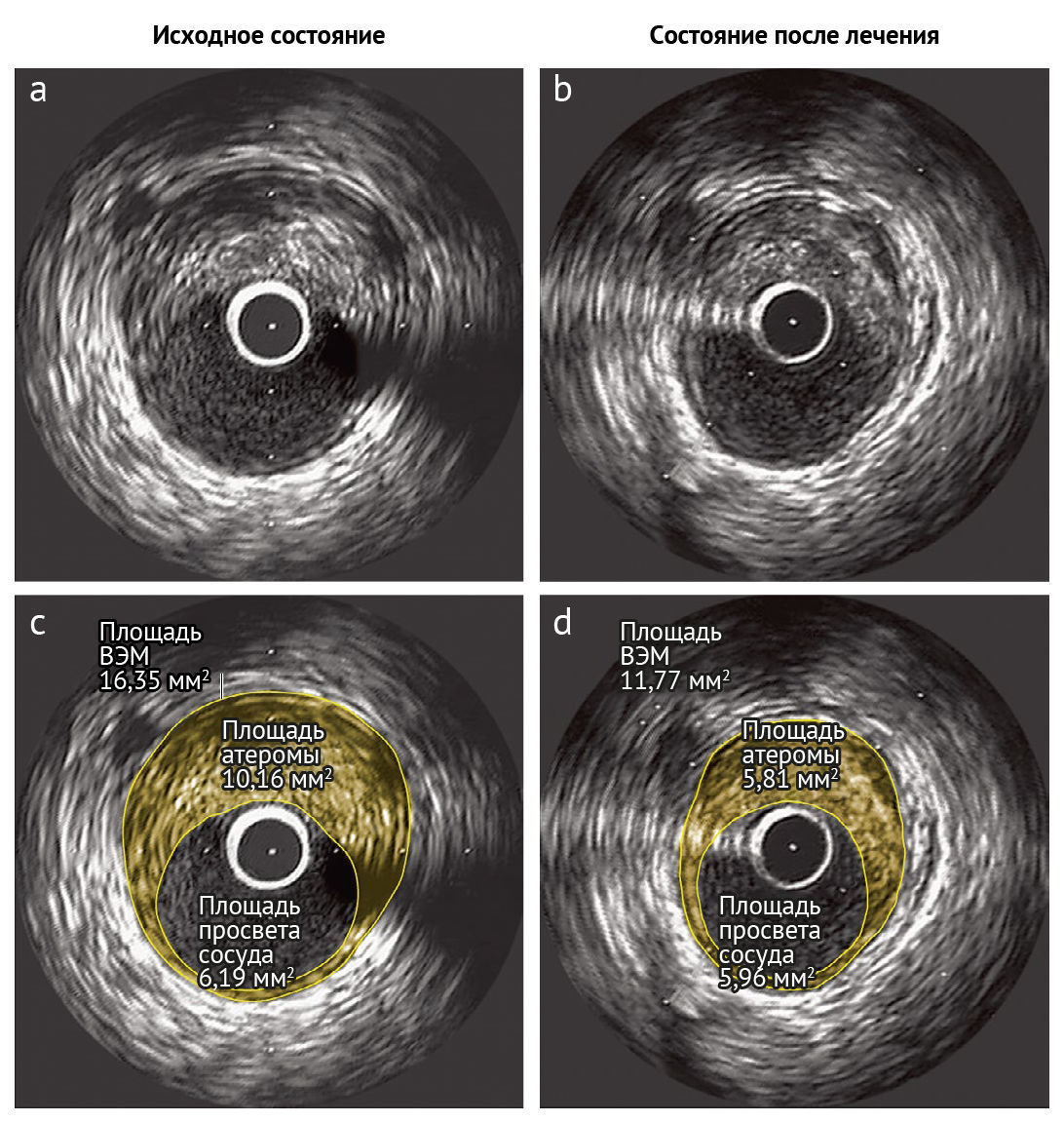
Рис. 2 | Оценка состояния бляшки с помощью ВСУЗИВизуализация поперечного среза атером, полученная посредством ВСУЗИ. Исходное состояние (фото а), состояние во время лечения высокой дозой розувастатина (40 мг/сут) (фото b). Две нижние фото демонстрируют оценку площади атеромы: 10,16 мм2 в исходном состоянии (фото с) и 5,81 мм2 во время лечения (фото d). Обобщая, результаты исследования отражают влияние лечения на уровне популяции клинического испытания, однако индивидуальные проявления этого влияния могут быть довольно разнородны.
ВЭМ — внешняя эластическая мембрана
Оптическая когерентная томография
ОКТ — это инвазивный метод внутрисосудистой визуализации, в котором используется ближний инфракрасный свет для создания поперечных или продольных изображений просвета и стенки артерии [6,16]. ОКТ обеспечивает большее разрешение, чем ВСУЗИ, позволяя формировать более подробные изображения микроструктур поверхности артериальной стенки (рис. 3). Благодаря ОКТ возможно дифференцировать морфологию бляшек (фиброзные бляшки, кальцинированные бляшки или бляшки, богатые липидами) и оценивать толщину фиброзной капсулы. Хотя ФАТК обычно определяют как толщину фиброзной покрышки <65 мкм [15], ОКТ-исследование бляшек in vivo показало, что этот порог следует увеличить до <80 мкм [17]. Из-за ограничений проникновения лучей в ткани ОКТ не может дать надежную оценку объема атеросклеротических бляшек, хотя модифицированная методика позволила оценить общую нагрузку бляшками [18].
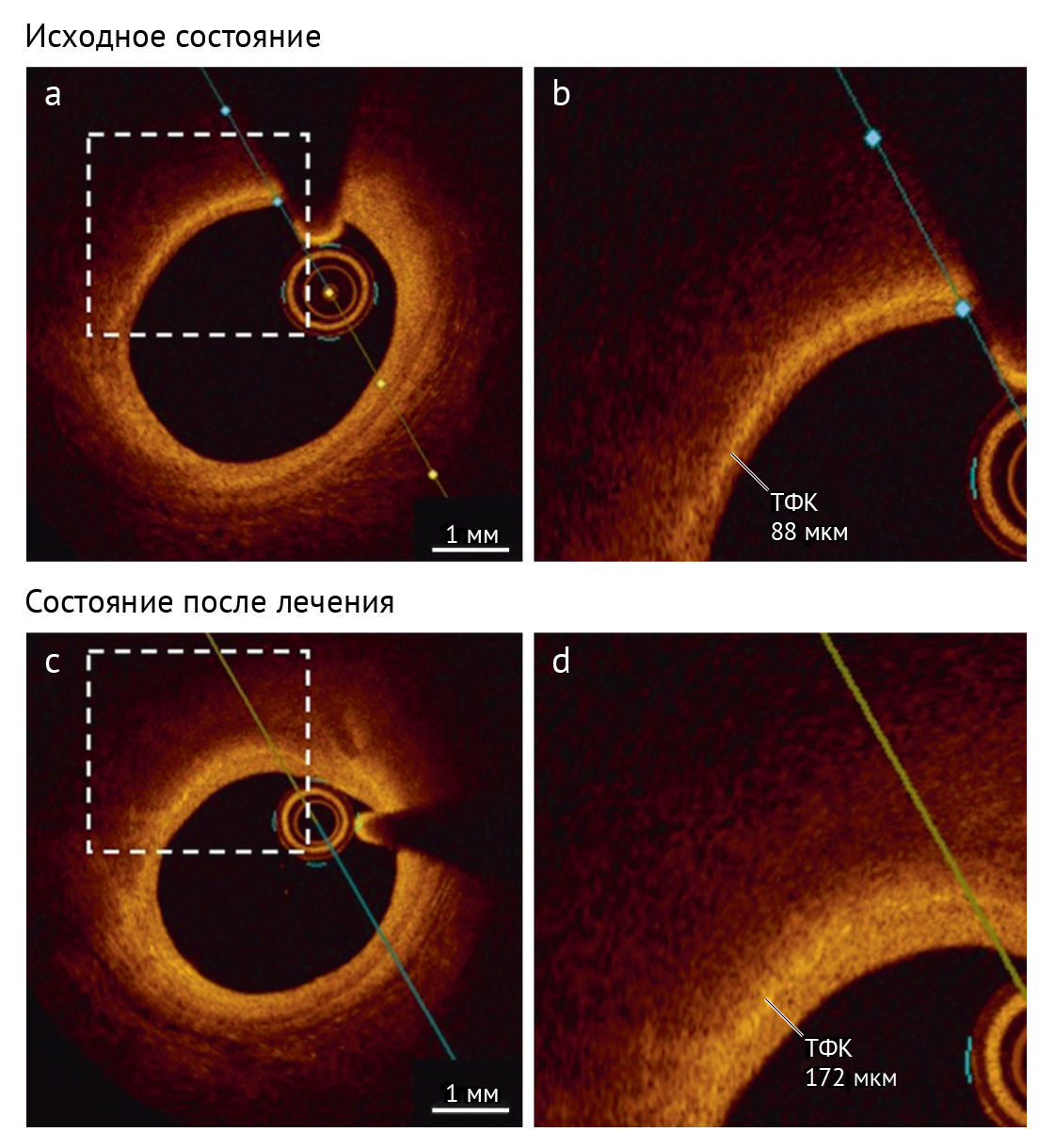
Рис. 3 | Оценка состава бляшки с помощью оптической когерентной томографии.Фотографии в высоком разрешении изменений морфологии бляшки, полученные с помощью оптической когерентной томографии, демонстрируют увеличение толщины фиброзной капсулы (ТФК) с 88 мкм (исходное состояние, фото a и b) до 172 мкм (состояние лечения, фото c и d) при использовании эволокумаба, в сочетании с терапией статинами, в ходе испытания HUYGENS.
Спектроскопия в ближней инфракрасной области (СБИКО)
С помощью СБИКО можно визуализировать содержание липидов в атеросклеротических бляшках, оценивая изменения состава бляшек, что недостижимо посредством традиционного ВСУЗИ [19]. В СБИКО применяются длины волн, соответствующие ближнему инфракрасному диапазону, для получения спектров отражения от коронарных бляшек; далее эти спектры обрабатываются ПО компьютера и представляются в виде блок-схемы, на которой ярко-желтый цвет соответствует липидам [20]. СБИКО — потенциально полезный инвазивный метод оценки влияния гиполипидемической терапии на содержание липидов в бляшках.
Коронарная КТ-ангиография
ККТА — это быстро развивающийся метод, используемый для визуализации степени артериального стеноза; исследование позволяет точно определить разновидность бляшек (кальцинированные, некальцинированные или смешанные) [21]. В ходе обсервационных исследований с помощью ККТА были выявлены определенные особенности бляшек (как например, положительное ремоделирование, «пятнистая» кальцификация и низкая степень их смягчения), которые связывают с повышенным риском неблагоприятных сердечно-сосудистых событий [21]. В число преимуществ ККТА над ВСУЗИ входят неинвазивность этого метода и возможность визуализации нескольких коронарных артерий. В ходе исследований было продемонстрировано обоснованное соответствие между скоплениями бляшек, детектированными с помощью ККТА и ВСУЗИ [22]. Тем не менее, стоит отметить, что по сравнению с исследованиями, где применялось ВСУЗИ, оценка регрессии и прогрессирование бляшек с помощью ККТА производилась в меньшем количестве хорошо контролируемых рандомизированных исследований, и все они были небольшими по размеру выборки. В перечень ограничений метода ККТА входят: более низкое разрешение, по сравнению с ВСУЗИ, а также вероятность появления артефактов визуализации, что ведет к неправильной классификации компонентов бляшек [21,23]. Хотя, по мере усовершенствования технологии ККТА радиационная нагрузка снижается, серийные клинические испытания приводят к кумулятивному радиационному воздействию, что вызывает особое беспокойство касаемо женщин (повышается риск радиационно-индуцированного рака молочной железы) [24].
Магнитно-резонансная томография сердца
Неинвазивная магнитно-резонансная томография (МРТ) сердца потенциально позволяет оценить толщину стенки коронарных сосудов, стенозы и такие характеристики, как положительное ремоделирование [25]. Однако этот метод не используется в качестве рутинного для оценки состояния коронарных артерий из-за необходимости более высоких технических и временных затрат по сравнению с CCTA [6,21]. Кроме того, разрешение МРТ сердца оказывается недостаточным для визуализации коронарных артерий, но приемлемым для более крупных сосудов.
Позитронно-эмиссионная томография
Позитронно-эмиссионная томография (ПЭТ) — это неинвазивный метод, который позволяет визуализировать участки воспаления и кальцификации бляшек с помощью радиолигандов [26]. Разрешение ПЭТ для оценки состояния бляшек ограничено тем, что миокард поглощает традиционно используемые ПЭТ-лиганды, такие как фтордезоксиглюкоза. Селективные радиоактивные индикаторы, благодаря которым возможно идентифицировать конкретные компоненты бляшек, включают 18F-фтордезоксиглюкозу (для изучения воспаления), 18F-фторид натрия (для оценки микрокальцификации) и 18F-фтормисонидазол (для оценки гипоксии) [26]. Использование ПЭТ в сочетании с КТ или МРТ может дать дополнительные преимущества. Хотя ПЭТ-визуализация обладает потенциалом для изучения коронарных бляшек, а конечные точки, установленные на основе ПЭТ, использовались в некоторых испытаниях, таких как рандомизированное исследование IIb фазы dal-PLAQUE дальцетрапиба, общая роль этого метода визуализации в рутинной оценке инволюции бляшек или стабилизации все еще находятся в зачаточном состоянии [6].Информационный бокс 1
Визуализация атеросклеротического поражения бляшкамиИнвазивные методы
Внутрисосудистое УЗИ является традиционным стандартом оценки поражения бляшками коронарных сосудов в ходе клинических исследований. Оптическая когерентная томография и спектроскопия в ближней инфракрасной области — это новые инвазивные методики, которые можно использовать для оценки морфологии и состояния бляшек более эффективно.
Неинвазивные методы
Коронарная компьютерная томографическая ангиография — это быстроразвивающийся неинвазивный метод, используемый для оценки поражения бляшками и их состава. Позитронно-эмиссионная томография и магнитно-резонансная томография сердца — это другие неинвазивные методики, однако они в меньшей степени подходят для визуализации коронарных бляшек.
Методы лечения
Изменение образа жизни
Изменение образа жизни посредством применения научно обоснованных, благоприятных для здоровья сердечно-сосудистой системы диет, как например, средиземноморской диеты, или же принципов, изложенных в «Диетических подходах к профилактике и контролю гипертонии», является важным компонентом модификации факторов риска ишемической болезни сердца (ИБС) [28]. Однако поскольку доступные данные — низкого качества, остается неясным, оказывает ли изменение образа жизни последовательное, клинически значимое влияние на стабилизацию и регрессию коронарных бляшек.
Существует мало данных о роли отдельных диетических изменений в содействии регрессии коронарных бляшек. В ходе исследования Lifestyle Heart [29] (очень небольшое рандомизированное исследование, опубликованное в 1990 году) было проведено случайное распределение 28 пациентов с коронарным атеросклерозом по 2 группам:
- интенсивного изменения образа жизни (вегетарианская диета с низким содержанием жиров, отказ от курения, умеренные физические нагрузки и работа со стрессовыми факторами);
- продолжения привычного для испытуемого образа жизни (группа контроля).
Через 1 год с помощью коронарной ангиографии был определен процент диаметра коронарного стеноза:
- в группе интенсивного изменения образа жизни он снизился в среднем с 40,0 % (стандартное отклонение 16,9 %) до 37,8 % (стандартное отклонение 16,5 %);
- в контрольной группе он увеличился со среднего значения 42,7 % (стандартное отклонение 15,5 %) до 46,1 % (стандартное отклонение 18,5 %).
Спустя 5 лет наблюдения выяснилось, что процент диаметра коронарного стеноза продолжил снижаться в группе изменения образа жизни [30]. В исследовании STARS [31], опубликованном в 1992 году, пациенты со стенокардией или перенесенным инфарктом миокарда были случайным образом распределены в группы:
- гиполипидемической диеты;
- гиполипидемической диеты с холестирамином;
- привычного для испытуемого рациона питания.
У лиц, соблюдавших только диетические рекомендации, и у лиц, соблюдавших диету и принимавших холестирамин, тормозилось прогрессирование сужения коронарных артерий и наблюдался больший диаметр просвета коронарной артерии, по сравнению с пациентами в группе обычного ухода (определялось с помощью УЗИ) [31]. Тем не менее использование оценки степени стеноза просвета и ангиографии в качестве суррогатных маркеров степени поражения бляшками является ограничением этих исследований.
В исследовании DISCO-CT 2021 года [32] 92 пациента с необструктивными коронарными бляшками (стеноз < 70 %) на ККТA были случайным образом распределены на группы:
- следующих рациону питания «Диетические подходы к остановке гипертонии» и принимающих оптимальную медикаментозную терапию (ОМТ);
- Принимающих только ОМТ.
Спустя примерно 70 недель значительной разницы ПОА между группами лечения не было выявлено. Степень поражения некальцинированными бляшками стала несколько меньше в группе терапии, по сравнению с контрольной группой (P = 0,045). В целом, хотя модификация диеты и остается краеугольным камнем профилактики и лечения АССЗ, конкретные преимущества диетических изменений в отношении регрессии коронарных бляшек в крупных, хорошо контролируемых, рандомизированных клинических исследованиях продемонстрированы не были.
Фармакологическое снижение уровня холестерина ЛПНП
Существуют современные высококачественные доказательства в поддержку использования фармакологической терапии для стабилизации и регрессии коронарных бляшек. В частности, в хорошо контролируемых клинических исследованиях было показано, что использование препаратов, снижающих уровень атерогенных липопротеинов, в основном холестерина ЛПНП, приводит к уменьшению количества бляшек и благоприятным морфологическим изменениям (таблица 1).
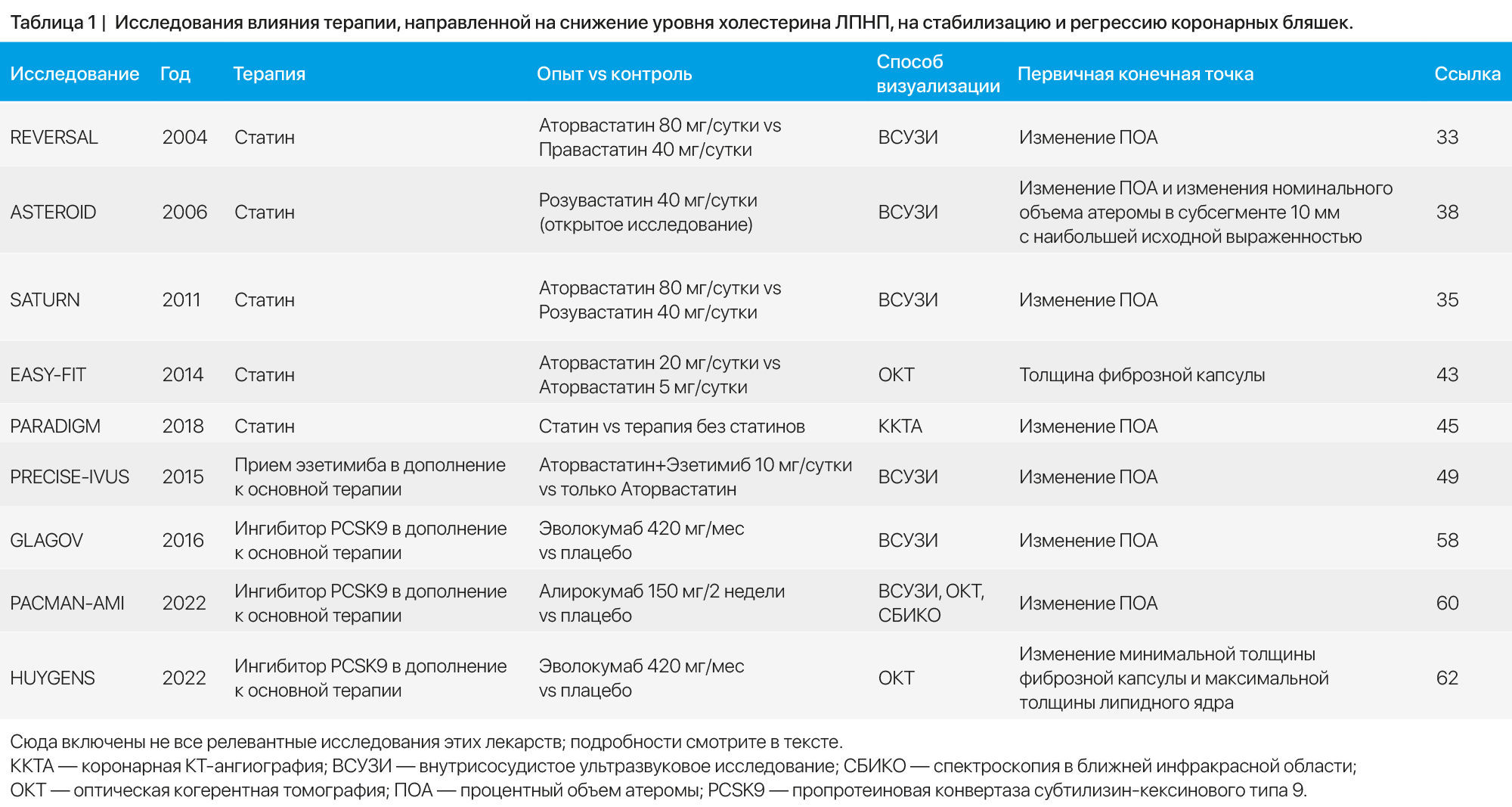
Статины. В ходе нескольких рандомизированных контролируемых исследований с помощью ВСУЗИ было продемонстрировано, что снижение уровня холестерина ЛПНП в плазме при терапии статинами приводит к стабилизации или даже регрессии бляшек у пациентов с хронической ИБС или ОКС. Согласно исследованиям, высокоинтенсивная терапия [назначение аторвастатина в дозе 40–80 мг/сут или розувастатина в дозе 20–40 мг /сут] оказывается более эффективной, по сравнению с низкоинтенсивной. Исследование REVERSAL [33] продемонстрировало, что у пациентов с ИБС, принимавших аторвастатин в дозе 80 мг в день, скорость прогрессирования объема атеромы была ниже, чем у тех, кто получал правастатин в дозе 40 мг в день. Эти эффекты, по-видимому, связаны с более выраженным снижением концентрации атерогенных липопротеинов и С-реактивного белка в плазме при интенсивном лечении статинами, чем при терапии этой группой в умеренных дозах [34]. В исследовании SATURN [35] ВСУЗИ использовалось для того, чтобы сравнить, изменяется ли количество бляшек при применении двух схем высокоинтенсивной терапии статинами: аторвастатином (80 мг в день) и розувастатином (40 мг в день). Было обнаружено, что содержание холестерина ЛПНП было немного ниже в группе приема розувастатина, однако в обеих группах наблюдались схожие эффекты на первичную конечную точку эффективности — изменение ПОА. Лечение аторвастатином снижало ПОА на 0,99 % (95 % ДИ от –1,19 до –0,63), тогда как лечение розувастатином снижало ПОА на 1,22 % (95 % ДИ от –1,52 до –0,90). Более выраженное снижение заранее заданной вторичной конечной точки — ООА — наблюдалось при приеме розувастатина (–6,39 мм3, 95 % ДИ от –7,52 до –5,12), чем при приеме аторвастатина (–4,42 мм3, 95 % ДИ от –5,98 до –3,26). Оба препарата вызывали регрессию бляшек у большинства пациентов (значения ПОА: 63,2 % в группе приема аторвастатина и 68,5 % — розувастатина) [35]. В исследовании STABLE [36] среди 312 пациентов с фиброатеромой, рандомизированных в группы приема розувастатина в разных дозировках (40 мг в день vs 10 мг в день), благоприятные изменения в составе бляшек наблюдались в обеих группах. Объем некротического ядра, объем бляшек и уровень ФАТК уменьшились с одинаковыми результатами в группах высокой и средней интенсивности терапии статинами [36]. Кроме того, как показало исследование JAPAN-ACS [37] (испытуемыми были пациенты с ОКС из Японии), терапия питавастатином в дозе 4 мг в день или аторвастатином в дозе 20 мг в день в течение 8–12 месяцев способствовала значительной регрессии бляшек без существенных различий между группами. Оценка проводилась с помощью ВСУЗИ.
Несколько дополнительных нерандомизированных исследований с использованием ВСУЗИ у пациентов со стабильной ИБС показали, что терапия статинами приводит к стабилизации или регрессии бляшек, или и к тому, и другому. Открытое слепое исследование ASTEROID [38], в котором испытуемыми были пациенты с ИБС, ранее не принимавшими статины, продемонстрировало, что прием розувастатина в дозе 40 мг в день привел к улучшению трех заранее заданных показателей ВСУЗИ у всех пациентов: 1) изменения ПОА; 2) изменения номинального объема атеромы в субсегменте 10 мм с наибольшей исходной выраженностью и 3) изменений нормализованного ООА для всей пораженной артерии. В 76-недельном открытом исследовании COSMOS [39], где участниками были пациенты со стабильной ИБС из Японии, прием розувастатина в дозе 2,5 мг в день привел к снижению ПОА, согласно данным ВСУЗИ.
За последнее десятилетие в нескольких небольших исследованиях использовались ОКТ и СБИКО в сочетании с ВСУЗИ для изучения влияния терапии статинами на состав и регрессию бляшек. IBIS-4 [40,41] — обсервационное исследование воздействия высокоинтенсивной терапии розувастатином на состав бляшек в неинфарктных коронарных артериях (что определялось посредством ВСУЗИ и ОКТ) среди 103 пациентов с ИМ с подъемом сегмента ST. После 13 месяцев интенсивной терапии розувастатином исследователи сообщили об увеличении минимальной толщины фиброзной капсулы, снижении степени накопления макрофагов. Также авторы отметили, что у пациентов чаще встречалась морфология бляшек, не соответствующая фенотипу ФАТК [41]. В исследовании ESCORT [42] испытуемыми были 53 пациента с ОКС. Они были случайным образом распределены на группы раннего старта терапии (от момента определения исходных показателей) и позднего старта терапии (через 3 недели после определения исходного уровня) питавастатином в дозе 4 мг в день; оценка осуществлялась с помощью ОКТ. Значительное увеличение толщины фиброзной капсулы в первые 3 недели наблюдалось в группе раннего приема статинов, достигнув одинаковой степени увеличения в обеих группах спустя 36 недель [42]. Кроме того, исследование EASY FIT [43], где участвовали 70 пациентов с нестабильной стенокардией, что оценивалось по ОКТ, показало, что лечение аторвастатином в дозе 20 мг в день приводило к большему увеличению толщины фиброзной капсулы, по сравнению с терапией аторвастатином в дозе 5 мг в день. В исследовании YELLOW [44] 87 пациентов с ИБС с многососудистым поражением, у которых был определен фракционный резерв кровотока, было выполнено ВСУЗИ и СБИКО. Испытуемые были случайным образом распределены на группы высокоинтенсивной терапии розувастатином и стандартной липидснижающей терапии. Результатом в первой группе стало снижение содержания липидов в бляшках, что оценивалось по индексу липидной нагрузки ядра бляшки в максимально утолщенном сегменте артерии 4 мм. Наконец, в исследовании PARADIGM [45] для оценки использования статинов применялся обсервационный регистр ККТА. Согласно данным работы, использование статинов оказалось связано с более медленной скоростью прогрессирования ПОА, более быстрым прогрессированием кальцинированного ПОА и уменьшением числа бляшек высокого риска [45].
Эзетимиб. Согласно клиническим рекомендациям Эзетимиб можно использовать для дальнейшего снижения уровня холестерина ЛПНП в плазме у пациентов с высоким риском сердечно-сосудистых событий, когда эффективность монотерапии статинами недостаточна [28]. Хотя при добавлении к статинам эзетимиба сердечно-сосудистый риск снижается (препарат выступает в качестве вторичной профилактики), для данного показания применение эзетимиба не одобрено FDA [46]. Существует определенный пласт доказательств в поддержку регрессии бляшек при применении эзетимиба на фоне терапии статинами. Остается неясным, почему наблюдаемый аддитивный эффект в морфологии бляшек (помимо регрессии объема) развивается именно при применении эзетимиба.
HEAVEN [47] — небольшое исследование, в котором проводилось сравнение интенсивной гиполипидемической терапии (аторвастатин 80 мг + эзетимиб 10 мг ежедневно) со стандартной гиполипидемической терапией у 89 пациентов со стабильной стенокардией, что оценивалось с помощью методики виртуального гистологического ВСУЗИ. Через 12 месяцев наблюдения в группе интенсивной гиполипидемической терапии ПОА снизился, по сравнению с увеличением значения этого показателя в группе стандартной терапии. В составе бляшек испытуемых двух групп не было выявлено никаких значимых различий [47]. Напротив, в небольшом исследовании ZEUS [48], проведенном среди пациентов с ОКС, комбинированная терапия эзетимибом в дозе 10 мг + аторвастатином в дозе 20 мг в день (n = 50), по сравнению с монотерапией аторвастатином в дозе 20 мг в день (n = 45), не привела к существенным различиям в прогрессировании бляшек (определялось с помощью ВСУЗИ). В исследовании PRECISE-IVUS [49] аторвастатин + эзетимиб (10 мг в день) сравнивали с монотерапией аторвастатином у пациентов из Японии, перенесших коронарное вмешательство. Дозу аторвастатина титровали до достижения целевого уровня холестерина ЛПНП в плазме < 70 мг/дл. Среди 202 пациентов, кому было выполнено ВСУЗИ в начале испытания и через 9–12 месяцев наблюдения, различия ПОА в среднем не превышали заранее установленную границу не меньшей эффективности. Тем не менее наблюдалось преимущество относительно вторичной конечной точки абсолютного изменения ПОА при комбинированной терапии; а также у бОльшего процента пациентов, получавших комбинированную терапию, наблюдалась регрессия бляшек (78 % против 58 %; P = 0,004) [49]. Кроме того, в ходе других небольших исследований были продемонстрированы потенциальные преимущества комбинированной терапии статинами и эзетимибом, по сравнению с терапией только статинами [50,51]. Напротив, исследование Ezetimibe-ACS [52] с участием 128 пациентов с ОКС, ранее не принимавших статины, показало, что прием питавастатина в дозе 2 мг + эзетимиба в дозе 10 мг в день не привело к значительному изменению регрессии коронарных бляшек, по сравнению с монотерапией питавастатином в дозе 2 мг в день (изменения определялись посредством ВСУЗИ). Предполагается, что причиной таких противоречивых результатов эффективности комбинированной терапии эзетимибом и статинами могли были различия в отборе пациентов (к примеру, пациенты, ранее не принимавшие статины, сравнивались с пациентами, принимавшими статины) или различия в размерах выборки.
Ингибиторы PCSK9. Алирокумаб и эволокумаб представляют собой моноклональные антитела (МАт) против PCSK9; их часто называют ингибиторами PCSK9. Эти МАт одобрены для дополнительного снижения уровня холестерина ЛПНП в плазме для вторичной профилактики, а также для первичной профилактики у пациентов с высоким риском сердечно-сосудистых событий [53–57]. В исследованиях с использованием внутрисосудистой визуализации было показано, что ингибиторы PCSK9 способствуют регрессии и стабилизации бляшек при добавлении к терапии статинами.
В исследовании GLAGOV [58] 968 пациентов были случайным образом распределены на группы:
- подкожного введения 420 мг эволокумаба ежемесячно в течение 76 недель + терапия статинами;
- плацебо в дополнение к терапии статинами.
В группе эволокумаба уровень холестерина ЛПНП в плазме был значительно ниже, чем в группе плацебо (36,6 мг/дл против 93,0 мг/дл; разница –56,5 мг/дл, 95 % ДИ –59,7–53,4, P < 0,001). Добавление эволокумаба приводило к большей регрессии бляшек при измерении ПОА посредством ВСУЗИ (снижение на 0,95 %), по сравнению с плацебо (увеличение на 0,05 %). При приеме эволокумаба (5,8 мм3) наблюдалось бОльшее снижение ООА, по сравнению с плацебо (0,9 мм3). У большего процента пациентов, принимавших эволокумаб, наблюдалась регрессия бляшек (64,3 % против 47,3 % в группе плацебо) [58]. Однако в ходе дополнительного исследования к GLAGOV не было выявлено существенных различий в составе бляшек между терапией эволокумабом + статинами и монотерапией статинами (оценивалось с помощью ВСУЗИ). Это указывает на ограничения данного метода внутрисосудистой визуализации для оценки изменений состава бляшек [59].
В рандомизированном исследовании PACMAN-AMI [60] 300 пациентов, перенесших ЧКВ по поводу острого ИМ, были случайным образом распределены на группу подкожного введения алирокумаба в дозе 150 мг каждые 2 недели и группу плацебо. Фоном пациенты принимали высокоинтенсивную терапию статинами, которая была начата в течение 24 часов после ЧКВ. Визуализация с помощью ВСУЗИ, СБИКО и OКТ проводилась в начале испытания и через 52 недели. Регрессия бляшек оказалась значительно выраженнее в группе алирокумаба, чем в группе плацебо, для первичной конечной точки ПОА (определенного с помощью ВСУЗИ) в неинфарктных артериях (–2,13 % в группе алирокумаба против –0,92 % в группе плацебо). Во вторичных конечных точках, связанных с составом бляшек, наиболее выраженное снижение наблюдалось по такому параметру, как индекс максимальной липидной нагрузки ядра (определялся с помощью СБИКО), и значительно большее увеличение наблюдалось в минимальной толщине фиброзной капсулы (измеренной с помощью ОКТ) при приеме алирокумаба по сравнению с плацебо. Это свидетельствует о стабилизации бляшек при использовании ингибитора PCSK9 [60]. Тройная регрессия (данный параметр определялся как сопутствующее снижение ПОА, снижение содержания липидов и увеличение минимальной толщины фиброзной капсулы) наблюдалась у одной трети пациентов. Большая выраженность наблюдалась при лечении алирокумабом, чем при приеме плацебо (40,8 % против 23 %, соответственно). Эту тройную регрессию связывают со снижением частоты комбинированной конечной точки летального исхода, ИМ и реваскуляризации [61].
В исследовании HUYGENS [62] на примере 161 пациента с ИМ без подъема сегмента ST изучалось то, как влияет подкожное введение эволокумаба в дозе 420 мг (ежемесячно) в течение 52 недель на ОКТ-показатели состава бляшек. Лечение эволокумабом привело к благоприятным изменениям в их составе, о чем свидетельствует большее увеличение минимальной толщины фиброзной капсулы и большее снижение максимальной липидной дуги (первичная конечная точка), а также снижение индекса макрофагов. Также наблюдались свидетельства регрессии бляшек (более выраженное снижение ПОА) при терапии эволокумабом, по сравнению с плацебо [62]. Однако рандомизированное исследование ODYSSEY-J-IVUS [63] дало противоречивые результаты. У 206 госпитализированных в течение 1–12 мес. (на момент проведения исследования) японских пациентов с ОКС и остаточной гиперлипидемией (уровень ХС-ЛПНП в плазме > 100 мг/дл) подкожное введение алирокумаба в дозе 75 мг каждые 2 недели на фоне низкоинтенсивной терапии статинами не оказало значимого эффекта на первичную конечную точку, коей являлось процентное изменение нормализованного ООА, по сравнению с плацебо [63]. Более короткий период лечения (36 недель) и меньший размер выборки, чем в исследованиях GLAGOV и PACMAN-AMI, могли повлиять на обнаружение значительных различий в объеме бляшек в ходе этого исследования.
Помимо ингибирования моноклональными антителами PCSK9 применяется инклизиран — препарат, в основе структуры которого лежит малая интерферирующая РНК, которая нацелена на PCSK9 и снижает уровень холестерина ЛПНП в плазме примерно на 50 % в комбинации с фоновой гиполипидемической терапией у пациентов с высоким риском сердечно-сосудистых заболеваний или с установленным риском сердечно-сосудистых заболеваний [64]. Влияние инклизирана на морфологию бляшек, нагрузку и исходы сердечно-сосудистых заболеваний еще не оценивалось.
Бемпедоевая кислота. Бемпедоевая кислота является ингибитором АТФ-цитрат-лиазы; препарат снижает уровень холестерина ЛПНП в плазме и риск серьезных сердечно-сосудистых событий у пациентов с непереносимостью статинов [65]. Влияние бемпедоевой кислоты на стабилизацию или регрессию бляшек еще не изучалось.
Снижение уровня холестерина ЛПНП и общего количества бляшек
Как указано выше, фармакологические средства, продемонстрировавшие благоприятное воздействие на состав и регрессию бляшек, интенсивно снижают содержание ЛПНП в плазме. Преимущества терапии, снижающей уровень холестерина ЛПНП, наблюдаются уже вскоре после коронарных событий. В небольшом исследовании ESCORT [42], участниками которого были 53 пациента, применение терапии статинами после ОКС было связано с увеличением толщины фиброзной капсулы в первые 3 недели лечения. В исследованиях PACMAN-AMI [60] и HUYGENS [62] регрессия бляшек наблюдалась примерно через 1 год после рандомизации в группу ингибиторов PCSK9. Хотя в большинстве исследований, в которых оценивалась стабилизация и регрессия бляшек, использовалась терапия статинами, исследования ингибиторов PCSK9 показывают, что снижение уровня холестерина ЛПНП в плазме посредством различных механизмов может способствовать благоприятному влиянию на общее количество бляшек. Более того, дополнительное снижение уровня холестерина ЛПНП в дополнение к фоновой гиполипидемической терапии может способствовать кумулятивному эффекту на количество бляшек. Совокупность данных исследований по липидоснижающим (ХС-ЛПНП) средствам, по всей видимости, предполагает наличие связи между достигнутым уровнем холестерина ЛПНП в плазме и изменением ПОА. При этом, наибольшее снижение ПОА наблюдалось в испытаниях, в которых у пациентов были достигнуты самые низкие уровни холестерина ЛПНП в плазме. Однако прямое сравнение ограничено различными дизайнами исследования и исходными данными пациентов [6].
Целевые уровни холестерина ЛПНП и остаточный сосудистый риск
Средний уровень холестерина ЛПНП в плазме после лечения составил: при добавлении эволокумаба к базовой терапии — 36,6 мг/дл (исследование GLAGOV) [58]; при добавлении алирокумаба к базовой терапии — 23,6 мг/дл (исследование PACMAN-AMI) [60]; при добавлении эволокумаба к фоновой терапии — 28,1 мг/дл (исследование HUYGENS) [62].
Эти уровни ХС-ЛПНП в плазме намного ниже обычно упоминаемого порога для терапии ХС-ЛПНП в плазме (70 мг/дл) в случае вторичной профилактики [28]. Современный экспертный консенсус признал роль снижения уровня ХС-ЛПНП в плазме. В «Согласованном экспертном заключении» Американского Колледжа кардиологии 2022 года по нестатиновой терапии предлагается порог ХС-ЛПНП в плазме 55 мг/дл для вторичной профилактики у пациентов с очень высоким риском (лица с несколькими крупными СС-событиями или одно крупное СС-событие и состояние в анамнезе, повышающее риск до высокого), а также общий порог лечения 70 мг/дл у пациентов, не входящих в группу высокого риска [53]. Обсуждаемые выше данные испытаний позволяют предположить, что даже дальнейшее снижение уровня ЛПНП, значительно ниже 55 мг/дл, может оказать благоприятное воздействие на биомаркеры визуализации АССЗ. Эти данные также подтверждают необходимость своевременного использования нестатиновой терапии, в частности эзетимиба и ингибиторов PCSK9, в дополнение к фоновой терапии статинами для достижения оптимального снижения уровня ХС-ЛПНП. Однако остаточный риск АССЗ может сохраняться, несмотря на интенсивное снижение уровня ХС-ЛПНП в плазме. Например, в исследовании FOURIER [54] в группе экспериментального лечения эволокумабом имелся 9,8 % риск развития первичного сердечно-сосудистого события в течение периода наблюдения (медиана 2,2 года). Факторы, способствующие остаточному риску АССЗ: остаточные липопротеины, липопротеин (а) и кардиометаболические факторы — еще одна группа точек воздействия терапии, о которой далее.
Аферез
Аферез является стратегией экстракорпорального лечения, направленной на снижение уровня липопротеинов у пациентов с высоким риском, например, с семейной гиперхолестеринемией или повышенными уровнями липопротеинов (а) в плазме, у которых уровень липидов в плазме снижен до неадекватных значений, несмотря на ОМТ [66–68]. В исследовании LACMART [69] у 18 пациентов с семейной гиперхолестеринемией агрессивная стратегия афереза и медикаментозная терапия привела к уменьшению минимального диаметра просвета сосуда (по данным коронарографии) и площади бляшек (по данным ВСУЗИ), по сравнению с одной лишь медикаментозной терапией. Однако в исследовании PREMIER [70], где испытуемыми были 160 пациентов с ОКС (без семейной гиперхолестеринемии), сочетание афереза ЛПНП с терапией статинами сформировало тенденцию к более выраженной регрессии бляшек, по сравнению со стандартной терапией, хотя значение первичной конечной точки (процентное изменение ООА) не достигло статической значимости. В целом, эти предварительные данные подтверждают взаимосвязь между агрессивным снижением уровня ХС-ЛПНП в плазме под действием афереза и регрессией бляшек.
Другие липопротеиновые мишени
Несмотря на попытки максимального снижения уровня ЛПНП в плазме, у людей с АССЗ может быть существенный остаточный сердечно-сосудистый риск, который частично обусловлен кардиометаболическими факторами и остаточными липопротеинами плазмы [71–73]. Ученые понимают важность терапевтических возможностей снижения остаточного риска путем воздействия на другие частицы липопротеинов, такие как холестерин ЛПВП (ХС-ЛПВП), триглицериды и липопротеин (а). Согласно предварительным данным существует возможность уменьшения бляшек за счет дополнительной модификации липопротеинов, помимо снижения уровня холестерина ЛПНП в плазме.
Было показано, что витамин B ниацин благоприятно влияет на содержание некоторых липопротеинов. Однако не существует высококачественных данных о влиянии терапии ниацином на коронарные бляшки. В одном небольшом рандомизированном исследовании (n = 71) высокие дозы никотиновой кислоты в сочетании с фоновой терапией статинами повышали уровень ХС-ЛПВП в плазме и приводили к значительной регрессии каротидных бляшек [74]. Напротив, рандомизированное исследование AIM-HIGH [75] у пациентов с уже диагностированным сердечно-сосудистым заболеванием не выявило дополнительной пользы от ниацина в сочетании со статинами, несмотря на улучшение показателей ХС-ЛПВП в плазме. Кроме того, в плацебо-контролируемом исследовании HPS2-THRIVE [76] у пациентов с сосудистыми заболеваниями добавление ниацина пролонгированного действия (ларопипранта) к фоновой терапии статинами не вело к значительному уменьшению сосудистых событий, а приводило к лишь к увеличению числа нежелательных явлений.
Холестерин ЛПВП. Ингибиторы белка-переносчика эфиров холестерина (БПЭХ) повышают уровень холестерина ЛПВП в плазме, на основании чего предполагается, что они способны снижать частоту сердечно-сосудистых событий. Однако исследование ILLUMINATE [77] ингибитора БПЭХ торцетрапиба не продемонстрировало эффективности и значительно увеличило риск СС-событий и смертельного исхода. Последующие исследования показали альдостероноподобный побочный эффект торцетрапиба, который заключался в повышении уровня натрия и снижении уровня калия в сыворотке [78,79]. Кроме того, в исследовании ILLUSTRATE [80] ВСУЗИ использовалось для оценки изменений коронарного атеросклероза у 910 пациентов, рандомизированных для приема торцетрапиба и аторвастатина или только аторвастатина. О положительном влиянии добавления торцетрапиба на ПОА не сообщалось. Разработка торцетрапиба была прекращена в 2006 году.
Рандомизированные плацебо-контролируемые исследования ингибиторов БПЭХ далцетрапиба (испытание dal-OUTCOMES [81] среди пациентов с ОКС) и эвацетрапиба (исследование ACCELERATE [82] среди пациентов с высоким СС-риском) не выявили снижения частоты сердечно-сосудистых событий, несмотря на повышение уровня ХС-ЛПВП в плазме. В испытании IIb фазы dal-PLAQUE [27] оценивалась безопасность и эффективность дальцетрапиба по сравнению с плацебо с помощью МРТ и ПЭТ–КТ сонных артерий и аорты среди 130 пациентов с высоким риском развития ишемической болезни сердца или с уже с таковой. Было обнаружено, что дальцетрапиб не оказывает патологического воздействия на артериальную стенку в течение 24 месяцев, а также было высказано предположение о пользе препарата в виде снижения степени неоангиогенеза [27]. Впоследствии, в ходе исследования REVEAL [83] было показано, что анацетрапиб в значительной степени снижает количество крупных коронарных событий, по сравнению с плацебо (10,8 % vs 11,8 %; ОР 0,91, 95 % ДИ 0,85–0,97, P = 0,004), у пациентов с АССЗ. Примечательно, что в исследовании II фазы, проведенном в 2023 году, было показано, что обицетрапиб в сочетании с эзетимибом приводит к существенному снижению уровня ХС-ЛПНП в плазме (до 63 %) [84]. Согласно этим данным, ингибиторы БПЭХ также влияют на снижение уровня холестерина ЛПНП в плазме (а не просто способствуя повышению уровня холестерина ЛПВП в плазме). Влияние обицетрапиба на состояние атеросклеротических бляшек еще не изучено.
Хотя уровень ХС-ЛПВП в плазме находится в обратно-пропорциональной зависимости с сердечно-сосудистыми заболеваниями, вопрос СС-риска в традиционных эпидемиологических исследованиях, как например, при фармакологическом воздействии миметиками ЛПВП, способном уменьшить степень этого риска, остается полем неопределенности [85]. Не существует последовательных данных для поддержки концепции того, что вследствие использования миметиков ЛПВП можно добиться регрессии бляшек. В рандомизированном исследовании CHI-SQUARE [86] среди 507 испытуемых с ОКС инфузия миметика ХС-ЛПВП (CER-100), по сравнению с плацебо, не привела к регрессии бляшек, что было обнаружено с помощью ВСУЗИ и количественной коронарографии.
Аналогичным образом, исследование Atherosclerosis Regression Acute Coronary Syndrome, посвященное препарату CER-100 (сравнение проводилось с плацебо), показало, что спустя 10 недель внутривенного введения препарата регрессия атеросклеротических бляшек у пациентов с ОКС, лечившихся статинами, не наступает. Более того, у пациентов с ОКС, получавших статины, введение миметика ХС-ЛПВП, содержащего аполипопротеин А-1 Milano (MDCO-216), не приводило к регрессии бляшек (что было показано в многоцентровом двойном слепом рандомизированном исследовании MILANO-PILOT [88]). И, наоборот, применение в более раннем рандомизированном исследовании комплексного препарата рекомбинантного аполипопротеина А-1 Milano и фосфолипидного комплекса (ETC-216) привело к значительной регрессии коронарных бляшек у пациентов с ОКС (по данным ВСУЗИ) [89].
Другим подходом к повышению уровня ХС-ЛПВП является инфузия восстановленного ЛПВП. Однако исследование ERASE [90] с участием 183 пациентов с ОКС показало, что эта стратегия не привела к значительной регрессии бляшек (процентному изменению объема атеромы или номинальному изменению объема бляшки при ВСУЗИ), по сравнению с плацебо [90].
Триглицериды. Высокие уровни триглицеридов в плазме являются потенциальным источником остаточного сердечно-сосудистого риска, хотя, в отличие от холестерина ЛПНП, связь между фармакологическим снижением уровня триглицеридов и снижением частоты сердечно-сосудистых событий изучено недостаточно [91,92]. Влияние приема икозапент этила (IPE), снижающего уровень триглицеридов, на состояние коронарных бляшек было изучено в исследовании EVAPORATE [93], в котором приняли участие 80 пациентов с атеросклерозом коронарных артерий (по данным ККТА). Испытуемые были рандомизированы на группы приема IPE (по 4 г/сут) или плацебо; фоном они принимали статины. Исследователи сообщили о значительном снижении первичной конечной точки изменения бляшек низкой плотности спустя 18 месяцев в группе IPE. Однако у исследования имелись и важные ограничения, такие как неравнозначность исходного объема бляшек в двух группах, что предполагает возможность регрессии к среднему значению. Кроме того, в качестве плацебо выступало минеральное масло, которое, как уже известно, побочно влияет на ряд биомаркеров воспаления [94]. Благоприятное влияние IPE на регрессию бляшек было обусловлено более чем 100 % увеличением объема бляшек в группе плацебо (т.е., минерального масла) [93]. Последующий апостериорный анализ 28 пациентов из группы плацебо в исследовании Garlic 5 (плацебо — не минеральное масло) и 32 пациентов из группы плацебо в исследовании EVAPORATE (плацебо — минеральное масло) не выявил существенных различий в прогрессировании объема бляшек между двумя группами плацебо [95]. Таким образом, представление о влиянии IPE на состояние бляшек продолжает развиваться.
В исследовании CHERRY [96] 193 пациента с ИБС, перенесших ЧКВ, были рандомизированы для приема эйкозапентаеновой кислоты (омега-3 жирная кислота) в дозе 1800 мг + питавастатин в дозе 4 мг/сут или только питавастатин в дозе 4 мг/сут. ВСУЗИ с интегрированным обратным рассеянием использовалось для анализа объема и состава коронарных бляшек. Через 6–8 месяцев наблюдения не наблюдалось существенной разницы в эффекте по первичной конечной точке между группами. Хотя комбинированная терапия была связана со значительным снижением вторичной конечной точки — нормализованного ООА — по сравнению с монотерапией питавастатином [96].
Влияние фибратов на стабилизацию или регрессию бляшек не изучалось. Однако следует отметить, что исследование PROMINENT [92] , где испытуемыми были пациенты с сахарным диабетом 2 типа и легкой и умеренной гипертриглицеридемией, показало, что по сравнению с плацебо пемафибрат не снижает частоту сердечно-сосудистых событий. Таким образом, роль фибратов во вторичной сердечно-сосудистой профилактике у пациентов с легкой и умеренной гипертриглицеридемией в современной практике сомнительна.
Липопротеин (а). Повышенные значения липопротеина (а) в плазме являются важным фактором риска и новой терапевтической мишенью в контексте АССЗ, связанных с прогрессированием бляшек с низкой аттенюацией (по данным ККТА) у пациентов со стабильной ИБС [97,98]. Лекарства, предназначенные для снижения уровня липопротеина (а) в плазме, изучаются в нескольких текущих исследованиях исходов сердечно-сосудистых заболеваний [99]: пелакарсен (исследование HORIZON [100]) и олпасиран (исследование OCEAN(a) [101]). Связано ли фармакологическое снижение уровня липопротеина (а) плазмы с регрессией или стабилизацией бляшек, еще предстоит установить.
Нелипидные мишени воздействия
Препараты, снижающие уровень глюкозы. В исследовании PREDICT [102] было показано, что у пациентов с диабетом наблюдается усиленное прогрессирование нескольких маркеров атеросклеротического поражения. Например, ООА, и более неблагоприятные изменения в морфологии бляшек, по сравнению с пациентами, не страдающими диабетом [102]. Более того, в дополнительном исследовании JAPAN-ACS было показано, что высокие исходные уровни конечных продуктов гликирования были в значительной степени связаны с прогрессированием бляшек [103]. Однако трудно утверждать достоверно, что прием сахароснижающих препаратов приводит к регрессии или стабилизации бляшек.
В исследовании PERISCOPE [104,105] среди 543 пациентов с диабетом и ИБС пиоглитазон (препарат, снижающий уровень глюкозы из класса тиазолидиндионов) способствовал развитию благоприятных изменений в соотношении триглицеридов и ХС-ЛПВП и снижал маркеры прогрессирования бляшек, включая изменение ПОА. Однако в исследовании APPROACH [106] росиглитазон (из тиазолидиндионов) не способствовал регрессии бляшек, по сравнению с глипизидом у пациентов с диабетом 2 типа и ИБС.
Влияние новых сахароснижающих средств, таких как ингибиторы натрий-глюкозного котранспортера 2 (SGLT2) и агонисты рецепторов глюкагоноподобного пептида 1, на состояние бляшек в ходе рандомизированных исследований изучено не досконально. Данные наблюдений показывают, что по сравнению со стандартной терапией использование ингибитора SGLT2 связано с увеличением минимальной толщины фиброзной капсулы и снижением степени липидной дуги и накопления макрофагов (что оценивалось по ОКТ у пациентов с диабетом 2 типа и многососудистой необструктивной ИБС) [107].
Антигипертензивные препараты. Данные о влиянии на атеросклероз антигипертензивных препаратов противоречивы. По всей видимости, какая-то связь между снижением артериального давления и маркерами стабилизации или регрессии бляшек существует. В исследовании CAMELOT [108] у пациентов с ИБС, получавших блокатор кальциевых каналов амлодипин в дозе 10 мг/сут, не наблюдалось прогрессирования атеросклероза (по данным ВСУЗИ), по сравнению с тенденцией к прогрессированию такового при приеме ингибитора ангиотензинпревращающего фермента (иАПФ) эналаприла в дозе 20 мг в день (в группе плацебо наблюдалось значительное прогрессирование атеросклеротического поражения). Исследование OLIVUS [109] показало, что блокатор рецепторов ангиотензина II олмесартан значительно снижает первичную конечную точку ПОА, по сравнению с плацебо, у пациентов со стабильной ИБС. Однако в исследовании PERSPECTIVE [110] было показано, что у пациентов с ИБС, получавших статины, иАПФ периндоприл не оказывал влияния на прогрессирование бляшек (по данным ангиографии или ВСУЗИ). Аналогичным образом, в плацебо-контролируемом исследовании AQUARIUS [111] использование прямого ингибитора ренина алискирена не привело к регрессии бляшек или замедлению прогрессирования атеросклероза (по данным ВСУЗИ) у пациентов с предгипертонией и ИБС.
Колхицин. Низкие дозы колхицина снижают частоту крупных сердечно-сосудистых событий в группах вторичной профилактики [112,113]. В обсервационном исследовании 80 пациентов с ОКС в анамнезе (менее 1 месяца назад) применение низких доз колхицина (0,5 мг/сут), при добавлении к ОМТ, связывают с более выраженным снижением уровня С-реактивного белка (измеренного с помощью высокочувствительного анализа) и объема бляшек с низкой аттенюацией (по данным ККТА), по сравнению с одной лишь ОМТ [114]. Это исследование предоставляет предварительные доказательства изменения состояния бляшек в лучшую сторону при лечении колхицином, и, следовательно, дальнейшее изучение влияния колхицина на степень атеросклеротического поражения сосудов оправдано.
Другие лекарственные средства. Было изучено несколько других методов лечения регрессии бляшек с различными механизмами действия без убедительных доказательств положительного эффекта. Использование препаратов тестостерона у пожилых мужчин с симптоматическим гипогонадизмом привело к бОльшему увеличению объема некальцинированных коронарных бляшек, по сравнению с плацебо [115]. В исследовании STRADIVARIUS [116] у пациентов с ИБС, абдоминальным ожирением и метаболическим синдромом применение римонабанта, селективного антагониста каннабиноидов 1-го типа, для снижения веса и с метаболической целью не привело к благоприятному влиянию на ПОА, однако привело к снижению ООА. Исследование IIb фазы ASSURE [117] показало, что применение апабеталона (RVX-208), ингибитора бромодомена и экстратерминального белка, у пациентов с ИБС и низким уровнем холестерина ЛПВП в плазме не привело к большей регрессии бляшек, по сравнению с плацебо. Комбинированная терапия антигиперлипидемическим препаратом пробуколом и ингибитором фосфодиэстеразы 3-го типа цилостазолом, по сравнению с монотерапией цилостазолом, не привела к значительным изменениям в составе или объеме бляшек в исследовании SECURE [118], где испытуемыми были 119 пациентов, перенесших ЧКВ. Аналогичным образом, использование антиоксиданта сукцинобукола не привело к более выраженной регрессии бляшек, по сравнению с плацебо, среди пациентов, перенесших ЧКВ [119].
Существуют клинические данные о снижении частоты сердечно-сосудистых событий (но при этом увеличении частоты кровотечений) при добавлении низких доз ривароксабана к аспирину у пациентов со стабильно протекающим АССЗ [120]. Небольшое исследование 97 пациентов, в котором проводилась оценка влияния ривароксабана, по сравнению с варфарином, на изменение количества и состава бляшек (по данным ККТА), показало следующее. Ривароксабан связан со снижением прогрессирования абсолютного и нормализованного объема фиброзных бляшек, по сравнению с варфарином, без существенной разницы в скорости прогрессирования общего объема бляшек, а также объемов не- и кальцинированных бляшек [121]. В целом, исследования терапевтической антикоагулянтной терапии варфарином или прямыми пероральными антикоагулянтами относительно регрессии бляшек дают противоречивые результаты [6].
Выводы
Стабилизация и регрессия коронарных атеросклеротических бляшек являются важными биомаркерами активности данного заболевания. ВСУЗИ, несмотря на свой инвазивный характер, традиционно является предпочтительным методом визуализации для оценки степени поражения коронарных сосудов бляшками. Появление более продвинутых методов визуализации бляшек, таких как ККТА, OКТ и СБИКО, облегчает изучение прогрессирования и регрессирования атеросклероза без рисков, сопровождающих инвазивные методики. Снижение уровня холестерина ЛПНП в плазме до очень низкого уровня посредством интенсивной терапии статинами имеет убедительные доказательства стабилизации и регрессии бляшек. Эти доказательства основаны на рандомизированных исследованиях с использованием ВСУЗИ. Однако у некоторых пациентов значительный остаточный сердечно-сосудистый риск сохраняется даже после максимального снижения уровня ЛПНП в плазме. С учетом сохранения риска АССЗ в популяции следующие вопросы крайне важны:
- адекватность текущих порогов холестерина ЛПНП в ходе лекарственной терапии;
- отбор пациентов для крайне интенсивного снижения уровня холестерина ЛПНП;
- влияют ли рутинные методы визуализации бляшек на принятие решений о лечении в клинической вторичной профилактике.
Усилия клиницистов и ученых в будущем должны быть сосредоточены на дополнительных стратегиях снижения риска, как например, новые мишени терапевтического воздействия — уровни липопротеина (а) и триглицеридов в плазме — с целью устранения остаточного сердечно-сосудистого риска посредством благоприятного воздействия на морфологию и количество бляшек.





