Введение
Открытие пенициллина Александром Флемингом в 1928 году ознаменовало новую эру медицины, сделав излечимыми многие бактериальные инфекции и позволив безопасно проводить сложные операции [13]. С момента внедрения пенициллина в клиническую практику в 1940-х годах β-лактамные антибиотики стали и остаются одними из важнейших средств лечения бактериальных инфекций [10, 12]. Однако уже в первые годы их применения появились резистентные штаммы: так, к концу 1940-х у Staphylococcus aureus повсеместно выявлялась устойчивость к пенициллину [14] вследствие продукции фермента, разрушающего этот антибиотик (пенициллиназы). В течение последующих десятилетий фармация разработала новые β-лактамы (цефалоспорины, карбапенемы и др.) для преодоления резистентности, но и бактерии не стояли на месте.
Сегодня β-лактамные антибиотики остаются самой широко применяемой группой противомикробных препаратов [5], поэтому борьба с резистентностью к ним имеет критически важное значение. Основную роль в развитии устойчивости играют ферменты — β-лактамазы, которые инактивируют антибиотик ещё до того, как он достигнет своей мишени. За десятилетия использования пенициллина и его производных микроорганизмы выработали впечатляющий арсенал защитных ферментов [7].
Первые β-лактамазы были выявлены уже в середине XX века — буквально через несколько лет после внедрения пенициллина. Однако сами эти ферменты существовали задолго до появления антибиотиков, будучи эволюционно связаны с пенициллин-связывающими белками (ПСБ) бактерий [3]. С течением времени они эволюционировали от узкоспектрных пенициллиназ, активных только против бензилпенициллина, до современных карбапенемаз, способных разрушать почти весь спектр β-лактамов.
Каждое новое поколение антибиотиков вызывало ответную реакцию у бактерий: мутации, горизонтальный перенос генов и появление всё более устойчивых ферментов. Так, в 1960-х был впервые описан плазмидный фермент TEM-1 (имя пациента из Греции, у которого впервые выделили штамм E. coli, продуцирующий TEM-1), который стремительно распространился среди Enterobacteriaceae, Haemophilus influenzae и Neisseria gonorrhoeae. Позднее появились SHV-1 у Klebsiella pneumoniae и семейство CTX-M, ставшее ведущей причиной резистентности E. coli, Klebsiella, Shigella spp. и Salmonella enterica. Точечные мутации в генах TEM и SHV привели к возникновению β-лактамаз расширенного спектра (БРСЛ, ESBL — Extended-spectrum β-lactamases), способных инактивировать цефалоспорины III поколения.
Параллельно появились новые классы ферментов: цефалоспориназы AmpC и металло-β-лактамазы (MBL), зависимые от ионов цинка. Сегодня β-лактамазы — наиболее распространённый механизм резистентности у грамотрицательных бактерий [13]. Описано более 8000 разновидностей этих ферментов [9, 15].
Таким образом, эволюция β-лактамаз — это непрекращающаяся гонка вооружений между микробами и фармакологами: появление нового β-лактама почти неизбежно сопровождается возникновением фермента, способного его разрушить. Этот процесс — основа нарастающей антибиотикорезистентности. Однако именно понимание структуры и функций β-лактамаз позволяет создавать таргетные ингибиторы и разрабатывать молекулы, способные обходить или подавлять бактериальные механизмы защиты [6].
За десятилетия клинического применения β-лактамов бактерии выработали множество разнообразных β-лактамаз. Эти ферменты существовали у бактерий задолго до эры современных антибиотиков, будучи эволюционно связанными с пенициллин-связывающими белками (ПСБ) бактерий [3]. В настоящее время описано более 8000 β-лактамаз, способных разрушать β-лактамное кольцо [9, 15]. Такая быстрая эволюция обусловлена как спонтанными мутациями, так и распространением генов β-лактамаз между бактериями посредством плазмид и других мобильных элементов ДНК. Для медицины это означает постоянное появление «супербактерий», создающих серьезную угрозу неэффективности терапии [6].
Классификации β-лактамаз
β-Лактамазы представляют собой чрезвычайно разнообразное семейство ферментов, поэтому для их систематизации используются две основные классификационные системы. Молекулярная классификация Эмблера делит β-лактамазы на четыре класса — A, B, C и D — по сходству аминокислотной последовательности и структурным особенностям активного центра [1]. Ферменты классов A, C и D — это сериновые β-лактамазы, в активном центре которых ключевую роль играет остаток серина, тогда как класс B — это металло-β-лактамазы (MBL), использующие для гидролиза ион цинка [1].
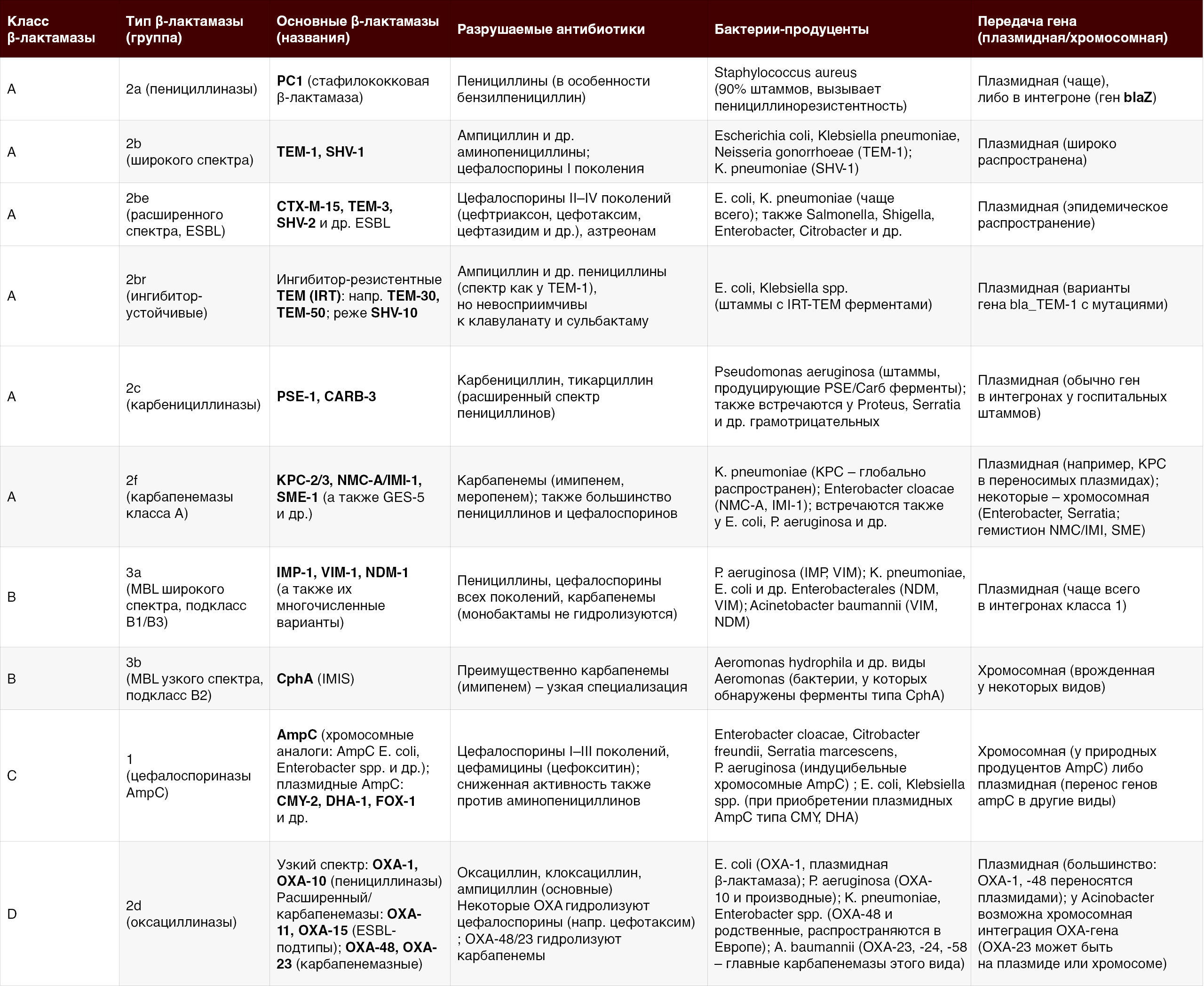
Примечание: β-лактамазы класса A (группа 2) обычно ингибируются классическими ингибиторами (клавулановой кислотой, сульбактамом, тазобактамом), за исключением некоторых 2br-мутантов и карбапенемаз.
Наиболее распространены и клинически значимы приобретенные MBL семейств IMP, VIM и NDM, которые выявлены по всему миру у различных грамотрицательных бактерий. Например, bla_NDM-1 впервые обнаружен у K. pneumoniae (Индия, 2007) и затем быстро распространился среди энтеробактерий по миру.
Индукция синтеза AmpC у таких бактерий, как Enterobacter, Citrobacter, Serratia и др., приводит к развитию резистентности при применении цефалоспоринов. Плазмидные AmpC (например, CMY-2, DHA-1) получили широкое распространение и могут вызывать устойчивость у E. coli, Klebsiella и других изначально не имевших AmpC видов.
Несколько оксациллиназ (OXA-11, OXA-14 – OXA-20) являются ESBL-модификациями, гидролизующими расширенный спектр цефалоспоринов. Карбапенемазы класса D включают семейства OXA-48-like (энтеробактерии) и OXA-23-like (ацинетобактер) – эти ферменты широко распространились в госпитальной среде по всему миру [1–3].
Другой широко используемый подход — функциональная классификация Буша-Жакоби-Медейроса, основанная на спектре гидролизуемых антибиотиков и чувствительности к ингибиторам [1], [3]. В этой функциональной схеме β-лактамазы разделяются на несколько групп:
- Группа 1 — цефалоспориназы класса C (AmpC, Amber-class C cephalosporinase). Характерна устойчивость к действию клавулановой кислоты и преимущественный гидролиз цефалоспоринов.
- Группа 2 — сериновые β-лактамазы классов A и D. Наиболее обширная группа, включающая несколько подклассов:
– 2a — стафилококковые пенициллиназы,
– 2b — β-лактамазы широкого спектра действия (например, TEM-1 – Temoniera-1),
– 2be — β-лактамазы расширенного спектра,
– 2br — ингибитор-резистентные β-лактамазы,
– 2f — карбапенемазы классов A и D (например, KPC – Klebsiella pneumoniae carbapenemase и OXA-48 – Oxacillinase-48), Большинство β-лактамаз группы 2 чувствительны к ингибиторам, таким как клавулановая кислота, за исключением 2br и части 2f. - Группа 3 — метало-β-лактамазы класса B. К ним относятся ферменты, такие как IMP (Imipenemase), VIM (Verona Integron-encoded Metallo-β-lactamase) и NDM (New Delhi Metallo-β-lactamase). Эти β-лактамазы инактивируют карбапенемы, устойчивы к действию ингибиторов и представляют собой один из самых грозных механизмов резистентности.[1].
Обе системы классификации дополняют друг друга: в клинической практике чаще оперируют понятиями классов A–D, но функциональные группы позволяют предсказать, какие антибиотики фермент способен гидролизовать и какие ингибиторы могут ему противодействовать [2]. Номенклатура отдельных β-лактамаз исторически складывалась хаотично (ферменты получали названия по месту обнаружения, свойствам или даже имени пациента), но сейчас принято присваивать новым ферментам порядковые номера в рамках семейств (например, TEM-1, TEM-2 и т.д.) [2]. Ниже приведено описание основных классов A, B, C, D β-лактамаз, наиболее значимых в клинике.
Существует ещё одна практическая классификация β-лактамаз, которая в клинической практике используется значительно чаще, чем формальные вышеописаные классификации. Она основана на функциональном делении β-лактамаз в зависимости от того, какие антибиотики они способны гидролизовать:
- Узкоспектровые β-лактамазы (Narrow-spectrum β-lactamases). Гидролизуют только «старые» пенициллины (например, ампициллин, бензилпенициллин), а также некоторые цефалоспорины 1 поколения, такие как цефалексин и цефазолин. Эти ферменты чувствительны к ингибиторам β-лактамаз (например, клавулановой кислоте).
- β-лактамазы расширенного спектра. Помимо пенициллинов, они инактивируют цефалоспорины 3-5 поколения (цефтриаксон, цефотаксим, цефтазидим), а также азтреонам.
- Карбапенемазы. Самая угрожающая группа: эти ферменты способны гидролизовать практически все β-лактамные антибиотики — от пенициллинов и цефалоспоринов до карбапенемов (имипенем, меропенем, дорипенем и др.).
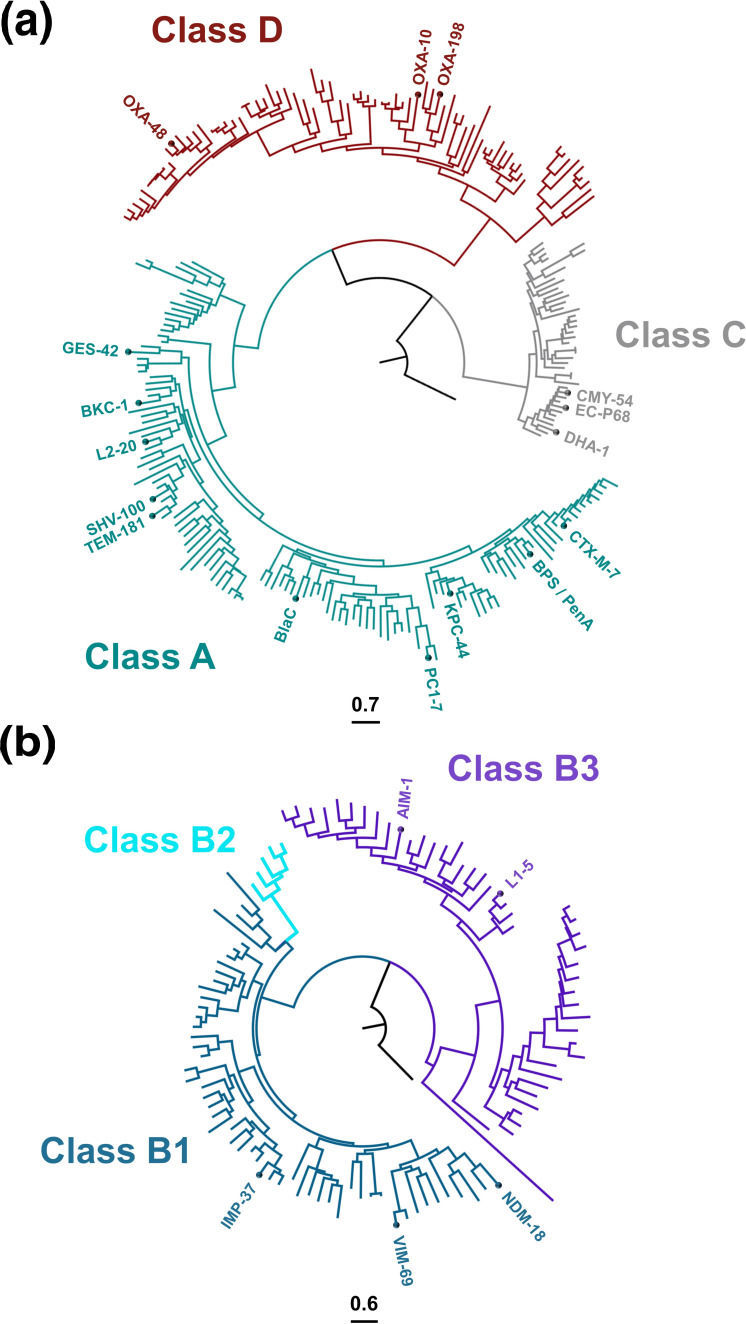
Филогенетическое древо бета-лактамаз
Класс A
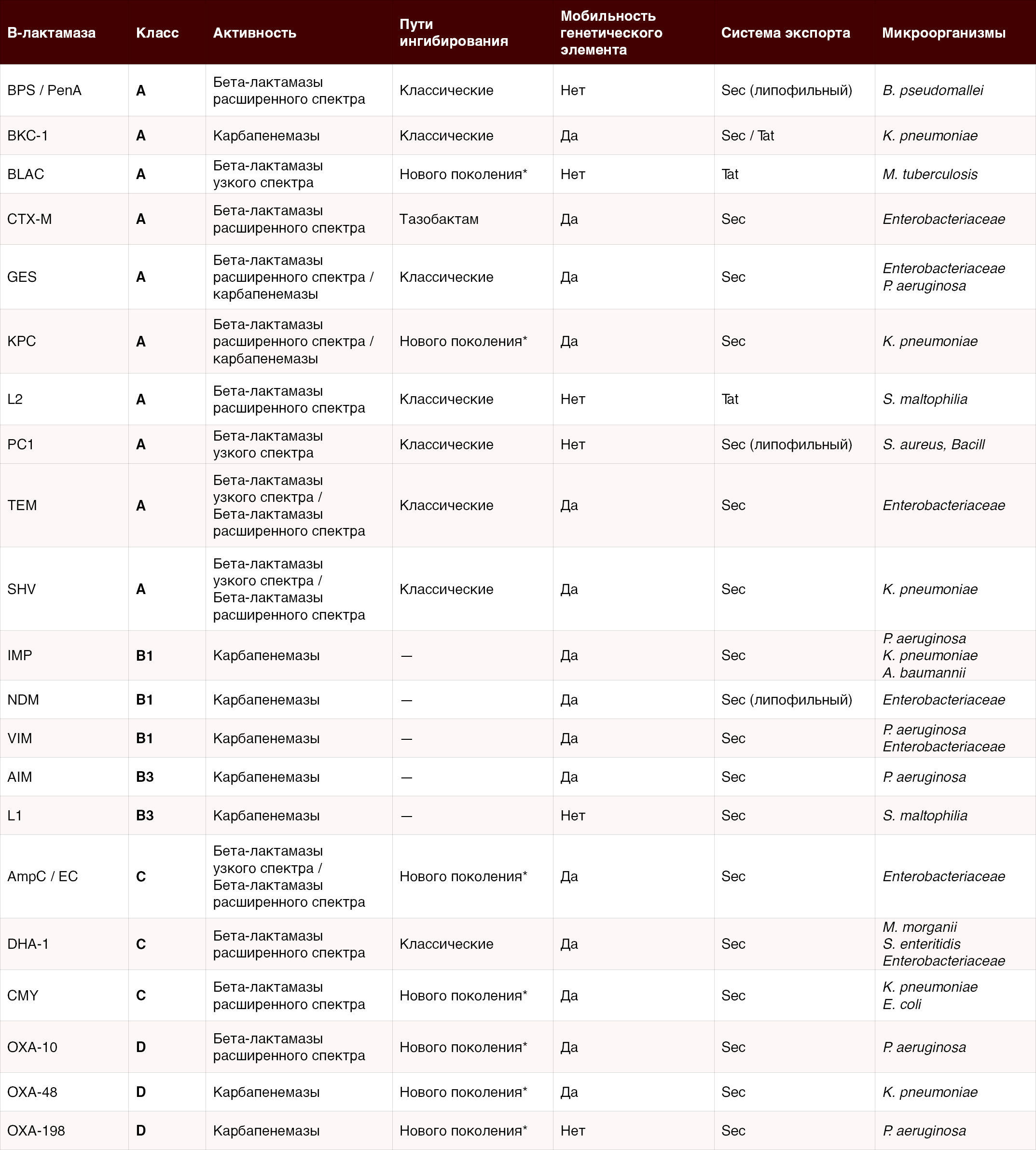
Класс A (Ambler) – самая обширная группа сериновых β-лактамаз. Эти ферменты обычно обладают широким спектром действия, гидролизуя пенициллины и многие цефалоспорины. Классическим примером являются плазмидные пенициллилазы Temoniera-1 и Sulfhydryl Variable-1 (SHV-1), широко распространившиеся среди кишечных бактерий и ставшие причиной резистентности к ампициллину у E. coli и Klebsiella pneumoniae уже в 1960–70-х годах [2]. До появления БЛРС именно TEM-1 оставалась основным фактором устойчивости к пенициллинам у E. coli и гонококков, а SHV-1 — у K. pneumoniae [2]. Позднее, путем точечных мутаций в генах TEM/SHV возникли БЛРС, способные разрушать цефалоспорины третьего поколения. Первые БЛРС (например, TEM-3, SHV-2) появились в 1980-х, а в 2000-х по всему миру распространились новые семейства БРЛС, главным образом CTX-M, ставшие наиболее распространенными β-лактамазами этого типа [2]. Ферменты класса A включают также серьезные карбапенемазы — например, KPC (Klebsiella pneumoniae carbapenemase), впервые выявленную в 2001 г. и ныне эндемичную во многих регионах. KPC относится к так называемым сериновым карбапенемазам и способна гидролизовать карбапенемы, что обуславливает крайне высокий уровень резистентности возбудителей [13]. В целом, классу A принадлежит множество клинически значимых β-лактамаз: помимо упомянутых TEM, SHV, CTX-M и KPC сюда входят и другие плазмидные β-лактамазы широкого спектра (например, PER, VEB, GES), а также хромосомные пенициллиназы некоторых Грам+ бактерий (фермент PC1 у S. aureus, обусловивший неэффективность пенициллина при стафилококковых инфекциях). Большинство β-лактамаз класса A эффективно подавляются классическими ингибиторами (клавулановой кислотой, тазобактамом), за исключением некоторых карбапенемаз (KPC) и мутантных БРЛС, устойчивых к ингибиторам (так называемые IRT — inhibitor-resistant TEM) — для них требуются новые ингибиторы.
Класс B
Класс B – это металло-β-лактамазы (MBL), фундаментально отличные по механизму действия. В активном центре MBL содержат ионы Zn2+, которые непосредственно активируют воду для гидролиза β-лактамного кольца. Эти ферменты способны разрушать практически все β-лактамные антибиотики, включая карбапенемы (исключение составляют лишь монобактамы, например азтреонам, который MBL гидролизуют крайне слабо) [1]. Металло-β-лактамазы обладают самым широким спектром гидролиза среди всех классов и потому представляют особую угрозу. К настоящему времени описано несколько десятков видов MBL, разделяемых на подгруппы B1, B2, B3. К клинически наиболее значимым относятся подгруппа B1: это приобретенные плазмидные карбапенемазы NDM, VIM, IMP, распространившиеся по всему миру [13]. Названия многих из них отражают географическое происхождение — например, New Delhi MBL (NDM) впервые выявлена в Индии в 2008 г., Verona integron MBL (VIM) — в Европе, Imipenemase (IMP) — в Японии. MBL подгруппы B3 (например, GIM, SIM) встречаются реже и обычно локальны. Подгруппа B2 (ферменты типа CphA) характерна для Aeromonas и гидролизует в основном только карбапенемы [1]. Металло-β-лактамазы часто обнаруживаются у полирезистентных госпитальных штаммов, сочетающих сразу несколько механизмов устойчивости. Так, бактерии, продуцирующие MBL, почти всегда одновременно устойчивы к фторхинолонам, аминогликозидам и другим антибиотикам [1]. Важнейшая проблема класса B — отсутствие эффективных ингибиторов в клинической практике: ни клавулановая кислота, ни другие доступные ингибиторы сериновых β-лактамаз не подавляют MBL [1]. Поэтому появление MBL (например, распространение NDM) резко ограничивает выбор антибиотикотерапии. Некоторые MBL являются приобретенными (плазмидными), другие же изначально присутствуют на хромосоме отдельных бактерий (например, L1 у Stenotrophomonas maltophilia, CcrA/CfiA у Bacteroides fragilis), однако последние обычно слабо экспрессируются и имеют меньшее клиническое значение [1]. Появление мобильных MBL в Enterobacterales и неферментерах с конца 1990-х привело к формированию штаммов с практически панрезистентным фенотипом.
Класс C
Класс C (по Эмблеру) — это AmpC-тип β-лактамаз, иначе называемые цефалоспориназы. Эти сериновые ферменты обычно не переносятся плазмидами, а закодированы в хромосомах многих грамотрицательных бактерий [13]. В нормальных условиях гены ampC у этих видов мало экспрессируются, поэтому первоначально штаммы чувствительны к β-лактамам. Однако под действием мутаций или индукции некоторыми антибиотиками синтез AmpC резко усиливается, что приводит к высоким уровням резистентности [13]. Классическими продуцентами AmpC являются возбудители из группы ESC (enterobacter, serratia, citrobacter) — например, Enterobacter cloacae, Citrobacter freundii, Serratia marcescens, а также Pseudomonas aeruginosa [2]. У этих бактерий повышенная экспрессия хромосомной AmpC приводит к устойчивости к большинству цефалоспоринов, включая цефтриаксон, цефотаксим и др. [2]. Кроме того, β-лактамазы класса C способны гидролизовать цефамицины (цефокситин), многие пенициллины и монобактам азтреонам [2]. В норме их активность недостаточна против карбапенемов, однако при сочетании с нарушением проницаемости мембран (потерей поринов) даже AmpC-β-лактамаза может обеспечивать устойчивость к карбапенемам [2].
Клиническая значимость AmpC возросла с обнаружением плазмидных вариантов этих ферментов: такие гены, как blaCMY, blaDHA, blaFOX были перенесены с хромосомных AmpC некоторых видов (C. freundii, Morganella morganii, Enterobacter) на плазмиды и распространились среди E. coli, Klebsiella и других патогенов [2, 13]. Плазмидные AmpC (иногда их называют цефаминазами) обычно гиперэкспрессируются за счет сильных промоторов и высокого числа копий гена, что делает их носителей высокоустойчивыми. Важное практическое отличие: ингибиторы первого поколения (клавуланат, тазобактам, сульбактам) плохо подавляют AmpC, поэтому инфекции, вызванные AmpC-продуцентами, не лечатся комбинированными препаратами типа амоксициллин-клавуланат или пиперациллин-тазобактам. К счастью, новые ингибиторы (например, авибактам, ваборбактам, релебактам, дурлобактам, энметазобактам) эффективно инактивируют большинство β-лактамаз класса C, что расширяет возможности терапии (см. ниже) [2].
Класс D
Класс D – это семейство так называемых оксациллиназ (OXA-ферментов). Они также относятся к сериновым β-лактамазам, но обладают рядом отличий (например, другой механизм активации серина в активном центре). Название «оксациллиназы» связано с тем, что первые выявленные ферменты этого класса гидролизовали оксациллин и клиоксакил — антистафилококковые пенициллины. Класс D включает десятки ферментов, большинство из которых обнаружены у грамотрицательных бактерий. Некоторые OXA-β-лактамазы имеют узкий спектр (разрушают преимущественно пенициллин и оксациллин) — примером служит OXA-1, часто встречающаяся у E. coli. Однако наибольшее клиническое значение имеют OXA, способные гидролизовать карбапенемы. К ним относятся прежде всего OXA-48 и родственные ферменты у Enterobacterales, а также многочисленные OXA у Acinetobacter baumannii (группы OXA-23, -24/40, -58 и др.) [13]. OXA-48 впервые выявлена в начале 2000-х в Турции, ныне её плазмидные гены широко распространены среди кишечных палочек и клебсиелл в Европе, Северной Африке и других регионах. Этот фермент отличается тем, что гидролизует карбапенемы менее эффективно, чем классические карбапенемазы (KPC, NDM), однако достаточно для клинической резистентности. Кроме того, OXA-48 не разрушает цефалоспорины III-V поколений (что маскирует её присутствие в стандартных тестах чувствительности) — из-за этих особенностей обнаружение OXA-48 представляет диагностическую сложность [5]. В то же время другие представители класса D у A. baumannii — OXA-23, OXA-24/40, OXA-58 — являются одной из главных причин высокой устойчивости ацинетобактеров к карбапенемам [13]. Гены OXA-карбапенемаз обычно находятся в составе мобильных элементов генома (например, транспозоны Tn2006/Tn2007 для OXA-23) и легко распространяются среди госпитальных штаммов A. baumannii. Следует отметить, что оксациллиназы класса D, как правило, не чувствительны к клавулонату и другим ингибиторам старого поколения [2]. Новый ингибитор авибактам способен частично подавлять некоторые OXA (в частности, OXA-48), что используется на практике в комбинации цефтазидим-авибактам для лечения инфекций, вызванных OXA-48-продуцентами [5]. В целом, распространение OXA-карбапенемаз, особенно в сочетании с другими механизмами резистентности, существенно ограничивает эффективность β-лактамов.
Механизм действия β-лактамаз
β-Лактамные антибиотики уничтожают бактерии, связываясь с их ферментами синтеза клеточной стенки — пенициллин-связывающими белками (ПСБ), которые имеют в активном центре серин. ПСБ представляют собой ферменты с транспептидазной и карбоксипептидазной активностью, участвующие в финальных этапах синтеза пептидогликана — поперечной сшивке его цепей и удалении концевых аминокислот. В результате β-лактам присоединяется к ПСБ (образуя ковалентный ацил-фермент), и жизненно важный фермент блокируется, что приводит к гибели клетки. β-Лактамазы действуют по схожему принципу, но с обратным исходом: они тоже присоединяют молекулу β-лактама к своему активному центру (формируя комплекс фермент–антибиотик), однако затем быстро гидролизуют (расщепляют) β-лактамное кольцо и высвобождают инактивированный антибиотик. Иными словами, β-лактамаза выступает как ловушка: она необратимо (в рамках жизни бактерии) нарушает структуру антибиотика, при этом сам фермент регенерируется и может разрушать следующие молекулы. На химическом уровне сериновые β-лактамазы осуществляют нуклеофильное присоединение β-лактама к активному серину с образованием ацил-энзима, после чего молекула воды гидролизует этот ковалентный комплекс, разрывая β-лактамное кольцо [6]. Для β-лактамаз эта реакция протекает очень быстро (в миллисекундных масштабах), тогда как для ПСБ разрыв связи происходит крайне медленно, поэтому ПСБ фактически необратимо блокируются антибиотиком. Таким образом, разница между мишенью и β-лактамазой — в скорости гидролиза: β-лактамаза действует как высокоэффективный катализатор, нейтрализуя антибиотик до того, как он достигнет ПСБ. Металло-β-лактамазы (Ambler класс B) используют иной механизм: в их активном центре один или два иона цинка координируют поляризацию β-лактамного амидного соединения и молекулы воды, что приводит к атаке молекулы воды на карбонильный центр β-лактама и его разрыву без образования ацил-фермента. Конечный результат тот же — разрыв четырехчленного β-лактамного кольца и превращение антибиотика в неактивный продукт. Все β-лактамазы ускоряют добавление молекулы воды к β-лактамному кольцу, тем самым «размыкая» его и лишая антибиотик способности ингибировать ПСБ [2, 13].
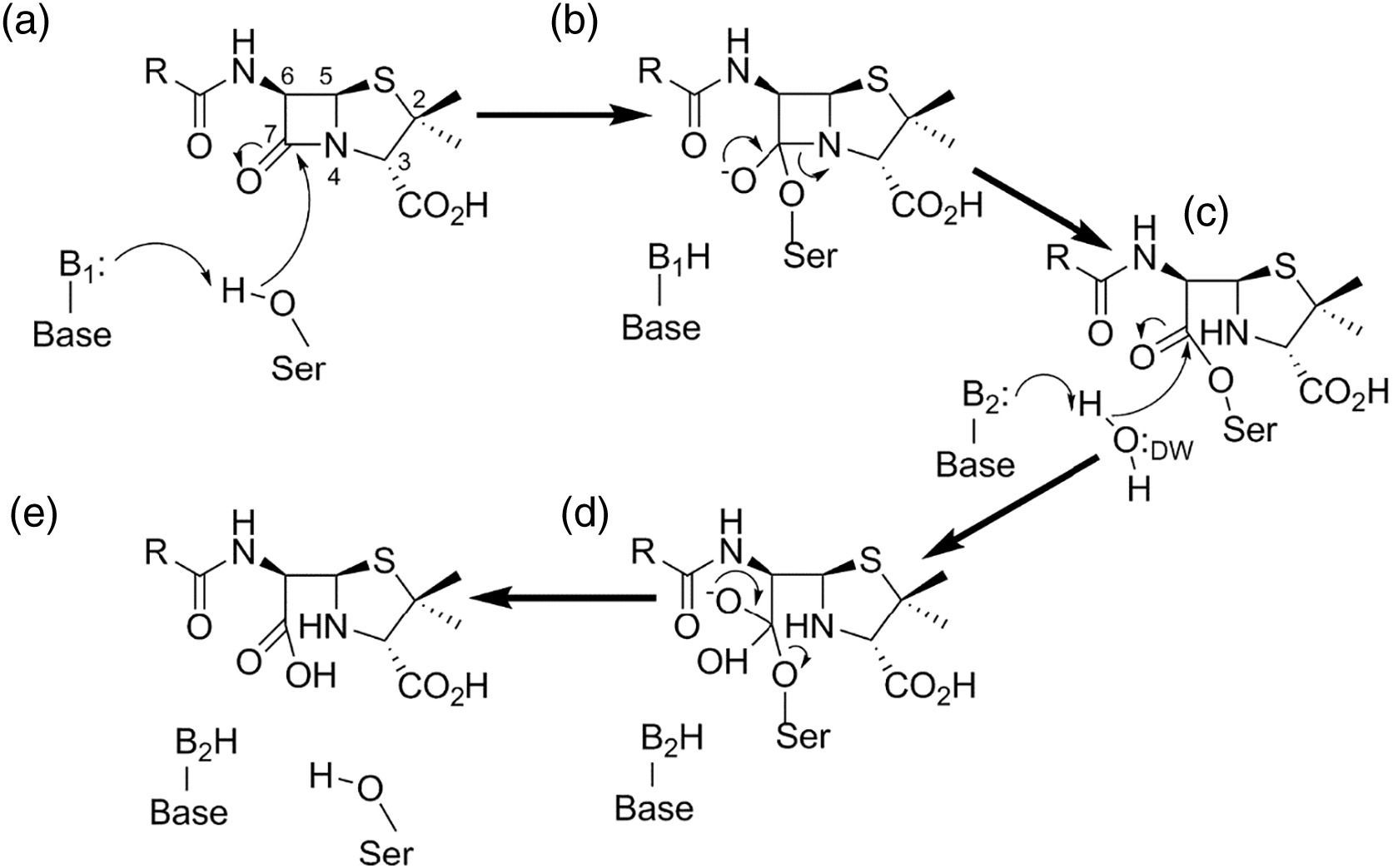
Механистическая схема работы сериновых β-лактамаз. На рисунке показан гидролиз обобщенного пенициллинового субстрата. (a) Общее основание B1 активирует серин (Ser) для нуклеофильной атаки на амидный карбонильный атом углерода (C7), что приводит к образованию ковалентного ацилферментного промежуточного продукта (c) через тетраэдрическое оксианионное переходное состояние ацилирования (b). Общее основание B2 активирует молекулу деацилирующей воды (DW) для нуклеофильной атаки на карбонильную группу ацилфермента, высвобождая продукт — пенициллоат (e) через тетраэдрическое переходное состояние деацилирования (d).
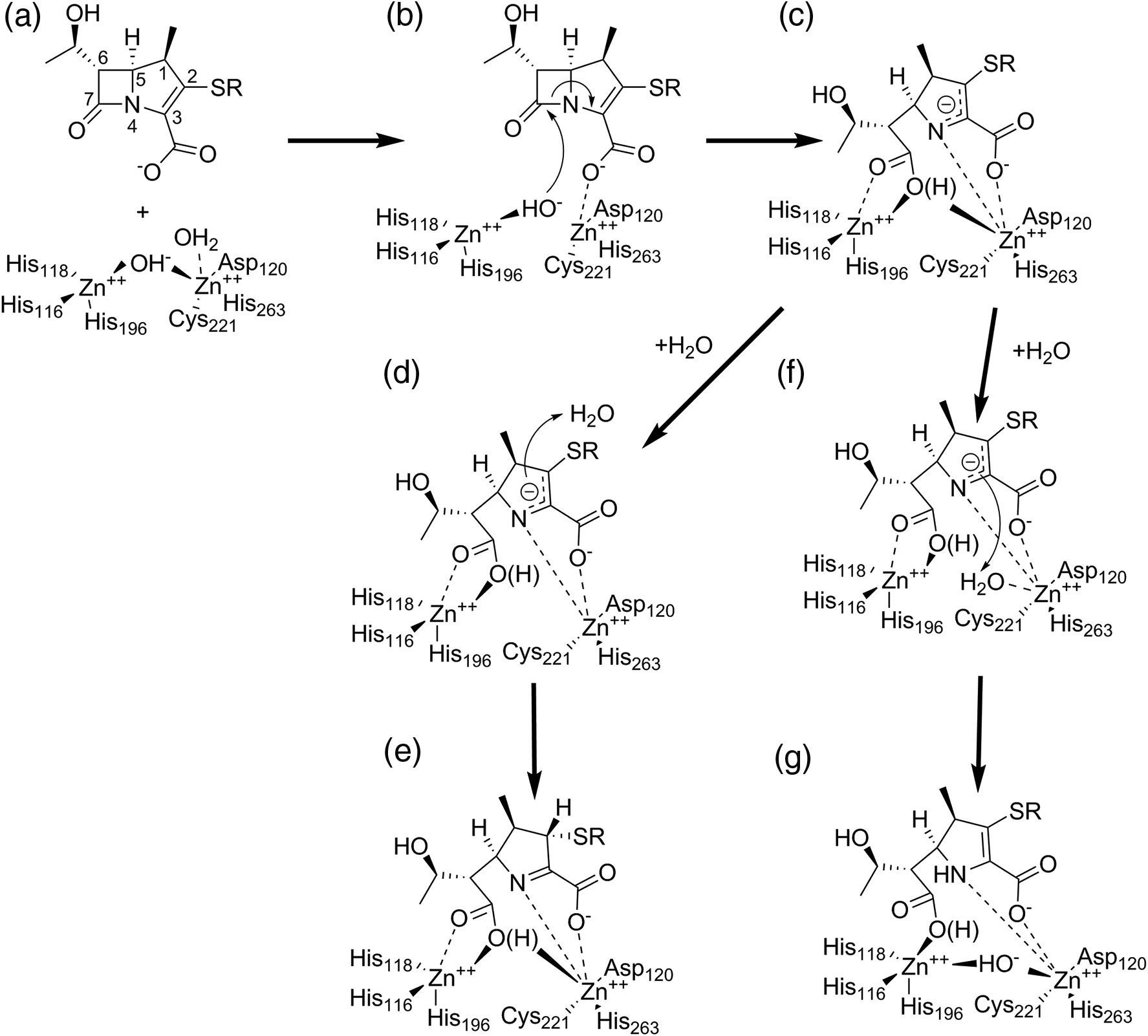
Возможный механизм гидролиза карбапенемов бинуклеарными металло-β-лактамазами класса B. (a) Связывание субстрата вытесняет гидроксид Zn-мостика в терминальное положение (b), что позволяет атаковать расщепляемый карбонил. (c) Анионный промежуточный продукт с делокализованным отрицательным зарядом вокруг пирролинового кольца разрешается либо (d) протонированием на C2 свободными молекулами воды, образуя (e) Δ1-пирролин, либо (f) протонированием на N4 поступающей водой в позиции мостика, образуя (g) Δ2-пирролиновый продукт. (Обратите внимание, что, как показано, связанная с Zn «апикальная» вода вытесняется субстратом; в некоторых предложениях указано, что при связывании субстрата она перемещается в позицию мостика)
Роль β-лактамаз в развитии резистентности
Продукция β-лактамаз – один из главных факторов, обусловливающих устойчивость бактерий к бета-лактамам. Многие опасные патогены, такие как кишечные палочки, клебсиеллы, синегнойная палочка и пр., приобрели гены β-лактамаз на плазмидах, которые легко распространяются между разными штаммами и видами бактерий (например, посредством конъюгации) [13]. Это приводит к быстрому распространению резистентности: так, появление гена blaCTX-M-15 (БРЛС класса A) в плазмидах E. coli и других энтеробактерий вызвало глобальную пандемию устойчивых к цефалоспоринам штаммов в 2000-х годах. Нередко у одного и того же клинического изолята обнаруживается сочетание нескольких β-лактамаз разных типов, что значительно расширяет спектр его резистентности [2]. Например, Klebsiella pneumoniae может одновременно продуцировать БРЛС (гидролизующий цефалоспорины) и OXA-48 (карбапенемазу), или P. aeruginosa — сразу несколько ферментов (AmpC + VIM и т.д.). В таких случаях суммарная активность β-лактамаз делает бактерию нечувствительной практически ко всем β-лактамным антибиотикам. Кроме того, β-лактамазные механизмы часто комбинируются с другими механизмами резистентности. Грамотрицательные бактерии могут снизить проницаемость своей клеточной стенки (утрата пориновых белков) и активнее выкачивать антибиотики (эффлюкс-помпы), что усиливает эффект β-лактамаз. Например, утрата поринов в клеточной стенке K. pneumoniae или Salmonella на фоне продукции плазмидной AmpC-β-лактамазы приводит к возникновению резистентности даже к карбапенемам [2]. В других случаях приобретение мутантных PBP (как PBP2a у MRSA) или модификация мишеней дополняют действие β-лактамаз, делая бактерию невосприимчивой к большинству доступных β-лактамов. В результате, во многих больницах появились мультирезистентные штаммы, продуцирующие одновременно β-лактамазы разных классов и обладающие устойчивостью к нескольким группам антибиотиков. Например, карбапенем-резистентные энтеробактерии с металло-β-лактамазами (NDM, VIM) обычно также несут гены ферментов БРЛС/AmpC и другие гены устойчивости, обеспечивая резистентность ко всем β-лактамам, фторхинолонам, аминогликозидам и др. [1]. Такая комбинация механизмов серьёзно ограничивает выбор эффективной терапии и повышает летальность инфекций.

Основные β-лактамазы у бактерий группы ESKAPE
В группу ESKAPE входят шесть проблемных патогенов, ответственных за большинство внутрибольничных инфекций и отличающихся множественной устойчивостью: Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa и Enterobacter spp. (наименование ESKAPE образовано первыми буквами латинских родов). Роль β-лактамаз в резистентности у этих возбудителей неодинакова:

Enterococcus faecium — кишечный грамположительный кокк, природно устойчивый ко многим β-лактамам. Устойчивость энтерококков к пенициллину/ампициллину чаще связана с аномально низким сродством ПСБ (мутация PBP5) и образованием слабосвязывающих пенициллин-связывающих белков. Собственные β-лактамазы энтерококки продуцируют редко; тем не менее у некоторых штаммов E. faecalis описана плазмидная пенициллиназа (аналогичная стафилококковой), придающая им устойчивость к пенициллину, но подавляемая ингибиторами. В целом же вклад β-лактамаз в антибиотикорезистентность энтерококков невелик — куда более актуальны модификации ПСБ и устойчивость к гликопептидам (ванкомицину). Такие штаммы обозначаются как VRE (Vancomycin-Resistant Enterococci)
Staphylococcus aureus — один из ключевых нозокомиальных возбудителей. S. aureus — грамположительный кокк, против которого изначально был чрезвычайно эффективен пенициллин, однако уже через несколько лет после начала его применения ситуация изменилась. S. aureus быстро приобрел плазмиду с геном β-лактамазы (фермента β-лактамазы класса A, известного как пенициллиназа BlaZ), и уже к 1950-м более 80 % изолятов стафилококков были пенициллин-резистентными [14]. В современной популяции S. aureus свыше 90 % штаммов продуцируют β-лактамазу BlaZ [5], вследствие чего естественные пенициллины (пенициллин G, ампициллин) практически не применяются для стафилококковых инфекций. Проблему частично решили разработкой β-лактамазоустойчивых пенициллинов (метициллина, оксациллина и др.), однако в 1960-х появился новый механизм резистентности — измененный PBP2a, не чувствительный к связыванию β-лактамами (MRSA). Тем не менее β-лактамаза остается важным фактором: S. aureus по-прежнему сохраняет ген blaZ на мобильном элементе (транспозоне), часто в составе мультирезистентных плазмид [5]. Этот фермент гидролизует пенициллин и аминопенициллины, а также ослабляет действие цефалоспоринов 1-го поколения, но подавляется клавулановой кислотой, поэтому оксациллинчувствительные стафилококки обычно успешно лечатся ингибиторзащищенными пенициллинами. Для лечения же MRSA требуются совсем другие группы антибиотиков (ванкомицин, линезолид и др.), так как β-лактамазы не играют роли при метициллинорезистентности.
Klebsiella pneumoniae — грамотрицательная энтеробактерия, один из самых известных представителей семейства Enterobacteriaceae, продуцирующих β-лактамазы. K. pneumoniae обладает врожденной хромосомной β-лактамазой широкого спектра SHV-1 (Ambler класс A), которая обеспечивает природную устойчивость к ампициллину. В дополнение к этому, клебсиеллы легко приобретают плазмидные β-лактамазные гены. Начиная с 1980-х основными проблемами стали БРЛС (например, TEM- и SHV-мутанты, а затем семейство CTX-M) — их распространение привело к неэффективности цефалоспоринов III поколения при многих госпитальных штаммах Klebsiella [2]. В 2000-х появилась еще более грозная угроза — карбапенемазы. K. pneumoniae стала первой энтеробактерией, в котором выявили плазмидную карбапенем-гидролизующую β-лактамазу KPC [13]. Вслед за KPC у клебсиелл появились и другие карбапенемазы: металло-β-лактамазы (NDM, VIM) и OXA-48. Сегодня K. pneumoniae считается корифеем по части β-лактамаз: в отдельных штаммах находят сразу несколько ферментов (например, одновременно KPC и VIM, или OXA-48 и CTX-M и т.д.). Эти механизмы в совокупности делают многих клебсиелл практически неуязвимыми к β-лактамным антибиотикам. Всемирная организация здравоохранения отнесла карбапенем-резистентные K. pneumoniae к патогенам критического приоритета. Для успешного лечения инфекций, вызванных такими штаммами, требуются комбинированные препараты с новыми ингибиторами (см. ниже).
Acinetobacter baumannii — неферментирующая грамотрицательная палочка, один из ведущих возбудителей госпитальных пневмоний, сепсиса у реанимационных больных. A. baumannii обладает поразительной способностью развивать резистентность. Главный механизм устойчивости к β-лактамам у этого патогена — продукция карбапенемаз OXA-класса D. Известно несколько групп ферментов: OXA-23, OXA-24/40, OXA-58 и др., которые распространяются клонами A. baumannii по всему миру [13]. Эти β-лактамазы не родственные по происхождению OXA-48 энтеробактерий, но функционально сходны: они инактивируют карбапенемы, зачастую не затрагивая расширенные цефалоспорины (поэтому Acinetobacter может оставаться чувствительным к цефтазидиму, но устойчивым к имипенему). Помимо OXA, у A. baumannii описаны и металло-β-лактамазы (NDM, VIM), однако они встречаются реже. Еще один фермент — хромосомная цефалоспориназа AmpC (ADC) класса C — тоже присутствует у всех ацинетобактеров, но его роль в резистентности второстепенна по сравнению с карбапенемазами. В силу множественной лекарственной устойчивости (как β-лактамазной, так и за счет эффлюкса, поринов и пр.) A. baumannii включен в число особо опасных патогенов, против которых срочно нужны новые антибиотики. Лечение тяжелых инфекций, вызванных карбапенем-резистентным Acinetobacter (Carbapenem-resistant A. baumannii (CRAB)), крайне затруднено; применяют комбинации полимиксинов, тигециклина, высоких доз сульбактама и новые препараты (например, цефалоспорины с ингибитором дулобактамом).
Pseudomonas aeruginosa — еще один неферментер (неферментеры — это грамотрицательные палочки, которые не ферментируют глюкозу в анаэробных условиях. К ним отнсятся также Acinetobacter spp., Stenotrophomonas maltophilia и другие.), грозный оппортунистический патоген. P. aeruginosa обладает природной устойчивостью ко многим антибиотикам за счет малой проницаемости внешней мембраны и активных эффлюкс-систем. В отношении β-лактамов у синегнойной палочки главную роль играет хромосомная AmpC-β-лактамаза (Ambler класс C), также называемая пенициллиназой типа PDC. Базально она экспрессируется слабо, но у мутантных штаммов или под действием индукторов уровень синтеза AmpC/PDC резко возрастает, что приводит к устойчивости к карбоксипенициллинам, большинству цефалоспоринов и ингибитор-защищенным пенициллинам. Таким образом, у P. aeruginosa может развиться резистентность к цефтазидиму, пиперациллину/тазобактаму и др. за счет гиперпродукции AmpC. В отличие от энтеробактерий, классических плазмидных БРЛС типа CTX-M у синегнойной палочки не встречается, однако описаны свои разновидности β-лактамаз расширенного спектра (PER, VEB, GES и др., Ambler класс A). Кроме того, P. aeruginosa нередко получает плазмиды с карбапенемазами — прежде всего металло-β-лактамазами VIM и IMP, реже NDM. В некоторых географических регионах до 20–30 % карбапенем-резистентных штаммов синегнойной палочки продуцируют MBL. В совокупности перечисленные механизмы делают P. aeruginosa трудноподдающимся терапии патогеном, особенно у ослабленных и реанимационных пациентов (где распространены так называемые XDR-штаммы с экстремальной резистентностью). Для лечения тяжелых инфекций, вызванных Pseudomonas, нередко требуются комбинации (например, цефтазидим/авибактам + азтреонам, цефтолозан/тазобактам и др.). [2, 13]
Enterobacter spp. — под этим названием обычно подразумеваются виды E. cloacae, E. hormaechei, E. aerogenes (ныне Klebsiella aerogenes) и родственные. Они, как и цитробактер, серрация, имеют индуцибельную хромосомную AmpC-β-лактамазу (Ambler класс C), которая при мутациях derepression (подавление функций репрессора, вторичная активация) начинает постоянно экспрессироваться в больших количествах [13]. Такие мутанты появляются спонтанно под влиянием β-лактамных антибиотиков и объясняют феномен «прорыва» терапии цефалоспоринами: например, при лечении Enterobacter цефалоспорином третьего поколения сначала может наблюдаться улучшение, а затем состояние ухудшается из-за селекции штамма с гиперпродукцией AmpC и инактивацией препарата. Поэтому инфекции, вызванные Enterobacter, не рекомендуется лечить цефтриаксоном и цефотаксимом — предпочтительны карбапенемы или цефепим, менее подверженный гидролизу AmpC. Помимо хромосомной AmpC, энтеробактеры способны получать плазмиды с β-лактамазами: у них встречаются БРЛС (CTX-M, TEM и др.), а с 2010-х ширится распространение карбапенемаз (KPC, NDM и др.), часто в составе конгломерата генов (например, плазмиды с bla_KPC также несут гены БРЛС). Карбапенем-резистентные Enterobacter наряду с карбапенем-резистентными клебсиеллами и эшерихиями отнесены к критическим патогенам по классификации ВОЗ.
Shigella spp. — близкородственный E. coli род, вызывающий бактериальную дизентерию. Исторически Shigella быстро приобрели плазмидные β-лактамазы узкого спектра, что сделало их устойчивыми к ампициллину еще во второй половине XX века. К примеру, многие изоляты Shigella dysenteriae и S. flexneri продуцируют TEM-1 или OXA-1, обеспечивая резистентность к ампициллину и амоксициллину. В клинике это привело к отказу от ампициллина как терапии шигеллеза. Вместо него предпочтение отдали ко-тримоксазолу, фторхинолонам или цефалоспоринам. Однако со временем у шигелл по всему миру стали появляться β-лактамазы расширенного спектра. Сейчас зарегистрированы штаммы Shigella sonnei и S. flexneri, продуцирующие CTX-M типы ESBL (например, CTX-M-15, -14 и др.). Это приводит к устойчивости ко всем цефалоспоринам III поколения — традиционному резерву при тяжелом течении шигеллеза у детей. Также описаны случаи приобретения плазмид AmpC (CMY-2) шигеллами, хотя реже, чем у сальмонелл [20].
Salmonella spp. — Salmonella enterica (тифозные и нетифозные серовары) приобрела широкий набор β-лактамаз, влияющих на эффективность терапии. В 1980–90-х у кишечных сальмонелл (S. Typhimurium, S. Enteritidis) распространились плазмидные TEM-1 и PSE-1, обеспечив устойчивость к ампициллину и карбоксипенициллинам. У S. Typhi множественная резистентность была связана с плазмидами, содержащими TEM-1 и гены устойчивости к другим препаратам, что привело к отказу от ампициллина и хлорамфеникола. Серьезной проблемой стало распространение устойчивости к цефтриаксону. Основные механизмы — продукция БРЛС (чаще CTX-M-15) и плазмидной AmpC (чаще CMY-2). Эти β-лактамазы выявлены у различных сероваров Salmonella по всему миру. Особенно часто CMY-2 встречается в США и Европе. Описаны также единичные случаи карбапенемаз (например, NDM-1 у S. Typhimurium в Индии) [20, 21].
N. gonorrhoea — Гоноккок изначально была чувствительна к пенициллину, но уже в 1970-х появились штаммы, продуцирующие плазмидные β-лактамазы типа TEM-1 (PPNG — penicillinase-producing N. gonorrhoeae), разрушающие пенициллины и их производные. Распространение гена blaTEM привело к отказу от пенициллина и переходу на цефалоспорины III поколения (например, цефтриаксон). Кроме β-лактамаз, у гонококков выявлены хромосомные мутации, повышающие минимальную ингибирующую концентрацию (MIC) пенициллина — мозаичные аллели гена penA (модифицированный PBP2) и мутации в регуляторных участках насоса mtrCDE, снижающие проникновение препарата. Такие штаммы обозначают как CPRNG — chromosomally mediated penicillin-resistant N. gonorrhoeae. Однако выраженная резистентность (>16 ЕД пенициллина) чаще обусловлена именно продукцией β-лактамазы. Таким образом, у N. gonorrhoeae обладает несколькими механизмами резистентности: β-лактамазы играют важную, но не основную роль, уступая по значимости хромосомным мутациям в мишенях и системах транспорта. [20].
Haemophilus influenzae — частый возбудитель респираторных инфекций — активно продуцирует β-лактамазы. Наиболее распространены плазмидные ферменты класса A: TEM-1 и ROB-1. Они гидролизуют ампициллин и амоксициллин, но чувствительны к ингибиторам (например, клавуланату). К 1990-м годам 15–30% изолятов по миру продуцировали β-лактамазу, а в некоторых странах Азии доля превышала 50%.Более сложный механизм — BLNAR (β-lactamase-negative ampicillin-resistant) — связан с мутациями в гене ftsI, кодирующем PBP3. Эти штаммы устойчивы к ампициллину, несмотря на отсутствие β-лактамазы. Отдельно выделяют BLPACR (β-lactamase positive, amoxicillin-clavulanate resistant), где сочетаются фермент и модифицированная мишень. К счастью, их доля невелика (<5%). В клинике наличие β-лактамазы исключает применение ампициллина. Предпочтение отдают амоксициллин/клавуланату или цефалоспоринам II–III поколений, активным как против β-лактамазопозитивных, так и против большинства BLNAR. При менингите используют цефотаксим или цефтриаксон. Лабораторно маркером β-лактамазы служит положительный тест с нитроцефином. Однако отрицательный результат не исключает BLNAR — такие штаммы выявляются по повышенному MIC при отсутствии фермента. Вне Японии доля BLNAR остаётся умеренной (до 10%).
Почему β-лактамазы чаще встречаются у грамотрицательных бактерий?
Отчетливо заметна разница между грамположительными и грамотрицательными бактериями в стратегии противодействия β-лактамным антибиотикам. Грамположительные (Staphylococcus, Enterococcus, Streptococcus и др.) имеют толстую клеточную стенку, но не обладают внешней мембраной. Если они продуцируют β-лактамазу, этот фермент выделяется во внешнюю среду и может диффундировать. В результате часть молекул антибиотика действительно инактивируется, но другая часть все же достигает бактериальных ПСБ и блокирует синтез стенки. Поэтому у грамположительных эволюционно менее выгодно производство β-лактамаз (эффект недостаточно полный), и основной путь приобретенной резистентности у них — модификация мишени. Так, Streptococcus pneumoniae вырабатывает измененные пенициллин-связывающие белки, понижающие сродство ко всем β-лактамам, что делает его устойчивым (при этом никаких β-лактамаз у пневмококка нет). S. aureus после эпохи пенициллиназы BlaZ тоже преодолел метициллин за счет мутантного PBP2a, а не новой β-лактамазы. Грамотрицательные бактерии, напротив, имеют тонкую клеточную стенку, окруженную внешней мембраной, образующей периплазматическое пространство — замкнутую среду вокруг клеточной стенки. β-Лактамазы у грамотрицательных локализуются именно в периплазме, где они могут задерживаться в высокой концентрации. Когда через порины внешней мембраны проникает молекула антибиотика, она сразу попадает в «ловушку» периплазматической β-лактамазы и разрушается до того, как достичь ПСБ на внутренней мембране. Такой механизм очень эффективен, поэтому грам- эволюционно приобрели множество β-лактамаз и широко распространили их гены. К тому же у грамотрицательных плазмиды и другие мобильные элементы горизонтального переноса играют большую роль, что способствует обмену генами β-лактамаз между различными видами [13, 14]. В результате именно среди грамотрицательных (энтеробактерий, неферментеров) мы наблюдаем наибольшее разнообразие β-лактамаз и наиболее выраженные проблемы с лекарственной устойчивостью. У грамположительных же долгое время была известна лишь одна плазмидная β-лактамаза (стафилококковая пенициллиназа), а остальные механизмы (изменение PBP у пневмококков, MRSA, образование толерантных L-форм и др.) преобладали. Тем не менее, ситуацию нельзя упрощать: некоторые грамотрицательные (например, Mycobacterium tuberculosis) вообще не имеют β-лактамаз, а некоторые грамположительные (анаэробы типа Bacteroides fragilis) как раз продуцируют β-лактамазы (например, фермент CepA у B. fragilis). Но в целом, клинически значимые β-лактамазы гораздо чаще встречаются и приносят проблемы именно у грамотрицательных патогенов.
Терапевтические последствия
Влияние β-лактамаз на выбор антибиотиков
Наличие у бактерии того или иного гена β-лактамазы существенно влияет на выбор эффективного антибиотика. Врачам важно учитывать характер β-лактамаз при выборе препарата. Например, при инфекциях, вызванных продуцентами БРЛС (расширенного спектра β-лактамаз, чаще всего E. coli или Klebsiella), установлено, что наилучшие результаты дает терапия карбапенемами. Карбапенемы (меропенем, имипенем и др.) устойчивы к гидролизу большинством БРЛС [8], поэтому являются препаратами выбора для тяжелых инфекций, вызванных БРЛС-продуцирующими энтеробактериями. Напротив, применение цефалоспоринов при таких инфекциях сопряжено с высоким риском неуспеха и селекции резистентных клонов. Аналогично, при инфекциях, вызванных бактериями с мощными AmpC-β-лактамазами (например, Enterobacter, Citrobacter, Serratia), неэффективны многие пенициллины и цефалоспорины, особенно третьего поколения [2]. Предпочтение отдают карбапенемам или цефепиму, который менее подвержен гидролизу AmpC за счет структуры молекулы. В случае грамотрицательных неферментеров (P. aeruginosa, Acinetobacter), уже изначально резистентных к ряду β-лактамов, выбор терапии тоже диктуется β-лактамазами: синегнойная палочка, гиперпродуцирующая AmpC, нечувствительна к пиперациллин/тазобактаму и цефтазидиму, но может ответить на карбапенем или цефепим; A. baumannii с OXA-карбапенемазой не лечится имипенемом, зато может быть чувствительна к комбинации сульбактам + цефалоспорин (цефоперазон, цефепим).
Для клинически значимого подбора терапии ключевую роль играет лабораторная диагностика. По рекомендациям European Committee on Antimicrobial Susceptibility Testing (EUCAST), антибиотики-маркеры помогают заподозрить тип β-лактамазы: пенициллин — маркер стафилококковой β-лактамазы; ампициллин ± нитроцефин — маркер у H. influenzae; цефотаксим/цефтазидим ± клавуланат — маркер ESBL у Enterobacterales; цефокситин — для AmpC; карбапенемы с ингибиторами — для карбапенемаз. Грамотная интерпретация этих тестов позволяет вовремя перейти на эффективную терапию и избежать неудачи лечения.
Ингибиторы β-лактамаз и новые комбинации
Для борьбы с бактериальными β-лактамазами были разработаны специальные ингибиторы β-лактамаз — вещества, необратимо блокирующие активность фермента. Клавулановая кислота, сульбактам и тазобактам — первые ингибиторы, внедренные в практику. Они значительно расширили спектр действия пенициллинов и цефалоспоринов при лечении инфекций, вызванных продуцентами β-лактамаз класса A. Так, комбинации амоксициллин/клавуланат, пиперациллин/тазобактам, ампициллин/сульбактам эффективно действовали на штаммы, продуцирующие узкоспекторные β-лактамазы (TEM-1, SHV-1) и многие БРЛС. Однако ингибиторы первого поколения не активны против большинства ферментов классов B, C и D. Поэтому при появлении у бактерий AmpC, металло-β-лактамаз или OXA-оксациллиназ эффективность старых ингибиторзащищенных комбинаций резко падала [2].
Среди этих веществ особое место занимает сульбактам, обладающий двойным действием: он не только ингибирует ферменты класса A, но и проявляет собственную бактерицидную активность против Acinetobacter baumannii, связываясь с его PBP-1a, -1b и -3. Это делает его «адресным» антибиотиком. Появление карбапенем-резистентных штаммов A. baumannii вновь вернуло интерес к сульбактаму, особенно в виде новой комбинации с дурлобактамом — мощным ингибитором β-лактамаз классов A, C и D. В 2023 году фиксированная комбинация сульбактам/дурлобактам была одобрена FDA для лечения инфекций, вызванных CRAB (carbapenem-resistant A. baumannii). [24, 25]
В 2010-х годах произошел прорыв: были созданы новые ингибиторы несравнимо большей мощности и спектра. К ним относятся: авибактам и родственные диазабициклоктаноны (ингибируют класс A, C и часть D) [2], ваборбактам (бороновый ингибитор, активный против KPC и др.), релебактам (ингибитор, комбинируемый с имипенемом). Уже одобрены и применяются несколько новых комбинаций: цефтазидим/авибактам, меропенем/ваборбактам, имипенем/циластатин/релебактам. Особое значение они имеют для лечения инфекций, вызванных карбапенем-резистентными энтеробактериями с KPC-карбапенемазами, в частности, введение авибактама и других новых ингибиторов значительно улучшило исходы у пациентов с такими инфекциями [11]. Новые ингибиторы эффективно «воскрешают» действие соответствующих β-лактамов против многих устойчивых патогенов. Например, авибактам блокирует KPC и OXA-48, благодаря чему комбинация цефтазидим/авибактам активна против продуцирующих их K. pneumoniae; Ваборбактам подавляет KPC, и меропенем/ваборбактам стал ценным оружием против KPC-продуцентов. Однако у этих средств есть ограничения: они не действуют на MBL (NDM, VIM и др.) [11]. К сожалению, в ряде регионов именно металло-β-лактамазы стали доминирующими (например, NDM широко распространена на Индийском субконтиненте и на Ближнем Востоке) [11]. Кроме того, наблюдается рост доля MBL и в ответ на широкое применение цефтазидим/авибактама (карбапенемазы KPC подавлены, но нишу занимают MBL) [11]. Поскольку коммерческих ингибиторов против MBL пока нет [10], для лечения инфекций, вызванных NDM-/VIM-продуцентами, применяют особые комбинации. Одним из решений стало сочетание монобактама азтреонама с ингибитором авибактамом: азтреонам устойчив к гидролизу MBL, но разрушается другими β-лактамазами, однако присутствующий авибактам защитит азтреонам от БРЛС и AmpC, благодаря чему азтреонам проявит бактерицидный эффект. На практике такую схему реализуют, например, сочетанным введением цефтазидим/авибактама и азтреонама — исследования показали высокую синергичность этой комбинации против MBL-продуцентов[11] В некоторых странах уже доступна фиксированная комбинация азтреонам/авибактам.
Другой ответ на проблему MBL — цефидерокол, сидерофорный цефалоспорин. Его молекула специально модифицирована для проникновения внутрь грамотрицательных бактерий с минимальным сопротивлением. Основу действия составляет механизм «троянского коня»: бактерия воспринимает молекулу цефидерокола как железосодержащий субстрат и активно транспортирует её внутрь клетки через железозависимые порины. В отличие от других цефалоспоринов, которые пассивно проникают через мембрану, цефидерокол использует энергозависимую систему захвата Fe³⁺, что позволяет ему достигать высокой концентрации в периплазматическом пространстве. Оказавшись внутри, цефидерокол связывается с ПСБ, нарушая синтез пептидогликана и вызывая лизис клетки — как и другие β-лактамы. Однако его структура дополнительно защищает β-лактамное кольцо от действия ферментов: цефидерокол устойчив к разрушению большинством β-лактамаз, включая сериновые (KPC, OXA) и металло-β-лактамазы (NDM, VIM, IMP) [4, 23]. Это делает его ценным резервным препаратом в терапии инфекций, вызванных панрезистентными грамотрицательными патогенами, особенно P. aeruginosa, A. baumannii и Enterobacterales с MBL.
Перспективы борьбы с резистентностью
Непрерывное появление новых β-лактамаз заставляет искать дополнительные способы борьбы с ними. Научные группы по всему миру продолжают разрабатывать новые ингибиторы: как вещества β-лактамной структуры, так и принципиально иных химических классов. В стадии клинических испытаний находятся ингибиторы для борьбы с металло-β-лактамазами (например, препараты на основе каптоптрила, бисморфалинового производного ANT431 и др.). Перспективен подход «двойных ингибиторов», сочетающих в одной молекуле активность против сериновых и металло-β-лактамаз. Также ведутся исследования по созданию вакцин против распространенных β-лактамаз с целью снизить колонизацию продуцентов у пациентов. Рассматриваются возможности применения фаговых ферментов или молекул РНК для подавления генов bla у возбудителей. Однако в ближайшей перспективе главными остаются классические пути: разработка новых антибиотиков, устойчивых к существующим β-лактамазам, и новых β-лактамазных ингибиторов. К счастью, за последние годы фармацевтическая индустрия активно взялась за эту проблему. В клинику уже внедряются несколько новых комбинаций β-лактама с ингибитором, а в исследовательском pipeline находится еще больше препаратов [2]. Таким образом, хотя эра β-лактамных антибиотиков осложнилась пандемией β-лактамаз, совместными усилиями ученых и клиницистов продолжается поиск решений, позволяющих удержать преимущество в этой «гонке вооружений» с бактериальной резистентностью.





