Согласно историческим источникам, еще много тысячелетий назад наши предки, столкнувшись с болезнями, вызываемыми микроорганизмами, боролись с ними доступными средствами. Со временем человечество начало понимать, почему те или иные используемые издревле лекарства способны воздействовать на определенные болезни, и научилось изобретать новые лекарства. Сейчас объем средств, используемых для борьбы с патогенными микроорганизмами, достиг особо крупных масштабов, по сравнению даже с недавним прошлым. Давайте рассмотрим, как на протяжении своей истории человек, порой того не подозревая, использовал антибиотики, и как, по мере накопления знаний, использует их сейчас.
Антибиотики и антибиотикорезистентность
Бактерии появились на нашей планете, по разным оценкам, приблизительно 3,5–4 миллиарда лет назад, задолго до эукариот [1]. Бактерии, как и все живые существа, взаимодействовали друг с другом, конкурировали и враждовали. Мы не можем точно сказать, использовали ли они уже тогда антибиотики, чтобы победить других прокариот в схватке за лучшую среду или питательные вещества. Но существуют доказательства наличия генов, кодирующих устойчивость к бета-лактаму, тетрациклину и гликопептидным антибиотикам, в ДНК бактерий, которые находились в древнем пермафросте возрастом 30 000 лет.
С момента, который принято считать официальным открытием антибиотиков, прошло чуть менее ста лет, но проблема создания новых антимикробных препаратов и использования уже известных при условии быстро возникающей резистентности к ним тревожит человечество не последние пятьдесят лет. Неспроста в своей Нобелевской речи первооткрыватель пенициллина Александр Флеминг предупреждал, что к использованию антибиотиков нужно подходить серьезно.
Так же, как и момент открытия антибиотиков человечеством на несколько миллиардов лет отсрочен от изначального их появления у бактерий, так и история использования человеком антибиотиков началась задолго до их официального открытия. И речь идет не о предшественниках Александра Флеминга, живших в 19 веке, а о совсем далеких временах.
Использование антибиотиков в древности
Еще в Древнем Египте плесневелый хлеб использовали для дезинфекции порезов (видео 1). Хлеб с плесневыми грибками в лечебных целях применяли и в других странах и, видимо, вообще во многих древних цивилизациях. Например, в Древней Сербии, Китае и Индии для предотвращения развития инфекций его прикладывали к ранам. Судя по всему, жители этих стран независимо друг от друга пришли к выводу о целебных свойствах плесени и использовали ее для лечения ран и воспалительных процессов на коже. Древние египтяне прикладывали к гнойникам на коже головы корки плесневелого пшеничного хлеба и считали, что использование этих средств поможет умилостивить духов или богов, ответственных за болезни и страдания.
Жители Древнего Египта для лечения ран использовали не только хлеб с плесенью, но и самостоятельно изготовленные мази. Есть информация о том, что примерно в 1550 г. до н.э. они готовили смесь из свиного сала и меда, которую наносили на раны и перевязывали специальной тканью. Такие мази обладали некоторым антибактериальным эффектом в том числе благодаря содержащейся в меде перекиси водорода. Египтяне не были первопроходцами в использовании меда — первым упоминанием о его целебных свойствах считают запись на шумерской табличке, датируемую 2100–2000 гг. до н.э., где говорится, что мед можно использовать как лекарство и мазь. И Аристотель также отмечал, что мед хорош для лечения ран.
В процессе исследования костей мумий древних нубийцев, живших на территории современного Судана, ученые обнаружили в них большую концентрацию тетрациклина [5]. Возраст мумий составлял примерно 2500 лет, и, скорее всего, высокие концентрации антибиотика в костях не могли появиться случайно. Даже в останках четырехлетнего ребенка его количество была очень высоко. Ученые предполагают, что эти нубийцы на протяжении длительного времени потребляли тетрациклин. Скорее всего, его источником были бактерии Streptomyces или другие актиномицеты, содержащиеся в зернах растений, из которых древние нубийцы делали пиво.
В борьбе с инфекциями люди по всему миру использовали и растения. Сложно понять, когда именно некоторые из них начинали применять, из-за отсутствия письменных или других материальных свидетельств. Некоторые растения использовали потому, что человек методом проб и ошибок узнавал об их противовоспалительных свойствах. Другие растения использовали в кулинарии, и вместе со вкусовыми свойствами они обладали и антимикробным действием.
Так обстоит дело с луком и чесноком. Эти растения с давних пор использовали в приготовлении пищи и медицине. Об антимикробных свойствах чеснока знали еще в Китае и Индии. А не так давно ученые выяснили, что народная медицина не зря использовала чеснок — его экстракты угнетают Bacillus subtilis, Escherichia coli и Klebsiella pneumonia .
В Корее издревле для лечения желудочно-кишечных инфекций, вызываемых сальмонеллой, используют лимонник китайский Schisandra chinensis. Уже в наши дни, после проверки действия его экстракта на эту бактерию, оказалось, что лимонник действительно обладает антибактериальным действием . Или, к примеру, на присутствие антибактериальных веществ проверили специи, которые широко используются по всему миру. Получилось, что душица, гвоздика, розмарин, сельдерей и шалфей угнетают такие патогенные микроорганизмы, как Staphylococcus aureus, Pseudomonas fluorescens и Listeria innocua . На территории Евразии народы часто заготавливали ягоды и, естественно, использовали их в том числе и в лечении. Научные исследования подтвердили, что некоторые ягоды обладают антимикробной активностью. Фенолы, особенно эллаготанины, содержащиеся в плодах морошки и малины, ингибируют рост кишечных патогенных микроорганизмов .
Бактерии как оружие
Заболевания, вызываемые патогенными микроорганизмами, еще с давних времен использовали для нанесения противнику вреда с минимальными собственными затратами.
Существует версия, что хан Джанибек при осаде крымского города Каффы пошел на хитрость и катапультами забрасывал трупы умерших от чумы в город. Захватить Каффу так и не удалось, потому что войско хана было ослаблено. Но начавшаяся в Каффе эпидемия вместе с людьми, которые стремились поскорее покинуть город, начала распространяться по всей Европе. Некоторые ученые предполагают, что именно это событие и положило начало пандемии чумы XIV века в Западной Европе.
Использование древними хеттами туляремии считается первым упоминанием о применении биологического оружия. Они засылали в стан неприятеля больных овец, которых те забирали к себе в стада. Распространялось заболевание, которому подвержены и домашние животные (овцы, свиньи, лошади), и человек, через укусы кровососущих насекомых. Проблема такого оружия в том, что оно неизбирательно. С этим столкнулись и древние хетты, которые в определенный момент вместе с захваченным скотом принесли к себе и туляремию.
Сейчас использование бактериологического оружия запрещено «Протоколом о запрещении применения на войне удушающих, ядовитых или других подобных газов и бактериологических средств» (кратко — «Женевским протоколом»), подписанным в 1925 году.
XX век
1940–1960-е годы XX века называют «золотой эрой» открытия антибиотиков. В то время, чтобы получить новое вещество, обладающее антибиотической активностью, можно было взять пробу почвы, выделить из нее микроорганизмы и изучать их. На этом же объекте исследования можно было испытывать новосинтезированные или выделенные из других микроорганизмов антибиотики. В 1980-х начала свое развитие комбинаторная химия, а в 1990-х ее методы стали использовать фармкомпании, в том числе и для поиска новых антибиотиков.
Официально, «золотая эра антибиотиков» начинается с открытия пенициллина. Это произошло в 1928 году, и первооткрывателем официально считают британского бактериолога Александра Флеминга (рис. 1). Кстати, ту самую чашку Петри, благодаря которой он сделал открытие и в дальнейшем получил Нобелевскую премию, вместе с той самой плесенью не так давно продали на аукционе за 14 тысяч долларов.
Строго говоря, Александр Флеминг (о котором рассказывает статья «Победитель бактерий») является первооткрывателем пенициллина лишь официально.
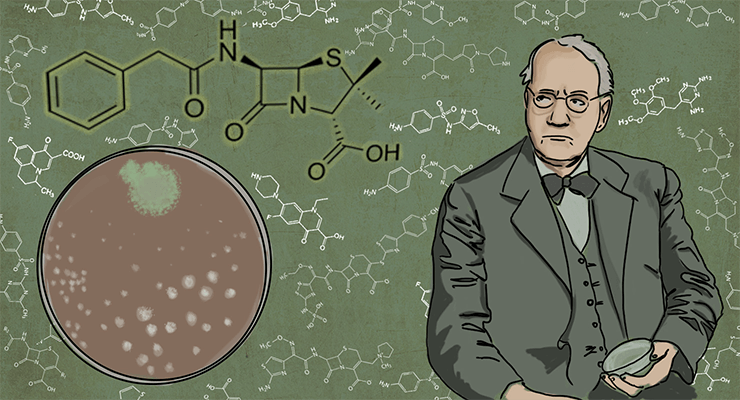
Поначалу открытие Флеминга не использовалось для лечения пациентов и продолжало свою жизнь исключительно за дверями лаборатории. К тому же, как сообщали современники Флеминга, он не был хорошим оратором и не мог убедить общественность в полезности и важности пенициллина. Вторым рождением этого антибиотика можно назвать его переоткрытие учеными из Великобритании Эрнстом Чейном и Говардом Флори в 1940–1941 гг.
В СССР тоже использовали пенициллин, причем если в Великобритании применяли не особенно производительный штамм, то советский микробиолог Зинаида Ермольева в 1942 году обнаружила таковой и даже сумела наладить производство антибиотика в условиях войны . Наиболее активным штаммом был Penicillium crustosum, и поэтому поначалу выделенный антибиотик называли пенициллин-крустозин. Его использовали на одном из фронтов во время Великой Отечественной войны для профилактики послеоперационных осложнений и лечения ран .
Зинаида Ермольева написала небольшую брошюру, в которой рассказала о том, как в СССР был открыт пенициллин-крустозин и как происходил поиск других антибиотиков: «Биологически активные вещества» .
В Европе пенициллин тоже использовали для лечения военных, причем после того, как этот антибиотик начали применять в медицине, он оставался привилегией исключительно военных. Но после пожара 28 ноября 1942 года в ночном клубе Бостона пенициллин стали применять и для лечения гражданских пациентов. У всех пострадавших были ожоги разной степени сложности, и в то время такие пациенты зачастую умирали от бактериальных инфекций, вызываемых, например, стафилококками. Компания Merck & Co. отправила пенициллин в госпитали, где содержались пострадавшие при этом пожаре, и успех лечения поставил пенициллин в центр внимания общественности. К 1946 году он стал широко использоваться в клинической практике.
Доступным для общественности пенициллин оставался вплоть до середины 50-х годов XX века. Естественно, находясь в неконтролируемом доступе, этот антибиотик зачастую использовался неуместно. Есть даже примеры пациентов, которые считали, что пенициллин — чудо-средство от всех человеческих болезней, и применяли его даже для «лечения» того, что ему по природе своей не способно поддаться. Но в 1946 году в одном из американских госпиталей заметили, что 14% взятых от больных пациентов штаммов стафилококка были устойчивы к пенициллину. А в конце 1940-х этот же госпиталь сообщил, что процент резистентных штаммов вырос до 59%. Интересно заметить, что первые сведения о том, что к пенициллину возникает устойчивость, появились в 1940 году — еще до того, как антибиотик стали активно использовать .
До открытия в 1928 году пенициллина, были, конечно, и открытия других антибиотиков. На рубеже XIX–XX веков заметили, что голубой пигмент бактерии Bacillus pyocyaneus способен убивать множество патогенных бактерий, таких как холерный вибрион, стафилококки, стрептококки, пневмококки. Он был назван пиоционазой, но открытие не послужило основой для разработки препарата, потому что вещество было токсично и нестабильно.
Первым коммерчески доступным антибиотиком стал препарат «Пронтосил», который разработал немецкий бактериолог Герхард Домагк в 1930-х годах . Есть документальные свидетельства, что первым вылеченным человеком оказалась его собственная дочь, которая долго страдала от заболевания, вызванного стрептококками. В результате лечения она выздоровела всего за несколько дней. Сульфаниламидные препараты, к которым относится и «Пронтосил», широко использовали во время Второй мировой войны страны антигитлеровской коалиции для предотвращения развития инфекций.
Вскоре после открытия пенициллина, в 1943 году, Альберт Шац, молодой сотрудник в лаборатории Зельмана Ваксмана , выделил из почвенной бактерии Streptomyces griseus вещество, обладающее противомикробной активностью. Этот антибиотик, названный стрептомицином, оказался активным против многих распространенных в то время инфекций, в том числе туберкулеза и чумы.
И все же, примерно до 1970-х годов никто серьезно не задумывался о развитии резистентности к антибиотикам. Затем были замечены два случая заболевания гонореей и бактериальным менингитом, когда бактерия, устойчивая к лечению пенициллином или антибиотиками пенициллинового ряда, вызывала смерть пациента. Эти события ознаменовали момент, когда с десятилетиями удачного лечения заболеваний было покончено.
Надо понимать, что бактерии — это живые системы, поэтому они изменчивы и со временем способны выработать резистентность к любому антибактериальному препарату (рис. 2). Например, к линезолиду бактерии не могли выработать устойчивость на протяжении 50 лет, но все-таки сумели приспособиться и жить в его присутствии . Вероятность развития антибиотикорезистентности в одном поколении бактерий составляет 1:100 млн. К действию антибиотиков они приспосабливаются по-разному. Это может быть усиление клеточной стенки, которую, к примеру, использует Burkholderia multivorans, вызывающая пневмонию у людей с иммунодефицитами. Некоторые бактерии, такие как Campylobacter jejuni, которая вызывает энтероколит, очень эффективно «выкачивают» антибиотики из клеток при помощи специализированных белковых насосов , и поэтому антибиотик не успевает подействовать.
Подробнее о способах и механизмах приспособления микроорганизмов к антибиотикам мы уже писали: «Эволюция наперегонки, или почему антибиотики перестают работать» . А на сайте проекта онлайн-образования Coursera есть полезный курс про антибиотикорезистентность Antimicrobial resistance — theory and methods. В нем достаточно подробно рассказывается об антибиотиках, механизмах устойчивости к ним и путях распространения резистентности.

Чтобы увидеть рисунок в полном размере, нажмите на него.сайт www.cdc.gov, рисунок адаптирован
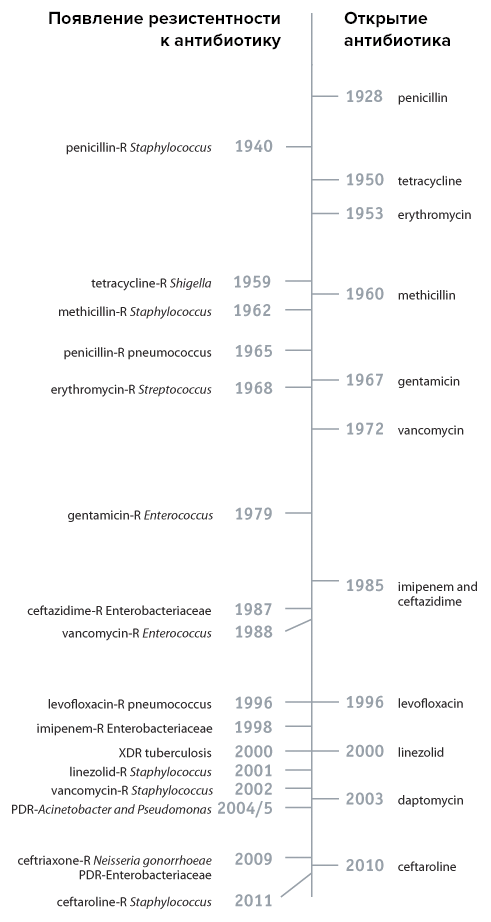
Первый случай возникновения метициллинустойчивого золотистого стафилококка (MRSA) зафиксировали в Великобритании в 1961 году, а в США — немного позднее, в 1968-м . Про золотистого стафилококка мы чуть подробнее поговорим дальше, но в контексте скорости выработки у него резистентности стоит отметить, что в 1958 году против этой бактерии стали использовать антибиотик ванкомицин. Он был способен работать с тем штаммами, которые не поддавались воздействию метициллина. И до конца 1980-х годов считалось, что к нему резистентность должна вырабатываться дольше или вообще не вырабатываться. Однако в 1979 и 1983 годах, по прошествии всего пары десятков лет, в разных частях мира были зафиксированы случаи устойчивости и к ванкомицину .
Похожий тренд соблюдался и для других бактерий, а некоторые оказались способными выработать резистентность вообще за год. Но кто-то приспосабливался немного медленнее, например, в 1980-х годах только 3–5% S. pneumonia были устойчивы к пенициллину, а в 1998 году — уже 34%.
XXI век — «кризис инноваций»
За последние 20 лет многие большие фармкомпании — например, Pfizer, Eli Lilly and Company и Bristol-Myers Squibb — сократили число разработок или вообще закрыли проекты по созданию новых антибиотиков. Это можно объяснить не только тем, что стало сложнее искать новые вещества (потому что все, которые было легко найти, уже нашли), но и потому что есть другие востребованные и более прибыльные области, например, создание лекарств для лечения онкологических заболеваний или депрессии.
Тем не менее, время от времени то один, то другой коллектив ученых или компания сообщает, что они открыли новый антибиотик, и заявляет, что «вот он уж точно победит все бактерии/некоторые бактерии/определенный штамм и спасет мир». После этого зачастую ничего не происходит, и такие высказывания вызывают у общественности только скепсис. Ведь помимо тестирования антибиотика на бактериях в чашке Петри, нужно провести испытания предполагаемого вещества на животных, а затем и на людях. Это занимает много времени, таит в себе немало подводных камней, и обычно на одной из этих фаз открытие «чудесного антибиотика» сменяется закрытием.
Для того чтобы найти новые антибиотики, применяют различные методы: как классической микробиологии, так и более новые — сравнительной геномики, молекулярной генетики, комбинаторной химии, структурной биологии. Некоторые предлагают отойти от этих «привычных» методов и обратиться к знаниям, накопленным на протяжении истории человечества. Например, в одной из книг Британской библиотеки ученые заметили рецепт бальзама от глазных инфекций, и им стало интересно, на что он способен сейчас. Рецепт датировался X веком, поэтому вопрос — будет работать или нет? — был действительно интригующим. Ученые взяли именно те ингредиенты, которые были указаны, смешали в нужных пропорциях и проверили на метициллинрезистентном золотистом стафилококке (MRSA). К удивлению исследователей, более 90% бактерий были убиты этим бальзамом. Но важно заметить, что такой эффект наблюдался только при совместном использовании всех ингредиентов .
Действительно, порой антибиотики природного происхождения работают не хуже современных, но их состав настолько сложен и зависит от многих факторов, что быть точно уверенным в каком-то определенном результате затруднительно. Также, невозможно сказать, замедляется ли скорость выработки устойчивости к ним или нет. Поэтому их не рекомендуют использовать как замену основной терапии, а как дополнение под строгим контролем врачей.
Проблемы резистентности — примеры болезней
Невозможно дать полную картину резистентности микроорганизмов к антибиотикам, потому как эта тема многогранна и, несмотря на несколько поутихший интерес со стороны фармкомпаний, достаточно активно исследуется. Соответственно, очень быстро появляется информация о все новых и новых случаях устойчивости к антибиотикам. Поэтому мы ограничимся лишь несколькими примерами для того, чтобы хотя бы поверхностно показать картину происходящего (рис. 3).
Туберкулез: риск в современном мире
Туберкулез особенно распространен в Центральной Азии, Восточной Европе и России, и то, что у туберкулезных микробов (Mycobacterium tuberculosis) возникает устойчивость не только к определенным антибиотикам, но и к их комбинациям, должно вызывать тревогу.
У пациентов с ВИЧ из-за пониженного иммунитета нередко возникают оппортунистические инфекции, вызываемые микроорганизмами, которые в норме могут без вреда присутствовать в организме человека. Одной из них является туберкулез, который к тому же отмечен как основная причина смерти ВИЧ-положительных пациентов по всему миру. О распространенности туберкулеза по регионам мира можно судить из статистики — у пациентов с ВИЧ, заболевших туберкулезом, если они проживают в Восточной Европе, риск умереть в 4 раза выше, чем если бы они жили в Западной Европе или даже Латинской Америке. Конечно, стоит отметить, что на эту цифру влияет то, насколько в медицинской практике региона принято проводить тесты на восприимчивость пациентов к лекарствам. Это позволяет применять антибиотики только при необходимости.
За ситуацией с туберкулезом наблюдает и ВОЗ. В 2017 году она выпустила доклад о выживаемости при туберкулезе и его мониторинге в Европе. Существует стратегия ВОЗ по ликвидации туберкулеза, и поэтому пристальное внимание обращается на регионы с высоким риском заражения этим заболеванием.
Туберкулез унес жизни таких мыслителей прошлого, как немецкий писатель Франц Кафка и норвежский математик Н.Х. Абель. Однако это заболевание вызывает тревогу и сегодня, и при попытке взглянуть в будущее. Поэтому и на общественном, и на государственном уровнях стоит прислушиваться к стратегии ВОЗ и стараться снизить риски заражения туберкулезом.
В докладе ВОЗ подчеркнуто, что с 2000 года фиксируется меньше случаев заражения туберкулезом: в период с 2006 по 2015 годы число случаев уменьшалось на 5,4% в год, а в 2015 уменьшилось на 3,3%. Тем не менее, несмотря на такой тренд, ВОЗ призывает с вниманием относиться к проблеме антибиотикорезистентности Mycobacterium tuberculosis, и, используя методы гигиены и постоянный мониторинг населения, уменьшать число случаев инфицирования.
Устойчивая гонорея
Американское агентство Центры по контролю и профилактике заболеваний (CDC) подсчитали, что в США ежегодно фиксируется более 800 тысяч случаев заболевания гонореей, а во все мире, по оценке ВОЗ, — 78 миллионов случаев. Это инфекционное заболевание вызывается гонококком Neisseria gonorrhoeae. В проведенных исследованиях за период с 2009 по 2014 годы показано, что многие штаммы гонококка резистентны к препарату первой линии — ципрофлоксацину, а также увеличивается число устойчивых штаммов к азитромицину и препаратам группы цефалоспоринов широкого спектра действия. В большинстве стран никакие другие антибиотики, кроме цефалоспоринов, не способны воздействовать на гонококка, но уже и к ним возрастает устойчивость. Недавно выявили три случая, когда гонококк оказывался устойчивым ко всем известным препаратам, применяемым для лечения гонореи.
Масштабы резистентности других бактерий
Примерно 50 лет назад начали появляться штаммы золотистого стафилококка, устойчивые к антибиотику метициллину (MRSA). Инфекции, вызванные метициллинрезистентным золотистым стафилококком, ассоциированы с бóльшим количеством смертей, чем инфекции, вызванные метициллинчувствительным стафилококком (MSSA). Большинство из MRSA также устойчиво и к другим антибиотикам. В настоящее время они распространены и в Европе, и в Азии, и в обеих Америках, и в Тихоокеанском регионе . Эти бактерии чаще других становятся устойчивыми к антибиотикам и в США убивают 12 тысяч людей за год. Есть даже факт, что в США MRSA в год уносит больше жизней, чем ВИЧ/СПИД, болезнь Паркинсона, эмфизема легких и убийства вместе взятые.
В период с 2005 по 2011 год стали фиксировать меньше случаев заражения MRSA как госпитальной инфекцией. Это связано с тем, что в медицинских учреждениях взяли под строгий контроль соблюдение гигиенических и санитарных норм. Но в общей популяции такой тренд, к сожалению, не сохраняется.
Энтерококки, устойчивые к действию антибиотика ванкомицина — большая беда. Они не так широко распространены на планете, по сравнению с MRSA, но в США каждый год фиксируется около 66 тысяч случаев заражения Enterococcus faecium и, реже, E. faecalis. Они являются причиной большого спектра заболеваний и особенно среди пациентов медицинских учреждений, то есть они — причина госпитальных инфекций. При заражении энтерококком около трети случаев приходится на штаммы, устойчивые к ванкомицину.
Пневмококк Streptococcus pneumoniae является причиной бактериальной пневмонии и менингита. Чаще заболевания развиваются у людей старше 65 лет. Возникновение резистентности усложняет лечение и в итоге приводит к 1,2 миллионам случаев заболевания и 7 тысячам смертей ежегодно. Пневмококк резистентен к амоксициллину и азитромицину. К менее распространенным антибиотикам он тоже выработал устойчивость, и в 30% случаев резистентен к одному или нескольким применяемым в лечении препаратам. Надо заметить, что даже если присутствует небольшой уровень устойчивости к антибиотику, это не снижает эффективность от лечения им. Использование препарата становится бесполезным в случае, если количество резистентных бактерий превышает определенный порог. Для внебольничных пневмококковых инфекций этот порог составляет 20–30%. В последнее время стало происходить меньше случаев заражения пневмококком, потому что в 2010 году создали новую версию вакцины PCV13, которая действует против 13 штаммов S. pneumoniae.
Пути распространения резистентности
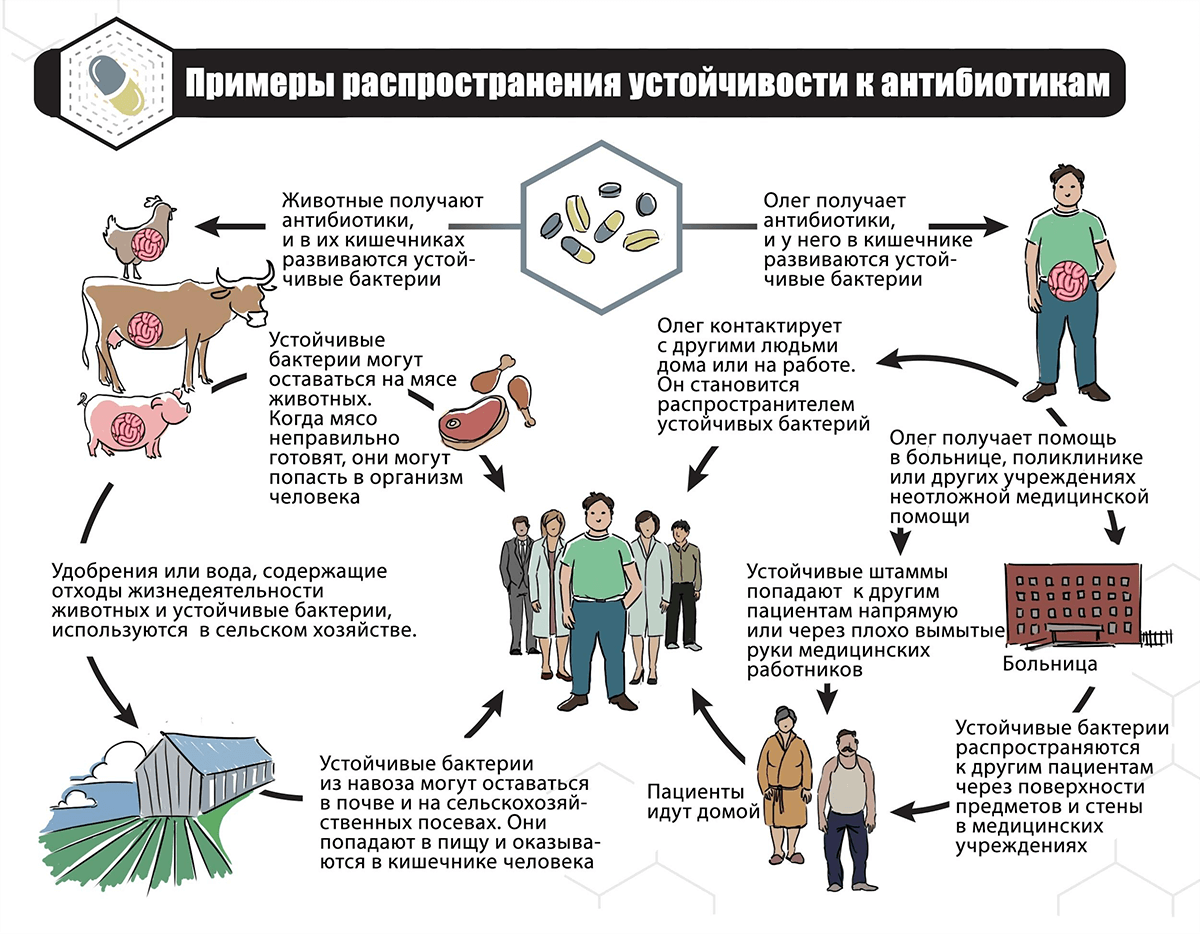
- От сельскохозяйственных животных. Антибиотики специально добавляют в корм скоту — в основном, для того чтобы ускорить рост животных и предотвратить инфекции. В США до 80% всех производимых антибиотиков используют как раз в виде добавки к корму. Резистентные бактерии могут перейти к человеку непосредственно на ферме, либо через плохо приготовленные и не стерилизованные продукты питания. Также, отходы жизнедеятельности животных попадают в окружающую среду, где и неметаболизированные антибиотики, и резистентные микроорганизмы могут влиять на микроорганизмы, живущие в этой среде.
- От растений. В растениеводстве широко применяют антибиотики, чтобы защитить растения от нежелательных патогенов, способных погубить весь урожай. Но если немного не рассчитать дозу используемого антибиотика, то может получиться устойчивый к нему микроорганизм. С плохо помытой и приготовленной пищей он попадает к человеку, у которого может вызывать неприятные последствия.
- От человека к человеку. Носитель антибиотикорезистентного микроорганизма может распространять этот микроорганизм и заражать других людей, например, в общественных местах и больницах (являясь потенциальной причиной появления госпитальной инфекции).
- Из окружающей среды. В среду микроорганизм попадает вышеперечисленными путями и через немытые руки и с плохо обработанной пищей вновь может оказаться у человека и стать неприятной проблемой.
Примерная схема показана на рисунке 4.
Чтобы увидеть рисунок в полном размере, нажмите на него.рисунок Елены Беловой
Пристальное внимание должно оказываться не только бактериям, которые уже развивают или развили резистентность, но и тем, которые пока не приобрели устойчивость. Потому что со временем и они могут измениться и начать вызывать более сложные формы заболеваний.
Внимание к нерезистентным бактериям можно объяснить и тем, что, даже легко поддаваясь лечению, эти бактерии играют роль в развитии инфекций у пациентов с ослабленным иммунитетом — ВИЧ-положительных, проходящих химиотерапию, недоношенных и переношенных новорожденных, у людей после операции и трансплантации. И так как этих случаев происходит достаточное количество —
- во всем мире в 2014 году было проведено около 120 тысяч трансплантаций;
- только в США ежегодно проходят химиотерапию 650 тысяч человек, однако не у всех есть возможность использовать препараты для борьбы с инфекциями;
- в США 1,1 миллиона человек — ВИЧ-положительные, в России — чуть меньше, официально 1 млн;
— то есть шанс, что со временем устойчивость появится и у тех штаммов, которые пока не вызывают опасений.
Госпитальные, или внутрибольничные, инфекции все чаще встречаются в наше время. Это те инфекции, которыми люди заражаются в больницах и других медицинских учреждениях при госпитализации и просто при посещении.
В США в 2011 году было зафиксировано более 700 тысяч заболеваний, вызываемых бактериями рода Klebsiella . Это, в основном, внутрибольничные инфекции, которые приводят к довольно обширному спектру заболеваний, таких как пневмония, сепсис, раневые инфекции. Как и в случаях со многими другими бактериями, еще с 2001 года началось массовое появление антибиотикорезистентных клебсиелл.
В одной из научных работ ученые задались целью узнать, как гены устойчивости к антибиотикам распространены среди штаммов рода Klebsiella. Они обнаружили, что 15 довольно далеких штаммов экспрессировали металло-бета-лактамазу 1 (NDM-1), которая способна разрушать почти все бета-лактамные антибиотики. Бóльшую силу эти факты обретают, если уточнить, что данные для этих бактерий (1777 геномов) получены в период с 2011 по 2015 годы от пациентов, которые находились в разных больницах с разными инфекциями, вызванными клебсиеллами.
Развитие резистентности к антибиотикам может произойти, если:
- пациент принимает антибиотики без назначения врача;
- пациент не следует назначенному врачом курсу приема лекарств ;
- врач не обладает должной квалификацией;
- пациент пренебрегает дополнительными мерами профилактики (мытье рук, продуктов питания);
- пациент часто посещает медицинские учреждения, в которых повышена вероятность заразиться патогенными микроорганизмами;
- пациент проходит плановые и внеплановые процедуры или операции, после которых зачастую нужно принимать антибиотики во избежание развития инфекций;
- пациент потребляет мясную продукцию из регионов, не соблюдающих нормы по остаточному содержанию антибиотиков (например, из России или Китая);
- у пациента снижен иммунитет из-за болезней (ВИЧ, химиотерапия при онкологических заболеваниях);
- пациент проходит длительный курс лечения антибиотиками, например, при туберкулезе.
О том, как пациенты самостоятельно уменьшают дозу антибиотика, можно прочитать в статье «Приверженность к приему лекарственных средств и пути ее повышения при бактериальных инфекциях» . Недавно британские ученые высказали достаточно спорное мнение о том, что не обязательно проходить весь курс лечения антибиотиками . Американские врачи, однако, на это мнение отреагировали с большим скепсисом.
Настоящее (влияние на экономику) и будущее
Проблема резистентности бактерий к антибиотикам охватывает сразу несколько сфер человеческой жизни . В первую очередь, это, конечно, экономика. По разным подсчетам, сумма, которую тратит государство на лечение одного пациента с устойчивой к антибиотикам инфекцией, колеблется от $18 500 до $29 000. Эта цифра подсчитана для США, но, пожалуй, ее можно использовать и как средний ориентир по другим странам, чтобы понимать масштаб явления. Такая сумма уходит на одного пациента, но если подсчитать по всем, то оказывается, что суммарно к общему счету, который государство тратит за год на здравоохранение, нужно добавлять $20 000 000 000. И это помимо $35 000 000 000 социальных расходов. В 2006 году из-за двух наиболее распространенных госпитальных инфекций, в результате которых у людей развивался сепсис и пневмония, умерли 50 тысяч людей. Это обошлось системе здравоохранения США в сумму, превышающую $8 000 000 000.
Ранее мы уже писали про сегодняшнюю ситуацию с антибиотикорезистентностью и о стратегиях по ее предотвращению: «Противостояние с резистентными бактериями: наши поражения, победы и планы на будущее» .
Если антибиотики первой и второй линий не работают, то приходится либо увеличивать дозы в надежде на то, что они сработают, либо использовать антибиотики следующей линии. И в том, и в другом случае высока вероятность повышенной токсичности препарата и побочных действий. К тому же, большая доза или новый препарат будут, скорее всего, стоить дороже предыдущего лечения. Это влияет на сумму, которую затрачивают на лечение государство и сам пациент. А также на срок нахождения пациента в больнице или на больничном, число посещений врача и экономические потери от того, что работник не трудится. Большее количество дней на больничном — это не пустые слова. Действительно, пациента с заболеванием, вызванным резистентным микроорганизмом, в среднем приходится лечить 12,7 дней, по сравнению с 6,4 для обычной болезни .
Кроме причин, которые непосредственно влияют на экономику — траты на лекарства, на оплату больничных и время нахождения в больнице, — есть еще и немного завуалированные. Это те причины, которые влияют на качество жизни людей, у которых обнаружены антибиотикорезистентные инфекции. Некоторые пациенты — школьники или студенты — не могут в полной мере посещать уроки, и поэтому у них возможны отставание в учебном процессе и психологическая деморализация. У пациентов, которые проходят курсы сильных антибиотиков, из-за побочных эффектов могут развиваться хронические заболевания. Помимо самих пациентов, заболевание морально угнетает их родственников и окружение, а некоторые инфекции настолько опасны, что заболевших приходится содержать в отдельной палате, где они зачастую не могут пообщаться с близкими. Также существование госпитальных инфекций и риск ими заразиться не позволяют расслабиться при прохождении курса лечения. Согласно статистике, около 2 миллионов американцев ежегодно заражаются госпитальными инфекциями, которые в итоге уносят 99 тысяч жизней. Чаще всего это происходит из-за заражения микроорганизмами, устойчивыми к антибиотикам . Важно подчеркнуть, что кроме перечисленных выше и, несомненно, важных экономических потерь, качество жизни у людей тоже сильно страдает.
Прогнозы на будущее разнятся (видео 2). Одни пессимистически указывают на то, что к 2030–2040 годам кумулятивные финансовые потери составят 100 триллионов долларов, что равняется среднегодовому убытку в 3 триллиона долларов. Для сравнения — весь годовой бюджет США лишь на 0,7 триллиона превышает эту цифру . Количество смертей от заболеваний, вызванных резистентными микроорганизмами, по оценке ВОЗ, к 2030–2040 годам приблизится к 11–14 миллионам и превысит смертность от рака.
Неутешительны и перспективы использования антибиотиков в кормах сельскохозяйственных животных (видео 3). В исследовании, опубликованном в журнале PNAS, подсчитали, что в 2010 году во всем мире в кормá было добавлено более 63 000 тонн антибиотиков . И это — только по скромным оценкам. Ожидается, что к 2030 году указанная цифра возрастет на 67%, но, что должно особенно встревожить, она удвоится в Бразилии, Индии, Китае, Южной Африке и России. Понятно, что, раз объемы добавляемых антибиотиков увеличатся, то и расход средств на них тоже увеличится. Существует мнение, что цель добавления их в корм — совсем не улучшение здоровья животных, а ускорение роста. Это позволяет быстро выращивать животных, получать прибыль от продаж и снова выращивать новых. Но при возрастающей антибиотикорезистентности, придется добавлять либо бóльшие объемы антибиотика, либо создавать комбинации из них. В любом из указанных случаев, затраты фермеров и государства, которое нередко их субсидирует, на эти препараты возрастут. При этом продажи сельскохозяйственной продукции могут даже снизиться из-за смертности животных, вызванной отсутствием действенного антибиотика или побочными эффектами нового. А также из-за страха со стороны населения, которое не хочет потреблять продукцию с этим «усиленным» препаратом. Снижение продаж или повышение цены на продукцию может ставить фермеров в бóльшую зависимость от субсидий со стороны государства, заинтересованного в обеспечении населения продуктами первой необходимости, которые как раз и предоставляет фермер. Также, многие сельхозпроизводители из-за вышеуказанных причин могут оказаться на грани банкротства, а, следовательно, это приведет к тому, что на рынке останутся лишь крупные сельскохозяйственные компании. И, как следствие, возникнет монополия крупных компаний-гигантов. Такие процессы негативно отразятся на социально-экономическом положении любого государства.
По всему миру активно развиваются направления науки, связанные с определением причин генетических заболеваний и их лечения, мы с интересом наблюдаем за тем, что происходит с методами, которые помогут человечеству «избавиться от вредных мутаций и стать здоровыми», как любят упоминать поклонники методов пренатального скрининга, CRISPR-Cas9 и только начинающего развиваться метода генетической модификации эмбрионов. Но все это может быть понапрасну, если мы окажемся неспособны противостоять заболеваниям, вызываемым резистентными микроорганизмами. Необходимы разработки, которые позволят преодолеть проблему резистентности, иначе всему миру несдобровать.
Возможные изменения в обычной жизни людей в ближайшие годы:
- продажа антибиотиков только по рецепту (исключительно для лечения болезней, угрожающих жизни, а не для профилактики банальных «простуд»);
- экспресс-тесты на степень устойчивости микроорганизма к антибиотикам;
- рекомендации по лечению, подтвержденные вторым мнением или искусственным интеллектом;
- дистанционное диагностирование и лечение без посещения мест скопления больных людей (в том числе мест продажи лекарств);
- проверка на наличие антибиотикорезистентных бактерий до проведения операций;
- запрет проведения косметических процедур без надлежащей проверки;
- сокращение потребления мяса и повышение его цены из-за удорожания ведения хозяйства без привычных антибиотиков;
- увеличение смертности людей в группе риска;
- увеличение смертности от туберкулеза в странах из группы риска (Россия, Индия, Китай);
- ограниченное распространение антибиотиков последнего поколения по миру для замедления развития устойчивости к ним;
- дискриминация в доступе к таким антибиотикам по финансовому статусу и по месту проживания.
Заключение
Меньше века прошло с начала масштабного использования антибиотиков. Вместе с тем, меньше века заняло у нас, чтобы результат этого достиг грандиозных масштабов . Угроза антибиотикорезистентности вышла на глобальный уровень, и было бы глупо отрицать, что именно мы своими же усилиями создали себе такого врага. Сегодня каждый из нас ощущает на себе последствия уже возникшей устойчивости и находящуюся в процессе развития устойчивость, когда получаем от врача выписанные антибиотики, принадлежащие не к первой линии, а второй или даже последней. Сейчас существуют варианты решения этой проблемы, но самих проблем — не меньше. Предпринимаемые нами действия по борьбе с быстро развивающими устойчивость бактериями напоминают гонку. Что будет дальше — покажет время.





