Клинические испытания агентов, редактирующих геном, в том числе технологий CRISPR-Cas9, нуклеаз «цинковые пальцы» и TALEN, расширяют границы терапии ex vivo, in vivo и иммуноонкологии.
С 2005 года программы редактирования генов медленно и постепенно внедряются в клинику. Но темп набирает обороты. Только за последние полтора года в США или ЕС в клиническое применение вошли не менее 11 таких программ, и шесть из них — это системы редактирования геномов на основе CRISPR-Cas. В настоящее время на стадии клинических испытаний находятся препараты для применения ex vivo, in vivo и в иммуноонкологии; формируется ассортимент препаратов для редактирования генома.
«Сейчас такое захватывающее время», — говорит Дженнифер Дудна (Jennifer Doudna) из Калифорнийского университета в Беркли, пионер технологии CRISPR-Cas и соучредитель нескольких компаний, работающих с CRISPR. После многих лет, потраченных на размышления о том, как эта новая технология может изменить лечение болезней, мы наконец вот-вот получим ключевые клинические данные.
Ожидаемые данные о безопасности и эффективности продемонстрируют возможности данного метода разрезания ДНК и смогут определить ближайшее будущее этого методы лечения. Пока что большинство программ по редактированию генов сосредоточены на редких моногенных заболеваниях и применении в области иммуноонкологии, но сторонники данной технологии уже рассматривают более широкие области применения.
«Типичный способ внедрения этой новой технологии, как и в случае любой другой, заключается в том, что , как и в отношении разработки лекарств, применение начинают с редких и/или чрезвычайно тяжелых заболеваний, где действительно нет других вариантов лечения. Поэтому результаты первых попыток применения очень сильно повлияют на то, признается ли технология как безопасная или подходящая для более широкого использования, — объясняет Дудна. — Я думаю, что это тот этап, где мы сейчас находимся с CRISPR».
Не стоит забывать и о других технологиях редактирования генов (рис. 1; вставка 1). Успешно развиваются методы, в основе которых лежат нуклеазы «цинковые пальцы» (Zinc finger nucleases, ZFN), TALEN (эффекторные нуклеазы, подобные активаторам транскрипции) и мегануклеазы. «Меня очень раздражает, что люди читают некоторые статьи о CRISPR, на самом деле не понимая широту или историю этой области», — говорит Чарльз Герсбах (Charles Gersbach), эксперт в генной инженерии и биомедицинский инженер Университета Дьюка. Он отмечает, что компания Sangamo Therapeutics была основана 25 лет назад для развития технологии ZFN, и с тех пор она проводит важные клинические испытания in vivo и ex vivo.
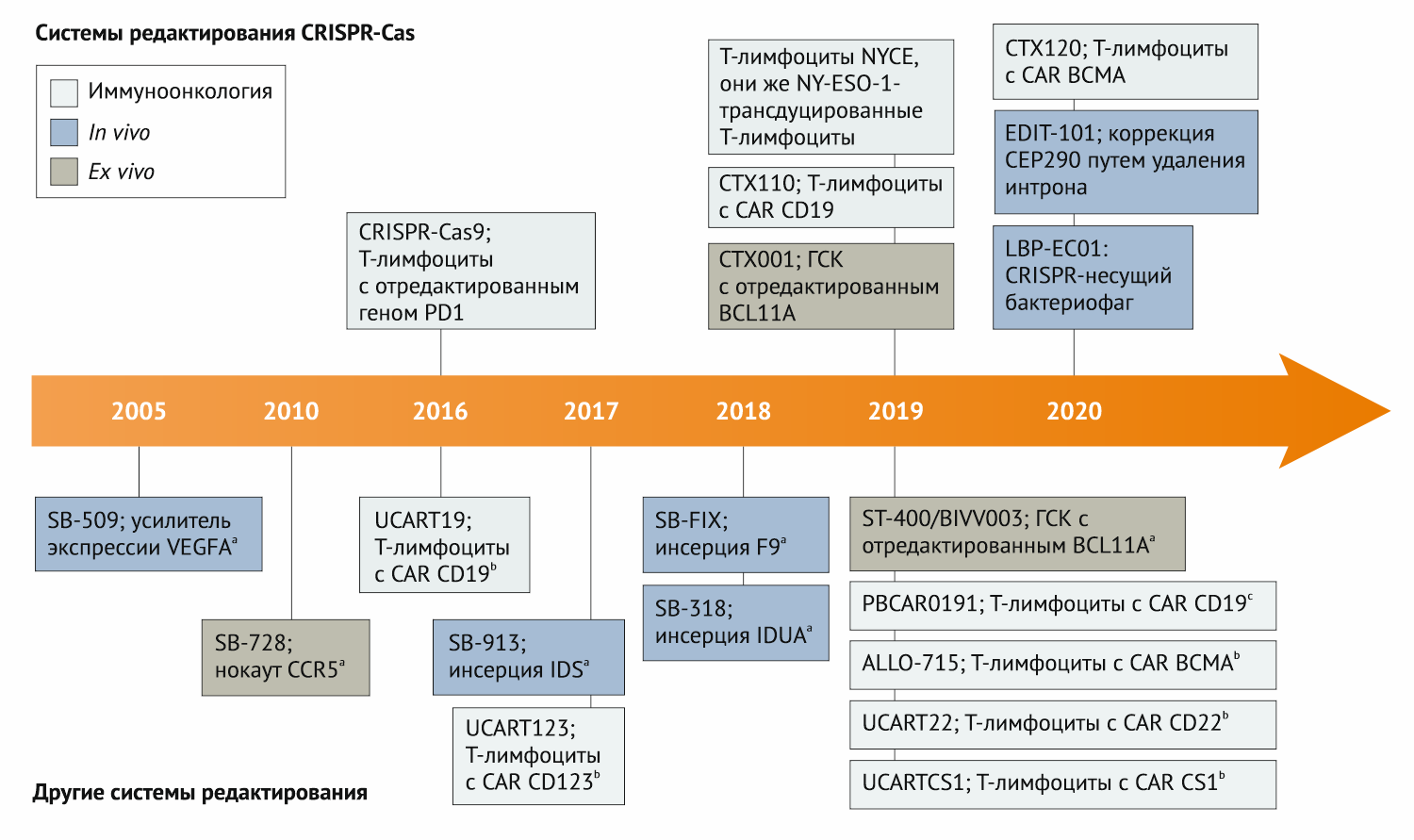
Рис. 1 | Хронология отобранных и финансируемых промышленными фирмами клинических испытаний по редактированию генов a — белки «цинковые пальцы». b — TALEN (эффекторные нуклеазы, подобные активаторам транскрипции). c — Мегануклеазы. CAR — химерный рецептор антигена; ГСК — гематопоэтические стволовые и прогениторные клетки.
Лидеры генной терапии, такие как Bluebird bio и Spark Therapeutics,
также закладывают ключевую основу, исследуя векторы доставки генов и
устанавливая заболевания или клетки, для которых возможно проведение
генной терапии. Путь прокладывают и первопроходцы в области клеточной
терапии иммуноонкологии, такие как Novartis и Kite Pharma, и пионеры
использования олигонуклеотидов, а именно Ionis и Alnylam. Уже заложены
основы редактирования генов. «Вся эта сфера действительно набирает
обороты, — говорит Джон Эванс (John Evans), генеральный директор
компании Beam Therapeutics, занимающейся CRISPR-редактированием на
уровне оснований ДНК. — Я думаю, что по всем направлениям все будет
только ускоряться».
Вставка 1 | Другие системы редактирования
Часто
говорят, что системы CRISPR-Cas упрощают редактирование генов.
Поскольку эти системы используют направляющую РНК для связывания ДНК, их
легко «запрограммировать» на взаимодействие с разными мишенями. Также
они обеспечивают надежное разрезание ДНК в необходимом месте, при этом
не требуя значительных усилий для восстановления целостности цепочки
ДНК. «Метод достаточно прост в применении и практически любой начинающий
аспирант, обладающий даже небольшими знаниями в области молекулярной
биологии, может использовать его для внесения изменений в интересующие
клетки», — говорит Дженнифер Дудна из Калифорнийского университета в
Беркли.
Учитывая простоту этой системы, сторонники метода
CRISPR–Cas ожидают, что он приведет к расширению набора технологий
редактирования генов.
Однако существуют и другие активно применяемые способы изменения генов.
Нуклеазы
«цинковые пальцы» (ZFN) были первыми инструментами редактирования
генов, которые нашли клиническое применение. Вместо того чтобы
использовать направляющую РНК для поиска и связывания ДНК-мишени, эти
ферменты рестрикции опираются на мотивы «цинковых пальцев» для
распознавания интересующих регионов. Компания «Sangamo Therapeutics»
может свободно работать в области ZFN не только благодаря солидному
портфелю собственных разработок, но и из-за накопленного опыта
детального дизайна этих мотивов.
«CRISPR — это как автомобили
марки Ford в области редактирования генома: любой может позволить себе
купить его. Мы же имеем дело с Maserati в области редактирования генов:
технологией, доступной очень немногим», — говорит Адриан Вулфсон (Adrian
Woolfson), руководитель отдела исследований и разработок в «Sangamo
Therapeutics».
Еще предстоит определить, существует ли
какое-либо различие в клинической эффективности систем ZFN и CRISPR-Cas,
но Вулфсон отмечает, что есть основания предполагать возможность этого.
«Например, поскольку ZFN не являются производными бактериальных систем,
они могут быть менее иммуногенными», — утверждает он.
Тем
временем компания «Cellectis» использует эффекторные нуклеазы, подобные
активаторам транскрипции (TALENs) — еще один подход на основе ферментов
рестрикции для редактирования причинных генов в области иммуноонкологии.
Компания «Precision Biosciences» работает с платформой редактирования
генов на основе мегануклеаз под названием ARCUS. В это же время компания
«Bluebird Bio» активно применяет «megaTAL» — гибрид TALEN и
мегануклеаз.
«Все они имеют разные плюсы и минусы, и все они
найдут разные области применения, где их преимущества будут использованы
максимально», — прогнозирует Джон Эванс (John Evans), генеральный
директор «Beam Therapeutics»
«Табун» гемоглобинопатий
Программы ex vivo, в которых с лечебной целью у пациентов
«изымают» их клетки и затем, после генной модификации, вводят обратно,
обеспечивают отправную точку c относительно низким риском для
редактирования генов.
Во-первых, механизм редактирования генов
проще внедрить в клетки в лабораторных условиях, чем в клетки организма.
При применении CRISPR in vivo, механизм будет состоять из
направляющей РНК, которая связывает интересующий участок ДНК, и белка
Cas, который разрезает ДНК. Для уже собранных клеток вне организма
пациента нет необходимости выбирать и оптимизировать вектор доставки,
который переносит систему редактирования генов через клеточные мембраны в
определенный тип клеток — вместо этого применяют электропорацию. Когда
исследователи применяют для этих клеток ток, в клеточных мембранах
открываются отверстия, через которые ZFN и CRISPR-Cas могут проникать в
ядро.
Применение ex vivo также обеспечивает
безопасность: риск нецелевого редактирования (клеток и тканей, не
являющихся нужными мишенями — прим. пер.) при использовании этих
программ ограничен. При применении их в аутологичных клетках (собранных
непосредственно у пациента — прим. пер.) система редактирования генов
вряд ли вызовет иммунные реакции. Кроме того, исследователи могут
количественно оценить эффективность редактирования, прежде чем повторно
вводить клетки пациентам, тщательно контролируя их вводимое количество.
Существует также два хорошо проверенных варианта применения ex vivo,используемых
в недостаточной мере. Это серповидноклеточная анемия, которой только в
США страдают до 80 000 человек, и β-талассемия — наследственные
заболевания, поражающие эритроциты, вызванные нарушением строения или
недостаточным уровнем гемоглобина — белка, который переносит кислород по
всему организму.
Все первые программы редактирования генов ex vivo
были сосредоточены на этих двух заболеваниях (таблица 1). «Почему мы
все начали отсюда? Потому что это убедительно», — говорит Лаура
Сепп-Лоренцино (Laura Sepp-Lorenzino), руководитель отдела безопасности
компании Intellia.
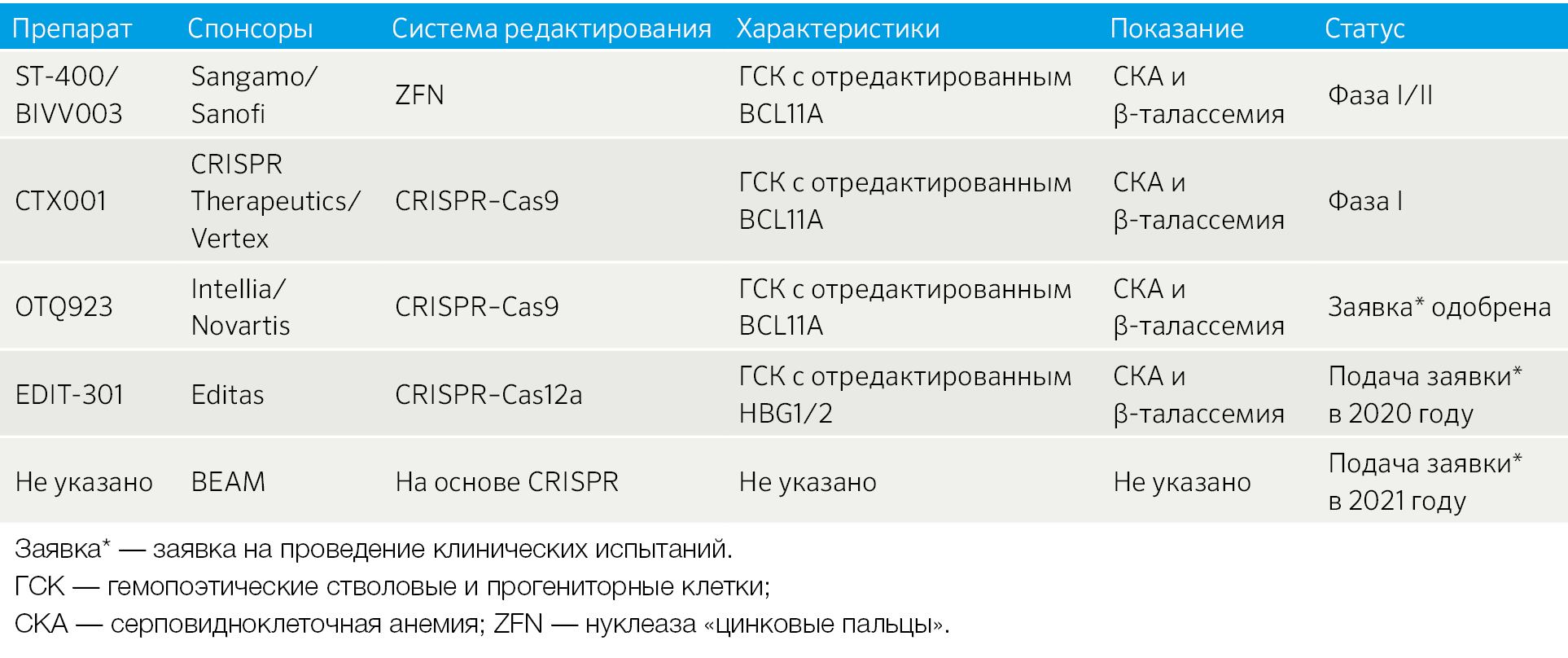
Таблица 1 | Выборочный перечень систем редактирования генов ex vivo, применяющихся в клинике или близких к клиническому применению
Однако первая волна технологий редактирования генов не направлена
на прямое исправление мутаций, приводящих к этим заболеваниям. Вместо
этого, используются подходы, основанные на разрезании ДНК, которые
изменяют экспрессию компенсаторного фетального гемоглобина. Обычно
фетальный гемоглобин экспрессируется только в течение 2–4 месяцев после
рождения. Но в случае экспрессии во взрослом возрасте, при редком
доброкачественном генетическом состоянии, называемом наследственной
персистенцией фетального гемоглобина, он защищает как от
серповидно-клеточной анемии, так и от β-талассемии.
Как и большинство других организаций, использующих технологию ex vivo,
экспериментальные препараты ST-400 и BIVV003 компании Sangamo
Therapeutics пытаются повысить уровень фетального гемоглобина путем
редактирования BCL11A. Этот регуляторный ген кодирует фактор
транскрипции «цинкового пальца», который обычно выключает экспрессию
фетального гемоглобина. Варианты этого гена могут повышать уровень
фетального гемоглобина, однако инактивация BCL11A может излечить
серповидноклеточную анемию у мышей.
Компания Sangamo Therapeutics
начала клинические испытания этих препаратов в мае 2018 года. По данным
ClinicalTrials.gov, первичные результаты ожидаются позднее, в 2020
году.
Компании CRISPR Therapeutics и Vertex в феврале 2019 года
внедрили в клинику потенциальный препарат CTX001, основанный на
технологии CRISPR-Cas. Сотрудники сообщили о его безопасности и
эффективности по предварительным данным исследований прошлого года на
двух пациентах и указали дату завершения испытаний в начале 2021 года.
Но
конкуренция в этом пространстве может быть жесткой. Помимо недавних
успехов в области применения малых молекул и антител при
серповидноклеточной анемии, в 2019 году Bluebird bio получила одобрение в
ЕС на применение препарата Betibeglogene autotemcel — генную терапию
однократного применения ex vivo, в которой используется
лентивирусный вектор для введения функциональной формы гена глобина в
эритроциты при β-талассемии. По результатам двух объединенных
исследований, подтвердивших применение препарата, почти 80 % пациентов с
β-талассемией больше не нуждались в переливании крови в течение по
крайней мере 12 месяцев после лечения. Компания приступила к подаче
заявки на регистрацию нового препарата в США и продолжает изучение
возможности его применения при серповидно-клеточной анемии.
«Но
успех Bluebird bio подтверждает этот подход», — говорит Сепп-Лоренцино.
Она добавляет, что есть множество возможностей для его улучшения.
«Извлеченные клетки не любят, когда с ними “возятся”, поэтому различные
способы манипуляций с ДНК могут сказываться на безопасности,
терапевтических и производственных преимуществах», — утверждает она.
Тонкости различных сайтов редактирования и используемых подходов также
могут влиять на уровни компенсаторной экспрессии гемоглобина, а общую
устойчивость и безопасность этих изменений можно определить только при
долгосрочном наблюдении.
«Я думаю, что появятся отличительные особенности», — добавляет она.
Тонкая настройка Т-лимфоцитов
Т-лимфоциты также служат доступным и привлекательным объектом редактирования генов ex vivo.
Компания
Sangamo Therapeutics впервые опробовала этот подход в 2010 году вместе
со своей второй программой для использования в клинике. До того, как
иммуноонкология вошла в моду, Sangamo Therapeutics нашли способ
настраивать Т-лимфоциты на борьбу с инфекционными заболеваниями. В
рамках своей ex vivo программы SB-728 компания использовала
ZFN, чтобы нарушить экспрессию рецептора CCR5 во взятых у пациента
Т-лимфоцитах. Для проникновения в Т-лимфоциты ВИЧ соединяется с
рецептором CCR5, поэтому Sangamo Therapeutics предположили, что этот
подход защитит Т-лимфоциты от ВИЧ-инфекции. В 2014 году Карл Джун (Carl
June), ведущий исследователь из Пенсильванского университета, и его
коллеги сообщили в New England Journal of Medicine, что редактор генов
компании Sangamo может модифицировать CCR5 и является безопасным, что
доказывает возможность использования ZFN для создания специальных
Т-клеток.
С тех пор SB-728 отошел на второй план, но потенциал
использования генно-инженерных Т-клеток в иммуноонкологии возрос
(таблица 2).
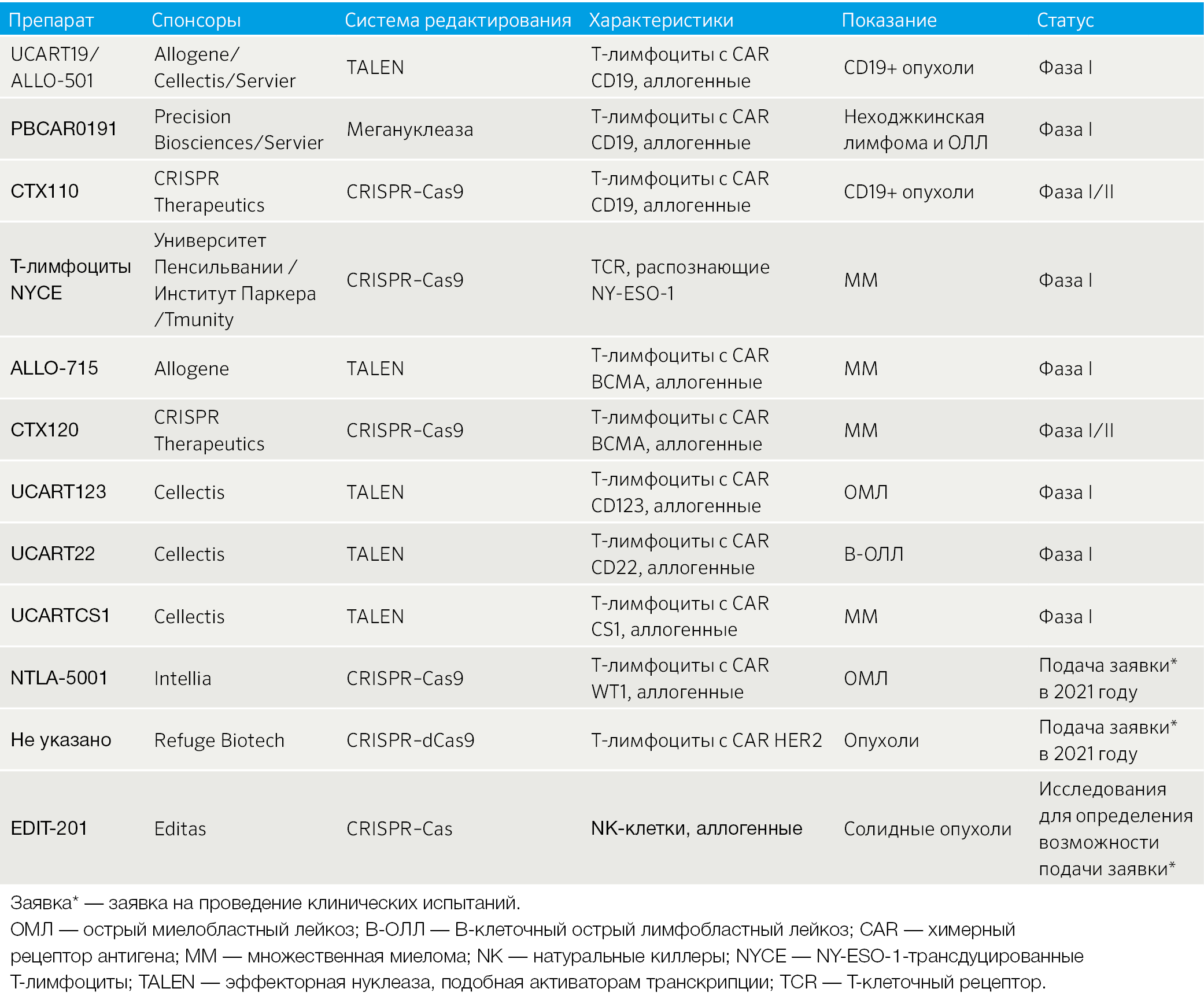
Таблица 2 | Выборочный перечень потенциальных систем редактирования генов в иммуноонкологии, применяющихся в клинике или близких к клиническому применению
В 2017 году FDA (англ. Food and Drug Administration, Управление
по санитарному надзору за качеством пищевых продуктов и медикаментов —
прим. пер.) одобрило препарат Tisagenlecleucel, разработанный Джуном и
его коллегами, и подчеркнуло, что перепрограммированные Т-лимфоциты
можно использовать для выслеживания злокачественных клеток. С помощью
Tisagenlecleucel исследователи собирают Т-лимфоциты у пациента и
обрабатывают их ex vivo лентивирусным вектором, кодирующим
химерный рецептор антигена (chimeric antigen receptor, CAR),
распознающий CD19. Когда эти клетки повторно вводят в организм пациента,
они могут находить и уничтожать злокачественно измененные клетки,
экспрессирующие CD19, за счет наличия на своей поверхности CAR к CD19.
Такая технология приводит к длительной и устойчивой ремиссии при остром
лимфобластном В-клеточном лейкозе и диффузной крупноклеточной
В-клеточной лимфоме.
Однако способ, которым CAR вводится в
T-лимфоциты, создает проблемы. Длительная экспрессия эндогенных
рецепторов на генно-инженерных T-лимфоцитах, например, снижает их
эффективность в уничтожении опухолевых клеток. T-лимфоциты также
восприимчивы к другим сдерживающим сигналам, что приводит к их
дисфункции и истощению. По мере того, как исследователи пытаются
устранить эти проблемы, ассортимент препаратов в области клеточной
терапии, нацеленной на CD19, пополняется все большим числом разработок.
Технологии
редактирования генов предлагают один из путей продвижения вперед. В
2019 году Джун вместе с коллегами из научных кругов и компанией Tmunity
провел еще один знаменательный эксперимент — лечение первого в США
пациента с помощью Т-лимфоцитов NYCE, кандидатного препарата,
разработанного по технологии CRISPR. Сначала команда использовала
CRISPR-Cas9 для нокаута генов, кодирующих эндогенные Т-клеточные
рецепторы (TCR), и гена, кодирующего PD1, белок регуляторной контрольной
точки (checkpoint). Затем они использовали лентивирусный вектор для
вставки трансгена, кодирующего TCR, который мог бы распознать антиген
NY-ESO-1, свойственный опухолевым клеткам. (В то время как CAR
распознают только те антигены, которые экспрессируются на поверхности
злокачественно измененных клеток, TCR могут определять более широкий
спектр антигенов).
Первые результаты команда опубликовала в
феврале (2020 года) в журнале Science, показав безопасность и
осуществимость этого подхода у трех пациентов. Сбор данных об
эффективности данного метода пока продолжается.
Другие компании
используют аналогичные подходы. Усовершенствованные методы
редактирования могут также стать ключом к созданию готовой к применению
аллогенной клеточной терапии, которая была бы легче в производстве, чем
аутологичные препараты.
В настоящее время основное внимание
уделяется разработке более совершенных клеток, нацеленных на CD19. «CD19
позволяет сравнивать вашу технологию с тем, что делают другие», —
объясняет Адриан Вулфсон (Adrian Woolfson), руководитель отдела
исследований и разработок в Sangamo Therapeutics и бывший руководитель
международной клинической программы в области иммуноонкологии и
гематологии в Pfizer. Также существует большой коммерческий рынок для
терапии, нацеленной на CD19, что еще больше повышает ее
привлекательность. «Это очень интуитивное указание направления, и также
существует проторенный путь. Люди, наверное, просто чувствуют себя на
нем комфортно», — говорит Вулфсон.
То же верно и для BCMA, еще одной тщательно изученной мишени в иммуноонкологии.
Возможности in vivo
Ассортимент препаратов in vivo, где в качестве редакторов генов выступают сами биомолекулы, включает более разнообразные программы (таблица 3).
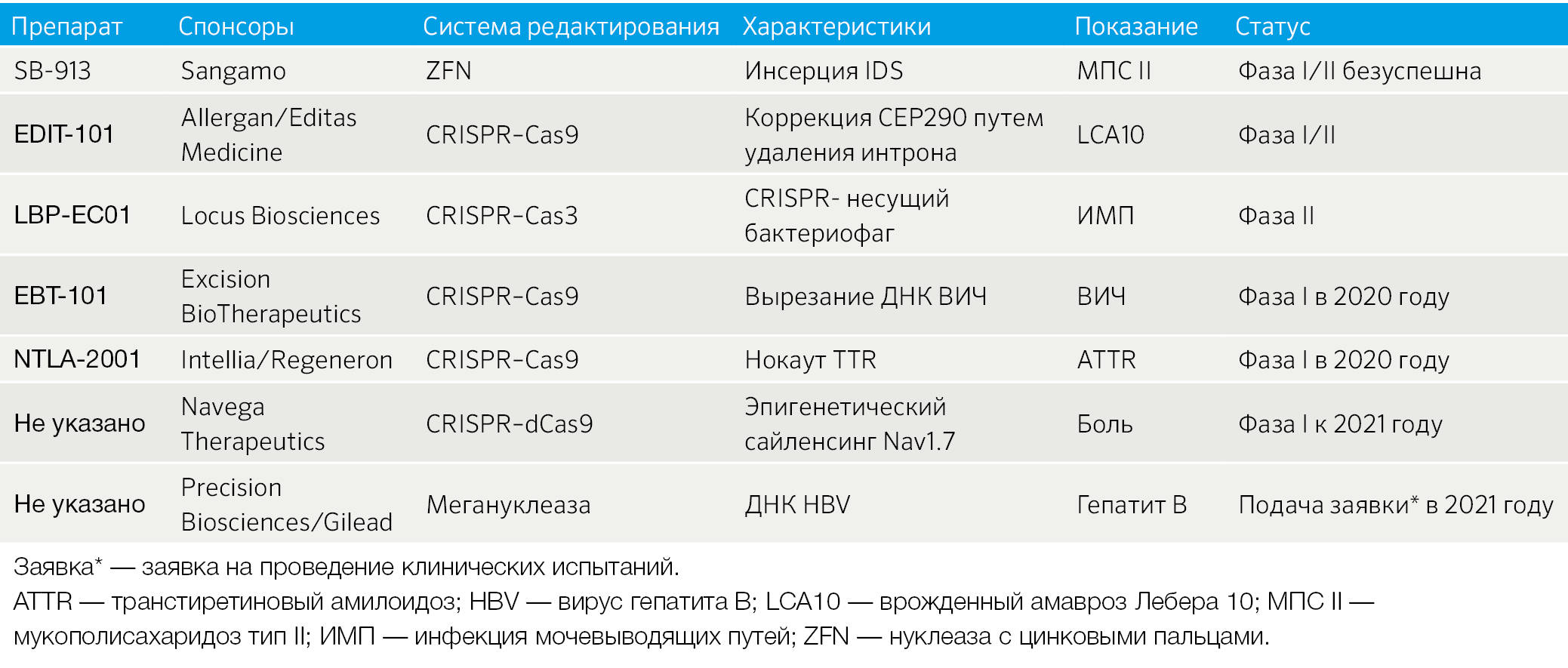
Таблица 3 | Выборочный перечень систем редактирования генов in vivo, применяющихся в клинике или близких к клиническому применению
Sangamo Therapeutics совершила прорыв и здесь с препаратом SB-913
для лечения редкого генетического заболевания, называемого
мукополисахаридозом II типа (МПС II). С помощью этой программы Sangamo
Therapeutics стремилась продвинуться на шаг дальше того, что достигли
такие препараты для генной терапии in vivo, как Voretigene
neparvovec от Spark и Onasemnogene abeparvovec от Avexis. Эти программы
показали возможность применения подходов in vivo с
использованием адено-ассоциированного вируса (AAV), который переправляет
новые гены в ядро. Однако доставляемые трансгены транскрибируются, в
основном, со свободно плавающей циркулирующей ДНК с минимальной
интеграцией в геном. С помощью SB-913 Sangamo Therapeutics хотела
продемонстрировать возможность точной вставки функциональной версии
отсутствующего гена непосредственно в хромосомную ДНК клетки. Помещая
трансген под контроль сильного промотора, компания также надеется
контролировать и уровень экспрессии белка.
Для достижения этого эффекта SB-913 от Sangamo Therapeutics был составлен из трех различных AAV-векторов. Первый нес мРНК, требуемую для транскрипции ZFN, которая могла бы разрезать геном человека в первой нужной точке, второй содержал код для ZFN, необходимый для разрезания ДНК во второй точке, а третий нес генетический шаблон для гена IDS, который требовалось вставить между двумя разрезами.
Sangamo Therapeutics начали клинические испытания SB-913 в ноябре
2017 года. К февралю 2019 года стало ясно, что у пациентов не
наблюдалось достаточного улучшения. Содержание белка IDS почти не
менялось.
Но, тем не менее, компания получила предварительные
данные об интеграции трансгена IDS, подтвержденные ПЦР-анализом биоптата
печени. Вулфсон добавляет, что у одного пациента, получившего самую
высокую дозу препарата, было обнаружено значительное повышение синтеза
ферментов. «Это, на наш взгляд, говорит о том, что мы впервые в истории
человечества отредактировали геном человека in vivo, —
добавляет он. — В этом смысле, в отношении редактирования генома нас
можно сравнить с братьями Райт. И теперь мы ремонтируем наш самолет».
Он
объясняет, что ключевая проблема этой программы заключалась в том, что
для достижения интеграции IDS все три вектора должны были успешно
проникнуть в клетки-мишени и совместно отредактировать их геном. С тех
пор компания изменила свой подход: для доставки разрезающих ZFN и
шаблона для синтеза IDS стали применяться всего два вектора, что
повысило шансы для интеграции IDS.
«Если на этот раз мы взломаем эту систему, то, скорее всего, сможем доказать общую полезность метода», — говорит Вулфсон.
Компании,
использующие методы на основе CRISPR, также изучают возможности
применения своих способов редактирования для точной вставки генов в
геном человека, но их первые программы для клинического применения in vivo имеют более простой подход, а именно удаление ДНК.
Например,
в знаковом исследовании EDIT-101, проведенного компаниями Editas и
Allergan, CRISPR-Cas9 используется для удаления фрагмента интронной ДНК.
Вырезая участок мутировавшего гена CEP290 у пациентов с врожденным
амаврозом Лебера 10 (LCA10), приводящим к слепоте, ученые надеются
стимулировать выработку функционального белка и восстановить зрение.
Используя
этот подход, Editas идет по стопам компании Spark Therapeutics,
первопроходца в генной терапии, которая в 2017 году впервые в мире
получила одобрение FDA на генную терапию для лечения врожденной слепоты,
обусловленной LCA2 с применением voretigene neparvovec . Выбрав
офтальмологическое заболевание, Spark Therapeutics избежали осложнений,
которые сдерживали развитие в области генной терапии. Поскольку глаз
является иммунопривилегированным органом, риск иммунного ответа на
чужеродные векторы и введенные трансгены снижен. Циркуляция
биологических жидкостей от глаза к другим частям тела ограничена, что
снижает риск побочных эффектов, а отсутствие обновления
отредактированных клеток повышает вероятность долгосрочных эффектов.
Компания Editas, соучредителем которой является Дудна, надеется, что система CRISPR-Cas9 также будет использовать эти преимущества.
Разрезая на части
Другие главные кандидаты для редактирования генома in vivo также используют системы CRISPR-Cas для разрезания ДНК.
Например, все ведущие программы компании Intellia для полного нокаута генов используют функциональность CRISPR-Cas. С помощью препарата NTLA-2001 Intellia и ее партнер Regeneron начинают охоту на транстиретин (TTR). Когда этот транспортный белок мутирует, он может сформировать неправильную структуру за счет нарушения фолдинга и образовать агрегаты, вызывая TTR-опосредованный амилоидоз. Компании надеются, что снизив экспрессию TTR, они обеспечат пациентам лечение, эффект которого сохранится на протяжении всей жизни.
«Поскольку показания к применению требуют особой осторожности, мы хотели получить достоверные подтверждения работоспособности выявляемого механизма, — говорит Сепп-Лоренцино. — И тогда мы сможем использовать его для проверки нашей технологии».
Действительно, для предшественников этой технологии — антисмысловых нуклеотидов и РНК-интерференции (RNAi) уже получены убедительные аргументы в пользу эффективности взаимодействия с TTR. В 2018 году FDA одобрило Patisiran компании Alnylam для лечения наследственного TTR-опосредованного амилоидоза, что сделало его первым в истории одобренным препаратом, использующим метод RNAi. Олигонуклеотид связывает мРНК TTR, подавляя ее экспрессию. (Сепп-Лоренцино раньше работала в Alnylam.) Регулирующие органы также одобрили антисмысловой олигонуклеотид Inotersen компаний Akcea Therapeutics и Ionis, достигающий аналогичного эффекта в тех же условиях.
После того, как биологические риски сведены к минимуму, и проложен путь к одобрению метода, Intellia может сосредоточиться на демонстрации преимуществ CRISPR-Cas9. Например, приводит ли этот метод редактирования генов к более низким уровням TTR? Улучшается ли профиль безопасности? Эффективна ли однократная доза?
Intellia также уходит от применения AAV-векторов, используя вместо
них для введения в клетки мРНК, кодирующую CRISPR-Cas, липидные
наночастицы. «Это может иметь значение для иммуногенности, а также для
будущего применения методов редактирования генов», — говорит
Сепп-Лоренцино (вставка 2).
Вставка 2 | Вариации векторов
Препараты
для редактирования генов хороши настолько, насколько хороши средства их
доставки. В конце концов, если редактирующие биомолекулы не могут
проникнуть в ядра клеток, которые они должны отредактировать, то как они
могут исправить дефектные гены? Таким образом, следуя по стопам
пионеров генной терапии, применявших адено-ассоциированные вирусные
(AAV) векторы для доставки полезной генетической информации в ядро,
большинство потенциальных программ редактирования генов in vivo стали использовать AAV-векторы.
Однако
выбор этого способа несет определенные риски и возможные проблемы.
Отдельные пациенты уже имеют иммунитет к некоторым AAV-векторам. У них
также может развиться иммунитет к данным векторам при необходимости
повторного введения препарата. В совокупности эти факторы могут
ограничить сферу применения систем редактирования с доставкой в виде
AAV-векторов. Отметим также, что AAV-векторы преимущественно
направляются в печень, мышцы и центральную нервную систему, что
ограничивает другие ткани, которые можно было бы отредактировать с
наибольшей эффективностью. Несущая способность вектора — около 5 тыс.
пар оснований (п.о.), то есть он вплотную вмещает CRISPR-Cas размером
3–4 тыс. п.о. Кроме того, иногда, хоть и достаточно редко, они могут
интегрироваться в геном хозяина, что указывает на возможность длительной
экспрессии этого механизма редактирования генов.
Компания
Intellia и ее партнер Regeneron используют другой подход, работая вместо
этого с липидными наночастицами (lipid nanoparticle, LNP) в качестве
систем доставки. За последние десятилетия регулирующие органы в США и ЕС
одобрили около дюжины препаратов, доставляемых LNP, в том числе
Patisiran компании Alnylam — олигонуклеотид для RNAi. Как и AAV, LNP
также имеют склонность накапливаться в печени и могут вызывать
иммуногенные реакции. «Но они не интегрируются в геном хозяина», —
говорит Лаура Сепп-Лоренцино, руководитель отдела безопасности компании
Intellia. И их несущая способность намного больше, чем у AAV. «Мы можем
“упаковывать” основания без ограничений», — отмечает она.
«Для
первых программ редактирования генов, основанных на разрезании ДНК,
несущая способность не являлась проблемой. Но по мере того, как сфера
применения генной инженерии усложняется, и разработчики препаратов
начинают задумываться о преимуществах одновременного выполнения
нескольких разрезов ДНК, значение приобретают более крупные векторы,
которые могут нести больше одной редактирующей биомолекулы», — добавляет
она.
Многие из самых передовых программ in vivo фокусируются на
редких генетических заболеваниях. Гены, которые экспрессируются в
печени, мышцах и ЦНС, являются высоко приоритетными мишенями, отчасти
из-за того, что именно в эти ткани склонны перемещаться AAV-векторы, но
сейчас для этого также рассматриваются и несколько особенных
инфекционных заболеваний.
В компании Locus Biosciences,
соучредителем которой является Герсбах (Gersbach), исследователи
перевернули первоначальное назначение систем CRISPR-Cas. Исторически,
бактерии синтезировали эти молекулярные «ножницы», режущие чужеродные
гены, для защиты от инфицирующих бактериофагов. Компания Locus
разработала бактериофаг, переносящий режущую систему CRISPR-Cas3,
которая находит и повреждает бактериальную ДНК. В то время как
основанные на бактериофагах стратегии десятилетиями боролись за то,
чтобы сдвинуться с мертвой точки, Locus считает, что CRISPR придаст
бактериофагу большую активность по уничтожению бактерий.
В
январе 2020 года компания Locus предложила для клинического
использования свой первый продукт на основе CRISPR-Cas — коктейль из
бактериофагов, несущих CRISPR-Cas3, нацеленный на ДНК Escherichia coli.
«Я думаю, что такой продукт повысит уровень креативности в этой области и
позволит иначе взглянуть на то, что можно сделать с помощью CRISPR», —
говорит Джозеф Никсон (Joseph Nixon), вице-президент по развитию бизнеса
в компании «Локус».
Вирусы тоже на повестке дня. Компания
Excision BioTherapeutics приближается к внедрению в клинику кандидатного
препарата на основе CRISPR-Cas9, который вырезает интегрированную ДНК
ВИЧ из человеческого генома, что потенциально позволит
ВИЧ-инфицированным пациентам прекратить прием антиретровирусной терапии.
Первое клиническое испытание должно начаться позднее в этом году.
Компания Precision Biosciences и ее партнер Gilead разработали программу
по борьбе с вирусом гепатита В на основе мегануклеазы, в 2021 году они
планируют подать заявку на проведение клинических испытаний. Некоторые
исследователи задумываются над тем, как использовать методы разрезания
ДНК для лечения COVID-19.
Критические вопросы
Как только результаты исследований по редактированию генов станут
известны, вероятно, что некоторые ключевые клинические выводы будут
иметь далеко идущие последствия.
С одной стороны, насколько
иммуногенны различные технологии редактирования? Как редакторы, так и
векторы, применяющиеся в программах in vivo, необходимые для
введения редакторов в клетки, чужеродны организму человека.
Следовательно, они способны вызывать иммунные реакции, которые могут
снизить эффективность терапии, разрушая (молекулярный) механизм
редактирования генов, или же причинять вред тканям. Применение генной
терапии привело к значительному снижению использования AAV-векторов. Но
системы CRISPR-Cas имеют бактериальное происхождение и неясно, как
иммунная система пациентов будет на них реагировать.
Предварительные
данные скрининга на иммуногенность неоднозначны. Один из анализов
иммунитета человека к белкам Cas9 показал, что у 58–78 % обследованных
индивидуумов был ранее существовавший иммунитет к различным вариантам
Cas9. Другое исследование, использующее другой тип измерения, определило
более скромные цифры — 2,5–10 %.
Недавнее исследование на мышах
также показало, что ранее существовавший иммунитет к Cas9 приводил к
элиминации клеток с отредактированным геномом. Еще предстоит выяснить,
верно ли это в отношении людей. «Я думаю, что это то, что мы пока не до
конца понимаем», — говорит Герсбах. «Мы и не поймем, пока препарат не
начнут вводить человеку», — добавляет он.
«Прямо сейчас я не
рассматриваю иммуногенность как главный ограничивающий фактор», —
говорит Дудна. Она объясняет, что исследователи уже обнаружили несколько
различных систем редактирования CRISPR-Cas у некоторых бактерий, и они
постоянно находят и разрабатывают новые. Если некоторые из этих систем
слишком иммуногенные, или организм уже сталкивался с ними раньше, они
будут заменены другими. «Но, безусловно, за этим нужно следить», —
добавляет она.
Также постоянную обеспокоенность вызывает
нецелевое редактирование. Системы редактирования генов специфичны, но,
тем не менее, они могут разрезать ДНК в непредусмотренных местах.
Частота, с которой происходят такие побочные явления, все еще остается
предметом дискуссий, и для оценки масштабов и последствий нецелевого
редактирования необходимы более совершенные методы.
Кроме того,
возникают вопросы относительно долгосрочных эффектов редактирования
генов. «Стабильны ли эти генетические манипуляции? И есть ли неожиданные
и непредвиденные их последствия? — спрашивает Дудна. — Я думаю, что эти
вопросы еще предстоит решить, и, вероятно, они будут очень важны в
первоначальных исследованиях. Они заложат основу для будущего применения
системы CRISPR».
Первые программы по редактированию генов,
внедренные в клинику — и, следовательно, первые, для которых будут
получены результаты — вряд ли предоставят много сведений для понимания
этих широких вопросов. Например, программы ex vivo и
иммуноонкологии, осуществляемые на клетках, изъятых у пациента, дадут
мало информации о влиянии различных векторов и редактирующих молекул на
иммунную систему хозяина.
Перенос информации о
ZFN-опосредованном иммунном ответе на CRISPR-Cas также ограничен. И даже
первое клиническое испытание препарата EDIT-101 от Editas для
редактирования in vivo даст немного информации об
иммуногенности или «нецелевом» редактировании, поскольку сетчатка очень
хорошо изолирована от остального организма.
«Ответы будут сильно
зависеть от каждой детали — от того, что, сколько и куда вы
доставляете, как долго это происходит и что представляет из себя
болезнь», — говорит Герсбах.
В конце концов, CRISPR-Cas — это
общий термин. «Когда вы используете слово CRISPR, вы охватываете
огромное множество различных технологий, — говорит Герсбах. — И, я
думаю, что это направление будет продолжать развиваться».
Затачивание инструментов
Уже сейчас возникает все больше вариаций инструментов для редактирования генома.
Например,
компания Beam Therapeutics надеется использовать подход редактирования
оснований, полученный по лицензии Дэвида Лю (David Liu) из Гарварда и
других специалистов, для продвижения CRISPR-Cas в новом направлении.
Вместо того, чтобы вырезать нежелательную ДНК, платформа Beam
Therapeutics меняет основания в цепочке ДНК. «Суть в том, что теперь мы
можем не только точно нацелиться на определенную область генома, но и
точно контролировать последовательность, которая получится в
результате», — говорит Эванс.
Эванс добавляет, что более половины генетических нарушений, приводящих к заболеваниям, вызваны однобуквенными изменениями.
Некоторые
из программ Beam Therapeutics могут найти применение в области
ультра-орфанных заболеваний (т.е. крайне редких. В России орфанным
считается заболевание с распространенностью не более 10 человек на 100
000 населения. — прим. пер.). «Нет сомнений, что в конечном итоге вы
столкнетесь с этим длинным списком болезней с очень маленьким
количеством больных, для которых в конечном итоге может потребоваться
другая тактика лечения. Я думаю, что именно в этой области мы и будем
активны», — говорит Эванс.
Он добавляет, что будут и более
широкие возможности. Например, все 80 000 больных серповидноклеточной
анемией в США имеют одну и ту же точечную мутацию E6V (замена
глутаминовой кислоты на валин в 6-м положении — прим. пер.) по крайней
мере в одном аллеле гена гемоглобина. Beam Therapeutics может
рассмотреть возможность прямого редактирования E6V для создания
бессимптомного варианта E6A (замена в том же 6-м положении глутаминовой
кислоты на аланин — прим. пер.). Компания также исследует подходы по
редактированию оснований ДНК для повышения экспрессии фетального
гемоглобина.
«Мы рассматриваем эти два различных подхода как
взаимодополняющие и планируем продвигать их параллельно, пока какие-либо
данные не помогут определить, какой из них предпочтительнее», — говорит
Эванс. Компания планирует в 2021 году подать заявку на проведение
клинических испытаний ex vivo своего набора препаратов.
«Нет сомнений в том, что в этой области уже исследуется множество препаратов. Однако сейчас еще самый ранний этап развития этих технологий, поэтому мы не боимся вступить в эту область», — говорит Эванс.
Назад в будущее
Другие редакторы также набирают обороты. Например, в 2013 году Дудна
вместе с коллегами из Cell показала, что CRISPR можно соединить с
каталитически неактивным белком dCas. Вместо того, чтобы разрезать ДНК,
dCas9 может связаться с эффекторными доменами для контроля экспрессии
генов-мишеней.
«Мы видим скачкообразный рост возможностей для различных эффекторов CRISPR», — говорит Дудна.
Герсбах
считает, что новые типы редакторов могут изменить ход игры. «Я убежден,
что функции этих эффекторов являются гораздо более гибким, мощным и
адаптируемым способом лечения заболеваний», — говорит ученый.
С
одной стороны, при использовании этих подходов «нецелевые» эффекты
редактирования могут стать более управляемыми. Введенный молекулярный
механизм, регулирующий транскрипцию, может столкнуться с ошибочным
геном, что приведет к синтезу одного или двух транскриптов мРНК, но вряд
ли это будет иметь столь же глубокий или продолжительный эффект, как
непреднамеренное разрезание ДНК.
Эти механизмы редактирования
генов следующего поколения могли бы также осуществлять регуляторное
редактирование (редактирование регуляции экспрессии генов — прим. пер.) —
врéменное и обратимое. В то время как системы редактирования генов, для
которых достаточно однократного введения, привлекательны для лечения
редких моногенных заболеваний, разработчики препаратов, вероятно, хотели
бы иметь возможность постоянно дозировать и корректировать активность
гена/белка-мишени с течением времени при других заболеваниях, особенно,
если это поможет уменьшить беспокойство пациентов, врачей и регулирующих
органов о возможных долгосрочных последствиях постоянного
редактирования.
Третье преимущество заключается в том, что многие распространенные заболевания вызваны дисбалансом экспрессии генов. По этой причине, они могут легче поддаваться корректировке путем регуляторного редактирования.
«Я думаю, что скоро мы увидим новую волну компаний, использующих преимущества этих подходов», — говорит Герсбах.
Примечательно, что первой программой компании Sangamo Therapeutics для клинического применения (еще до попыток модифицировать CCR5), был ДНК-связывающий белок «цинковые пальцы» — транскрипционный фактор (ZFP-TF), разработанный для усиления экспрессии VEGFA (фактор роста эндотелия сосудов-альфа — прим. пер.). Препарат SB-509 в конечном итоге потерпел неудачу во II фазе клинических испытаний при диабетической невропатии. Компания считает, что отрицательному результату способствовало сочетание факторов, включая недостаточную активацию VEGFA и многогранность биологии заболевания. Однако достижения все же были сохранены, и компания внедрила инновации, выходящие за рамки этой устаревшей технологии. Почти половина раскрытых программ компании на доклиническом этапе исследований в настоящее время включает редакторы регуляции генов. Заключенная в начале этого года сделка Sangamo Therapeutics и Biogen по разработке препаратов на сумму 350 млн. долл. США авансом и до 2,4 млрд. долл. США в качестве возможных поэтапных выплат также указывает на возможности, открывающиеся в области лечения неврологических заболеваний, включая болезнь Альцгеймера и Паркинсона.
Компания Refuge Biotechnologies, соучредителем которой является Стэнли Ци (Stanley Qi), соавтор открытия dCas9, тем временем использует инструменты dCas9 для разработки клеточной терапии в иммуноонкологии. Компания Navega Therapeutics также работает над улучшением препарата, в котором dCas9 используется для подавления экспрессии ионного канала Nav1.7, ключевого компонента болевого пути, который завел в тупик разработку препаратов на основе малых молекул и антител. Генеральный директор Ана Морено (Ana Moreno) надеется, что этот кандидатный препарат появится в клинике в следующем году.





