Введение
Вакцинация против вируса папилломы человека (ВПЧ) с помощью двухвалентной вакцины (Церварикс) была введена в Англии, Великобритания, 1 сентября 2008 года: плановая вакцинация была предложена девочкам в возрасте 12–13 лет с программой охвата девушек в возрасте 14–18 лет в 2008–2010 гг. Авторы количественно оценили раннее влияние данной программы на развитие рака шейки матки и карциномы in situ — а именно на цервикальную интраэпителиальную неоплазию третьей степени (ЦИН3).
Методы
В настоящем обсервационном исследовании авторы использовали расширение пуассоновской модели типа возраст-период-когорта для оценки относительного риска развития рака шейки матки в трех вакцинированных когортах по сравнению с более ранними когортами, которые не проходили вакцинацию против ВПЧ. Данные из популяционного регистра рака были получены 26 января 2021 года и проанализированы на предмет наличия установленного диагноза рака шейки матки и ЦИН3 с 1 января 2006 года по 30 июня 2019 года у женщин в возрасте 20–64 лет, которые проживали в Англии. Авторы использовали три вакцинированные когорты, чтобы учесть различия относительно учебного года, в котором была предложена вакцина, а также ее национальный охват. Поправка на влияние вмешивающихся факторов была сделана с использованием информации об изменениях в политике цервикального скрининга и событиях, которые повлияли на развитие рака шейки матки.
Полученные данные
Авторы использовали данные за 13,7 миллионов человеко-лет наблюдений за женщинами в возрасте от 20 до 30 лет. Предполагаемое относительное снижение заболеваемости раком шейки матки по возрасту на момент введения стратегии вакцинации составило 34 % (95 % ДИ 25–41) в возрасте 16–18 лет (12–13 учебный год), 62 % (52–71) в возрасте 14–16 лет (10–11 учебный год) и 87 % (72–94) в возрасте 12–13 лет (8 учебный год) по сравнению с контрольной невакцинированной когортой. Соответствующее снижение риска для ЦИН3 составило 39 % (95 % ДИ 36–41) для тех, кто был вакцинорован в возрасте 16–18 лет, 75 % (72–77) — в возрасте 14–16 лет и 97 % (96–98) — в возрасте 12–13 лет. Эти результаты оставались одинаковыми во всех моделях. Авторы подсчитали, что к 30 июня 2019 года в вакцинированных группах в Англии было на 448 (339–556) случаев рака шейки матки и на 17 235 (15 919–18 552) случаев ЦИН3 меньше, чем ожидалось.
Обсуждение
После введения программы иммунизации против ВПЧ в Англии наблюдалось существенное снижение заболеваемости раком шейки матки и ЦИН3 у молодых женщин, особенно у тех, которым вакцина была предложена в возрасте 12–13 лет. Программа иммунизации против ВПЧ практически устранила рак шейки матки у женщин, родившихся 1 сентября 1995 года и позже.
Исследование в контексте
Данные, имевшиеся до проведения исследования
Рандомизированные контролируемые исследования и мониторинговые исследования продемонстрировали пользу вакцинации против вируса папилломы человека (ВПЧ) для профилактики ВПЧ-инфекции и цервикальной интраэпителиальной неоплазии (ЦИН), но прямых доказательств ее влияния на заболеваемость раком шейки матки недостаточно. Предварительные данные о том, что вакцинация защищает от рака, связанного с ВПЧ, были получены в результате совместного пассивного наблюдения за женщинами, участвовавшими в двух финских испытаниях вакцин (одно — с использованием четырехвалентной вакцины, а другое — с двухвалентной вакциной), по сравнению с невакцинированной когортой; однако число людей с диагностированным раком было слишком мало, чтобы точно оценить эффективность. Анализ показателей заболеваемости раком шейки матки в Швеции продемонстрировал снижение риска его развития у лиц, получавших Гардасил (четырехвалентную вакцину против ВПЧ), но оценки эффективности варьировались в зависимости от внесенных корректировок.
Дополнительная ценность настоящего исследования
Авторы наблюдали значительное снижение заболеваемости раком шейки матки и заболеваемости ЦИН3 у молодых женщин после введения вакцинации против ВПЧ в Англии, особенно у лиц, которым вакцина была предложена в возрасте 12–13 лет. Данное исследование предоставляет первые прямые доказательства профилактики рака шейки матки с помощью Церварикса (двухвалентной вакцины против ВПЧ). Были определены когорты с учетом возраста, в котором женщинам была предложена вакцинация против ВПЧ, и различий в национальном охвате. Это определение позволило оценить эффект программы плановой вакцинации, проводимой среди девочек в возрасте 12–13 лет (8 учебный год), отдельно от дополнительных наверстывающих программ, которые были направлены на девочек в возрасте 14–16 лет (10–11 учебные годы) и 16–18 лет (12–13 учебные годы), которые, возможно, уже подвергались воздействию ВПЧ до вакцинации и среди которых охват был ниже.
Значение всех имеющихся данных
Полученные результаты дополняют очень ограниченную литературу доказательствами того, что национальные программы иммунизации против ВПЧ могут привести к существенному снижению заболеваемости раком шейки матки, особенно если охват вакцинацией высок и вакцина предлагается женщинам в более молодом возрасте. Несмотря на то, что оценивать полный эффект английской программы вакцинации против ВПЧ еще слишком рано, результаты способствуют лучшему пониманию и признанию преимуществ иммунизации против ВПЧ.
Введение
Вакцинация против вируса папилломы человека (ВПЧ) была внедрена более чем в 100 странах и лежит в основе глобальной стратегии ВОЗ по ликвидации рака шейки матки [1, 2]. В 2019 году мировой рынок вакцин против ВПЧ-инфекций достиг примерно 41,4 миллиона доз; при этом двухвалентная вакцина, согласно оценкам, занимала долю рынка, равную по объему около 23 % [3]. В рандомизированных контролируемых испытаниях было показано, что вакцины предотвращают типоспецифические инфекции ВПЧ и цервикальную интраэпителиальную неоплазию (ЦИН) в когортах, ранее не инфицированных ВПЧ, но качественные эмпирические данные об их влиянии на заболеваемость раком шейки матки отсутствуют.
Вакцинация против ВПЧ была введена в Англии (Великобритания) 1 сентября 2008 года с использованием двухвалентной вакцины (Церварикс). Цель состояла в том, чтобы снизить заболеваемость раком шейки матки путем предотвращения персистенции инфекций двух наиболее распространенных типов ВПЧ высокого риска (16 и 18), которые ответственны примерно за 80 % всех случаев рака шейки матки в Великобритании [4]. Поскольку вакцина против ВПЧ наиболее эффективна, когда ее вводят до любого контакта с вирусами ВПЧ (т. е. до начала половой жизни), девочкам в возрасте 12–13 лет (8 учебный год) была предложена плановая вакцинация.
В Англии учащимся в начале 8 класса (с 1 сентября) исполняется 12 лет, а в течение учебного — 13 лет. В 2008–2009 учебном году девочкам в возрасте 17–18 лет (родившимся в период с 1 сентября по 31 августа 1991 года), а в 2009–2010 учебном году – девочкам в возрасте 14–18 лет (родившимся в период с 1 сентября 1991 года по 31 августа 1995 года) была предложена программа «наверстывание упущенного». Ежегодный охват иммунизацией против ВПЧ тремя дозами в период с 2008–2009 по 2011–2012 учебный год был очень высоким для учащихся 8 учебного года (диапазон 80,9–88,0 %), но ниже для догоняющих когорт (70,8–75,7 % для 10–11 классов и 38,9–48,1 % за 12–13 классы) [5–7]. 1 сентября 2012 года двухвалентная вакцина была заменена четырехвалентной (Гардасил) и в данной статье не рассматривается.
Через 10 лет после введения плановой вакцинации против ВПЧ в Англии было отмечено значительное сокращение случаев инфицирования 16/18 и 31/33/45 типами ВПЧ у женщин в возрасте 16–24 лет, проходящих скрининг на хламидиоз [8]. В Шотландии у женщин в возрасте 20 лет было зарегистрировано выраженное снижение числа случаев предраковых заболеваний шейки матки [9]. Раннее моделирование показало, что вакцинация против ВПЧ не окажет заметного влияния на заболеваемость раком шейки матки минимум в течение 8 лет после введения программы, но к концу 2019 года в Великобритании произойдет существенное снижение заболеваемости среди женщин в возрасте 20–29 лет [10]. В 2020 году анализ частоты рака шейки матки у шведок, которые получали или не получали четырехвалентную вакцину (Гардасил), показал снижение риска развития заболевания, но величина эффекта зависела от поправок, сделанных на искажающие факторы [11].
Прошло уже более 10 лет с тех пор, как в Англии была введена вакцинация против ВПЧ. Хотя еще рано оценивать полное воздействие этой программы на заболеваемость раком шейки матки, на данный момент возможно исследовать ранние изменения. Другие вакцины против ВПЧ также продемонстрировали эффективное снижение инфицирования и частоты развития ЦИН [8, 12], но единственное прямое доказательство влияния на рак шейки матки относится к четырехвалентной вакцине [11]. Авторы использовали данные популяционного регистра рака для оценки раннего воздействия программы иммунизации с помощью двухвалентной вакцины (с использованием Церварикс) на развитие рака шейки матки и отдельно — на заболеваемость раком шейки матки in situ (ЦИН3) в Англии.
Методы
Дизайн исследования
Авторы попытались оценить влияние вакцинации против ВПЧ на заболеваемость раком шейки матки по результатам наблюдений. Взаимосвязь между вакцинацией и заболеваемостью раком шейки матки на индивидуальном уровне, вероятно, будет затруднена из-за в значительной степени неизмеряемых факторов, связанных с убеждениями, поведением и образом жизни. И, наоборот, связь между предложением о проведении вакцинации и диагностикой рака шейки матки осложняется фиксируемыми факторами, такими как возраст, календарное время и когорта рождения (которая определяет, предлагалась бы женщинам вакцинация против ВПЧ или нет, а также когда их впервые обследовали на предмет заболеваний шейки матки), но не зависит от неизмеримых факторов, таких как убеждения и образ жизни. Авторы определили три группы вакцинированных, чтобы учесть учебный год, в котором была предложена вакцина (в возрасте 12–13, 14–16 или 16–18 лет), и различия в охвате вакцинацией. Также в исследование были включены четыре невакцинированные когорты в зависимости от даты рождения, которые впоследствии разделили таким образом, чтобы провести сравнение между группами женщин, которым был предложен скрининг на заболевания шейки матки в разном возрасте.
В отсутствие популяционного и перекрестного иммунитета от типов ВПЧ, отличных от 16 и 18, ожидается, что программа вакцинации против ВПЧ снизит показатели заболеваемости раком шейки матки примерно на величину, равную произведению 80 % (т. е. приблизительного процента случаев рака шейки матки, вызванных в Англии ВПЧ 16/18) [4] и количества вакцинированных. С использованием этого приближения был получен нижний предел ожидаемой эффективности, если предположить, что введение менее трех доз не обеспечивает защиту, и верхний предел, если предположить, что 100 % эффективность (против заболевания, вызванного ВПЧ 16/18) обеспечивает одна доза вакцины. Ожидаемое снижение заболеваемости раком шейки матки в этом случае составит около 36–48 %, 59–64 % и 68–71 % в группах, которым была проведена вакцинация в возрасте 16–18, 14–16 и 12–13 лет соответственно.
На основании данных скрининга снижение риска в двух последних группах может быть больше, чем предполагалось, за счет популяционного и частичного перекрестного иммунитета или более высокой распространенности ВПЧ 16/18 среди лиц, у которых инфицирование диагностировано в более раннем возрасте. Напротив, эффективность вакцинации у женщин, вакцинированных в более позднем возрасте, будет ниже, чем предполагалось ранее, потому что многие из тех, у кого развился бы рак шейки матки в возрасте 20 лет, были бы инфицированы до вакцинации.
Данные
Данные о заболеваемости раком шейки матки (МКБ-10 — C53) и ЦИН3 (МКБ-10 — D06), диагностированных в период с 1 января 2006 года по 30 июня 2019 года у женщин в возрасте 20–64 лет, проживающих в Англии, были получены 26 января 2021 года из набора данных, подготовленного Национальной службой регистрации и анализа рака [13], Public Health England (PHE). Данные о среднегодовом населении были получены от Национального статистического управления Великобритании [14].
Авторы использовали пуассоновскую модель типа возраст-период-когорта [15, 16] для оценки влияния вакцинации против ВПЧ на показатели заболеваемости раком шейки матки и— отдельно — ЦИН3. В дополнение к обычным параметрам (возраст, период и когорта) были включены соотношения возраст-когорта и возраст-период для обработки различных событий (обсуждаемых ниже), про которые известно, что они влияют на заболеваемость раком шейки матки. Случаи рака были объединены по возрасту в месяцах, периоду и когорте, а соответствующие оценки населения (человеко-время) были включены после логарифмического преобразования в качестве смещения; при оценке 95 % доверительного интервала (ДИ) использовались робастные стандартные ошибки [17, 18].
Модели включали комбинацию следующих ковариант. Были рассмотрены семь возрастных групп: от 20,0 до 24,5 лет, от 24,5 до 26,0 лет, от 26,0 до 30,0 лет, от 30,0 до 35,0 лет, от 35,0 до 45,0 лет, от 45,0 до 55,0 лет и от 55,0 до 65,0 лет. В частности, точка отсечения в 24,5 лет была включена для учета значительного увеличения числа случаев диагностики рака в течение нескольких месяцев после первого скрининга [19] и того факта, что с 2012 года женщины впервые проходили скрининг в возрасте 24,5 лет.
В анализе были сохранены старшие возрастные группы для фиксации тенденции в диагностике и регистрации ЦИН3 и рака шейки матки с течением времени. Эта информация была полезна для оценки происходящих событий, сезонных колебаний регистраций и любой неполной регистрации из-за включения более свежих данных. Анализ чувствительности проводился с использованием ограниченных кубических сплайнов [20, 21].
Тремя основными периодическими эффектами были: (1) линейный тренд во времени (дрейф), средний период которого пришелся на 1–31 января 2016 года, (2) четыре индикаторные переменные для учета сезонных колебаний диагнозов (все диапазоны включают полный месяц): январь — март, апрель — июнь, июль — сентябрь и октябрь — декабрь, (3) четыре фиктивные переменные для корректировки с учетом возможной неполной регистрации недавних диагнозов рака (все диапазоны включают полный месяц): январь 2006 года — декабрь 2017 года (полная регистрация), январь 2018 года — сентябрь 2018 года, октябрь 2018 года — март 2019 года, апрель 2019 года — июнь 2019 года (наименее полная регистрация).
Авторы определили семь когорт рождения, соответствующих различиям в
возрасте при первом приглашении на скрининг и в школьных годах, в
которых предлагалась вакцинация против ВПЧ. Изменения в возрасте
относительно первого скрининга сильно влияют на возрастные показатели
заболеваемости раком [19]. В Англии в 1988 году была введена
национальная программа цервикального скрининга для женщин в возрасте
20–64 лет. В 2004 году возраст первого приглашения на скрининг был
увеличен до 25,0 лет. Поскольку новая политика осуществлялась в течение
15-месячного периода, начиная с августа 2004 года, женщин, родившихся в
период с сентября 1984 года по октябрь 1985 года, впервые пригласили на
обследование либо в 20, либо в 25 лет. В 2012 году возраст первого
приглашения на скрининг снова изменился (24,5 лет), поэтому были
определены семь когорт рождения в зависимости от того, предлагалась ли
вакцинация, возраста при первом приглашении на скрининг и возраста при
предложении вакцинации против ВПЧ (рисунок 1).
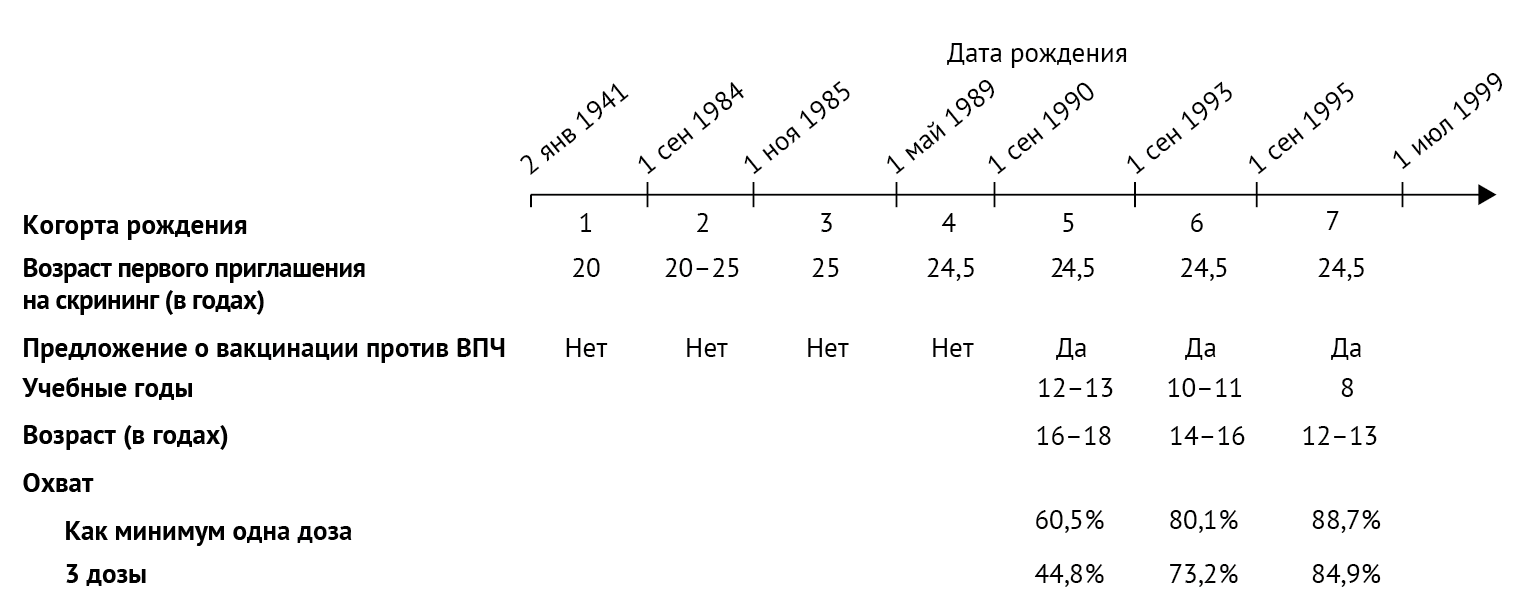
Рисунок 1 | Схематическое представление когорт рождения Охват вакцинацией включает (при наличии данных) подчищающую вакцинацию (т. е. когда женщины вакцинируются в более поздний год, чем тот, в котором им впервые была предложена вакцинация).
Было проведено две взаимосвязи возраст-период. Во-первых,
индикаторная переменная для женщин в возрасте от 20 до 50 лет в период с
1 января по 30 июня 2009 года для учета увеличения проведения скрининга
шейки матки в результате так называемого эффекта Джейд Гуди (огласка,
связанная с последними месяцами и смертью знаменитости Джейд Гуди от
рака шейки матки) [22]. Во-вторых, индикаторная переменная для женщин в
возрасте 24,5 лет и старше в период с 1 марта по 30 июня 2019 года для
учета ожидаемого роста заболеваемости в связи с информационной кампанией
PHE по скринингу шейки матки, начатой 5 марта 2019 года [23].
Для взаимосвязи возраст-когорта авторы включили набор индикаторных
переменных для учета увеличения числа диагностируемых распространенных
случаев рака, обусловленных изменениями политики в возрасте первого
приглашения на скрининг [19]. Авторы предположили, что приглашение на
первый скрининг значительно увеличивает обнаружение рака в течение шести
месяцев и в меньшей степени — в течение следующих шести месяцев. В
частности, были рассмотрены индикаторные переменные для следующих
когортных и возрастных групп: (1) женщины в когорте 2 в возрасте от 25,0
до 25,5 лет; (2) женщины в когорте 2 в возрасте от 25,5 до 26,0 лет;
(3) женщины в когорте 3 в возрасте от 25,0 до 25,5 лет; (4) женщины в
когорте 3 в возрасте от 25,5 до 26,0 лет; (5) женщины в когортах 4–7 в
возрасте от 24,5 до 25,0 лет; (6) женщины в когортах 4–7 в возрасте от
25,0 до 25,5 лет. Цель этих шести индикаторных переменных состояла в
том, чтобы зафиксировать увеличение числа диагнозов, поставленных в
течение шести месяцев и следующих 6–12 месяцев после первого приглашения
на скрининг шейки матки.
Стратегии моделирования
На основе плана статистического анализа код анализа был написан до того, как авторы получили доступ к данным. После тестирования на имитированных данных, состоящих из искусственных записей о раке, код был отправлен в PHE для запуска анализа реальных данных, а затем были опубликованы результаты. Код анализа был впоследствии пересмотрен и запущен для данных, полученных позднее. В этой статье представлены как результаты исходной (слепой) модели, так и результаты последующих моделей (пересмотренные после просмотра результатов моделирования по предварительной выписке данных).
В основном анализе рассматривались три модели, которые различаются только с точки зрения корректировок, внесенных в связи с недостаточной регистрацией (проблема была в том, что раковые заболевания, диагностированные в конце 2018 года и в первые шесть месяцев 2019 года, возможно, не были зарегистрированы к дате извлечения данных, но любая такая недостаточная регистрация должна в равной степени затрагивать все возрасты) и кампании по повышению осведомленности PHE. Модель 1 включает все основные эффекты для возраста и когорты, возрастные взаимодействия по когортам, линейный тренд (дрейф), индикаторные переменные для эффекта Джейд Гуди и сезонные эффекты. Модель 2 (корректировка для неполной регистрации) — это модель 1, но с дополнительными индикаторными переменными для возможной неполной регистрации. Эту модель планировалось использовать до получения каких-либо данных.
Применение этих моделей позволило оценить количество случаев рака и ЦИН3, предотвращенных с начала программы вакцинации против ВПЧ. Было проведено сравнение ожидаемого числа событий в вакцинированных когортах (с различными эффектами для каждой когорты) с соответствующими ожидаемыми числами, когда эффекты когорты должны были быть такими же, как в последней невакцинированной когорте (т. е. в контрольной группе). Точечные оценки и 95 % доверительные интервалы были получены с помощью команды «margins» в Stata (версия 16.1).
В рамках анализа чувствительности для ЦИН3 были подобраны модели для подвыборки женщин в возрасте 24,5 лет и старше, поскольку ЦИН3 диагностируется исключительно с помощью скрининга, а частота CIN3 у женщин в возрасте 20,0–24,5 лет существенно снизилась, поскольку скрининг в этой возрастной группе был прекращен. Дополнительные анализы чувствительности оценивали надежность представленных моделей (например, путем изменения количества и расположения узлов кубического сплайна).
Национальная служба регистрации и анализа рака (NCRAS) имеет юридическое разрешение Государственного секретаря по вопросам здравоохранения и социального обеспечения на сбор и использование личной информации о пациентах и их заболеваний без запроса прямого согласия. Это разрешение дается потому, что в общественных интересах использовать эту информацию для улучшения методов диагностики и лечения рака. Предложение по этому проекту было официально рассмотрено Группой старших руководителей NCRA, и данные NCRAS признано целесообразным использовать в правовых рамках.
Результаты
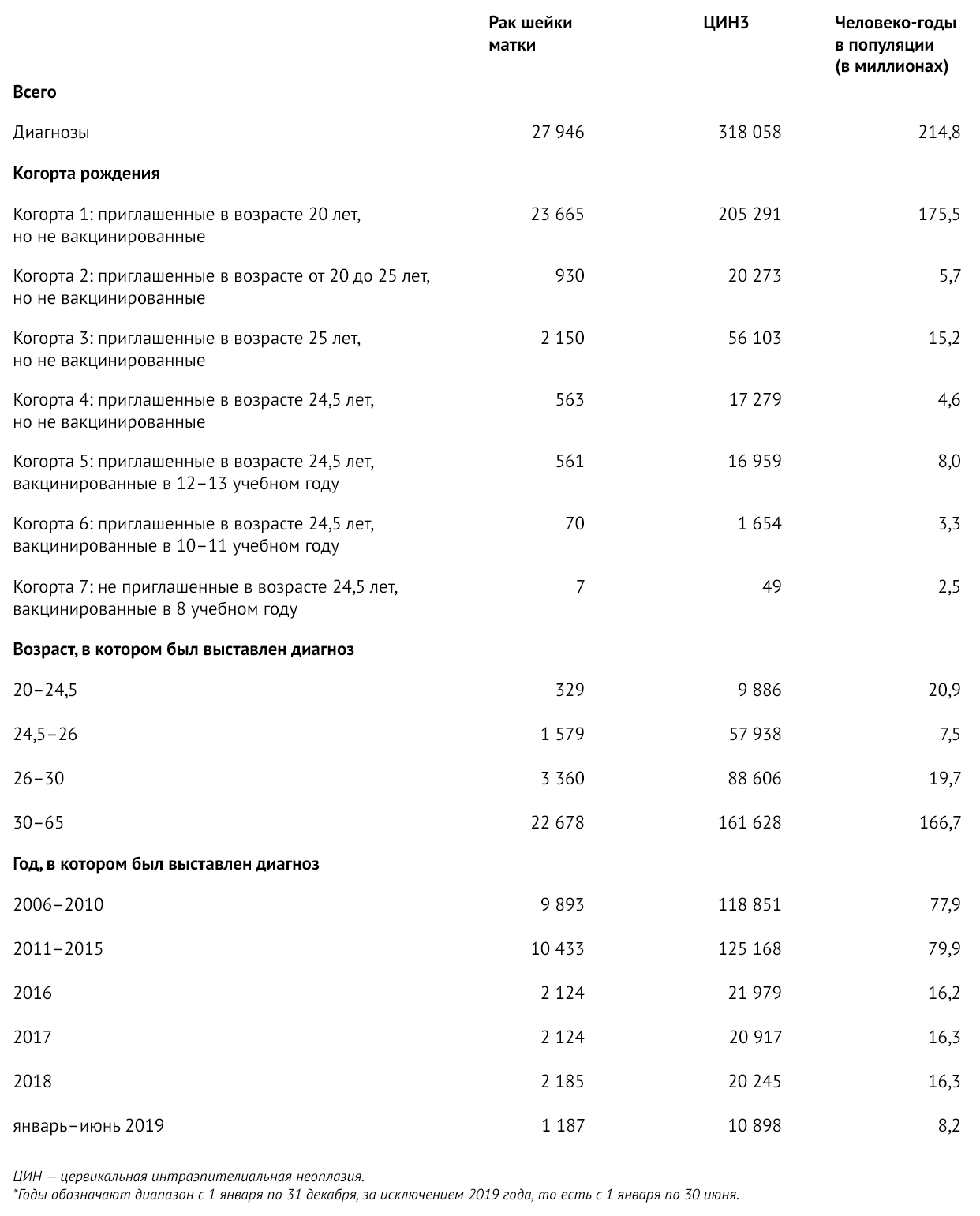
В период исследования было зафиксировано 27 946 диагнозов «рак шейки матки» и 318058 — ЦИН3 (таблица 1). Исследование включало в общей сложности 13,7 миллионов человеко-лет наблюдения за женщинами в возрасте от 20 до 30 лет в трех вакцинированных группах.
Таблица 1 | Характеристики случаев рака шейки матки и ЦИН3, включенных в исследование
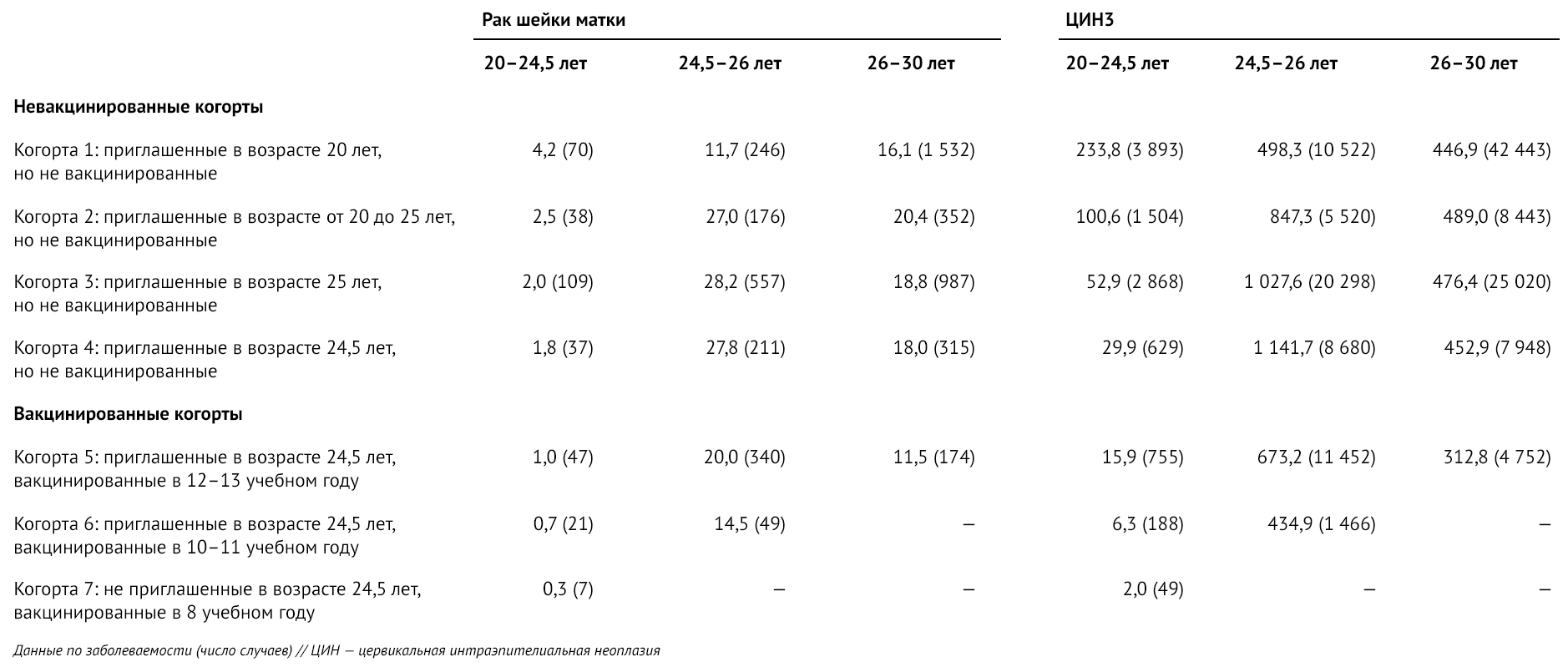
Общие показатели заболеваемости на 100 000 человеко-лет (таблица 2) были особенно низкими у женщин в когорте 7, которым вакцина была предложена в возрасте 12–13 лет (0,3 для рака шейки матки и 2,0 — для ЦИН3). Также было отмечено, что общие показатели заболеваемости раком шейки матки и ЦИН3 у женщин в возрасте от 24,5 до 26,0 лет в когортах 2–4 были намного выше, чем в когорте 1, что является результатом изменения возраста первого приглашения на скрининг. Этот вывод также показан в значительных результатах во взаимосвязи возраст-когорта.
Таблица 2 | Общие показатели заболеваемости раком шейки матки и ЦИН3 на 100 000 человеко-лет в разбивке по когортам и возрастным группам (для простоты — ограниченные возрастом < 30,0 лет)
Оценочные коэффициенты заболеваемости (IRR) для конкретной когорты очень мало изменились в моделях (таблица 3), каждая из которых была скорректирована с учетом взаимодействия относительно возраста и периода, но различались в том, допускали ли они явную недостаточную регистрацию или эффект кампании по расширению участия в скрининге. Для лучшего понимания ниже будут представлены результаты по модели 3.
Таблица 3 | Оценочные показатели IRR и 95 % ДИ рака шейки матки или ЦИН3 среди вакцинированных и невакцинированных когорт рождения
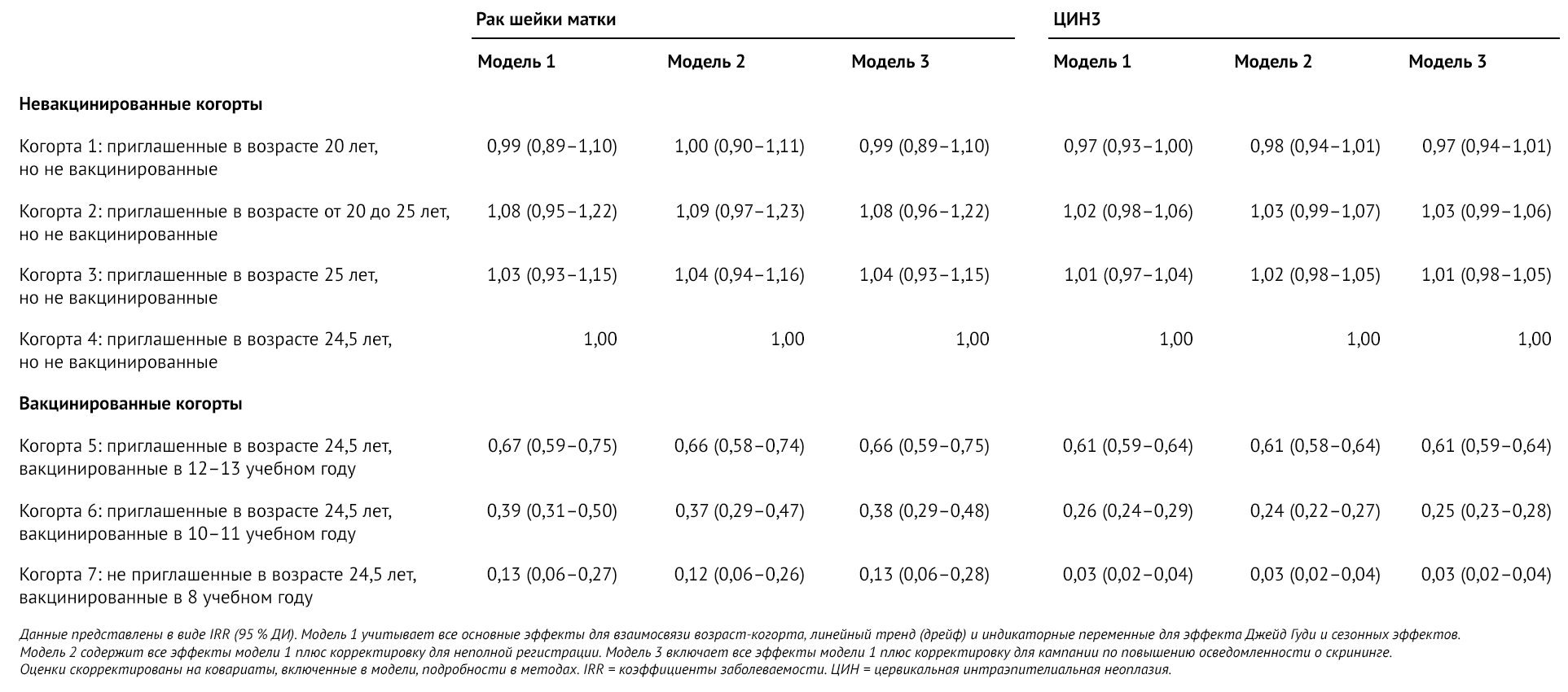
Показатели заболеваемости раком шейки матки, согласно оценкам, были на 34 % (95 % ДИ 25–41) ниже в когорте 5 (вакцина, предлагаемая в 12–13 учебные годы), на 62 % (52–71) ниже в когорте 6 (вакцина, предлагаемая в 10–11 учебные годы) и на 87 % (72–94) ниже в когорте 7 (вакцина, предлагаемая в 8 учебном году) по сравнению с невакцинированной когортой 4. Соответствующая эффективность программы вакцинации в профилактике ЦИН3 была снижена на 39 % (95 % ДИ 36–41) в когорте 5, на 75 % (72–77) — в когорте 6 и на 97 % (96–98) — в когорте 7.
Когда для ЦИН3 в рамках анализа чувствительности были исключены женщин в возрасте 20,0–24,5 лет (невозможно оценить эффекты для когорты 7), предполагаемый показатель заболеваемости в модели 3 для когорты 5 был на 35 % ниже (по сравнению с 39 %), а для когорты 6 был на 66 % ниже (по сравнению с 75 %), чем для когорты 4. Общая разница между вакцинированными когортами 5–7 и невакцинированной когортой 4 была значительной (p < 0,0001) во всех моделях для рака шейки матки и ЦИН3. Этот эффект был также продемонстрирован при тесте совместного эффекта когорт 5 и 6 по сравнению с когортой 4 у женщин с ЦИН3 в возрасте 24,5 лет и старше (p < 0,0001).
В анализах чувствительности диапазоны оцененных IRR для когорты 5 были 0,66–0,69 для рака шейки матки и 0,60–0,61 для ЦИН3, для когорты 6 были 0,32-0,40 и 0,21-0,27, а для когорты 7 — 0,12-0,30 и 0,03-0,07 — для ЦИН3. Большая вариабельность, наблюдаемая в результатах для когорты 7, ожидаема, поскольку 31 марта 2019 года женщинам в этой когорте было не более 24,5 лет, и диагноз рака шейки матки у таких молодых женщин встречается редко.
На рисунке 2 показаны оценки модели 3 совокупной заболеваемости в
возрасте от 20 до 30 лет для когорт 4–7. Модели 1 и 2 показали
аналогичные результаты. Исходя из модели 3, было подсчитано, что к 30
июня 2019 года было на 448 (95 % ДИ 339–556) меньше случаев рака шейки
матки и на 17 235 (15 919–18 552) меньше случаев ЦИН3 в вакцинированных
когортах в Англии, чем ожидалось, если бы когортные эффекты были такими
же, как в последней невакцинированной когорте (модели 1 и 2).
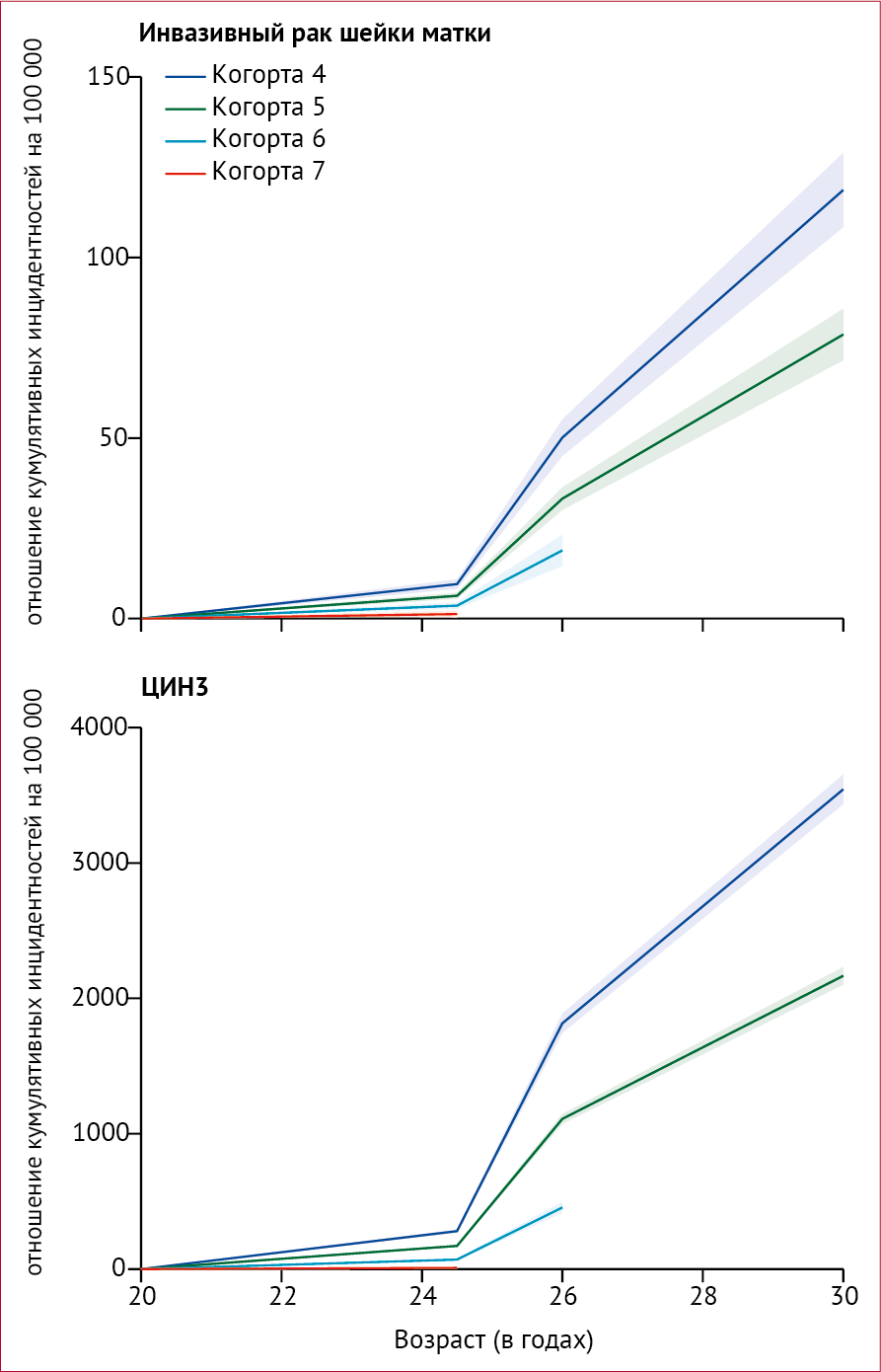
Рисунок 2 | Отношение кумулятивных инцидентностей рака шейки матки и ЦИН3 по возрастным группам Заштрихованная область указывает на 95 % ДИ. ЦИН = цервикальная интраэпителиальная неоплазия. Оценки по модели 3 со всеми остальными ковариатами, зафиксированными на исходных значениях.
Обсуждение
Внедрение национальных программ иммунизации против ВПЧ представляет собой важный шаг в профилактике рака шейки матки. Насколько известно, данное исследование предоставляет первые прямые доказательства влияния вакцинации против ВПЧ с использованием двухвалентной вакцины Церварикс на заболеваемость раком шейки матки. Было отмечено значительное снижение заболеваемости раком шейки матки во всех трех вакцинированных группах, и особенно у тех, кому была предложена вакцина в 8 учебном году (в возрасте 12–13 лет). Успех программ вакцинации зависит не только от эффективности вакцины, но и от доли вакцинированного населения.
Появляется все больше данных [24–27] о том, что одна доза вакцины против ВПЧ обеспечивает хорошую защиту от персистирующей инфекции с эффективностью, аналогичной эффективности трех доз. Sankaranarayanan с соавт. [28] показали, что краткосрочная защита, формируемая при введении одной дозы четырехвалентной вакцины против ВПЧ, аналогична защите двух или трех доз, подчеркнув, что этот график дозирования заслуживает дальнейшего исследования [29]. Аналогичные результаты были получены в отношении двухвалентной вакцины [30].
Ежегодный охват ВПЧ одной дозой в Англии в период с 2008–2009 по 2011–2012 гг. составлял от 85,9 % до 90,6 % в обычных когортах (когорта 7) и от 55,6 % до 81,9 % в «наверстывающих» когортах [6, 7]. Впоследствии охват оставался высоким до тех пор, пока пандемия COVID-19 не повлияла на вакцинацию в 2019–2020 учебном году [31]. Кроме того, непривитые женщины в когортах, имеющих право на вакцинацию, вероятно, получат пассивную защиту (популяционный иммунитет) в рамках программы вакцинации. Эмпирические данные, свидетельствующие об иммунитете к ВПЧ 16 и 18 типов и перекрестной защите от ВПЧ 31, 33 и 45 типов, были получены в Шотландии после введения программы иммунизации против ВПЧ [9].
В настоящем исследовании вопрос о том, предлагалась бы женщинам вакцинация против ВПЧ или нет, зависит только от их когорты рождения, и этот фактор не связан с ненаблюдаемыми факторами, такими как образ жизни и поведение. По-прежнему существовала путаница по возрасту и периоду (и их взаимодействию), но, поскольку они наблюдались, с ними можно было справиться путем тщательного моделирования. Заболеваемость раком шейки матки быстро меняется с возрастом и зависит от рака, обнаруженного при скрининге, особенно при первом обследовании. Точный возраст первого и последующих скринингов со временем меняется. Даже небольшие изменения в цервикальном скрининге (или отчетности о гистологии шейки матки) или регистрации случая злокачественного процесса могут оказать существенное влияние на тенденции в зарегистрированной ЦИН3 у женщин в возрасте 20 лет.
Анализ опубликованных данных, основанный на заболеваемости в пятилетних возрастных группах и календарном году постановки диагноза, может привести к смешению вакцинированных и невакцинированных когорт в любой возрастной группе, что скроет эффекты вакцинации. Изменения в получении вакцины в зависимости от возраста и более высокая вероятность уже существующей инфекции во время вакцинации у женщин, у которых рак шейки матки развивается в относительно молодом возрасте, вероятно, изменят ожидаемое воздействие вакцинации, особенно в «наверстывающих» группах. Поэтому когорты были определены с учетом возраста, в котором женщинам была предложена вакцинация против ВПЧ, и различий в охвате вакцинацией.
Это определение позволило оценить эффект программы плановой вакцинации, предлагаемой девочкам в возрасте 12–13 лет (8 учебный год), отдельно от кампаний по наверстыванию упущенного, которые были нацелены на девочек в возрасте 14–16 лет и 16–18 лет, которые, возможно, уже подвергались ВПЧ-инфекции до вакцинации. Прежде чем оценивать влияние вакцинации, требовалось провести тщательное моделирование, чтобы точно определить различные когорты рождения и скорректировать изменения в цервикальном скрининге, а также возможные вековые тенденции в отношении рака шейки матки во всех возрастах.
В предыдущих исследованиях [19, 22] содержится подробная информация о влиянии измененной политики относительно возраста первого скрининга и конкретных событий (например, смерти Джейд Гуди) на заболеваемость раком шейки матки, поэтому в представленных регрессионных моделях авторы тщательно скорректировали это смешение. Когортный эффект, который, возможно, связан с внедрением вакцинации против ВПЧ, может отражать изменения в основной частоте инфекций, передаваемых половым путем, но национальные данные о хламидиозе, гонорее и генитальном герпесе у молодых женщин в период с 2010 по 2019 год не показали существенных тенденций к снижению [32]. Таким образом, результаты исследования дают объективную оценку влияния двухвалентной вакцины против ВПЧ на популяционном уровне (в разном возрасте и с разным уровнем охвата) на последующие показатели заболеваемости раком шейки матки.
Предварительные доказательства того, что вакцинация защищает от ВПЧ-ассоциированного рака, были представлены в финском исследовании, в котором анализировались данные пассивного наблюдения за двумя рандомизированными контрольными исследованиями эффективности вакцины с группой сравнения невакцинированных женщин [33]. Однако не все женщины получали одну и ту же вакцину (одни были вакцинированы Цервариксом, а другие — Гардасилом), и число случаев малигнизации было слишком мало, чтобы точно оценить эффективность.
Настоящее исследование имеет некоторые ограничения, ключевым из которых является то, что данные о статусе вакцинации на индивидуальном уровне были недоступны, поэтому авторы не могли оценить эффективность на индивидуальном уровне. Кроме того, у авторов отсутствует информация о типе ВПЧ при каждом из видов рака. Поскольку речь идет об обсервационном исследовании регулярно получаемых записей реестра рака, существует риск, что взаимосвязь между предложением вакцины против ВПЧ и последующей диагностикой рака шейки матки будет нарушена факторами, не учтенными в анализе. Однако, как упоминалось ранее, подробная информация об изменениях в политике цервикального скрининга и о происходящих событиях, которые повлияли на заболеваемость раком шейки матки, была доступна и позволила авторам тщательно скорректировать эти известные вмешивающиеся факторы.
Другим важным ограничением является относительно небольшое число лиц с онкологическими заболеваниями, ожидаемое (при отсутствии вакцинации) в вакцинированных когортах. Эта проблема наиболее остро стоит в группах вакцинированных в возрасте 12–13 лет, для которых ожидаемое число случаев рака было меньше 60. Кроме того, поскольку большая часть времени наблюдения за когортой 6 проводится в возрасте моложе 25,0 лет, большинство злокачественных новообразований (и практически все ЦИН3) будут выявлены при помощи скрининга, и поэтому небольшие различия в точном возрасте первого скрининга могут оказать большое влияние на количество зарегистрированных случаев в возрасте моложе 25,0 лет.
Скорректированный IRR для ЦИН3 в когорте 6 может быть ложно низким из-за снижения случаев проведения обследования женщин моложе 24,75 лет (даже трехмесячная задержка скрининга может оказать большое влияние на результаты для этой когорты). Авторы также отметили, что IRR в таблице 3 ниже для ЦИН3, чем для рака шейки матки (особенно для когорт 6 и 7). Это открытие является несколько неожиданным, поскольку доля ЦИН3, обусловленная ВПЧ 16/18, меньше, чем доля, приходящаяся на рак шейки матки, вызываемый этими типами ВПЧ. Данное наблюдение может быть артефактом и требует дальнейшего исследования (включая типирование ВПЧ при ЦИН3 у молодых женщин).
В настоящем исследовании снижение риска рака шейки матки, ожидаемое в «наверстывающих» когортах (когорты 5 и 6) при схеме, требующей трех доз и предполагающей отсутствие перекрестного и популяционного иммунитета (т. е. 36 % и 59 %), находится в пределах 95 % ДИ. Однако величина сокращения, о котором сообщалось, для лиц, которым была предложена вакцина в 8 учебном году (87 % для рака и 97 % для ЦИН3), была намного больше, чем можно было бы ожидать (68 %) при данной схеме, и тем более превзошла ожидания, если предположить, что одна доза обеспечивает 100 % защиту от ВПЧ 16 и 18 типов (71 %). Mesher с соавт. [4] обнаружили, что в Великобритании распространенность ВПЧ 16/18 была особенно высокой (92,9 % [95 % ДИ 85,6–97,0]) среди женщин с диагнозом рак шейки матки в возрасте до 30 лет.
Этот эффект мог бы, по крайней мере, частично объяснить масштабы сокращения числа тех, кому была предложена вакцинация в 8 учебном году. Тем не менее, полученные результаты (особенно для ЦИН3) также могут объясняться популяционным иммунитетом у невакцинированных женщин в вакцинированных когортах или перекрестным иммунитетом к ВПЧ-инфекции, исключая 16 и 18 типы, как показано для заболевания высокой степени злокачественности [9] и специфичной для типа ВПЧ-инфекции [12]. Независимо от обоснования, вышеперечисленные выводы должны в значительной степени успокоить тех, кто все еще сомневается в преимуществах вакцинации против ВПЧ. Авторы исследования показали, что вакцинация против ВПЧ с высоким охватом девочек в возрасте 12–13 лет практически ликвидировала рак шейки матки и предраковые заболевания в возрасте до 25 лет (согласно объему наблюдаемых данных). Девочек и женщин, претендующих на вакцинацию против ВПЧ, следует побуждать к получению вакцины в любом возрасте, но в идеале при первом предложении, чтобы гарантировать, что эта успешная программа продолжит приносить пользу молодым поколениям.