Избыточный синтез и выделение муцинов (белковых компонентов слизи, благодаря которым она имеет желеобразную консистенцию) играет важную роль в образовании слизи, что может вызывать обструкцию дыхательных путей при многих патологиях дыхательной системы [1]. Муцины синтезируются бокаловидными клетками (разновидность эпителиоцитов, выстилающих дыхательные пути) и мукоцитами желез подслизистой. Внутри клетки муцины упаковываются в специальные пузырьки, называемые секреторными гранулами. Соединения, стимулирующие секрецию муцина (иначе называемые секретагогами), например, АТФ, инициируют молекулярный каскад сигнальных реакций, приводящий к слиянию гранул и клеточной мембраны; данный процесс запускается ионами кальция [2]. В число белков, опосредующих это слияние, входят т. н. SNARE-белки (от англ. soluble NSF attachment receptor), расположенные по большей степени в клеточной мембране, и кальций-чувствительный белок синаптотагмин-2, находящийся на мембране гранул. В своей статье в Nature Лай с соавт. [3] сообщают, что генно-инженерный пептид нарушает взаимодействие комплекса SNARE-белков с синаптотагмином-2, вследствие чего блокируется секреция муцина в условиях in vitro и in vivo.
В основе патологического образования слизи при бронхиальной астме, хронической обструктивной болезни легких (ХОБЛ) и муковисцидозе лежат сложные механизмы. Среди них гиперпродукция и гиперсекреция слизи, ее дегидратация, образование поперечных сшивок муцина вследствие окислительного стресса, избыток биополимеров немуциновой природы (например, ДНК и актина) в слизи [4–6]. Лекарственные средства, одобренные в настоящее время для коррекции вышеупомянутых патологических процессов слизеобразования, направлены на восстановление процессов гидратирования слизи или на расщепление муцина и полимеров ДНК в слизи. Такие препараты разработаны для лечения муковисцидоза и, согласно результатам клинических испытаний, они улучшают состояние легочной ткани [7].
Тем не менее, в основе патологического образования слизи при муковисцидозе и других патологиях легочной ткани лежат разные механизмы, они служат объяснением различной реакции на применяемые препараты. К примеру, при муковисцидозе в слизи обнаруживается высокое содержание ДНК, а при других заболеваниях оно относительно низкое [8]. Таким образом, при муковисцидозе рекомендовано применение препаратов, расщепляющих ДНК. Аналогичным образом, в результате мутаций при муковисцидозе нарушается работа ионного канала, называемого трансмембранным регулятором муковисцидоза (CFTR — от англ. Cystic Fibrosis Transmembrane conductance Regulator), который регулирует гидратацию слизи путем контроля транспорта ионов натрия и хлора внутрь эпителиоцитов воздухоносных путей. По этой причине применение препаратов-модуляторов CFTR противопоказано у людей с данной патологией [9]. Таким образом, на данный момент существует крайне мало препаратов, воздействующих на слизистый компонент патогенеза заболеваний легких, отличающихся от муковисцидоза.
Одним из способов уменьшения чрезмерного объема слизи в легочной ткани является снижение ее продукции. Белок интерлейкин-13 (IL-13) играет ключевую роль в гиперпродукции муцина при бронхиальной астме, а белки, способные связываться с рецепторами семейства ErbB (в число этих белков входят, например, эпидермальный фактор роста, трансформирующий фактор-α и амфирегулин), влияют на гиперпродукцию муцина при ХОБЛ [10]. Следовательно, ингибирование этих белков представляет собой обоснованный метод влияния на патогенез гиперпродукции муцина. Возможно, что уже одобренные для применения при астме ингибиторы IL-13 могут уменьшать запасы муцина в эпителиоцитах воздухоносных путей, однако в клинических испытаниях данных препаратов не проводилась оценка того, сколько муцина эти эпителиоциты могут содержать [см. ссылку 11 оригинальной работы]. В ходе одного клинического испытания ингаляционной формы ингибитора эпидермального фактора роста не было выявлено статистически значимого уменьшения запасов муцина в эпителиоцитах воздухоносных путей пациентов с ХОБЛ [12].
Альтернативной стратегией уменьшения избыточного образования слизи
является нарушение слияния гранул муцина с клеточной мембраной, что
способствует блокированию его секреции (рис. 1). Секретагоги муцина
активируют клеточные рецепторы, что запускает внутриклеточную
кальций-опосредованную сигнализацию, инициирующую процесс слияния. Так
как кальций-зависимые белковые комплексы, запускающие слияние гранул с
мембраной и саму секрецию, уже хорошо изучены, разработка ингибиторов
этого процесса вполне возможна. Это являет собой метод лечения
гиперсекреции муцина с широким потенциальным применением (при астме,
ХОБЛ и других заболеваниях бронхолегочной системы). Здесь необходимо
помнить, что выделение муцина — это естественная реакция воздухоносных
путей, которая запускается в ответ на вдыхание множества патогенных
веществ и токсинов. На данный момент не существует препаратов, при
приеме которых в адекватных дозировках не блокировалась бы секреция
муцина (что предупреждало бы развитие патологий), и не тормозилось бы
протективное действие слизи. В этом направлении требуются дальнейшие
исследования.
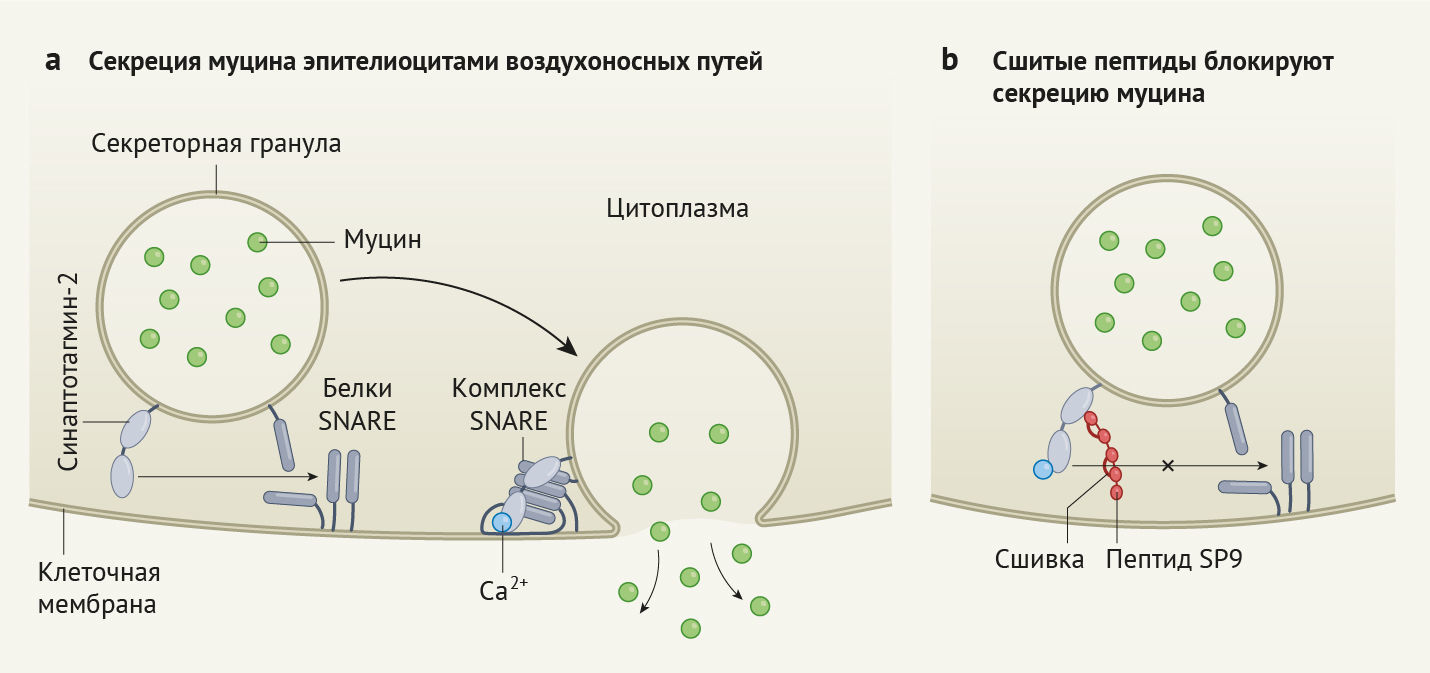
Рисунок 1 | Метод купирования угрожающе высокого количества слизи
При
многих заболеваниях легких слизь перекрывает воздухоносные пути, однако
существует крайне немного способов купирования данного состояния.
а
— Муцин, являясь ключевым компонентом слизи, проникает в воздухоносные
пути, в то время как секреторные гранулы (органеллы, содержащие муцин)
сливаются с мембранами эпителиоцитов воздухоносных путей. Это слияние
зависит от взаимодействия между белком синаптотагмином-2 (Syt-2),
связанного с ионами кальция, и белками SNARE, которые приобретают
конформацию, называемую комплексом SNARE. На рисунке для упрощения
изображены лишь несколько белков, задействованных в процессе слияния.
b — Лай с соавт. [3] сообщают об обнаружении способа блокирования секреции муцина в условиях in vitro и in vivo
(у мышей). Метод ученых основан на пептиде SP9 (пептид, содержащий
углеводородные сшивки, стабилизирующие его структуру). SP9 связывается с
Syt2, что предотвращает связывание последнего с белками SNARE,
ингибируя слияние секреторных гранул с клеточной мембраной и блокируя
секрецию муцина.
Лай с соавт. разработали пептид под названием SP9, блокирующий слияние гранул муцина с клеточной мембраной в эпителиоцитах воздухоносных путей. SP9 иначе называется сшитым пептидом: его субъединицы надежно скреплены синтетическими углеводородными связями, которые стабилизируют его структуру в определенной конформации [13]. Такие пептиды обладают лучшей аффинностью к фармакологическим мишеням и по сравнению с пептидами, лишенным таких сшивок, повышают проницаемость клеток. Также эти пептиды менее подвержены быстрому распаду, в особенности они лучше справляются с задачей нарушения белок-белковых взаимосвязей [14], таких как связь между синаптотагмином-2 секреторных гранул и белками комплекса SNARE в клеточной мембране.
При разработке SР9 авторы учли сведения о ключевых аминокислотных остатках в составе соединений-лигандов белков комплекса SNARE и синаптотагминов. Благодаря этому ученым удалось разработать пептид, игибирующий кальций-опосредованное слияние гранул с мембраной. В составе SP9 также находится пептидный хвост, пронизывающий мембрану клетки, который облегчает проникновение всего пептида внутрь клеток. Работа Лай с соавт. предоставляет убедительные свидетельства того, как спроектированный пептид SP9 попадает в эпителиоциты воздухоносных путей. Это блокирует секрецию муцина, стимулированную АТФ, в эпителиоцитах, обработанных IL-13, в условиях in vitro и in vivo (у мышей).
Требуют дальнейшего изучения аспекты возможности приема сшитых пептидов в аэрозольной форме в достаточных дозировках, а также их безопасности (в особенности в условиях постоянного приема при хронических состояниях) для получения одобрения для применения этих средств при заболеваниях легких, связанных с патологией слизи в воздухоносных путях. Тем не менее, подтвердив возможность блокировки кальций-опосредованной секреции муцина, Лай с соавт. демонстрируют потенциал такого метода как новой стратегии терапии при заболеваниях легких, связанных с патологией слизи в легочной ткани (например, при ХОБЛ и бронхиальной астме, в отношении которых существует еще много нерешенных вопросов лечения).