В недавней статье, опубликованной в журнале Cell, Хэ с соавт. сообщили, что витамин C (VitC) модифицирует остатки лизина в белках и пептидах, образуя витцил-лизин. Этот процесс они назвали витцилированием (vitcylation, от Vit C. Кстати, а как вы бы назвали? Аскорбирование? Аскорбление?). Авторы показывают, что витцилирование передатчика сигнала и активатора транскрипции-1 (STAT1) усиливает его фосфорилирование и, таким образом, способствует активации интерферонового пути в раковых клетках и усиливает противоопухолевый иммунитет [1].
Предупреждаем, что несмотря на некоторые данные в доклинических исследованиях, аскорбиновая кислота не является противоопухолевым средством.
Витамин C, также известный как L-аскорбиновая кислота, обладает плейотропным действием на дифференцировку клеток, передачу сигналов и регуляцию иммунных клеток. В физиологических условиях витамин C существует преимущественно в форме аскорбат-аниона, который может окисляться до дегидроаскорбиновой кислоты. Он является мощным антиоксидантом и ловушкой свободных радикалов, эффективно подавляет действие различных активные формы кислорода [1]. Однако в более высоких концентрациях витамин C также проявляет прооксидантную активность, что может вызывать окислительный стресс и гибель опухолевых клеток [2]. Вдобавок к уже перечисленным физиологическим функциям витамин C выступает и как кофактор множества ферментов, многие из которых участвуют в важнейших биохимических процессах. К основному классу этих ферментов относятся Fe2+-зависимые диоксигеназы, такие как коллаген-модифицирующие пролил-/лизилгидроксилазы, которые необходимы для правильной укладки коллагеновых волокон и, следовательно, для стабильного формирования внеклеточного матрикса [2]. Витамин С также участвует в регуляции активности факторов, индуцируемых гипоксией (HIF), посредством стимуляции гидроксилирования пролина [2]. Более того, витамин C является важным эпигенетическим модификатором, действующим на уровне ДНК и деметилирования гистонов. В этом отношении витамин C служит кофактором для т. н. TET-ферментов, которые «чистят» ДНК от метилированного цитозина. Кроме того, витамин C также необходим для оптимальной каталитической активности гистондеметилаз, что представляет собой еще один важный этап эпигенетической регуляции [2, 3]. В целом, описанные к настоящему времени механизмы действия витамина С охватывают широкий спектр эффектов, влияющих на различные клеточные системы в норме и при патологии (рис. 1а). В частности, витамин C играет важную роль в регуляции и дифференцировке иммунных клеток. Среди множества описанных эффектов витамина C следует выделить:
- усиление дифференцировки CD4+ Т-лимфоцитов из гемопоэтических клеток-предшественников;
- активацию регуляторных Т-клеток (Treg) посредством деметилирования специфичного для Treg транскрипционного фактора FOXP3;
- усиление эффекторной функции Т-клеток, включая γδ-Т-клетки [4].
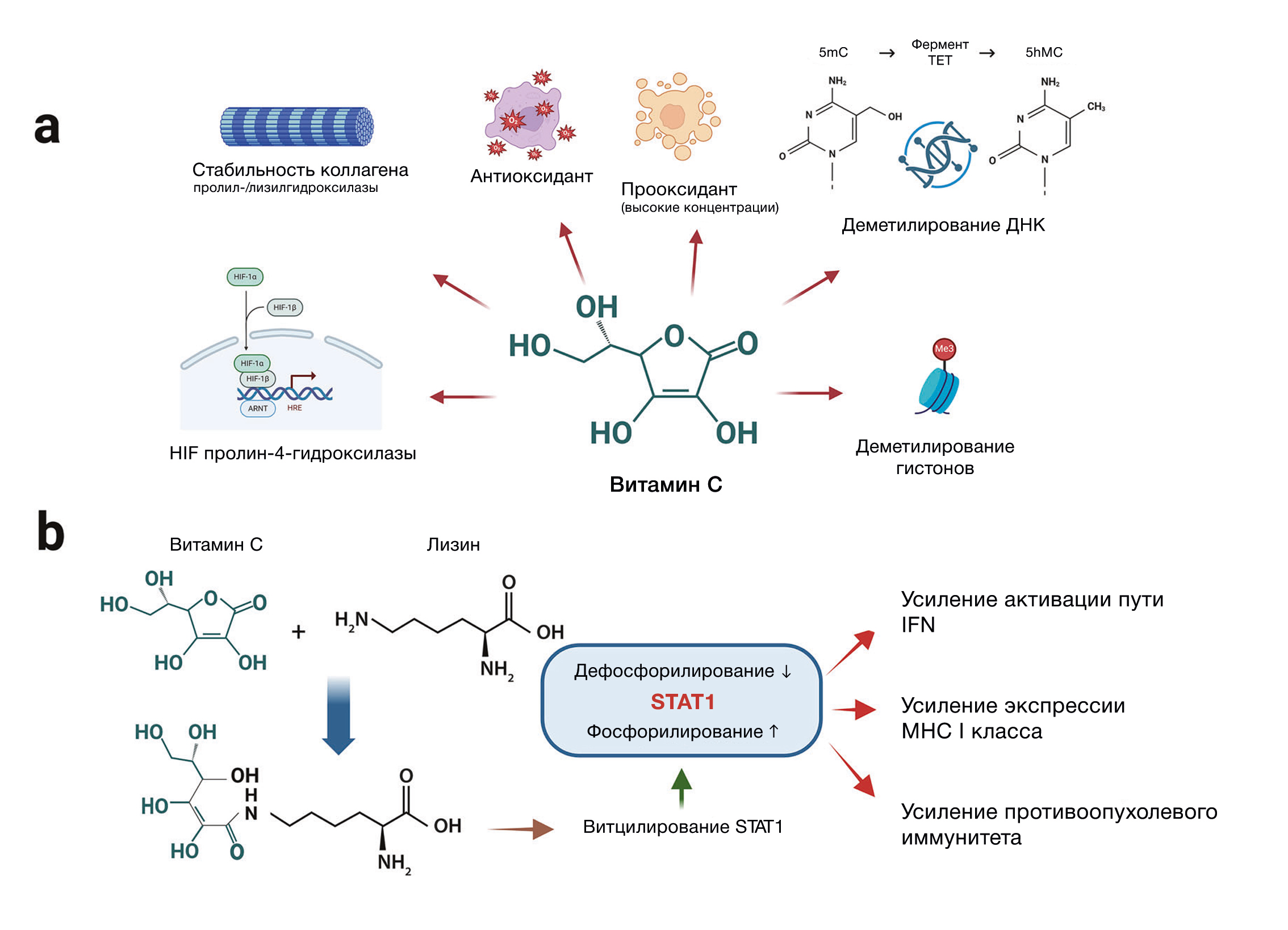
Рис. 1 | Молекулярные механизмы действия витамина Ca — Краткое изложение хорошо описанных эффектов витамина C. Витамин C действует как кофактор для множества цитоплазматических ферментов, включая диоксигеназы. Примерами являются пролил-/лизилгидроксилазы, которые необходимы для правильной укладки коллагеновых волокон, или пролин-4-гидроксилазы, участвующие в распаде факторов, индуцируемых гипоксией (HIF), тем самым регулируя HIF-зависимую экспрессию генов. Витамин C также является мощным антиоксидантом, устраняя различные активные формы кислорода (АФК), однако в более высоких концентрациях может оказывать и прооксидантное действие. Кроме того, витамин C — важный эпигенетический модификатор. Он действует как кофактор для диоксигеназ TET, которые осуществляют деметилирование ДНК, гидроксилируя 5-метилцитозин (5mC) в 5-гидроксиметилцитозин (5hmC). Другой уровень эпигенетической регуляции — это состояние метилирования гистонов, депонированных в хроматине. Витамин C является важным кофактором для гистондеметилаз JmjC.
b — Витцилирование — это открытая посттрансляционная модификация белков, опосредованная витамином C. Он модифицирует остатки лизина в пептидах и белках. Витцилирование передатчика сигнала и активатора транскрипции (STAT)-1 усиливает его фосфорилирование, предотвращая дефосфорилирование. В результате усиливается активация интерферонового (IFN) пути и повышается экспрессия MHC I класса в опухолевых клетках, что связано с усилением противоопухолевого иммунитета.
Хэ с соавт. выявили ещё один молекулярный механизм действия витамина С — посттрансляционную модификацию анионами аскорбата остатков лизина в пептидах и белках. Как отмечают авторы, витамин C содержит структуру лактона, которая также присутствует в других субстратах, используемых для посттрансляционной модификации остатков лизина в белках (например, гомоцистеин тиолактон и янтарный ангидрид). Чтобы проверить, действительно ли витамин C модифицирует остатки лизина в белках, авторы добавили анионы аскорбата к синтетическим пептидам, содержащим остатки лизина, и провели матрично-активированную лазерную десорбцию/ионизацию — времяпролетную масс-спектрометрию, которая выявила сдвиг масс пептидов в соответствии с индуцированной витамином C модификацией. Важно отметить, что они продемонстрировали, что витцилирование оказалось специфичным для лизина и прекращалось, когда лизин в пептидах заменяли другими аминокислотами, такими как цистеин, аргинин или аланин. В соответствии с зависимостью витцилирования от [аминокислотной] последовательности, авторы обнаружили, что не каждый лизин-содержащий пептид был модифицирован. Дальнейшие эксперименты с пептидами вне клеток показали, что витцилирование происходит в зависимости от концентрации витамина С (EC50 2 мМ) и pH (при допустимом диапазоне 7,0–9,5). Концентрации витамина С существенно различаются в разных тканях, но дозы витамина С, необходимые для модификации лизина белков, находятся в пределах физиологического диапазона внутриклеточных концентраций витамина С [4]. Следовательно, можно предположить, что витцилирование возможно как в интактных клетках, так и in vivo. В результате авторы обработали линии раковых клеток человека и мыши витамином С (2 мМ) и обнаружили выраженное витцилирование белков в клетках обоих видов со значительным совпадением [результатов].
Для дальнейшего изучения физиологического значения недавно идентифицированной модификации белка авторы провели анализ экспрессии раковых клеток мышей, обработанных витамином С. Наибольшие изменения экспрессии наблюдались в генах, связанных с реакцией на интерферон и воспалительным ответом. Ключевым фактором в иммунном ответе на интерферон является STAT1. Фактически, авторы обнаружили, что обработка витамином С линий раковых клеток человека и мыши индуцировала витцилирование специфического остатка лизина (K298) в STAT1, связанное с усилением фосфорилирования тирозина 701 и повышением активности STAT1. Анализ различных линий опухолевых клеток показал, что витцилирование является широко используемым механизмом фосфорилирования (и, следовательно, активации) STAT1, но не STAT2 или STAT3. С точки зрения механизма выяснилось, что витцилирование STAT1 ингибировало взаимодействие с фосфатазой TCPTP, тем самым предотвращая дефосфорилирование STAT1.
На следующем этапе авторы задались вопросом, имеет ли какое-либо биологическое значение усиленная активация STAT1, возникающая в результате витцилирования и длительного фосфорилирования. Поскольку STAT1 связывает путь интерферона с процессингом антигена, они сосредоточились на регуляции генов, вовлеченных в работу этого пути. Обработка линий раковых клеток витамином C привела к повышению экспрессии различных генов этого пути, а также к повышению экспрессии МНС (главного комплекса гистосовместимости) I класса на поверхности клеток. Авторы исключили другие механизмы участия витамина C в этом процессе, в частности антиоксидантную/прооксидантную активность и активацию фермента TET. Они утверждают, что активация STAT1 посредством витцилирования является основным механизмом. Затем они продемонстрировали, что обработанные витамином C опухолевые клетки, экспрессирующие овальбумин (OVA), вызывали более сильный ответ трансгенных CD8 T-клеток OVA-TCR, чем необработанные антигенпрезентирующие клетки. Серия изящных экспериментов показала, что усиленная презентация антигена была обусловлена витцилированием STAT1, а не другими эффектами витамина C. Таким образом, эффекты, вызванные витамином C, были устранены в клетках с мутацией STAT1-K298R, но не в клетках с дефицитом TET2 или HIF-1α. Наконец, авторы подтвердили свои результаты in vitro на иммунокомпетентных мышах с трансплантированными сингенными опухолевыми клетками в отсутствие или в присутствии витамина C. Рост опухоли подавлялся при лечении витамином C, и этот эффект можно было снова связать с витцилированием STAT1 в опухолевых клетках, используя те же стратегии, что и в экспериментах in vitro. Результаты исследования представлены на рис. 1b.
В этом исследовании было обнаружено, что модификация лизина витамином C — это новая посттрансляционная модификация белка с потенциально далеко идущими последствиями для молекулярной клеточной биологии и иммунологии опухолей. Однако необходимы дополнительные исследования, чтобы полностью оценить значение витцилирования по отношению к другим хорошо описанным эффектам витамина С, таким как роль в качестве кофактора ферментативных реакций, его антиоксидантная и прооксидантная активность. Хотя авторы отметили частичную зависимость последовательности лизин-специфической модификации белка, спектр белков, затронутых этой посттрансляционной модификацией, требует более детального изучения. STAT1 был идентифицирован как важная мишень для витцилирования, имеющая последствия для активации пути интерферона и противоопухолевого иммунитета. Известно, что высокие дозы витамина С усиливают иммунотерапию рака, однако основные механизмы до сих пор четко не выявлены [5]. Исследование Хэ и соавт. предполагает, что витцилирование белков может играть роль в этом процессе [1]. В будущих исследованиях важно проанализировать потенциальные механизмы иммуностимулирующего действия витамина C на уровне посттрансляционной модификации и эпигенетической регуляции. Как показали авторы, сочетание витамина C с другими терапевтическими подходами, такими как применение ингибиторов контрольных точек, может дополнительно усилить противоопухолевый иммунный ответ.