Распространенность диабета, связанного с COVID-19, является результатом действия не одного фактора, а сочетания склонности к развитию заболевания и специфических для COVID-19 механизмов, влияющих на метаболизм. Пока не ясно, существует ли особая форма «постковидного» диабета (связанная, как предполагают, с длительным повреждением β-клеток).
В своей статье автор основывается на личном опыте лечения пациентов с COVID-19 в пресвитерианской больнице при Колумбийском университете (Нью-Йорк). Автор работал там с марта 2020 года, когда в Нью-Йорке разразилась пандемия. Первая волна достигла пика в середине апреля, когда, согласно внутрибольничной переписи, с диагнозом COVID-19 находилось 772 пациента, из которых около 280 человек нуждались в инвазивной искусственной вентиляции легких или экстракорпоральной мембранной оксигенации. С первых дней пандемии пациенты с диабетом составляли значительную долю среди госпитализированных, а уже среди них подавляющую часть составляли лица в кетоацидотическом состоянии. Итоги и эмпирические наблюдения совместной работы автора с его коллегами на медицинском факультете университетской клиники Колумбийского университета и Пресвитерианской больницы Нью-Йорка представлены в другой работе [1].
Что известно на данный момент
Недавние мета-анализы подтвердили высказывавшиеся ранее предположения о том, что сахарный диабет является фактором риска для развития коронавирусной инфекции [2], госпитализации в отделение интенсивной терапии и случаев, когда оказание неотложной помощи является жизненно необходимым [3, 4]. Также диабет является фактором риска для таких жизнеугрожающих состояний, когда требуется проведение интубации трахеи и искусственной вентиляции легких [5], заместительной почечной терапии [6]; повреждения миокарда [7], тромбоэмболических осложнений [8] и летального исхода [9]. Личный опыт работы автора служит наглядной демонстрацией такой статистики: у большинства пациентов, поступавших в состоянии гипергликемии и кетоацидоза, выявлялся плохо контролируемый сахарный диабет (гликозилированный гемоглобин HbA1c ≥ 10 %/ 13,3 ммоль). Хотя преобладающим был диабет второго типа, автор сталкивался и со случаями диабета первого типа, однако все они характеризовались контролируемым течением. По показателю гликозилированного гемоглобина удавалось диагностировать впервые выявленный сахарный диабет, что было очень распространенной ситуацией. Исключить факт существования сахарного диабета ранее, особенно в условиях госпитализации в связи с тяжелой формой COVID-19, оказалось сложной задачей. У пациентов мог быть близкий к нормальному уровень HbA1c в результате изменения образа жизни, или же HbA1c находился на грани нормы и патологии, а пороговое значение оказалось достигнутым вследствие тяжелого течения самой коронавирусной инфекции. Тем не менее, у пациентов без четких признаков диабета может выявиться гипергликемия на фоне стресса, и в такой ситуации длительная противодиабетическая терапия не является целесообразной. Только долгосрочное наблюдение позволяет достоверно обнаружить, способствует ли COVID-19 дебюту диабета по сравнению с другими провоцирующими факторами. К примеру, часто внебольничная пневмония сопровождается гипергликемией у пациентов без диабета, однако в случае пожилых людей это может быть его предвестником. Таким образом, гипергликемия сама по себе не уникальна для COVID-19 (рис. 1).
Что остается невыясненным
Был поднят вопрос о том, может ли SARS-CoV-2 (вирус, являющийся
причиной COVID-19) среди прочего вызывать диабет. Но выявление четкой
причинно-следственной связи, выходящей за рамки случайного совпадения,
остается сложной задачей. По-видимому, в основе патогенеза гипергликемии
при COVID-19 лежит несколько причин; в первую очередь, нарушение
утилизации глюкозы, а также снижение секреции инсулина (рис. 1). Любое
воспалительное состояние может вызвать инсулинорезистентность и усилить
выработку глюкозы в печени за счет повышения уровня контринсулярных
гормонов, выброса цитокинов и липидов и прямого повреждения гепатоцитов.
Кроме того, воспаление может нарушать поглощение глюкозы
периферическими тканями из-за гиподинамии, истощения мышечной ткани,
цитокинов и нарушений водно-электролитного баланса, что изменяет
проницаемость мембран. Ожирение — еще один важный фактор риска для
упомянутых выше сопутствующих заболеваний [10], а местное воспаление
жировой ткани может служить потенциальным объединяющим фактором «триады»
(нарушение метаболизма глюкозы, воспаление и нарушение иммунного
ответа) (рис. 1).
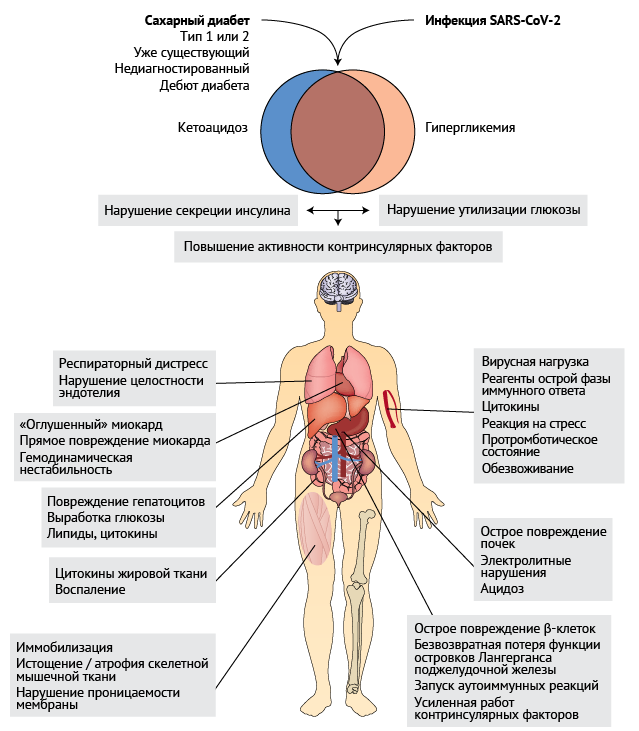
Рисунок 1 | Механизмы COVID-ассоциированной гипергликемии и кетоацидоза Существование гипергликемии и кетоацидоза у пациентов с COVID-19 подняло вопрос, не лежит ли в основе этого сахарный диабет вне зависимости от того, присутствовал ли он у человека ранее. Кетоацидоз может возникнуть независимо от гипергликемии даже у пациентов, которые не лечились ранее ингибиторами натрий-глюкозного котранспортера Sglt2. Механизмы данных метаболических нарушений включают: нарушение утилизации глюкозы, снижение секреции инсулина или усиление контринсулярных реакций. На рисунке рядом с каждым органом-мишенью показаны патофизиологические особенности при сочетании сахарного диабета, любого острого интеркуррентного заболевания и факторов, специфичных для COVID-19. В зависимости от клинического течения эти аномалии могут развиваться не все сразу, а постепенно.
Кетоацидоз и COVID-19
Высокая распространенность кетоацидоза среди пациентов с COVID-19 и диабетом [11] необычна и поднимает вопрос о способности вируса воздействовать на β-клетки поджелудочной железы. Необходимо различать пациентов с гипергликемическим и эугликемическим кетоацидозом. Также необходимо помнить, что почти не существует прецедентов вирусных инфекций, которые приводили бы к значительному клиническому повреждению β-клеток при отсутствии предрасполагающего аутоиммуннитета, и что причиной кетоацидоза является не только низкое содержание инсулина, но и изменение соотношения глюкагон/инсулин. Таким образом, предположение о том, что COVID-19 приводит к кетоацидозу, который развивается вследствие прямого повреждения β-клеток, требует тщательного изучения. Автор полагает, что причина, вероятнее всего, окажется многокомпонентной, и внепанкреатические факторы, вероятно, играют большую роль, чем внутрипанкреатические. Среди последних — нарушение секреции инсулина у пациентов с неконтролируемой гипергликемией обусловлено «оглушением» β-клеток [12]. Цитокиновый шторм, связанный с COVID-19, склонность к тромбозам (потенциально затрагивает микрососудистое русло и непосредственно β-клетки) также могут стать причиной повреждения β-клеток. Гипотеза о том, что COVID-19 вскрывает тип диабета, характеризующегося склонностью к кетозу, привлекательна, однако объясняет вышеописанное патологическое состояние лишь частично, потому что неизвестно, что именно способствует развитию кетоза у этих пациентов.
Однако многие пациенты с COVID-19 поступают в катаболическом, кетоацидотическом состоянии, усугубляемом сниженной способностью компенсации метаболического ацидоза посредством почечных и легочных механизмов вследствие:
- сопутствующей острой почечной недостаточности со сниженной реабсорбцией анионов HCO3–;
- нарушения легочного газообмена, который должен предотвращать компенсаторный респираторный алкалоз.
Кроме того, лихорадка и снижение поступления жидкости в организм (нарушение пищевого режима) истощает пациента, что усугубляет электролитные нарушения. Активация таких механизмов (патологически действующих в данной ситуации), как контринсулярная система, по всей видимости, приводит к дальнейшему подавлению функции β-клеток. Эти факторы могут служить объяснением эугликемического кетоацидоза, а также напоминанием о том, что экстрапанкреатические факторы не менее важны, чем потенциальное прямое воздействие на β-клетки, по степени воздействия на метаболизм и запуск гипергликемического кетоацидоза.
Β-клетки поджелудочной железы и SARS-CoV-2
Может ли SARS-CoV-2 непосредственно повредить β-клетки? Точного ответа нет. Результаты исследований РНК, доступные в начале пандемии, свидетельствовали о том, что рецептор АПФ2, используемый вирусом SARS-CoV-2 для проникновения в клетку, отсутствует в β-клетках, тогда как рецептор TMPRSS (мембранно-связанная сериновая протеаза 2) и недавно открытый рецептор NRP1 (нейропилин 1) присутствуют, хотя и в незначительном количестве [13]. Некоторые результаты иммуногистохимических исследований панкреатических островков согласуются с этими выводами [14, 15], тогда как согласно иным данным, рецепторы вируса SARS-CoV-2 находятся и в β-клетках [16]. Может ли экспрессия этих рецепторов запускаться в β-клетках вследствие коронавирусной инфекции? Такая индукция возможна, однако продемонстрировать ее в эксперименте очень трудно. По опыту автора и его коллег, отсутствует явная связь между диабетическим кетоацидозом и показателями воспаления, такими как количество лейкоцитов и тромбоцитов, С-реактивный белок, D-димер и ферритин. Однако для того, чтобы вирус сам по себе приводил к значительному снижению функционала β-клеток, и таким образом нарушилась секреция инсулина, количество проникших вирусных частиц в клетку должно быть значительным. Кроме того, если бы вирус приводил к необратимому нарушению функции β-клеток, развивающийся диабетический кетоацидоз после коронавирусной инфекции требовал бы инсулинотерапии, чего не наблюдается в практике. Действительно, в большинстве случаев кетоацидоз в острой фазе заболевания бывает легкой или средней степени тяжести. Трудности, возникающие при лечении кетоацидоза при COVID-19 экстрапанреатического характера: при инфузионной терапии часто приходится соблюдать очень тонкий баланс между поддержанием адекватной перфузии органов и предотвращением накопления жидкости в легких вследствие респираторного дистресс-синдрома, «оглушенного» миокарда или развившегося повреждения миокарда и протромботического состояния. Повреждение почечных канальцев также приводит к длительным и необычным нарушениям электролитного баланса, которые купируются с трудом. Помимо этого, в связи с широко распространенным использованием глюкокортикостероидов при лечении COVID-19 восстановление функции β-клеток может замедляться.
По мнению автора, вопрос о том, поражает ли вирус β-клетки, слишком ограничен в плане клинического приложения. Независимо от уровней экспрессии рецепторов к SARS-CoV-2, существует крайне мало свидетельств того, что вирусные инфекции напрямую вызывают необратимое повреждение β-клеток [17]. Стресс-индуцированная гипергликемия, вызванная инфекцией, обычно носит временный характер. Предполагается, что только у пациентов, предрасположенных к развитию диабета первого типа, вирусная инфекция с интеркуррентным течением способна окончательно нарушить функцию β-клеток. Соответственно, если COVID-19 действительно являлся бы причиной стойкого инсулинозависимого диабета, вирус SARS-CoV-2 был бы уникальным. Сведения о SARS1 в этом отношении неубедительны [18]. Однако, если бы COVID-19 вызвал потерю β-клеток у пациентов с предрасполагающим к этому аутоиммунным фоном, в связи с пандемией наблюдалась бы повышенная заболеваемость сахарным диабетом первого типа. Ограниченный объем сведений по этому вопросу не подтверждает такой сценарий развития [19]. Однако, возможно, число случаев диабета первого типа учтено не полностью, потому что пациенты избегают лечения в крупных медицинских центрах (в том числе, в университетских клиниках), и с большей вероятностью обратятся за медицинской помощью в амбулаторное звено. Согласно недавним сведениям о генетической аутоиммунной предрасположенности к развитию дыхательной недостаточности у пациентов с COVID-19 [20], предложен план исследований, нацеленных на выявление аутоиммунных звеньев патогенеза кетоацидоза при сахарном диабете первого типа, связанного с COVID-19. Однако остается неясным, будет ли достаточно пациентов для проведения такого исследования.
Каковы дальнейшие шаги?
Существует несколько причин, по которым люди с диабетом более восприимчивы к COVID-19. Помимо этого, поскольку сахарный диабет является мультифакторным заболеванием, механизмы, действующие у отдельных пациентов, также могут быть неоднородными. Нельзя сбрасывать со счетов вероятность того, что SARS-CoV-2 может вызвать диабет, но и не нужно приписывать данное патологическое состояние безосновательно, особенно при отсутствии непосредственно указывающих на него фактов. Необходимо с осторожностью истолковывать результаты исследований, в которых проводилась оценка восприимчивости β-клеток к инфекции SARS-CoV-2 in vitrо. Возможность стимуляции развития инфекции в условиях пробирки не служит доказательством того, что инфекция может развиться in vivo.
Хороший контроль гликемии — лучший способ уберечь людей с диабетом от палаты интенсивной терапии при COVID-19. Необходимо продолжать отслеживать возможность того, что развитие вторичного сахарного диабета является отдельным клиническим проявлением в рамках «длительно протекающего COVID-19», а люди с сахарным диабетом должны быть вакцинированы одними из первых. Рациональная инсулинотерапия остается единственным эффективным и безопасным способом лечения диабетического кетоацидоза при COVID-19, а у пациентов должен осуществляться постоянный дистанционный контроль гликемии как в палатах интенсивной терапии, так и в постреанимационных палатах для контроля воздействия вируса на пациентов, являющихся носителями.





