АКТУАЛЬНОСТЬ ПРОБЛЕМЫ Заболеваниями желчного пузыря в США страдают около 20 млн. человек. Ежегодно острый холецистит в США диагностируют примерно у 200 000 человек.
НАБЛЮДЕНИЯ Острый холецистит в 90-95% случаев вызван обструкцией пузырного желчного протока при желчнокаменной болезни. Примерно у 5-10% пациентов с острым холециститом наблюдается бескаменный (некалькулезный) холецистит, который определяют как острое воспаление желчного пузыря без образования камней, чаще всего на фоне тяжелого критического состояния. К типичным проявлениям острого холецистита относят острую боль в правом подреберье, лихорадку, тошноту, которая может быть связана с приемом пищи; а при обследовании выявляют болезненные ощущения в правом подреберье. Ультразвуковое исследование области правого подреберья в диагностике острого холецистита обладает чувствительностью около 81% и специфичностью около 83%. Если результат УЗИ не позволяет поставить окончательный диагноз, золотым стандартом диагностики выступает гепатобилиарная сцинтиграфия (внутривенное введение радиоактивного вещества, выделяемого с желчью). Раннее проведение лапароскопической холецистэктомии (в течение 1-3 дней после постановки диагноза), по сравнению с поздней холецистэктомией (после 3 дней), связано с лучшими результатами лечения, в т.ч. вызывает меньше послеоперационных осложнений (11,8% при ранней операции против 34,4% при поздней), связано с меньшей продолжительностью пребывания в стационаре (5,4 дня по сравнению с 10,0 днями) и меньшими расходами на лечение. Ранняя лапароскопическая холецистэктомия у беременных связана с меньшим риском осложнений у матери и плода по сравнению с отсроченной операцией (1,6% при ранней операции и 18,4% при отсроченной) и рекомендуется на любом триместре беременности. У пациентов старше 65 лет проведение лапароскопической холецистэктомии связано с более низким уровнем смертности при 2-летнем наблюдении (15,2%), по сравнению с консервативным лечением (29,3%). Для пациентов с исключительно высоким периоперационным риском эффективным методом лечения является чрескожная холецистостомия, при которой в просвет желчного пузыря под визуальным контролем устанавливают дренажный катетер. Однако в рандомизированном исследовании чрескожная холецистостомия была связана с более высокой частотой послеоперационных осложнений (65%), чем лапароскопическая холецистэктомия (12%). В случае некалькулезного острого холецистита чрескожная холецистостомия должна выполняться только у пациентов в тяжелом состоянии на момент постановки диагноза; всем остальным следует проводить лапароскопическую холецистэктомию.
ВЫВОДЫ И ЗНАЧИМОСТЬ Острый холецистит, как правило обусловленный обструкцией желчным камнем пузырного желчного протока, ежегодно поражает около 200 000 человек в США. Для большинства пациентов терапией первой линии при остром холецистите является лапароскопическая холецистэктомия в течение 3 дней после постановки диагноза.
Острый холецистит — это острое воспалительное заболевание желчного пузыря, которое примерно в 90-95% случаев возникает из-за обструкции пузырного желчного протока желчными камнями [1]. Реже, примерно у 5-10% пациентов с диагнозом «острый холецистит», встречается некалькулезный (бескаменный) холецистит, при котором острое воспаление желчного пузыря развивается без образования камней.
В США заболеваниями желчного пузыря страдают около 20 млн. человек, а непосредственные ежегодные затраты на их лечение оценивают более чем в 6,3 млрд. долларов; при этом ежегодно более чем у 200 000 человек диагностируют именно острый холецистит [2-4]. От 10% до 15% всего взрослого населения США страдает желчнокаменной болезнью, при этом примерно у 80% заболевание протекает бессимптомно [5]. У 20% пациентов с желчнокаменной болезнью в конечном итоге развиваются осложнения, частота которых составляет от 1% до 4% ежегодно. При этом острый калькулезный холецистит оказывается первым клиническим проявлением у 10-15% пациентов с желчными камнями [6].
Некалькулезный острый холецистит, который определяют как острое воспалительное заболевание желчного пузыря при отсутствии желчнокаменной болезни, напротив, имеет многофакторную этиологию. К факторам риска некалькулезного острого холецистита относят критические состояния, диабет, ВИЧ-инфекцию, атеросклероз и полное парентеральное питание [7,8]. Некалькулезный острый холецистит встречается примерно у 5-10% пациентов с острым холециститом. Некалькулезный острый холецистит встречается примерно у 0,2-0,4% всех пациентов в критическом состоянии, обычно у пациентов в возрасте 50 лет и старше, и, по крайней мере, в 3 раза чаще у мужчин, чем у женщин [9-11].
Методы
Поиск англоязычных работ по острому холециститу, включая исследования его факторов риска, патогенеза, диагностики и лечения, проводился в базах данных PubMed и Cochrane. Были отобраны работы, опубликованные в период с 1 января 2000 года по 31 декабря 2021 года. Основополагающие исследования, опубликованные до 2000 г., включались, если были важны для обзора, а более свежие данные при этом отсутствовали.
Всего было обнаружено 4802 исследования. Авторы обзора отдавали приоритет рандомизированным клиническим исследованиям, мета-анализам, систематическим обзорам, национальным или международным руководствам, популяционным и наблюдательным исследованиям. Всего было рассмотрено 102 работы, в том числе 4 рандомизированных клинических исследования, 6 мета-анализов, 5 систематических обзоров, 7 национальных или международных руководств, 30 популяционных исследований и 50 наблюдательных (перекрестных) исследований.
Факторы риска
Желчнокаменная болезнь – самый частый фактор риска развития острого холецистита. Наибольшая распространенность желчнокаменной болезни отмечается среди испаноязычных жителей Центральной и Южной Америки, а также американцев индейского происхождения [2,12]. Глобальная распространенность желчнокаменной болезни с поправкой на возраст и пол составляет примерно 35% среди индейцев мапуче и 27% среди испаноязычных лиц [13]. Распространенность желчнокаменной болезни среди жителей стран Африки к югу от Сахары, напротив, составляет примерно 5%, а в Азии – от 3,2 до 15,6% [14,15].
В США распространенность заболеваний желчного пузыря по возрастам оценивалась на основе выборки из более чем 14 000 человек в возрасте от 20 до 74 лет, у которых с помощью УЗИ или после холецистэктомии в желчном пузыре были обнаружены камни. Распространенность заболеваний желчного пузыря составила 8,6% среди неиспаноязычных белых мужчин и 16,6% среди неиспаноязычных белых женщин, 8,9% среди американских мужчин мексиканского происхождения и 26,7% среди американских женщин мексиканского происхождения, а также 5,3% среди неиспаноязычных чернокожих мужчин и 13,9% среди неиспаноязычных чернокожих женщин [2]. Различия в расовой и этнической распространенности желчнокаменной болезни не объясняются такими факторами риска, как ожирение, потеря веса, беременность, употребление менее 1 или 2 порций алкогольных напитков в день (7–14 г/день) [16].
Также не доказано, что какие-либо генетические маркеры объясняют различия в риске желчнокаменной болезни между расовыми и этническими группами. Более значительную долю риска желчнокаменной болезни можно объяснить другими факторами, такими как диета с высоким содержанием жиров или низким содержанием клетчатки [17]. Хотя у женщин камни в желчном пузыре встречаются в 2-3 раза чаще, эта разница, как правило, уменьшается с возрастом, одновременно риск развития желчнокаменной болезни с возрастом увеличивается [6]. Патофизиологическая основа высокой распространенности желчнокаменной болезни у пожилых людей остаётся невыясненной.
Частой причиной образования желчных камней, особенно у детей, являются наследственные гемолитические анемии, особенно талассемия и серповидно-клеточная анемия [18]. Бразильское университетское исследование с участием 107 пациентов, в ходе которого оценивалась частота встречаемости желчнокаменной болезни у пациентов с серповидноклеточной анемией, показало, что ее распространенность составляет 4,4% у пациентов младше 10 лет, 35,4% у пациентов в возрасте от 11 до 29 лет и 18,2% у пациентов в возрасте 30 лет и старше [19].
Беременность способствует образованию желчных камней и билиарного сладжа. Сладж – это взвесь слизи, холестерина и солей кальция, которая образуется в желчном пузыре у 5,1% беременных во втором триместре, у 7,9% в третьем триместре и у 10,2% в период от 4 до 6 недель после родов [20, 21].
Ожирение также является фактором риска желчнокаменной болезни. В проведенном в США исследовании среди 13 962 участников третьего Национального исследования здоровья и питания (National Health and Nutrition Examination Survey) обнаружено, что женщины, у которых были камни в желчном пузыре, имели более высокий средний индекс массы тела по сравнению с женщинами без камней в желчном пузыре (29,7 кг/м2 против 25,9 кг/м2, соответственно), тогда как у мужчин с камнями в желчном пузыре средний ИМТ составлял 28,3 кг/м2 по сравнению с 26,5 кг/м2 у мужчин без камней в желчном пузыре [22]. Значительное снижение массы тела, особенно после бариатрических операций, также связано с образованием камней в желчном пузыре [23]. Ретроспективный анализ 586 пациентов (75,7% женщин) показал, что 91,3% пациентов, у которых после бариатрической операции появились симптомы желчнокаменной болезни и камни в желчном пузыре, потеряли более 25% от прежней массы тела [24].
Прием некоторых лекарственных препаратов также связан с повышенной частотой образования камней в желчном пузыре; так, длительное применение (>1 месяца) октреотида приводит к формированию камней в 5-66% случаев, а прием 10 доз цефтриаксона — в 8,8% случаев [25,26]. Также острый калькулезный холецистит чаще встречается у пациентов с диабетом [27]. Показатель заболеваемости холециститом на 10 000 человеко-лет у пациентов с сахарным диабетом 2 типа составил 51,6 против 35,5 у индивидов без диабета 2 типа [28]. В популяционном исследовании с участием 71 369 человек применение аналогов глюкагоноподобного пептида для лечения диабета 2 типа (эксенатид или лираглутид) было связано с повышенным риском заболеваний желчных протоков и желчного пузыря по сравнению с одновременным применением как минимум двух пероральных противодиабетических препаратов (6,1 против 3,3 на 1000 человеко-лет соответственно) [29].
В исследованиях отдельных групп пациентов в развитии некалькулезного острого холецистита факторами риска выступали критические состояния (0,2%-0,4%), тяжелые травмы (10%), ожоги (0,4%-3,5%), операции на сердце с искусственным кровообращением (0,08%) и полное парентеральное питание (16%). У пациентов, перенесших трансплантацию костного мозга, частота развития некалькулезного острого холецистита достигала 4% [30-34].
Патогенез
Острый холецистит, вызванный камнями в желчном пузыре, возникает после обструкции пузырного желчного протока желчными камнями, билиарным сладжем или литогенной желчью [35]. Степень и длительность обструкции пузырного протока определяют скорость прогрессирования острого холецистита и тяжесть воспаления желчного пузыря. Обструкция пузырного протока повышает внутрипросветное давление в желчном пузыре и вместе с перенасыщенной холестерином желчью инициирует острую воспалительную реакцию. Примерно у 20% пациентов с острым холециститом возникают вторичные бактериальные инфекции кишечными микроорганизмами (чаще всего Escherichia coli, Klebsiella и Streptococcus faecalis) [36].
Прогрессирование острого холецистита после обструкции пузырного желчного протока включает 3 различные фазы. Первая фаза характеризуется воспалением и проявляется отеком стенки желчного пузыря (через 2-4 дня после появления симптомов). Вторая фаза характеризуется кровоизлиянием и некрозом стенки желчного пузыря, что может привести к перфорации желчного пузыря в месте ишемической гангрены и последующему желчному перитониту (через 3-5 дней после появления симптомов). Третья фаза – хроническая или гнойная – характеризуется лейкоцитарной инфильтрацией, некрозом и нагноением тканей и обширной инфекцией (на 6-й день после появления симптомов или позже) (Рисунок).
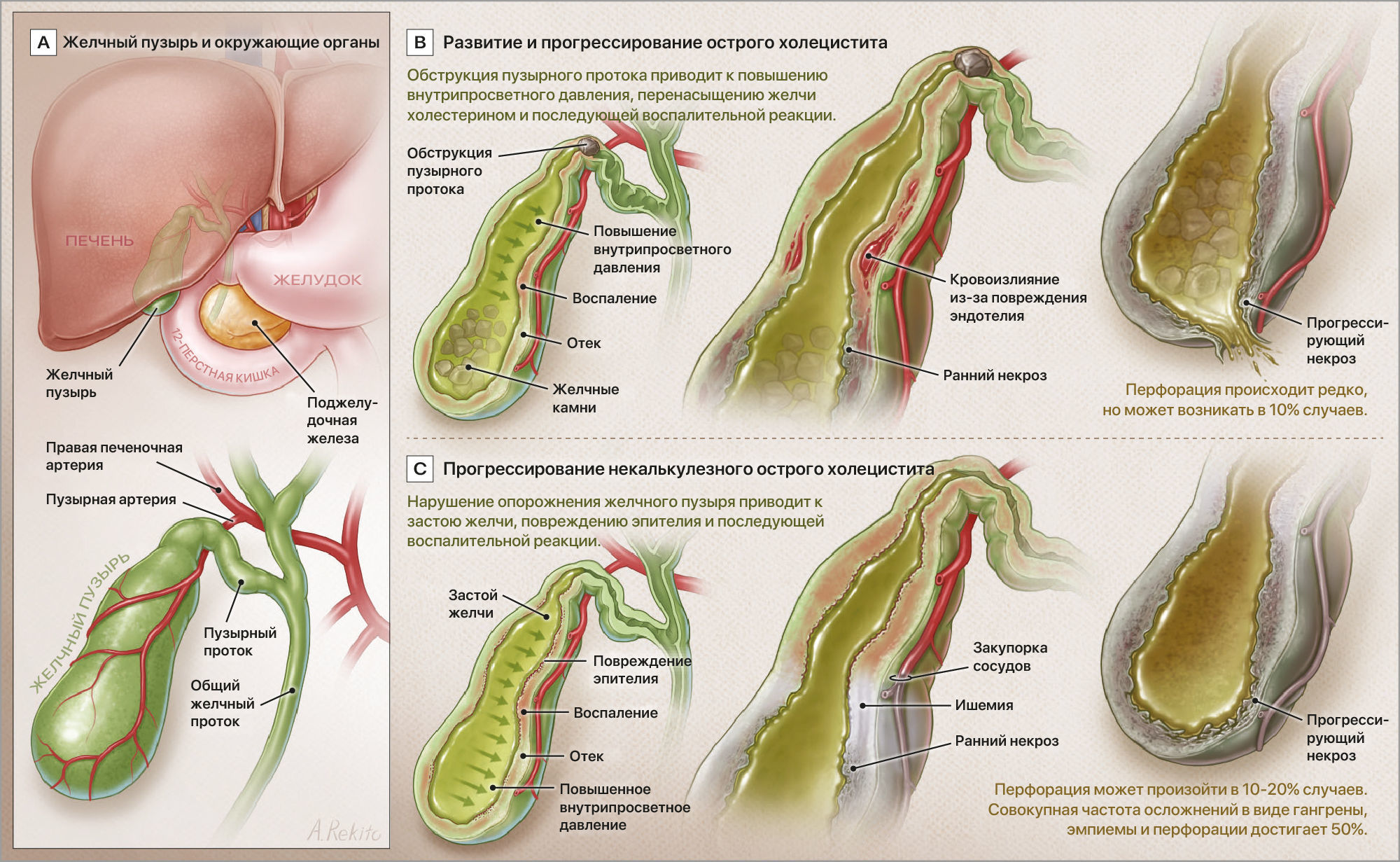
Рисунок. Развитие острого холецистита
После острой фазы внутрипросветное нагноение замещается грануляционной тканью и переходит в подострый холецистит, а затем в хронический холецистит [37]. Некалькулезный острый холецистит, напротив, имеет многофакторный патогенез и, вероятно, обусловлен застоем желчи или ишемией стенки желчного пузыря. Застой желчи может быть вызван голоданием или кишечной непроходимостью, что приводит к сгущению желчи, токсичному для эпителия желчного пузыря [38]. Из-за повреждения эндотелия возникает окклюзия микрососудов желчного пузыря, что приводит к его ишемии на фоне гипоперфузии, которая может возникнуть у пациентов в критическом состоянии [1]. Некалькулезный острый холецистит может также прогрессировать до гангрены, эмпиемы и перфорации желчного пузыря в случае до 50% пациентов [10].
Диагностика
Острый холецистит следует подозревать у пациентов с постоянной болью в правом подреберье, как связанной, так и не связанной с приемом пищи. Типичными симптомами являются лихорадка, тошнота и рвота. В систематическом обзоре 2017 г., включающем 3 наблюдательных исследования, диагностическая чувствительность симптомов лихорадки при холецистите составила от 31 до 62% [39]. При осмотре у 95,7% пациентов отмечалась болезненность в правом подреберье, связанная с локализованным перитонитом [40]. Симптом Мерфи (прерывание вдоха из-за боли при пальпации правого подреберья) патогномоничен для острого холецистита. Симптом Мерфи в отношении острого холецистита обладает чувствительностью в 62% и специфичностью в 96% [39]. У пациентов обычно наблюдается лейкоцитоз со сдвигом влево и незрелыми формами нейтрофилов.
При тяжелом остром холецистите может наблюдаться легкая желтуха (концентрация билирубина в сыворотке крови <3 мг/дл [для перевода в мкмоль/л нужно умножить на 17,104]), вызванная воспалением вокруг желчевыводящих путей или прямым давлением переполненного желчного пузыря на желчевыводящие пути [1]. Ни один клинический признак или лабораторный анализ не является достаточным для установления или исключения холецистита без дополнительных исследований [41]. Рекомендуемые лабораторные исследования при обследовании на острый холецистит должны включать общий анализ крови и биохимический анализ сыворотки, в том числе печеночные пробы, уровень билирубина и липазы сыворотки крови (для исключения острого панкреатита при дифференциальной диагностике), в дополнение к рентгенографии грудной клетки и электрокардиографии.
Диагностические критерии острого холецистита в соответствии с Токийским руководством [42,43] приведены во Вставке. В небольших исследованиях, включающих менее 200 пациентов, чувствительность этих критериев оценивалась от 83% до 85%, а специфичность — от 37% до 50% [44,45].Вставка. Диагностические критерии острого холецистита
На основе Токийского руководства 2018 годаМестные признаки воспаления
• Симптом Мерфи
• Опухоль, боль или болезненность в правом подреберье
Системные признаки воспаления
• Лихорадка
• Повышенный уровень С-реактивного белка
• Повышенное количество лейкоцитов в крови
Результаты визуализации, характерные для острого холецистита
• Предположительный диагноз: 1 местный признак плюс 1 системный признак
• Определенный диагноз: 1 местный признак плюс 1 системный признак плюс 1 результат визуализации, характерный для острого холецистита
Адаптировано из публикации Yokoe et al. [42]
Диагностические исследования
Ультразвуковое исследование правого подреберья
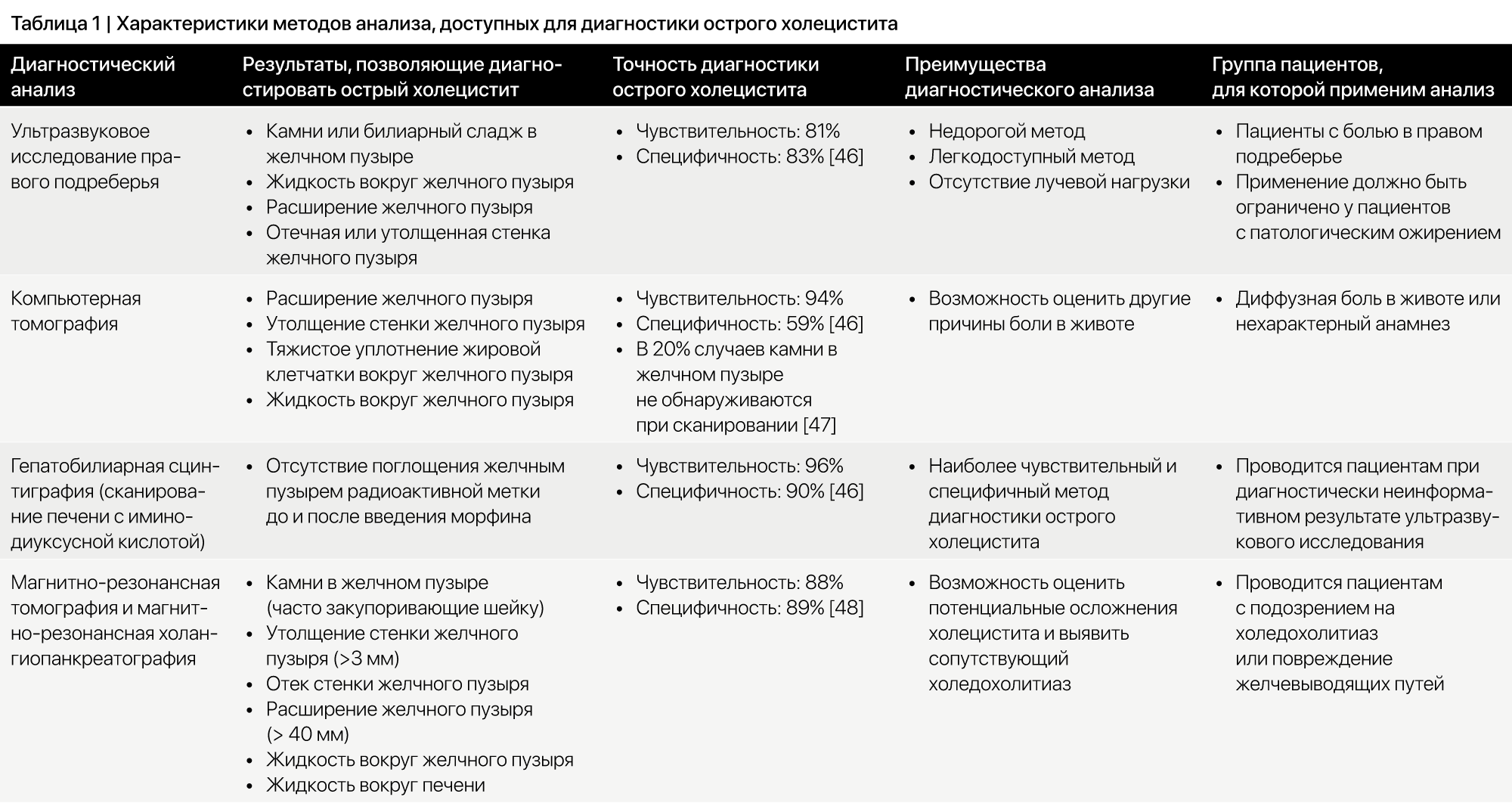
Ультразвуковое исследование – предпочтительный метод первичной визуализации при подозрении на острый холецистит благодаря относительно низкой стоимости, доступности, короткой продолжительности обследования и отсутствию ионизирующего излучения (Таблица 1). На сонограммах обычно определяется жидкость вокруг желчного пузыря (перипузырная жидкость), расширение (вздутие) желчного пузыря, отечная стенка желчного пузыря и, при наличии, камни и/или билиарный сладж в желчном пузыре. В метаанализе 2012 года, включающем 5859 пациентов с острым холециститом, показано, что чувствительность УЗИ в отношении диагностики острого холецистита составляет 81%, а специфичность – 80% [46].
В исследовании 189 пациентов с подозрением на острый калькулезный холецистит наличие камней в желчном пузыре и положительный ультразвуковой симптом Мерфи (максимальная болезненность в брюшной полости при надавливании ультразвуковым датчиком в проекции желчного пузыря) позволили выявить острый холецистит с чувствительностью 48%. Специфичность в отношении острого холецистита у пациентов с отрицательным симптомом Мерфи составила 96%. Все чаще в качестве метода диагностики острого холецистита используется УЗИ «у постели больного», проводимое не-радиологами, особенно врачами отделения неотложной помощи. В исследовании, включающем 1690 пациентов, УЗИ «у постели больного», выполненное врачами отделения неотложной помощи, показало чувствительность 88% (95% ДИ: 84%-91%) и специфичность 87% (95% ДИ: 82%-91%) при использовании радиологической картины в качестве эталонного критерия [49].
Компьютерная томография
В случае неосложненного острого холецистита компьютерная томография (КТ) показывает расширение желчного пузыря, утолщение его стенок, тяжистое уплотнение жировой клетчатки вокруг желчного пузыря и жидкость вокруг желчного пузыря [50]. Выявление камней зависит их состава и толщины срезов КТ. По меньшей мере в 20% случаев камни в желчном пузыре ослабляют рентгеновское излучение в той же степени, что и желчь, и не обнаруживаются при КТ [47]. В мета-анализе 2012 года, включающем 5859 пациентов, чувствительность КТ при диагностике острого холецистита определена в 94%, а специфичность – в 59% [46].
Гепатобилиарная сцинтиграфия (сканирование печени с иминодиуксусной кислотой)
Гепатобилиарная сцинтиграфия, известная также как сканирование печени с использованием иминодиуксусной кислоты, представляет собой один из методов диагностики в ядерной медицине, при котором внутривенно вводится меченный технецием аналог иминодиуксусной кислоты (радиофармпрепарат). Радиофармпрепарат выводится с желчью [51,52]. Перед введением радиоактивного препарата пациент должен голодать не менее 4-6 часов. Введение субанальгетической дозы морфина вызывает сокращение сфинктера Одди, таким образом отводя поступающую желчь в желчный пузырь. У пациентов с проходимым пузырным протоком заполнение желчного пузыря будет заметно уже через 30 минут после введения морфина.
Продолжающееся отсутствие визуализации желчного пузыря при более позднем сканировании или при введении увеличенной дозы морфина подтверждает обструкцию пузырного протока. Гепатобилиарная сцинтиграфия в диагностике острого холецистита обладает чувствительностью 96% и специфичностью 90% [46]. Ультразвуковое исследование предпочтительно в качестве первоначального диагностического теста, а гепатобилиарная сцинтиграфия предназначена для 20% пациентов с неоднозначными результатами УЗИ. Гепатобилиарная сцинтиграфия является наиболее надежным методом визуализации у пациентов с подозрением на некалькулезный острый холецистит [30].
Магнитно-резонансная томография и магнитно-резонансная холангиопанкреатография
Магнитно-резонансная томография при остром неосложненном холецистите выявляет: (1) камни в желчном пузыре (часто в шейке желчного пузыря или пузырном протоке), (2) утолщение стенки желчного пузыря (>3 мм), (3) отек стенки желчного пузыря, (4) расширение желчного пузыря (диаметр >40 мм), (5) жидкость вокруг желчного пузыря и (6) жидкость вокруг печени [53]. Наличие 1 или более из этих 6 признаков указывает на острый холецистит, при этом чувствительность метода составляет 88%, а специфичность – 89% [48]. Магнитно-резонансную томографию также можно использовать для оценки потенциальных осложнений острого холецистита, таких как гангренозный, эмфизематозный и перфоративный холецистит. Кроме того, магнитно-резонансная томография и, в частности, магнитно-резонансная холангиопанкреатография позволяют исключить сопутствующий холедохолитиаз на фоне холецистита, что может помочь в планировании лечения [54,55].
Дифференциальная диагностика
Острый холецистит необходимо дифференцировать с такими заболеваниями, как желчная колика и острый холангит, также вызывающими боли в правом подреберье, тошноту или рвоту. Термин «желчная колика», подразумевающий боль в животе из-за обструкции пузырного протока, ошибочен. Желчная колика проявляется постоянными интенсивными болями в правом подреберье при отсутствии лихорадки и лейкоцитоза. Эта боль не периодическая и не коликообразная, как принято считать, а относительно постоянная из-за обструкции пузырного протока и проходит только после того, как камни попадают обратно в желчный пузырь [5]. Желчная колика обычно появляется через пару часов после приема пищи и проходит в течение нескольких часов. На УЗИ стенка желчного пузыря находится в пределах нормы, без каких-либо признаков жидкости вокруг желчного пузыря.
Острый холангит характеризуется лихорадкой, желтухой и болью в правом подреберье, при этом на УЗИ выявляются расширенные внутри- и внепеченочные желчные протоки. Другие диагнозы, которые следует учитывать у пациента с симптомами острого холецистита, включают острый гастрит, язвенную болезнь желудка, грыжу пищеводного отверстия диафрагмы, острый панкреатит, острый вирусный гепатит, острый аппендицит и инфаркт миокарда.
Лечение
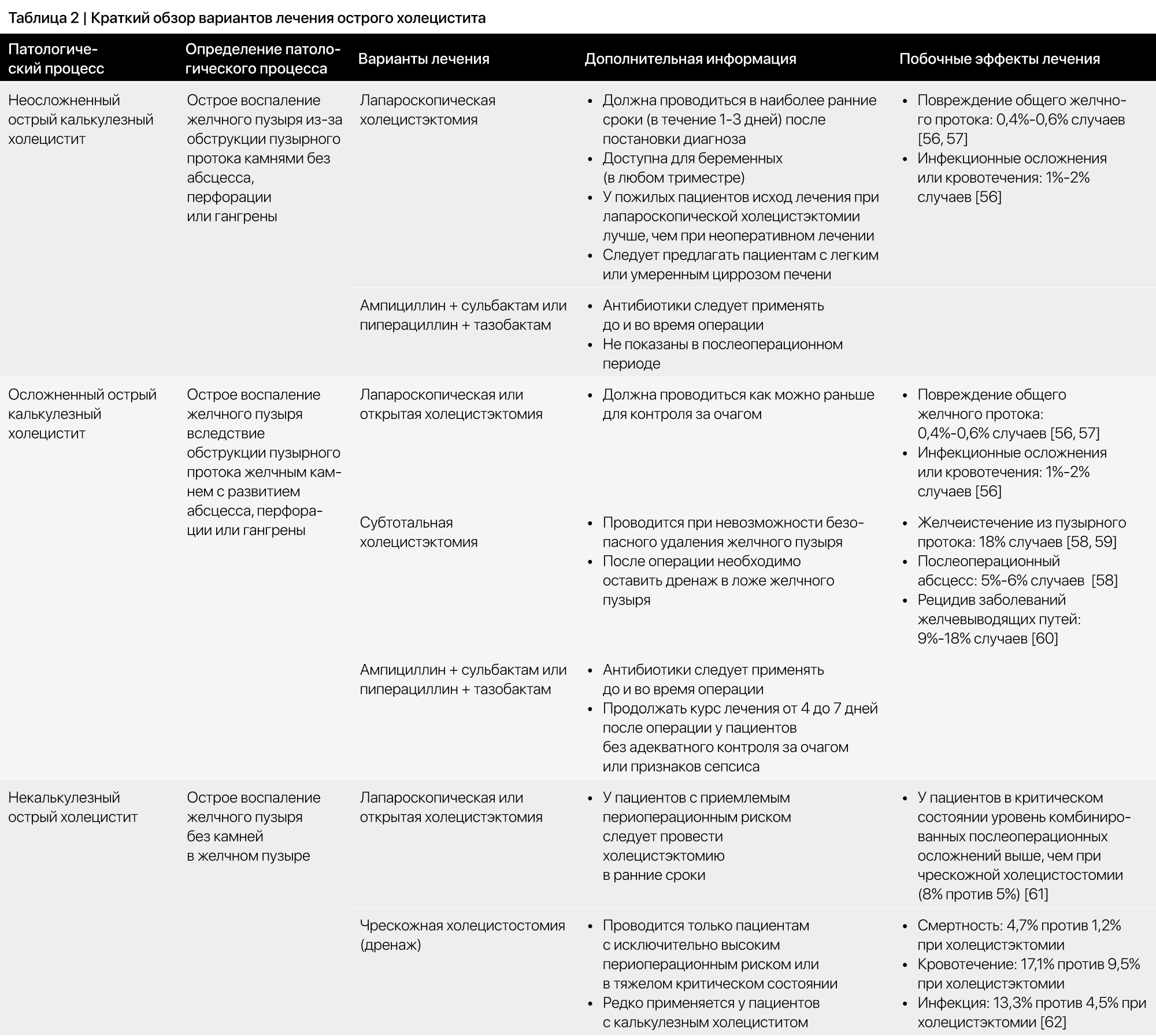
Холецистэктомия – стандартный метод лечения острого калькулезного холецистита (таблица 2). В США стандартом лечения является лапароскопическая холецистэктомия [63-65].
Ранняя или отсроченная холецистэктомия
В открытом рандомизированном клиническом исследовании 2013 года (n=618) сравнивались пациенты с острым холециститом, которым операция была выполнена в течение 24 часов после поступления, и пациенты, которым сначала проводилась антибиотикотерапия, а затем холецистэктомия в период от 7 до 45 дней после поступления. Исследование обнаружило значительно меньшую частоту послеоперационных осложнений в течение первых 75 дней в группе пациентов, которым была выполнена ранняя холецистэктомия (11,8% у пациентов, прооперированных в течение 24 часов после поступления, против 34,4% у пациентов, прооперированных через 7-45 дней после поступления; P<0,001). Ранняя холецистэктомия также была связана с меньшей средней продолжительностью пребывания в стационаре (5,4 дня для пациентов, прооперированных в течение 24 часов после поступления, против 10,0 дней для пациентов, прооперированных через 7-45 дней после первичной госпитализации; P<0,001) и меньшими общими расходами на госпитализацию (2919 евро против 4262 евро соответственно; P<0,001) [66].
Наблюдение 15 760 шведских пациентов с острым холециститом показало, что повреждение желчных протоков после операции реже возникало у пациентов, перенесших холецистэктомию в течение 4 дней после поступления (0,17% против 0,53% у тех, кто перенес холецистэктомию более чем через 4 дня; Р=0,008), и что уровень смертности в течение 30 дней был ниже среди тех пациентов, которым была выполнена холецистэктомия в течение 2 дней после поступления, по сравнению с более чем 2 днями после поступления (0,39% против 1,33% соответственно; P=0,004) [67]. Наблюдательное исследование, проведенное в 2015 году с участием 45 452 пациентов из Франции, показало, что частота госпитализаций в отделение интенсивной терапии, повторных операций и послеоперационного сепсиса была ниже у пациентов, прооперированных в период от 1 до 3 дней после поступления, чем у пациентов, прооперированных позже. Смертность также была ниже среди пациентов, перенесших холецистэктомию в период с 1-го по 3-й день, чем среди пациентов, перенесших холецистэктомию на 5-й день (1,0% против 1,9%, соответственно; P<0,001) [68].
В 2020 г. в результате анализа более 100 000 холецистэктомий в штате Нью-Йорк было показано, что пациентам, которые перенесли холецистэктомию менее чем через 72 часа после поступления, реже требовалось проведение операции открытым способом (7,5% против 13,8% при холецистэктомии через 72 часа после поступления; P<0,001) [69]. Однако эти результаты могут быть искажены из-за более раннего назначения операции более здоровым пациентам. Кроме того, данные по 243 536 пациентам из базы данных Общенациональной выборки стационарных больных США (Nationwide Inpatient Sample) показали, что у не-белых пациентов частота экстренной госпитализации была выше, чем у белых (84% против 78%, соответственно; P<0,001), что косвенно говорит о неравенстве в доступе к медицинской помощи в отношении не-белых пациентов с острым холециститом [70]. В целом, ранняя холецистэктомия связана со значительно лучшими исходами лечения, чем отсроченная холецистэктомия [66-69].
В случае примерно от 2% до 15% пациентов в ходе проведения лапароскопической холецистэктомии требуется переход на холецистэктомию открытым способом. Это происходит, когда во время лапароскопической операции невозможно выполнить безопасную хирургическую диссекцию [71]. Систематический обзор 30 наблюдательных и, в основном, ретроспективных исследований от 2017 года показал, что, несмотря на низкое качество данных и высокую вероятность предвзятости, в большинстве исследований мужской пол, пожилой возраст, высокий ИМТ и наличие острого холецистита связаны с повышенной частотой перехода к операции открытым способом [72]. В одном одноцентровом проспективном наблюдательном исследовании, включающем 732 пациента, было отмечено несколько переменных, в значительной степени ассоциированных с переходом от лапароскопической холецистэктомии к операции открытым способом: предшествующие операции на верхних отделах брюшной полости (11% против 0,8% у пациентов, перенесших лапароскопическую холецистэктомию), ИМТ более 30 (55% против 18%), наличие камней в шейке желчного пузыря (51% против 16%) и толщина стенки желчного пузыря более 3 мм (38% против 0,4%) [73].
Осложнения после холецистэктомии
Проведенный в 2011 году анализ швейцарской национальной базы данных, включающей 4113 пациентов (средний возраст 59,8 лет; 52,8% женщин), перенесших лапароскопическую холецистэктомию по поводу острого холецистита, показал, что у 6,1% пациентов возникли послеоперационные осложнения [56]. Наиболее частыми осложнениями были кровотечение из брюшной стенки или внутрибрюшное кровотечение (1,8%) и поверхностная раневая инфекция (1,0%). Повреждение внепеченочных желчных протоков произошло у 17 пациентов (0,4%). Согласно проведенному в 2021 году анализу Национальной базы данных США о повторных госпитализациях (US National Readmissions Database), включающей 1 768 725 пациентов, перенесших лапароскопическую холецистэктомию, восстановление поврежденных желчных протоков потребовалось 0,46% пациентов.
Повреждение желчных протоков во время операции обычно проявляется желтухой и лихорадкой в послеоперационном периоде и диагностируется интраоперационно или в течение нескольких дней после операции. Несмотря на то, что хирург может справиться с большинством кровотечений или инфекционных осложнений, опасения по поводу повреждения желчевыводящих путей требуют быстрой диагностики и вмешательства хирурга, обладающего опытом гепатобилиарной реконструкции. Оценка послеоперационной желтухи должна включать функциональные печеночные пробы. Ультразвуковое исследование является первым практическим методом выявления скопления жидкости или расширения желчных протоков. При послеоперационной оценке повреждения желчных протоков магнитно-резонансная холангиопанкреатография более информативна, чем КТ, и должна проводиться при аномальном уровне билирубина или аномальных результатах УЗИ [74].
Острый холецистит у пожилых пациентов
Применяемое на начальном этапе консервативное лечение с отсроченной холецистэктомией рассматривалось как альтернатива немедленной холецистэктомии у пожилых пациентов (в возрасте >65 лет) [75]. Однако результаты исследований постоянно показывают, что исходы после ранней лапароскопической холецистэктомии у восьмидесятилетних пациентов сопоставимы с таковыми у более молодых пациентов [76]. В исследовании 2010 года, проведенном на основе данных Medicare по обследованию 29 818 пациентов старше 65 лет, было показано, что среди пациентов, которым не проводилась первичная холецистэктомия, 38% были повторно госпитализированы по поводу осложнений, связанных с желчным пузырем, тогда как среди тех, кому была выполнена первичная холецистэктомия, частота повторной госпитализации составила всего 4%.
Отказ от проведения холецистэктомии при первичной госпитализации был связан с более высокой смертностью в течение 2 лет (29,3%) по сравнению с пациентами, которым холецистэктомия была выполнена при первичной госпитализации (15,2%) (P<0,001) [77]. В аналогичном исследовании в Англии были проанализированы данные 47 500 пациентов в возрасте 80 лет и старше из национальной базы данных больниц. Хотя в исследовании была продемонстрирована высокая 30-дневная смертность в группе пациентов, перенесших раннюю холецистэктомию по сравнению с группой пациентов, перенесших отсроченную холецистэктомию (11,6% против 9,9%, соответственно), было отмечено более значительное повышение смертности в течение 1 года среди пациентов, перенесших отсроченную холецистэктомию (20,8 против 27,1%; Р<0,001) [78]. Однако, на результат этих наблюдательных исследований, вероятно, повлиял искажающий фактор – для ранней холецистэктомии отбирались более здоровые пациенты.
Острый холецистит во время беременности
Негинекологические операции проводятся у 1-2% беременных пациенток, а абдоминальная хирургия, в том числе холецистэктомия, составляет 45% этих операций [79]. Действующие рекомендации Американской коллегии акушеров-гинекологов и Общества американских гастроэнтерологических и эндоскопических хирургов рекомендуют выполнять лапароскопическую холецистэктомию при остром холецистите в любом триместре [80,81]. Несмотря на эти рекомендации, национальные данные из США показали, что примерно 60% беременных женщин с острым холециститом получали консервативное лечение [82].
По последним данным, при беременности риск, связанный с холецистэктомией, ниже, чем риск, связанный с консервативным лечением острого холецистита. В исследование 2017 года, проведенное на основе национальной базы данных Англии, были включены 47 628 беременных пациенток, прооперированных по поводу неакушерской патологии [83]. Предполагаемый риск осложнений негинекологической хирургии во время беременности был относительно низким: 1 мертворождение приходилось на 1 из 287 хирургических операций и 1 преждевременные роды – на 1 из 31 операции. Несмотря на то, что это исследование было наблюдательным и, возможно, не учитывало существенных искажающих факторов, оно показало, что частота акушерских осложнений, связанных с хирургическим вмешательством, невелика.
В исследовании 2021 года была изучена Национальная выборка стационарных больных США (US National Inpatient Sample) и было выявлено около 24000 беременных женщин с диагнозом «острый холецистит». Среди этих пациенток ранняя лапароскопическая холецистэктомия по поводу острого холецистита была связана с меньшим числом преждевременных родов или спонтанных абортов, при выполнении в течение 1 дня после постановки диагноза, по сравнению с задержкой на 7 дней и дольше (1,6% против 18,4% соответственно; Р<0,001) [84]. Таким образом, лапароскопическая холецистэктомия должна быть рекомендована беременным женщинам с острым холециститом независимо от триместра.
Острый холецистит у пациентов с циррозом печени
В ретроспективных исследованиях оценка по шкале Чайлд-Пью и по шкале модели терминальной стадии заболевания печени (Model for End-stage Liver Disease, MELD) связана с исходами до холецистэктомии у пациентов с острым холециститом. Ретроспективное исследование, проведенное в 2010 году в Греции и включавшее 220 пациентов с циррозом печени и острым холециститом, показало более высокую частоту периоперационных осложнений у пациентов с оценкой от 10 до 15 баллов по шкале Чайлд-Пью (класс C; декомпенсированное заболевание) или с оценкой, превышающей 13 баллов по шкале MELD, по сравнению с пациентами с более благоприятными показателями (диапазон баллов MELD 6-40 [85]). В более позднем анализе базы данных по улучшению качества хирургии Американского колледжа хирургов (American College of Surgeons National Surgical Quality Improvement) были показаны аналогичные результаты и обнаружено, что более высокие баллы по шкале MELD связаны с более высокой частотой послеоперационных осложнений (раневых, инфекционных или респираторных) и смертности. Среди пациентов с показателем MELD более 15 баллов смертность составила 3,2% [86]. Наличие асцита и показатель MELD более 20 баллов были связаны с еще более высоким риском смерти (33,3%) или послеоперационных осложнений после лапароскопической холецистэктомии (66,7%).
В американском исследовании 2021 года, включающем 349 пациентов-ветеранов с циррозом печени, отмечены более низкие показатели послеоперационных осложнений (9,5% против 31,5%; P<0,001) и смертности (3,5% против 11,9%; P=0,003) среди пациентов, перенесших лапароскопическую холецистэктомию по сравнению с операцией открытым способом [87]. Несмотря на отсутствие результатов клинических исследований, имеющиеся данные свидетельствуют о том, что у пациентов с оценками по шкале Чайлд-Пью от 5 до 6 баллов (класс А; хорошо компенсированное заболевание) или от 7 до 9 баллов (класс В; значительное функциональное нарушение), а также у пациентов с оценкой по шкале MELD менее 15 баллов холецистэктомия более безопасна, чем консервативное лечение.
Однако доказательная база этих критериев не вполне определена, и при оценке рисков у пациентов с циррозом печени и острым холециститом врачи должны учитывать дополнительные клинические факторы, такие как возраст, наличие асцита и другие сопутствующие заболевания. Если холецистэктомия признана небезопасной, альтернативным методом лечения может быть внутренний дренаж с помощью эндоскопической ретроградной холангиопанкреатографии или трансдуоденальный дренаж, в зависимости от квалификации имеющихся специалистов [88,89].
Лечение осложненного холецистита
Осложненный острый холецистит определяется как холецистит в сочетании с одним из следующих осложнений: некроз желчного пузыря, перфорация, перипузырный абсцесс или желчно-кишечный свищ. Пациенты с этими осложнениями подвержены более высокому риску неблагоприятных исходов после холецистэктомии. Несмотря на необходимый старт антибиотикотерапии сразу после поступления, консервативное лечение в таких случаях нецелесообразно, поскольку антибиотиков недостаточно для устранения некроза ткани или абсцесса.
Для большинства пациентов с осложненным холециститом целесообразным первоначальным подходом является лапароскопическая холецистэктомия, однако может потребоваться переход к открытой операции. Невозможность безопасного рассечения желчного пузыря во время лапароскопической или открытой холецистэктомии должна стать поводом для выполнения субтотальной холецистэктомии, которая заключается в удалении большей части стенки желчного пузыря, камней и закрытии отверстия пузырного протока путем фенестрации [90]. Анализ данных по 290 855 пациентам из Общенациональной выборки стационарных больных показал, что среди тех, кому была выполнена субтотальная холецистэктомия, по сравнению с перенесшими тотальную холецистэктомию, было больше мужчин (68,2% против 48,3%; Р<0,001), пациентов азиатского происхождения (5,4% против 2,4%; Р=0,013),а также пациентов, злоупотреблявших алкоголем (4,9% против 2,4%; Р<0,001) [91].
Имеется мало данных о том, как необходимо лечить желчно-кишечный свищ и возможную кишечную непроходимость при попадании камня из желчного пузыря в кишечный тракт. В серии наблюдений, проведенных в 2020 году и включавших 15 пациентов с желчно-кишечным свищом, отмечалась высокая вариабельность стратегии лечения: 5 пациентам была выполнена лапаротомия и удаление камня без реконструкции тканей в области свища, 8 пациентам – открытая холецистэктомия и лапароскопическая реконструкция, 2 пациентам – лапароскопическая реконструкция [92].
В нескольких исследованиях сообщалось о частоте осложнений после открытой и лапароскопической субтотальной холецистэктомии. Проведенный в 2015 году мета-анализ данных 1228 пациентов из 30 исследований, включавший как рандомизированные, так и наблюдательные данные, показал более высокую распространенность желчеистечения (из остатка желчного пузыря или культи пузырного протока) после субтотальной холецистэктомии у пациентов, которым не закрывали пузырный проток или культю желчного пузыря, по сравнению с теми, кому данные манипуляции провели (42,0% против 16,5% соответственно) [58]. В этом обзоре также сообщалось, что дополнительные послеоперационные вмешательства были обычным явлением у пациентов, перенесших эндоскопическую ретроградную холангиопанкреатографию, которая потребовалась 4,1% пациентам после субтотальной холецистэктомии. Еще 1,8% пациентов перенесли повторную операцию из-за осложнений со стороны желчевыводящих путей (41%), абсцесса (23%), по поводу завершения холецистэктомии (18%), кровотечения (9%) или кишечной непроходимости (9%). Подпеченочный абсцесс развился у 2,9% пациентов, но только 5% подверглись чрескожному дренированию под контролем визуализации. В целом, данные по лечению осложненного холецистита указывают на пользу применения как открытой, так и лапароскопической субтотальной холецистэктомии с установкой дренажа в ложе желчного пузыря из-за относительно высокой частоты желчеистечения.
Антибиотикотерапия
Острый холецистит – это, прежде всего, воспалительный процесс, однако у 20% пациентов из-за обструкции пузырного протока и застоя желчи может возникнуть вторичная бактериальная инфекция желчного пузыря [1,36]. Для лечения инфекции, вызванной грамотрицательными и анаэробными микроорганизмами, обычно применяют комбинацию ампициллина с сульбактамом или комбинацию пиперациллина с тазобактамом. Эти комбинированные препараты следует назначать перед операцией для защиты от сепсиса и раневой инфекции.
Несмотря на ограниченность данных, Токийское руководство 2018 года рекомендует использовать антибиотики в случае неосложненного холецистита до и во время оперативного вмешательства [93]. Данные о применении антибиотиков после операции свидетельствуют о том, что рутинное применение антибиотиков после операции не связано с улучшением исходов. Исследование, проведенное в 2014 году с участием 414 французских пациентов, которых случайным образом разделили на группу получавших амоксициллин и клавулановую кислоту только до операции и группу с дополнительным 5-дневным курсом антибиотикотерапии после операции, не выявило различий в частоте инфекций после холецистэктомии: 17% в группе без лечения и 15% в группе с продленным послеоперационным курсом антибиотиков (абсолютная разница 1,93% [95% ДИ: от 8,98% до 5,12%]) [94].
Аналогичным образом, в исследовании 2017 года с участием 150 пациентов из Нидерландов, пациенты были разделены на группы получавших либо однократную дозу цефазолина перед операцией, либо как минимум 3-дневный курс цефуроксима и метронидазола. Значимых различий в уровне инфекционных осложнений после холецистэктомии, составивших приблизительно 4% в обеих группах, не было (абсолютная разница составила 0,2% [95% ДИ: от -8,2% до 8,2%]) [95]. Поэтому вопрос о применении антибиотиков после операции следует рассматривать только для пациентов с признаками остаточной инфекции или сепсиса [93].
Чрескожная холецистостомия (дренаж)
У пациентов с острым холециститом и исключительно высоким периоперационным риском альтернативой холецистэктомии может быть чрескожная холецистостомия (установка дренажной трубки). К пациентам с повышенным периоперационным риском относят пожилых пациентов с многочисленными сопутствующими заболеваниями и пациентов в критическом состоянии на момент постановки диагноза [96]. Чрескожная холецистостомия предполагает установку чрескожного дренажного катетера в просвет желчного пузыря под визуальным контролем [97]. Дренаж устраняет компрессию желчного пузыря, одновременно отводя инфекцию, и может облегчить течение холецистита, тем самым предоставляя больше времени для стабилизации состояния пациента перед холецистэктомией. Несмотря на данные об увеличении частоты применения дренажа за последние 20 лет, остается неясным, какой группе пациентов лучше всего подходит проведение чрескожной холецистостомии [98].
По сравнению с пациентами с некалькулезным острым холециститом, применение чрескожной холецистостомии у пациентов с калькулезным холециститом остается спорным. В Кокрейновском обзоре 2013 года, посвященном пациентам высокого риска с калькулезным острым холециститом, было сделано заключение о недостаточности доказательств для определения того, улучшает ли чрескожная холецистостомия исходы лечения [99]. Впоследствии в многоцентровом рандомизированном исследовании в Нидерландах (исследование CHOCOLATE [100]) сравнивали лапароскопическую холецистэктомию и чрескожную холецистостомию у 142 пациентов с острым холециститом и повышенным риском периоперационных осложнений. Средний возраст пациентов в обеих когортах был больше 70 лет, сахарный диабет наблюдался у 20-24% пациентов и у всех пациентов оценка по шкале острых физиологических расстройств и хронических функциональных изменений (Acute Physiology and Chronic Health Evaluation, APACHE) составляла 7 баллов или выше. Исследование было досрочно прекращено после того, как запланированный промежуточный анализ показал более высокий уровень осложнений (сердечно-легочные и инфекционные осложнения, необходимость повторного вмешательства и рецидивирующие заболевания желчевыводящих путей) среди пациентов в группе чрескожной холецистостомии (65% против 12% у тех, кто перенес лапароскопическую холецистэктомию; Р<0,001).
Аналогичным образом в исследовании 2020 года, охватывающем 358 624 пациента и анализ общенациональной базы данных о повторных госпитализациях в США, было установлено, что среди пациентов в возрасте 65 лет и старше с признаками ишемической дисфункции органов и острого холецистита чрескожная холецистостомия была связана с более высокой смертностью по сравнению с лапароскопической холецистэктомией (16% против 2% соответственно; Р<0,001), увеличением числа комбинированных послеоперационных осложнений (60% против 25%; Р<0,001) и более длительной продолжительностью пребывания в стационаре (15 дней против 9 дней; Р<0,001). Однако в этом исследовании не проводилось различий между некалькулезным и калькулезным холециститом [101].
Данные относительно применения чрескожной холецистостомии у пациентов с некалькулезным острым холециститом неоднозначны. В крупном многоцентровом исследовании базы данных пациентов из Калифорнии изучались исходы оперативных вмешательств у 1725 пациентов в критическом состоянии с некалькулезным холециститом [61]. У пациентов, перенесших чрескожную холецистостомию, исходы были значительно лучше, чем у тех, кто перенес лапароскопическую или открытую холецистэктомию; в том числе выявлено меньшее число комбинированных послеоперационных осложнений (5,0% против 8,0% соответственно; Р<0,05) и снижение расходов на госпитализацию (40 516 долларов против 51 596 долларов; Р<0,05). Тем не менее, при сравнении чрескожной холецистостомии с лапароскопической холецистэктомией периоперационные исходы не отличались. В исследовании, проведенном на основе Общенациональной выборки стационарных больных США за 2000-2014 гг., было проанализировано 200 915 пациентов в возрасте 65 лет и старше с острым холециститом [62]. У пациентов, перенесших чрескожную холецистостомию, смертность была выше по сравнению с пациентами, перенесшими холецистэктомию (4,7% против 1,2% соответственно; Р < .001), наблюдались более частые послеоперационные кровотечения (17,1% против 9,5%; Р<0,001), более высокий уровень инфицирования (13,3% против 4,5%; Р<0,001), отмечался более длительный срок пребывания в стационаре в больнице (в среднем 1,25 дня [95% ДИ: 1,14-1,37 дня]) [62].
Таким образом, чрескожную холецистостомию не следует широко применять для лечения острого холецистита. Чрескожная холецистостомия может быть более полезной для пациентов с некалькулезным холециститом, но если есть возможность выполнить лапароскопическую холецистэктомию, то существующие данные говорят об отсутствии существенных различий в исходах чрескожной холецистостомии и лапароскопической холецистэктомии у пациентов с некалькулезным холециститом.
Ограничения
Данный обзор имеет ограничения. Во-первых, в него были включены только англоязычные исследования. Во-вторых, при поиске литературы могли быть пропущены некоторые релевантные исследования. В-третьих, не проводилась формальная оценка качества включенных исследований.
Выводы
Острый холецистит, как правило обусловленный непроходимостью желчного протока, ежегодно поражает около 200 000 жителей США. Для большинства пациентов терапией первой линии при остром холецистите является лапароскопическая холецистэктомия в течение 3 дней после постановки диагноза.