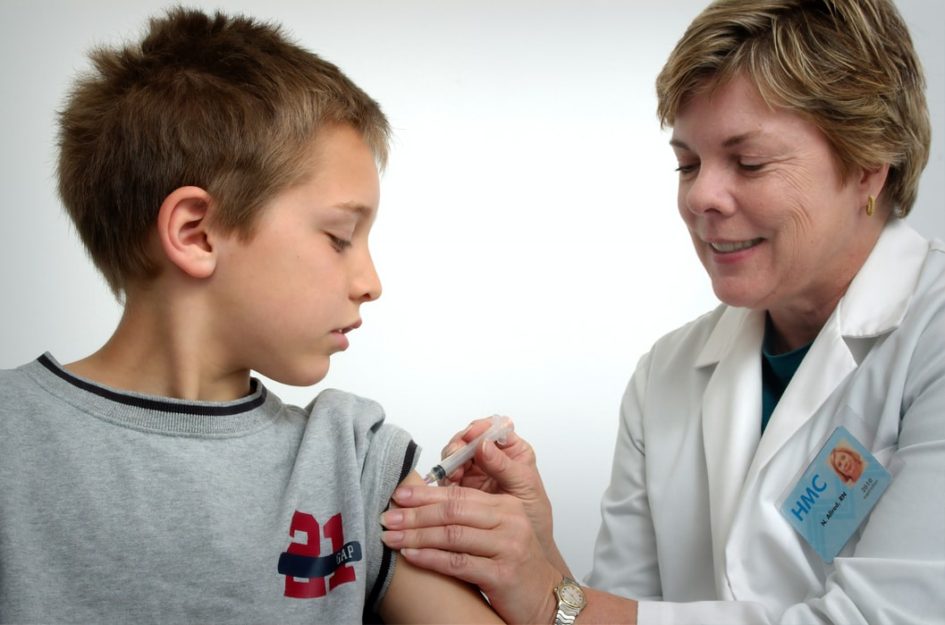
Полиомиелит — на удивление известная болезнь, если учесть, что сегодня она встречается крайне редко. В 2019 году во всем мире было зарегистрировано всего 176 случаев заболевания диким вирусом.
Но так было не всегда. Эпидемии полиомиелита, начавшиеся в середине XX века, долго не удавалось купировать. Вакцины против инфекции разработали не сразу: на это потребовались годы, в течение которых тысячи детей умирали, а десятки тысяч — становились инвалидами. В довакцинную эпоху заболеваемость полиомиелитом составляла около 600 тысяч случаев в год. К 1988 году, когда была создана Глобальная инициатива по борьбе с полиомиелитом, от инфекции в мире ежегодно страдало 350 тысяч детей . Сама болезнь до сих пор остается практически неизлечимой (рис. 1). В мире сегодня около 20 миллионов жертв полиомиелита [1].
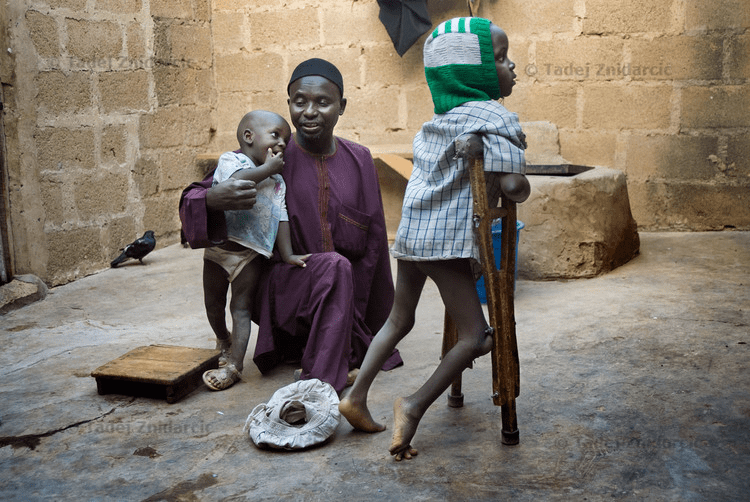
Рисунок 1а. Жертвы полиомиелита в Нигерии, где дикий полиовирус всё еще циркулирует. Умар, пострадавший от полиомиелита, родился в 2003 году, когда в нигерийском штате Кано иммунизация детей была байкотирована. Мальчик передвигается с костылями.
Living with Polio in Northern Nigeria
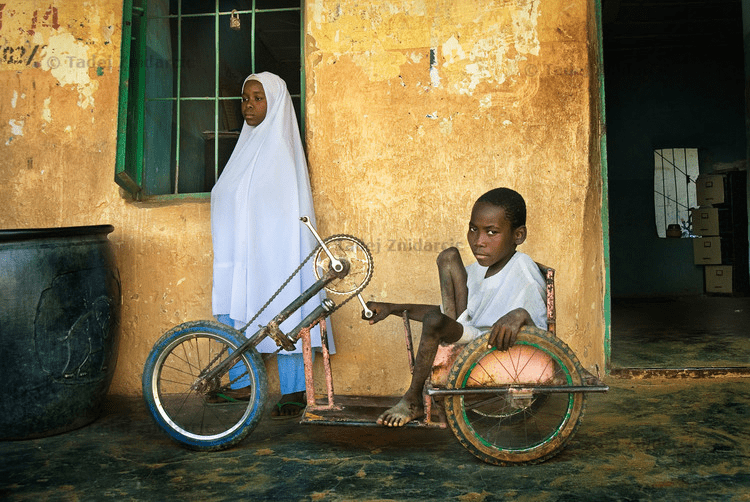
Рисунок 1б. Жертвы полиомиелита в Нигерии, где дикий полиовирус всё еще циркулирует. Наджа Ату Юсиф (слева), переболев полиомиелитом, осталась хромой. Ее брат Адаму Юсиф после болезни не может ходить, а для передвижения использует трехколесный велосипед.
Living with Polio in Northern Nigeria
Полиомиелит — болезнь грязных рук
Полиомиелит — по большей части детская болезнь. В развивающихся странах 65–75% случаев инфекции встречаются у детей в возрасте до 3 лет и 95% — у детей в возрасте до 5 лет. Маленькие дети больше подвержены заражению, так как полиомиелит передается через грязные игрушки и посуду. Подросткам и взрослым также есть, чего опасаться, — у них осложнения после инфекции тяжелее и встречаются чаще. Смертность от полиомиелита у детей составляет 5%, а у взрослых — 15–30% [2].
Изучение останков мумий и древних изображений дает понять, что полиомиелит сосуществует с нами очень давно. Он был распространен еще в Древнем Риме, Греции и Египте (рис. 2).

Рисунок 2а. Полиомиелит в древности: обложка документа ВОЗ о провозглашении ЕС свободным от полиомиелита регионом, 2002 год. На фотографии — надгробная плита времен 18-й египетской династии (580–1350 гг. до н.э.). Изображенный на ней человек пострадал от полиомиелита и остался инвалидом. Его правая нога повреждена из-за болезни.
«Сертификация ликвидации полиомиелита»
ченые всего мира исследуют полиомиелит с конца XIX века, до этого момента о нем почти ничего не было известно (рис. 3).

Второе название полиомиелита — болезнь Гейне—Медина. Оно отсылает к двум врачам, положившим начало борьбы с инфекцией. Якоб Гейне в 1840 году в Германии отделил полиомиелит от других видов паралича, а Карл Медин из Швеции через 50 лет после этого доказал его инфекционную природу и показал, что далеко не все случаи полиомиелита заканчиваются поражением нервной системы.
Крошка-вирус
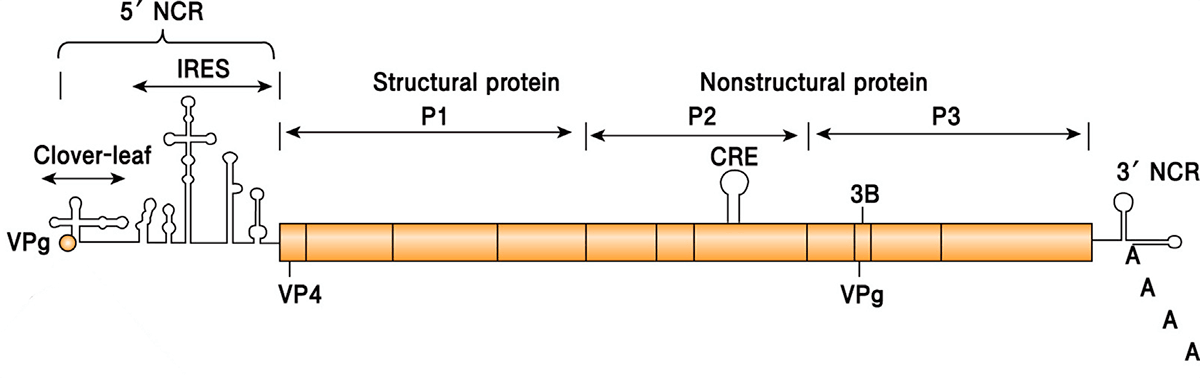
Полиовирус хорошо изучен. Он относится к роду энтеровирусов (вид — энтеровирус С), населяющих пищеварительный тракт, к семейству пикорнавирусов — маленьких вирусов (piccolo — «маленький» по-итальянски) с геномом в виде молекулы РНК. Пикорнавирусы отличаются простым строением: одноцепочечная (+)РНК (позитивная, или кодирующая) и окружающая ее белковая оболочка — капсид (рис. 4).
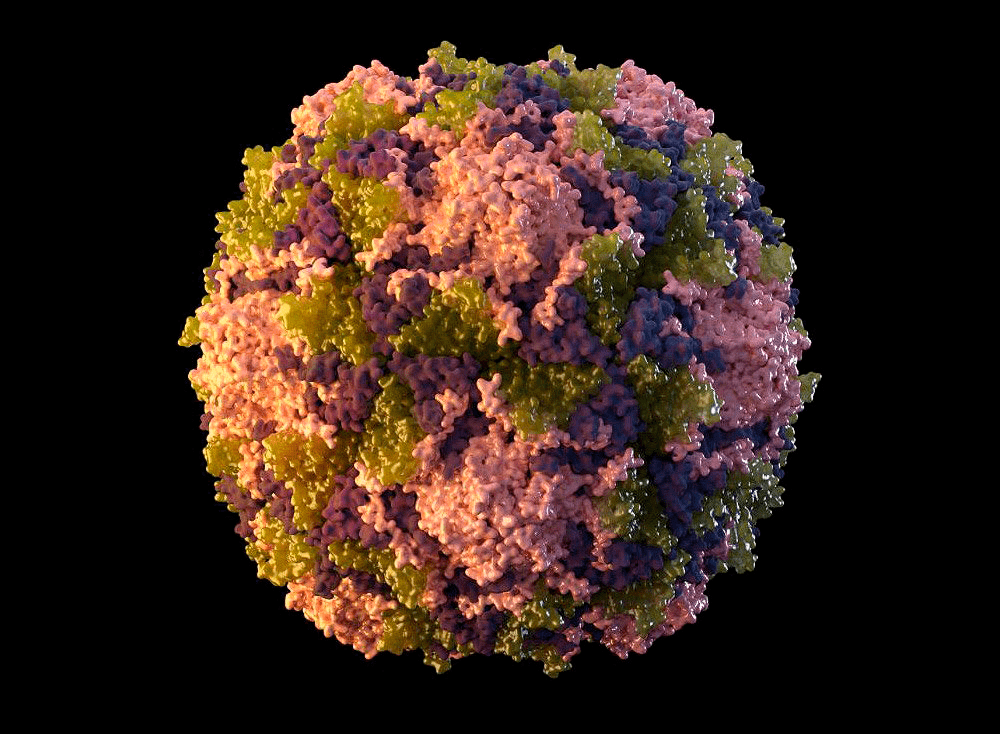
Дикие полиовирусы делят на три серотипа (1, 2 и 3) в зависимости от конфигурации белков на их поверхности. Все серотипы вызывают полиомиелит человека, а иммунитет против вируса одного типа не защищает от других.
Белковая оболочка вируса надежно оберегает его от внешних воздействий. Полиовирус может жить в воде несколько месяцев, а в богатой органикой среде (например, фекалиях) — до полугода. Оправдывая звание энтеровируса, он устойчив к кислой среде желудочно-кишечного тракта. Капсид полиовируса не содержит липидов, а потому даже обработка спиртом или хлороформом, растворяющими жир, ему нипочем. Полиовирус без труда переживает холода, но быстро инактивируется при температуре выше 50 °C. В геноме вируса полиомиелита закодирован один большой белок-предшественник, из которого потом нарезаются все нужные вирусу белки (рис. 5).
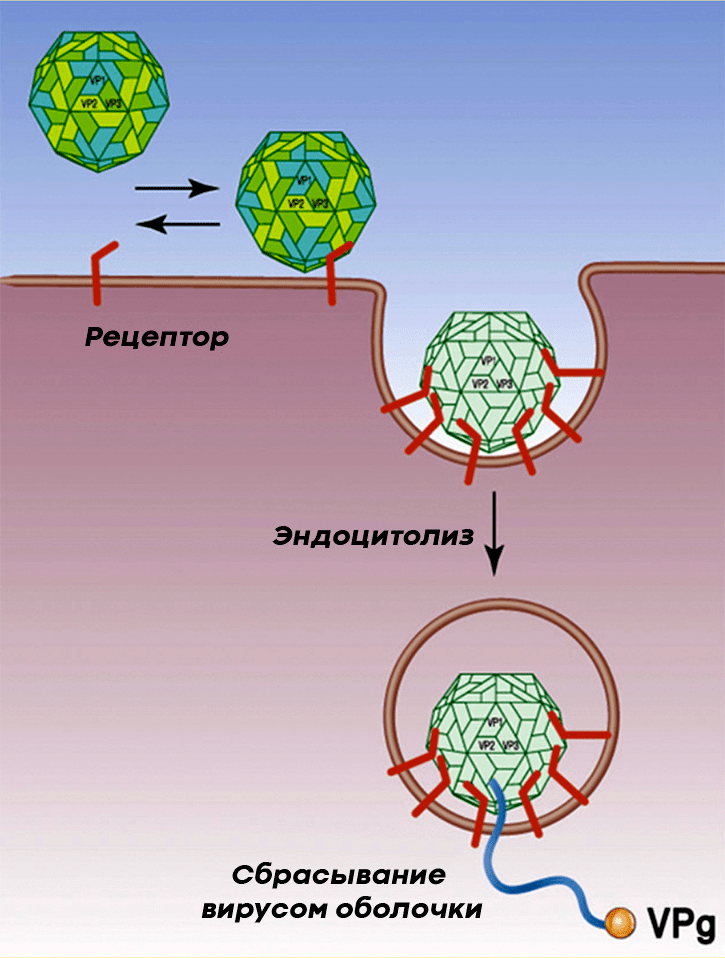
Полиовирус проникает в клетки человека, прикрепляясь к расположенному на них гликопротеину CD155, который пронизывает мембрану клетки, выставляя наружу три своих домена (рис. 6). Из-за этого CD155 получил название «рецептор к полиовирусу», или PVR (the human poliovirus receptor). PVR нужен клеткам для собственных нужд (например, для адгезии клеток), но вирус использует его для своих целей, а именно, чтобы проникнуть внутрь клеток и подчинить их себе.
PVR — не просто рецептор
Рецептор полиовируса человека (the human poliovirus receptor, PVR) — это белок на поверхности клеток нашего организма, который имеет множество разных функций. Он обеспечивает правильную клеточную адгезию, участвует в движении и пролиферации (размножении) клеток, особенно во время эмбрионального развития. PVR известен также как регулятор клеточного иммунитета. Он помогает лейкоцитам проходить сквозь стенки сосудов, перемещаясь к очагу воспаления.
Интересно, что PVR в больших количествах представлен на поверхности опухолевых клеток (эпидермальные и остеогенные карциномы, рак молочной железы и толстого кишечника, нейробластома и др.) из-за постоянной активности у них морфогенного фактора Sonic hedgehog и факторов транскрипции Gli1 и Gli3 [4]. Во всех здоровых клетках PVR экспрессируется на низком уровне, что делает его прекрасным маркером различных видов опухолей.
Ученые используют PVR на поверхности опухолевых клеток для прицельной борьбы с раком. В качестве противоопухолевых препаратов они предлагают генетически модифицированные безопасные полиовирусы, которые разрушают опухоль, но не затрагивают соседние ткани [5], [6].
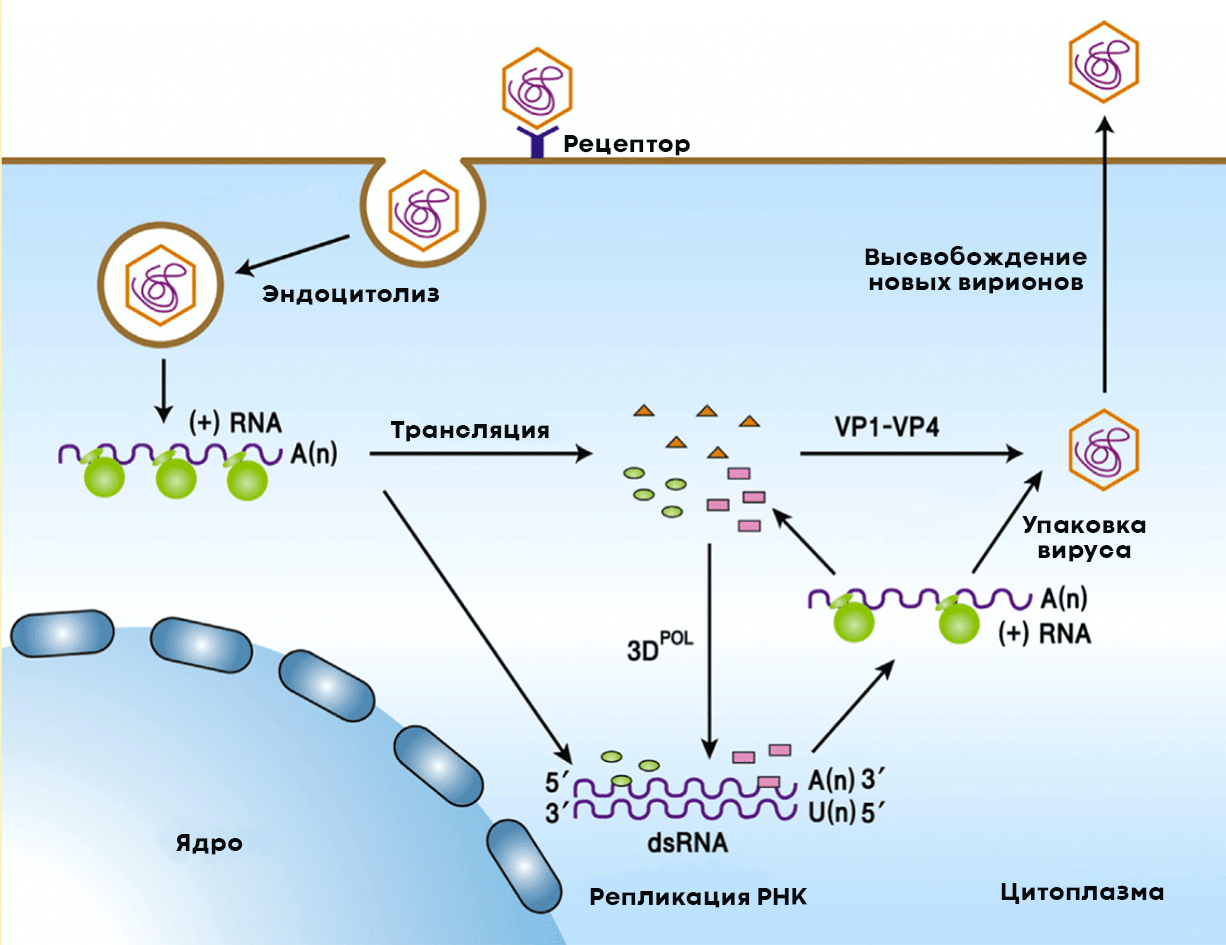
После проникновения в цитоплазму клетки-хозяина полиовирус начинает размножаться (рис. 7). Для этого ему нужно копировать собственную РНК, но для начала — запастись вирусными структурными и неструктурными белками. Последние необходимы вирусу для копирования собственного генома. Из копий вирусной РНК и структурных белков в зараженных клетках формируются новые вирионы. Цикл репродукции вируса в клетке занимает всего семь часов.
Полиомиелитная рулетка
У полиомиелита два пути передачи. В развивающихся странах полиомиелитом преимущественно заражаются через загрязненную еду и воду, куда полиовирус попадает из фекалий заболевших, а в регионах с высоким уровнем гигиены на первый план выходит заражение через капельки слюны при кашле, чихании или разговоре.
Человек начинает выделять полиовирус через 2–4 дня с момента заражения. В носоглотке он сохраняется в течение 1–2 недель [7]. Одна из причин, почему полиовирус такой живучий, заключается в его способности долго присутствовать в кишечном тракте и выделяться в окружающую среду от нескольких недель до месяцев. Если учесть, что инфекция может быть бессимптомной, становится понятно — оградить ребенка от заражения полиомиелитом очень непросто.
Попадая в наш организм через рот, вирус проникает в слизистую оболочку верхних дыхательных путей и желудочно-кишечного тракта и начинает активно размножаться в носоглотке (в аденоидах и миндалинах) и тонком кишечнике (в лимфатических узлах — пейеровых бляшках). Инкубационный период болезни составляет от 3 до 35 дней, в среднем — 7–10 дней.
Сценариев дальнейшего развития инфекции несколько.
Около 72% людей, заразившихся вирусом, не чувствуют никаких симптомов, полиомиелит для них проходит незаметно. Есть и те (их примерно 24%), у кого по завершении инкубационного периода в течение нескольких дней поднимается температура, появляется расстройство пищеварения, боль в горле, тошнота, головная боль и усталость. Но в оставшихся случаях полиомиелит так просто не сдается [8].
Довольно редко, примерно у 4% заразившихся, из-за полиовируса возникает асептический менингит — воспаление оболочек головного мозга. Он тяжело переносится, сопровождаясь лихорадкой, сильными головными болями и рвотой, но, как правило, заканчивается выздоровлением.
Наконец, примерно у каждого двухсотого заболевшего вирус с лимфой и кровью перемещается к нервным волокнам и попадает в двигательные нейроны в спинном мозге, стволе головного мозга или в моторной коре (рис. 8). Это приводит к разрушению нейронов и последующему вялому параличу мышц: человек больше не может ими управлять, и мышцы со временем атрофируются. Обычно под полиомиелитом (polios — «серый», myelos — «спинной мозг») понимают как раз паралитическую форму заболевания.
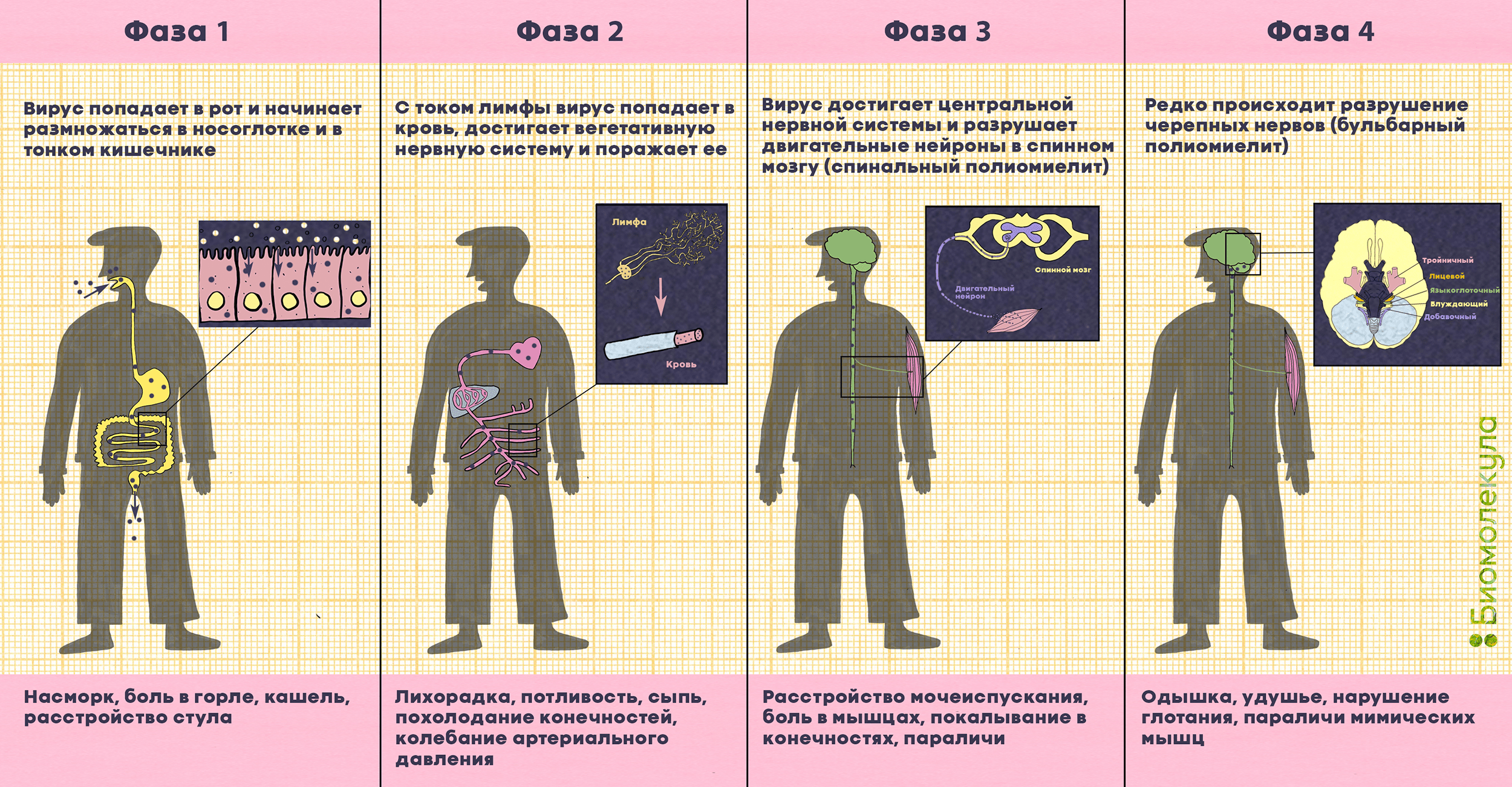
На ранней стадии (сразу после окончания инкубационного периода) паралитический полиомиелит проявляется в виде повышенной температуры, головной боли, скованности в спине и шее, слабости и болях в мышцах. У больных могут возникать трудности с глотанием и мочеиспусканием, запор, иногда отмечается потеря поверхностных и глубоких рефлексов (например, мышечных — сокращений мышц руки или ноги при ударе по сухожилию). Паралич, как правило, развивается через 1–10 дней после начала первых симптомов и прогрессирует в течение 2–3 дней.
Паралитические формы полиомиелита принято разделять на спинальную и бульбарную. Спинальный полиомиелит характеризуется поражением двигательных нейронов спинного мозга, которые отвечают за движение мышц, в том числе туловища, конечностей и межреберных. Бульбарный полиомиелит более редкий (2% от всех случаев паралитического полиомиелита). Он возникает, когда полиовирус добирается до черепных нервов в бульбарной области ствола головного мозга (отдела, который соединяет кору головного мозга со спинным мозгом). Разрушение этих нервов ослабляет соответствующие им мышцы, вызывая затруднение дыхания, речи и глотания. Если вирус разрушает нервные клетки, контролирующие мышцы диафрагмы, пациент перестает дышать самостоятельно, таких больных подключают к аппаратам искусственного дыхания. Частое осложнение бульбарного полиомиелита — энцефалит, воспаление головного мозга.
Примерно в 19% всех случаев паралитического полиомиелита болезнь затрагивает нервы и в спинном, и в головном мозге. Этот смешанный вид заболевания называют бульбарно-спинальным полиомиелитом. Пораженными в этом случае часто оказываются верхняя часть шейного отдела спинного мозга, нервы, обеспечивающие глотание, и диафрагмальный нерв. Помимо трудностей с дыханием, при бульбарно-спинальной форме могут наблюдаться параличи конечностей и проблемы с сердцем.
Паралич, вызванный полиомиелитом, может привести к смерти, если повреждены нервы, важные для обеспечения жизненно необходимых функций (например, дыхания). Каждые 2–20 человек из 100 с проявившимся параличом умирают. Чаще всего причиной смерти служит отказ мышц диафрагмы (рис. 9а). Соответственно, бульбарная и бульбарно-спинальная формы полиомиелита самые опасные.
То, какие параличи возникнут у больного и насколько тяжелыми они будут, зависит от степени поражения вирусом нервной системы. Полные параличи возникают при гибели не менее четверти нервных клеток спинного мозга. Паралич после полиомиелита чаще всего остается на всю жизнь. Частичное или полное восстановление двигательной активности возможно, но для этого необходима длительная реабилитация, за время которой здоровые мышцы постепенно возьмут на себя работу парализованных (рис. 9б).
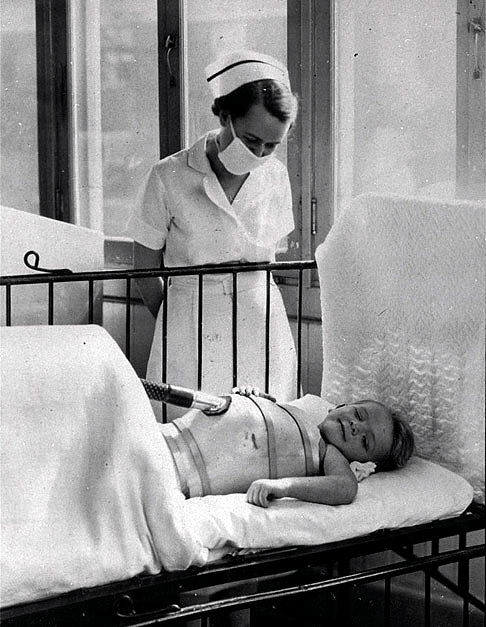
Рисунок 9а. Последствия полиомиелита: пациент госпиталя Гордон Джексон, подключенный к портативному респиратору, облегчающему дыхание (1937 год, Торонто). Большинство смертей из-за полиомиелита вызвано разрушением нервов, ответственных за дыхание.

Будет ли заразившийся ребенок или взрослый парализован, никогда нельзя сказать заранее. Это всегда игра в рулетку. Однако с повышенным риском параличей из-за полиомиелита связывают недоедание, иммунодефицитные состояния, физические нагрузки, хронические болезни и повреждения скелетных мышц. В группу риска по полиомиелиту входят также беременные женщины. У них выше риск и заражения, и осложнений [9].
Вероятность развития паралитического полиомиелита увеличивается с возрастом, так же, как и степень паралича. У детей поражение полиовирусом центральной нервной системы чаще всего заканчивается непаралитическим менингитом, паралич возникает в одном из 1000 случаев. При этом чаще всего он ограничивается поражением одной из ног. У подростков и взрослых паралич из-за полиомиелита возникает гораздо чаще, в одном из 75 случаев, и чаще бывает обширным, распространяясь на грудную клетку, область живота и конечности.
Важен также серотип возбудителя. Самые высокие показатели паралича (1 из 200 случаев заражения) связаны с полиовирусом типа 1, а самые низкие (1 из 2000) — с типом 2 [10]. Вирус типа 3 вызывает паралич в 1 случае из 1150. К сожалению, единственный до сих пор циркулирующий первый серотип дикого полиовируса — самый опасный.
Кроме параличей, острый полиомиелит грозит разного рода осложнениями, включая пневмонию, нарушение расправления легких (ателектазы), воспаление сердечной мышцы (миокардит), а при бульбарной форме — острое расширение желудка, желудочно-кишечные расстройства, язвы и непроходимость кишечника [11]. Пострадавшие от полиомиелита многие годы могут страдать из-за повреждений опорно-двигательной системы: сколиоза, защемлений нервов и патологий сухожилий в области спины. Даже после полного выздоровления, через 15–40 лет перенесенная инфекция может спровоцировать новые осложнения: повышенную усталость, боли, проблемы с дыханием, ослабление мышц и потерю их функциональности. Постполиомиелитный синдром встречается у 25% людей, переболевших паралитической формой болезни.
Полиомиелит и Фрида Кало
Фрида Кало является, пожалуй, самой знаменитой мексиканской художницей. Большую роль в творческом становлении Фриды сыграло ее слабое здоровье (рис. 10).



Рисунок 10а. Фрида Кало и полиомиелит: автопортрет Фриды Кало, 1931 год. Рисунок, нарисованный во время четырехлетнего пребывания художницы в Соединенных Штатах, изображает перевязанную изъязвленную правую ногу.
Еще до того, как попасть в аварию (автобус, в котором она ехала, столкнулся с трамваем), перевернувшую всю ее жизнь, Фрида Кало переболела полиомиелитом. В 6 лет он стоил ей нескольких месяцев в постели и больной ноги. Правая нога Фриды всю жизнь оставалась слегка деформированной. Она была короче левой, поэтому художнице приходилось носить ботинки с разной толщиной подошвы. В детстве художница подвергалась нападкам со стороны сверстников из-за своего физического дефекта, и это оказало значительное влияние на и без того впечатлительного ребенка.
Со временем проблемы с ногой усугублялись, у Фриды даже начали появляться трофические язвы. Скорее всего, причиной этому, помимо полиомиелита, были врожденные неврологические патологии.
Впоследствии Фрида Кало перенесла несколько операций на поврежденной ноге, что в конечном итоге закончилось гангреной и ампутацией ноги ниже колена в 1953 году незадолго до ее смерти [12].
Диагностика и лечение
Диагностируют полиомиелит по наличию в мазке из горла или кале вирусной РНК. Кроме того, выявить инфекцию может помочь анализ крови на антитела, специфические к полиовирусу. Обнаружение вируса в спинномозговой жидкости является явным, но не обязательным признаком паралитического полиомиелита.
Если полиовирус выделен у пациента с параличом, врачи дополнительно выясняют, является ли этот вирус диким или вакцинным (да, вакцинный вирус очень редко может вызвать настоящую болезнь). Определить источник вируса важно, потому что на каждый зарегистрированный случай паралитического полиомиелита, вызванного диким полиовирусом, приходится до нескольких тысяч бессимптомных носителей. Каждый случай заражения диким вирусом — это угроза эпидемии.
Эффективного лечения от полиомиелита нет. Всё, что могут сделать врачи для уже заразившегося пациента — облегчить симптомы и снизить риск осложнений. Для того чтобы избежать развития вторичных инфекций в ослабленном организме, используют антибиотики, в остальном поддерживающая терапия включает обезболивающие, физические упражнения, массажи и полноценное питание. Иногда применяют хирургическое лечение, например, удлинение сухожилий и пересадку нервов.
Борьба с полиомиелитом
Полиомиелит начал приобретать характер эпидемий в конце XIX — начале XX веков, когда медицина активно развивалась, а уровень жизни в городах становился всё выше. Внимание к личной и общественной гигиене в то время способствовало снижению распространения энтеровирусов, в том числе полиовирусов, среди младенцев, и всё больше детей оказывались лишены естественно приобретенного иммунитета к возбудителям инфекций. В то же время, благодаря сокращению детской и старческой смертности население многих стран росло, и количество восприимчивой к полиомиелиту молодежи быстро увеличивалось. При этом сама болезнь и способы ее передачи все еще были не до конца ясны, бороться с полиомиелитом было сложно, и он стал настоящим бедствием: от него умирали тысячи детей, а десятки тысяч становились инвалидами. В начале 1950-х годов в США вспышки полиомиелита ежегодно вызывали около 15 000 случаев паралича при численности населения чуть больше 150 млн. В 1952 году там был зафиксирован пик заболеваемости — 57 тыс. случаев и 21 тыс. паралитических больных [13].
Действенных способов лечения не было, как нет их и сейчас. Заболевшие дети попадали в госпитали, где проводили месяцы, а иногда годы. В редких случаях последствия паралича сглаживались длительной реабилитацией, но большинство детей оставались парализованы частично или полностью на всю оставшуюся жизнь. Если вирус затрагивал мышцы диафрагмы, больных помещали в металлические ящики, где работе легких помогала попеременная смена давления внутри. Такие аппараты получили название «железные легкие».
Железные легкие
В истории борьбы с полиомиелитом большую роль играют аппараты, поддерживающие дыхание тяжелых больных. Они не всегда были такими, как сейчас. В середине прошлого века жертв полиовируса спасали так называемые «танковые» аппараты искусственной вентиляции легких (рис. 11), куда человека помещали целиком. Суть их работы сводилась к смене давления внутри аппарата, которая заставляла воздух попеременно наполнять и освобождать легкие.

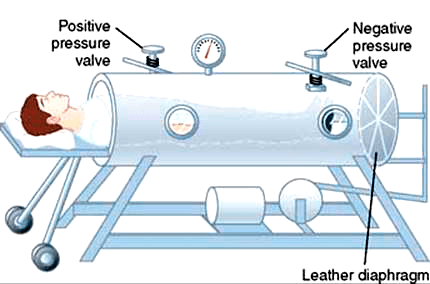
Рисунок 11а. «Железные легкие»: танковый аппарат искусственной вентиляции легких. Пострадавший от полиомиелита мог нуждаться в таком аппарате несколько недель или лет, иногда — всю жизнь.
«“Железные легкие” — дыхательные аппараты для жертв полиомиелита»
Существовало множество модификаций «железных легких», которые заполняли целые отделения в больницах (рис. 12).

Очевидно, что узникам «танков» было нелегко. Они не могли покинуть их без подключения к другому аппарату, помогающему дышать, им приходилось всё время лежать на спине и принимать жидкое питание через трубки. Аппарат же мог выключиться из-за перебоев в электропитании. Но, что самое главное, использование «железных легких» не могло вылечить пациентов. Дети, пораженные вирусом, взрослели, жили и умирали, скованные металлической конструкцией. После года, проведенного в аппарате, пациенты уже не могут вернуться к нормальной жизни из-за атрофии дыхательных мышц. К современному электростимулятору таких пациентов подключить уже нельзя: их мышцы настолько слабы, что не могут работать даже с помощью искусственной стимуляции.
Сегодня обладателей «железных легких» осталось совсем мало. Прожив всю жизнь в аппарате, они постоянно находятся в страхе, опасаясь его поломки. Часто сами больные или их родственники год за годом озабочены поиском новых деталей для устаревших конструкций аппаратов. Например, Марта Лиллард, одна из немногих, все еще использующих громоздкую капсулу в 2020 году, собрала ее из двух аппаратов, один из которых обошелся ей в 8 тысяч долларов. Если женщина ненадолго покидает «железные легкие», ее дыхание поддерживает портативный механический вентилятор (рис. 13).
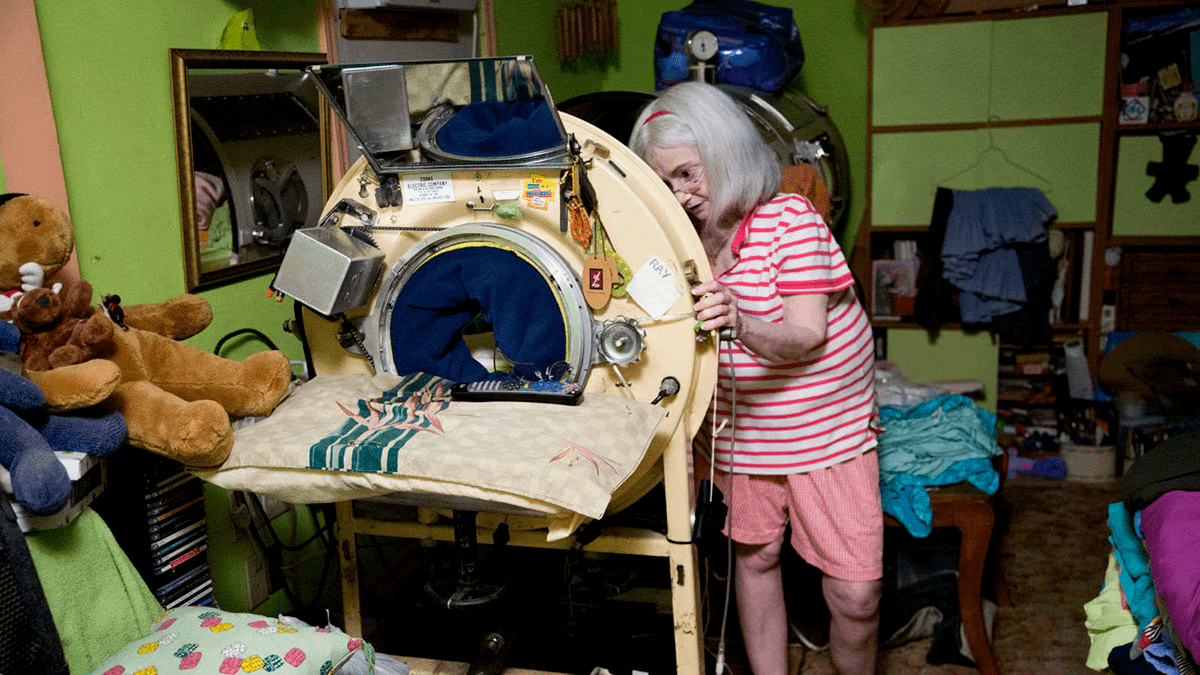
Профилактика полиомиелита включала изоляцию больных, дезинфекцию помещений и частое мытье рук. Все эти меры давали незначительный эффект из-за большого числа бессимптомных носителей вируса, которых сложно выявить. Распространение получали и более необычные подходы. Например, в 1930-е годы в США остановить вспышки полиомиелита пытались, используя раствор сернокислого цинка, вводимый интраназально для прижигания слизистой. Метод был основан на ошибочном предположении, что полиовирусы достигают нервной системы через обонятельный нерв [14].
В 1921 году жертвой полиомиелита стал будущий президент США, Франклин Рузвельт (рис. 14). Во многом благодаря этому общественное мнение о полиомиелите резко изменилось: его перестали считать исключительно детской инфекцией. Позднее, в 1938 году, Рузвельт основал Фонд борьбы с паралитическим полиомиелитом (The National Foundation for Infantile Paralysis) с целью поддержать научные исследования и оказать помощь пострадавшим от болезни. Вскоре фонд перерос в некоммерческую благотворительную организацию March of Dimes — «Марш гривенников», — собирающую пожертвования (рис. 15). Важен был каждый цент.
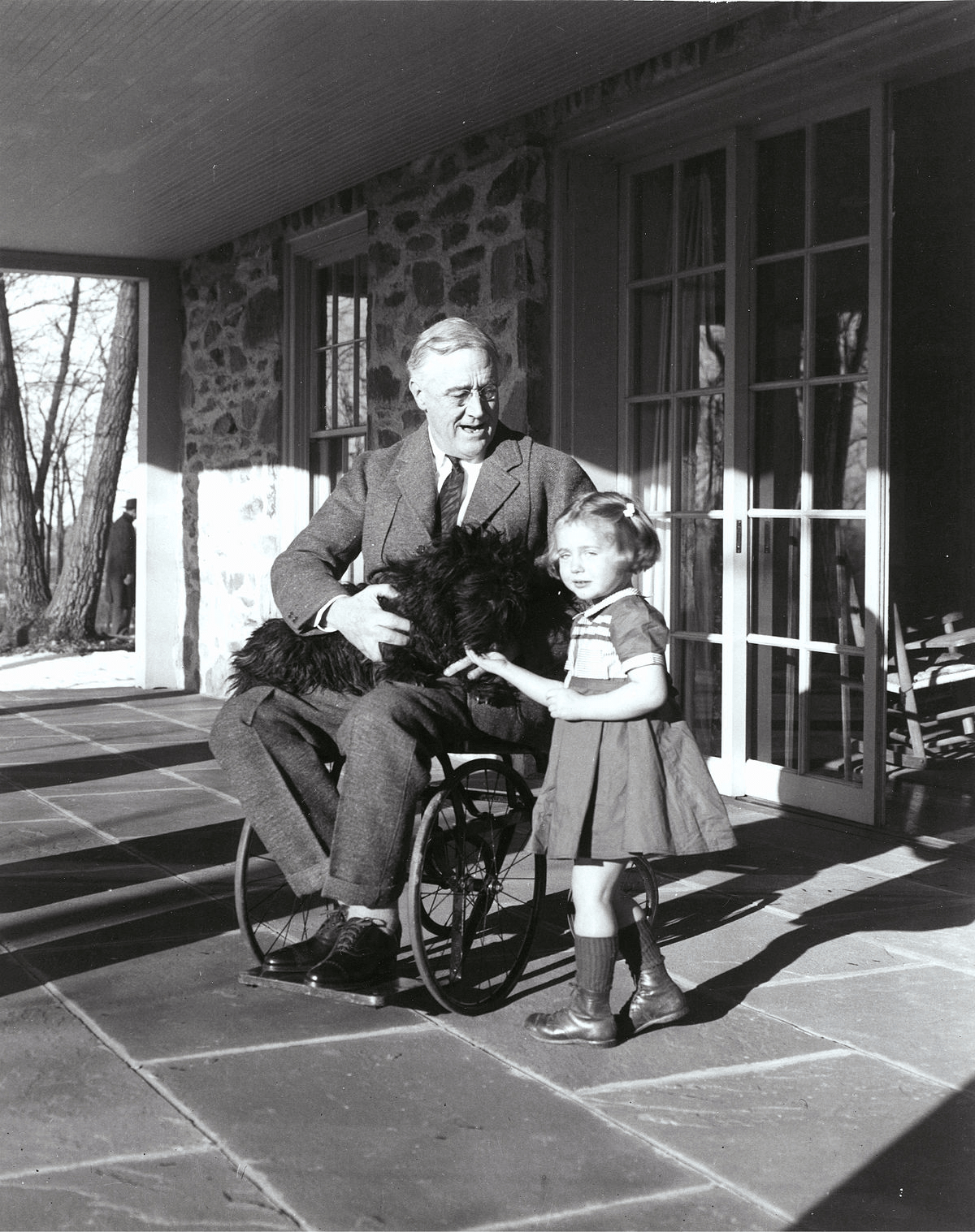


Рисунок 14. Президент США Франклин Рузвельт в инвалидном кресле. Он заболел полиомиелитом в 39 лет.
Усилиями March of Dimes (фонд финансировал исследования вакцин) в середине 1950-х годов в США эпидемию удалось переломить: Джонас Солк разработал первую инактивированную вакцину против полиомиелита.
Сегодня, в эпоху победы над полиомиелитом, целью организации является сохранение здоровья детей, а ее основные усилия сосредоточены на профилактике преждевременных родов — основной причины детской смертности в мире с 2005 года.
Глобальная инициатива по борьбе с полиомиелитом
Крупные вспышки полиомиелита в середине XX века были настолько страшными, что побудили страны в 1988 году создать Глобальную инициативу по борьбе с этой инфекцией — The Global Polio Eradication Initiative, GPEI (видео 1). Сегодня это объединение включает правительства 200 стран, которым помогают пять партнеров: Всемирная организация здравоохранения (ВОЗ), Ротари клуб, Центры США по контролю и профилактике заболеваний (CDC), Детский фонд ЮНИСЕФ, Фонд Билла и Мелинды Гейтс и Альянс по вакцинам и иммунизации GAVI.
Международные усилия, направленные против распространения полиовирусов, привели к сокращению заболеваемости паралитическим полиомиелитом на 99%. Считается, что Инициатива помогла спасти около 16 миллионов людей, которые могли стать инвалидами, и 1,5 миллиона тех, кто мог бы погибнуть. В настоящее время Инициатива преследует цель ликвидировать полиомиелит полностью. Одним из важнейших направлений ее работы является дополнительная иммунизация населения против полиомиелита в эндемичных странах и регионах, где риск ввоза полиовирусов очень велик.
Одна болезнь, две вакцины
Сегодня для всех очевидно, что одержать победу над полиомиелитом никогда бы не удалось, если бы не были разработаны противополиомиелитные вакцины. Первой такой вакциной стала инактивированная формалином вакцина Джонаса Солка (ИПВ — инактивированная полиомиелитная вакцина) на основе диких полиовирусов. Ее начали широко применять в США в 1955 году. Вирусы для вакцины выращивали на почечной ткани обезьян. ИПВ была действенна, но имела явные недостатки: низкую эффективность, высокую стоимость и необходимость введения нескольких инъекций для достижения результата. Производство вакцины Солка было небезопасным, дикие вирусы из лаборатории могли заразить кого-нибудь или даже попасть в вакцину в случае нарушения процесса инактивации .
Так и случилось в США, когда вакцину только начали выпускать. Препарат компании Cutter Laboratories, содержащий живые дикие вирусы полиомиелита, ввели 200 тыс. детей. В результате у 204 детей развился паралич, 10 человек умерли [15].
Кроме того, ИПВ провоцировала недостаточную выработку местного иммунитета в кишечнике. В результате привитые дети, хоть и не болели, всё еще оставались переносчиками инфекции. Тем не менее вакцина Солка помогла снизить заболеваемость полиомиелитом в несколько раз.
Важным достижением на пути ликвидации полиомиелита стало создание вслед за ИПВ живой оральной полиовакцины (ОПВ). Получить живую вакцину было гораздо сложнее, чем инактивированную. Для этого требовалось ослабить все три типа дикого вируса, а после доказать эффективность и безопасность полученного препарата . Исследование вакцины проводили на приматах, вводя вакцину в головной и спинной мозг животных. При этом невозможно было точно судить о том, как будущая вакцина поведет себя при использовании на людях.
Подробнее о том, как получают живые ослабленные (аттенуированные) вакцины, читайте в одной из предыдущих статей нашего спецпроекта — «Разработка вакцин: чем и как имитировать болезнь?» [16]. — Ред.
В основу ОПВ легли ослабленные штаммы полиомиелита LS-c 2ab/KP2 (тип 1), P712 Ch 2ab/KP2 (тип 2) и Leon 12a1b/KP3 (тип 3), полученные американским вирусологом Альбертом Сэйбиным в 1956 году [17]. Кроме него, над живой вакциной для компании Lederle работали польский и американский вирусологи Хилари Копровский и Геральд Кокс. Они ослабляли вирусы, вводя их в мозг хлопковых крыс. Копровский получил вакцину раньше Сэйбина и даже раньше Солка — в 1950 году . Он добился ее испытаний в Бельгийском Конго и в Польше, но в США она так и не получила признания [18].
Вообще-то первые попытки создать живую вакцину против полиомиелита начались гораздо раньше [19], а в 1930-е годы идея о полиомиелитных вакцинах чуть было не оказалась похороненной из-за губительных экспериментов Джона Кольмера, который испытал опасный прототип живой вакцины на 10 тыс. детей. Подробнее об этом читайте в статье «История вакцинации» [20] нашего спецпроекта. — Ред.
Альберт Сэйбин проводил ослабление вирусов на культурах ткани почек обезьян макак резус, после чего отбирал пригодные для вакцины штаммы вируса. Они были не способны вызвать заболевание, но провоцировали иммунный ответ организма, защищая его от диких полиовирусов в будущем.
Вирус полиомиелита 1 типа до появления вакцин вызывал около 80% всех паралитических случаев болезни, поэтому ему при разработке уделялось повышенное внимание. Для создания вакцинного штамма вируса 1 типа Сэйбин использовал высоковирулентный штамм Mahoney, который был ослаблен путем многократного пересева на культурах почечных клеток и на коже обезьян. Аттенуированный штамм Сэйбина 2 типа был получен из дикого штамма P712, а вакцинный вирус 3 типа — из дикого штамма Leon [21].
Важную роль в создании и внедрении ОПВ сыграли российские врачи-вирусологи.
Отечественные ученые, победившие полиомиелит
Первые эпидемии полиомиелита в Прибалтике, Казахстане и Сибири начались в 1949 году, а в 1950 году в СССР было зарегистрировано более 17 тысяч случаев болезни [22]. В 1957 году, после поездки в Америку советских вирусологов — Михаила Петровича Чумакова, Марины Константиновны Ворошиловой (жены М.П. Чумакова) и Анатолия Александровича Смородинцева (рис. 16), — инактивированную вакцину Солка начали производить и в СССР, но для победы над болезнью этого было недостаточно. Необходим был более эффективный, дешевый и удобный в применении препарат. Его можно было получить в короткий срок, используя уже созданные Сэйбиным ослабленные штаммы вируса.

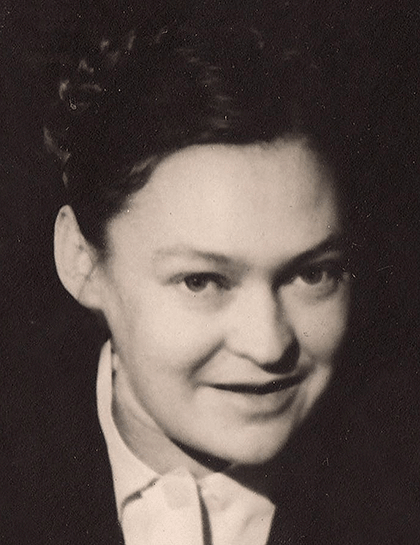

Рисунок 16а. Советские вирусологи, наладившие первое массовое производство живой оральной полиовакцины в СССР: Михаил Петрович Чумаков (1909–1993 гг.) за работой. Российский ученый-вирусолог, внесший вклад в борьбу с клещевым энцефалитом, полиомиелитом и множеством других инфекционных заболеваний. В 1950 году возглавил Институт вирусологии Ивановского, который позднее был переименован в Институт полиомиелита и вирусных энцефалитов СССР. Разработал и внедрил живую оральную полиовакцину, в основу которой легли аттенуированные штаммы Альберта Сэйбина. Эта вакцина успешно использовалась в 60 странах мира.
«Михаил Петрович Чумаков — советский вирусолог»
Осенью 1956 года Анатолий Смородинцев получил у Альберта Сэйбина живые ослабленные вирусы, после чего в Институте экспериментальной медицины АМН СССР и в Институте полиомиелита и вирусных энцефалитов СССР (сегодня — Федеральный научный центр исследований и разработки иммунобиологических препаратов им. М.П. Чумакова РАН), который возглавлял Михаил Чумаков, началось тестирование живой вакцины. Ученые испытывали препарат сперва на себе, потом — на родных, ведь вакцина предназначалась детям. Первым маленьким пациентом, получившим вакцину, стала пятилетняя внучка Смородинцева.
Анатолий Александрович Смородинцев решился: он привил вакцину своей любимой внучке. Во имя здоровья миллионов детей это сделал человек, который лучше, чем кто-либо представлял последствия возможной неудачи. Это был подвиг во имя миллионов людей.А.Б. Прутко «Укрощенный вирус»
Чтобы доказать безвредность выделяемых человеком вакцинных вирусов, коллектив Смородинцева осуществлял их передачу от человека к человеку. Новые поколения вирусов выделяли из кишечника привитых, выращивали на культуре клеток и снова вводили в качестве вакцины. В результате был показан высокий уровень безопасности препарата.
В 1958 году успешно провели клинические исследования новой пероральной вакцины и доказали ее эффективность. В 1959 году масштабные испытания живой вакцины прошли в Литовской и Эстонской ССР, где заболеваемость полиомиелитом была очень высокая [21]. С января по май вакциной Сэйбина были привиты около 10 млн детей в 11 республиках Союза [23].
Результаты превзошли все ожидания — новые случаи инфекции регистрировались всё реже, а вакцинация в стране приобрела массовый характер. В 1960 году в СССР было привито 72 млн человек. Вакцину было легко вводить, она не требовала инъекций, а цена ее была гораздо ниже, чем у ИПВ. Благодаря отечественным ученым, полиомиелит в стране удалось остановить за 1,5 года [24].
После этой победы советскую вакцину начали импортировать другие страны. За всё время работы на базе Института полиомиелита было изготовлено около 6 млрд доз ОПВ. За научную разработку, организацию массового производства и внедрение в медицинскую практику живой противополиомиелитной вакцины М.П. Чумакову и А.А. Смородинцеву в 1963 году присудили Ленинскую премию. Тогда же трехкомпонентная оральная полиовакцина на базе штаммов Сэйбина была сертифицирована в США [25]. Задержка с внедрением живой вакцины в Америке, среди прочего, была связана с недоверием американского научного сообщества к российским ученым и их методам оценки безопасности вакцины.
ИПВ и ОПВ сегодня
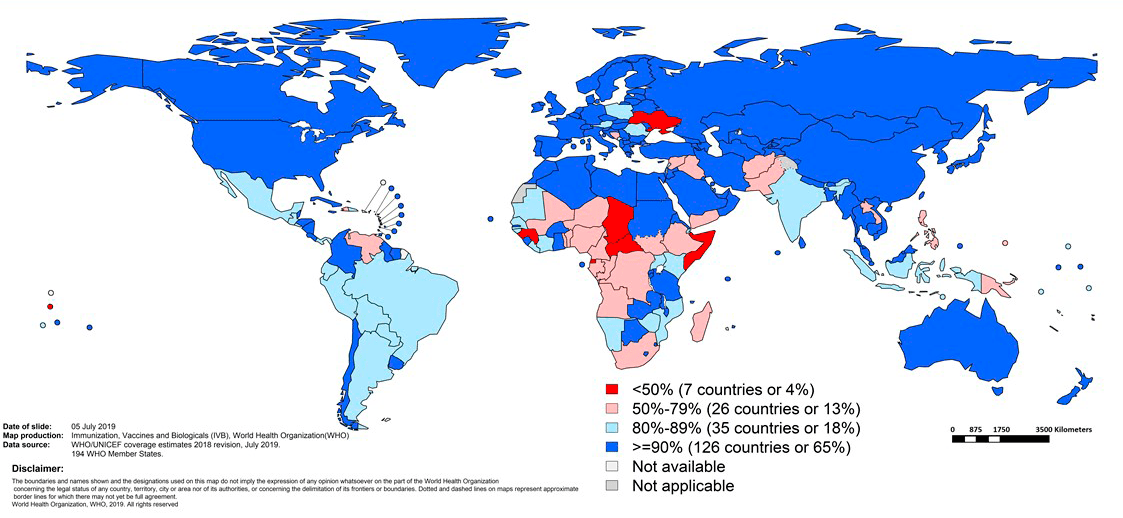
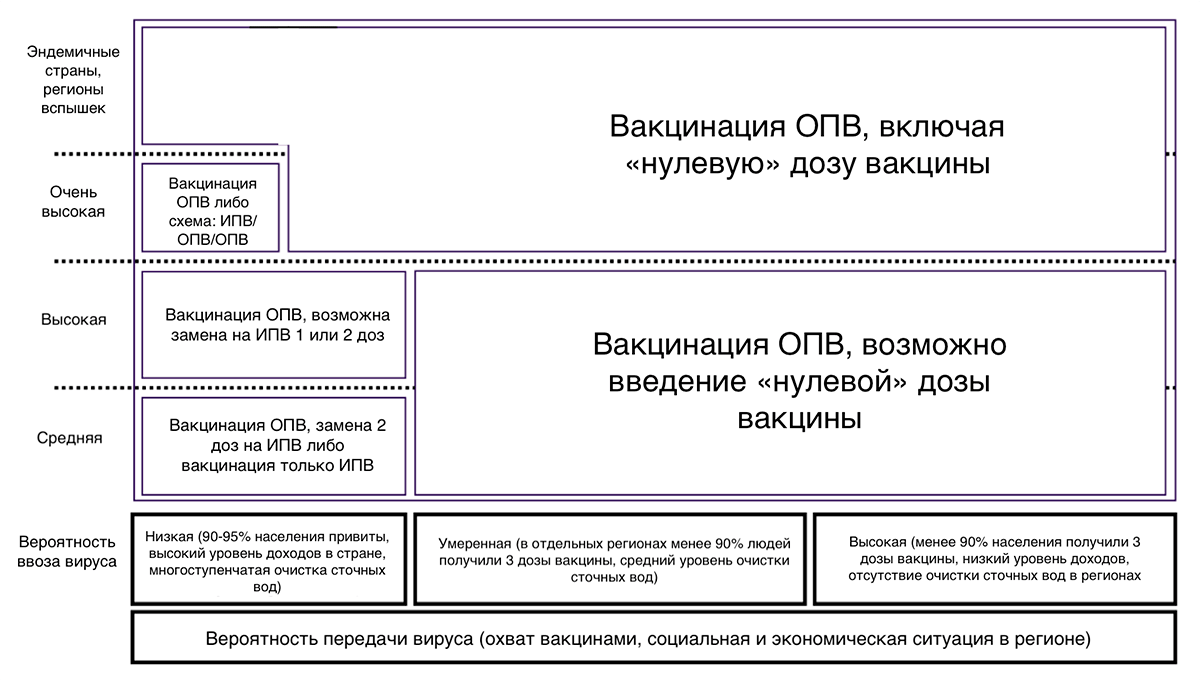
Для профилактики полиомиелита сегодня используют и живые пероральные, и инактивированные вакцины, вводимые подкожно или внутримышечно. Для лучшей защиты ВОЗ рекомендует введение минимум трех доз (рис. 17), а также последующую ревакцинацию. К сожалению, пока 3 дозы вакцины получают не все дети.
Существует пять видов вакцин против полиомиелита, которые используют во всем мире, включая:
- инактивированную полиовакцину (ИПВ) против трех серотипов полиовируса;
- бивалентную оральную полиовакцину (защищает от полиовируса 1 и 3 типов);
- моновалентные пероральные вакцины (защищают от отдельных типов полиовируса, 1 или 3).
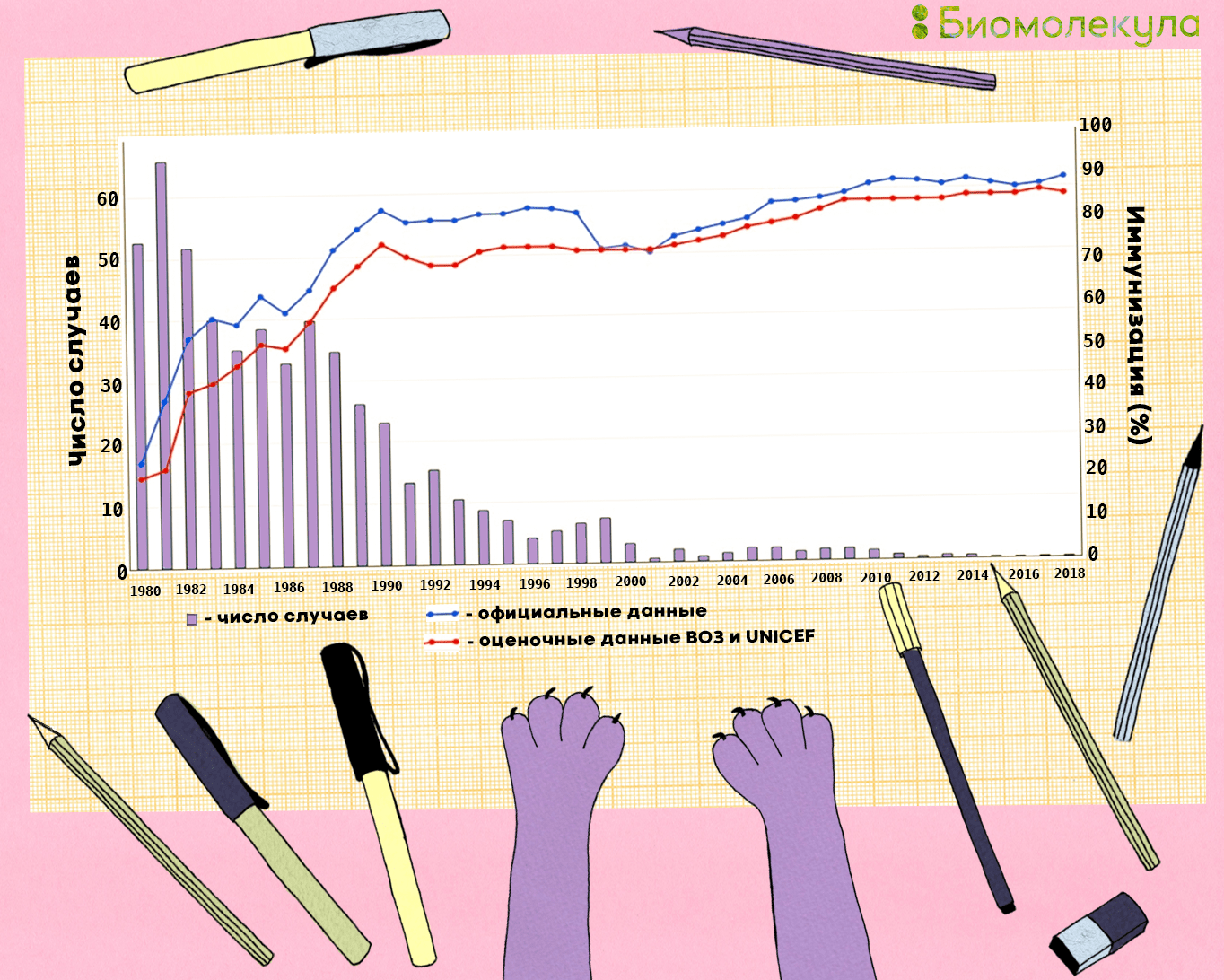
Их широкое использование позволило добиться больших успехов в области ликвидации паралитического полиомиелита (рис. 18).
Инактивированная трехкомпонентная вакцина (ИПВ)
ИПВ, созданная в 1955 году Солком, была существенно доработана. Если раньше ее эффективность не превышала 80%, то сейчас она близка к 100% (после введения двух доз — около 89%) [26], [27], а иммунитет сохраняется на всю жизнь. Вакцина всё еще не вызывает интенсивного местного иммунного ответа в слизистой кишечника, из-за чего привитые только ИПВ часто продолжают выделять вирус с калом [28], но подавляет размножение вируса в носоглотке [29], [30]. Это значит, что ИПВ способна сдерживать распространение инфекции в регионах, где основной тип передачи вируса — воздушно-капельный.
В основе ИПВ обычно лежат дикие полиовирусы Mahoney (тип 1), MEF-1 (тип 2) и Saukett (тип 3), которые выращивают в культуре клеток Vero или диплоидных клеток человека, после чего инактивируют формальдегидом. При производстве ИПВ строго контролируется концентрация вирусов каждого типа — от этого зависит эффективность вакцины. ИПВ может быть самостоятельным препаратом или входить в состав многокомпонентных вакцин [31].
Инактивированная полиовакцина вводится внутримышечно или подкожно. Она признана более безопасной, чем ОПВ, так как не несет в себе даже малейшего риска развития вакцино-ассоциированного паралитического полиомиелита. Среди известных побочных эффектов после введения ИПВ — покраснения (0,5–1%), уплотнения (3–11%) и болезненность (14–29%) в месте инъекции.
Большим недостатком ИПВ, несмотря на строгий контроль производства, до сих пор остается риск попадания в вакцину живого дикого вируса. В некоторых странах, например, в Японии и Китае, уже лицензированы ИПВ на базе аттенуированных штаммов Сэйбина [32], [33]. Такие препараты в перспективе можно производить в регионах, где заводы не могут обеспечить безопасное получение традиционных ИПВ.
Интересным способом получить совершенно безопасные ИПВ может стать наработка пустых вирусных капсидов, несущих все антигены вируса, но не вирусную РНК [34]. Это станет возможным, если такие «пустые» вирусы получится стабилизировать и производить в больших количествах.
Одновременно с этим, специалисты продолжают разрабатывать новые подходы к получению ИПВ, которые помогут снизить их стоимость и увеличить иммуногенность. Такие исследования затрагивают процессы выращивания вирусов [35], методы введения вакцин [36] и использование новых адъювантов [37], [38].
Живые оральные полиовакцины
Современные живые оральные полиовакцины (ОПВ) содержат ослабленные штаммы Сэйбина типов 1, 2 и 3, прошедшие дополнительные пассажи и выращенные на первичных клетках почек африканских зеленых мартышек [39].
Эффективность ОПВ приближается к 100% после трех доз вакцины и зависит от выбранного графика вакцинации, состава вакцины (считается, что трехкомпонентная ОПВ, от которой отказались в 2016 году, была менее эффективна, чем двухкомпонентная вакцина [40]) и условий жизни в регионе, где проходит иммунизация. Дети, испытывающие недостаток питания, чаще остаются не защищенными даже после трех доз ОПВ [41], [42]. Эта проблема касается преимущественно бедных регионов и решается путем введения бустерных доз ИПВ [43]. Иммунитет к заболеванию после вакцинации стойкий и, вероятно, остается на всю жизнь [44].
Важное преимущество живых вакцин — формирование местного иммунного ответа в кишечнике, что делает невозможным размножение диких полиовирусов в организме привитых детей. ОПВ также эффективны против полиомиелита в регионах с низким уровнем иммунизации. Вакцинный вирус способен передаваться от привитого ребенка к непривитым через грязные игрушки и посуду, защищая и их тоже. Привитый ребенок выделяет в окружающую среду вакцинный вирус в течение нескольких недель [45].
ОПВ, как и другие живые вакцины, воздействуют на врожденный иммунитет. В последние годы все больше работ подтверждают неспецифический защитный эффект после вакцинации ОПВ, который снижает смертность от всех причин [46]. Это свойство живой вакцины может стать аргументом против отказа от нее в будущем.
Главным осложнением после ОПВ признан вакцино-ассоциированный полиомиелит (ВАПП), не отличимый от дикой инфекции.
ВАПП и ВРПВ и как с ними бороться
Оральные полиовакцины (ОПВ) содержат в себе ослабленный, но всё еще живой вирус полиомиелита. К сожалению, в очень редких случаях (3–4 случая на 1 млн впервые привитых ОПВ ) вирусы в составе ОПВ могут вызывать у детей вакцино-ассоциированный паралитический полиомиелит (ВАПП), неотличимый от настоящего. Обычно это происходит, когда вакцинацию начинают сразу с ОПВ, причем в 40% случаев его причиной становится вирус 2 типа, входящий в состав вакцины. Часто осложнение связано с наличием у ребенка иммунодефицита или тяжелых хронических заболеваний. ВАПП может возникнуть также у непривитых детей, которые контактировали с ребенком, получившим ОПВ.
В РФ с 1998 по 2014 гг. было зарегистрировано 127 случаев ВАПП [47].
Чтобы снизить риски возникновения ВАПП, в большинстве стран, включая Россию, первую прививку от полиомиелита детям делают с помощью ИПВ (в России — первые две), и только потом подключают ОПВ. Эта тактика была рекомендована ВОЗ для всех без исключения стран, начиная с 2016 года. Она давно зарекомендовала себя, например, в США (рис. 19) [48].
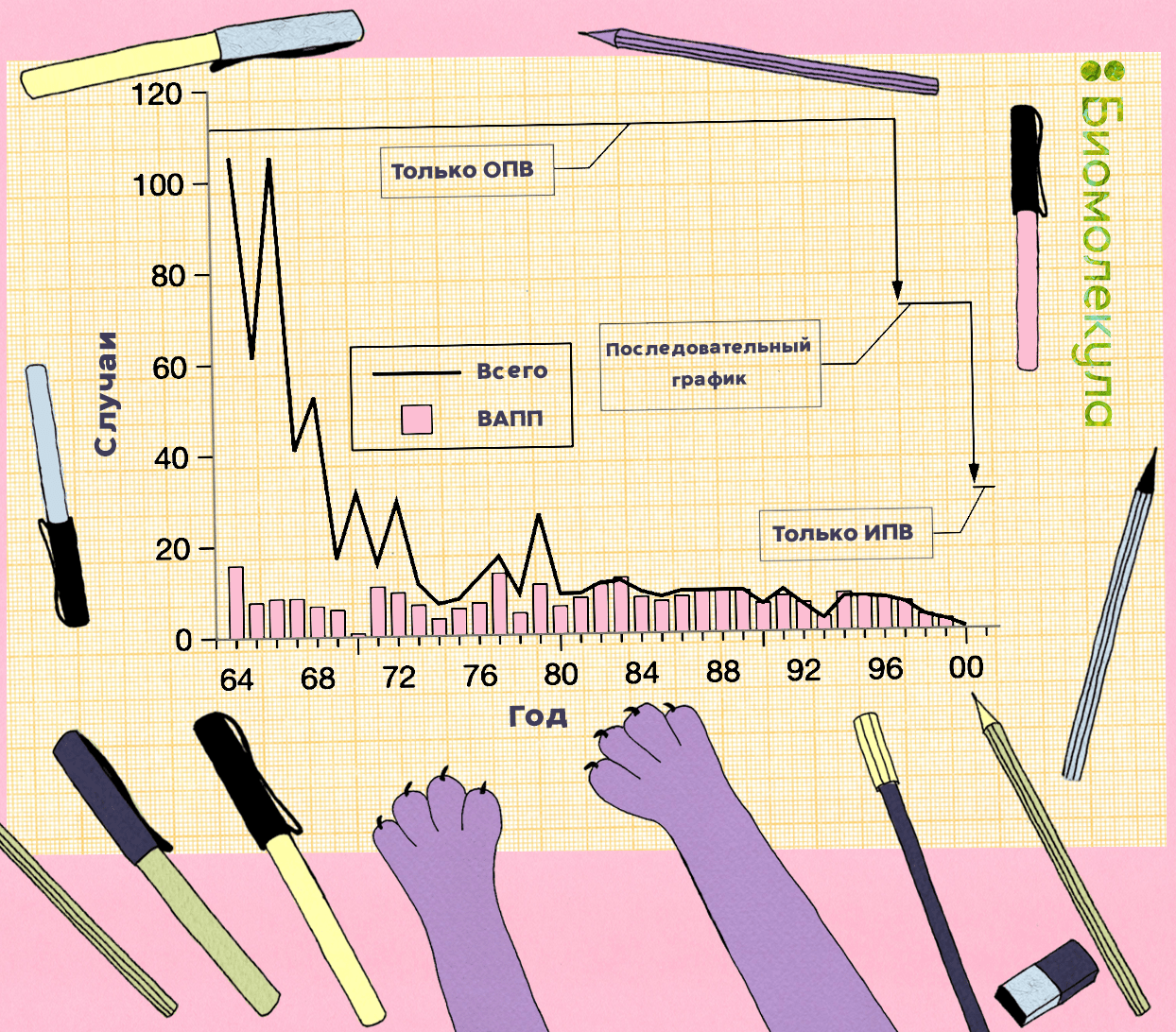
В России введение в 2008 году последовательной вакцинации ИПВ и ОПВ (2 дозы ИПВ + 1 доза ОПВ, последующая ревакцинация ОПВ) помогло снизить количество случаев ВАПП в 2,6 раза [47].
Другой действенный способ — отделять детей, которые еще не получили первую дозу ИПВ, от тех, кто уже привился ОПВ. Официальные правила разделения детей до и после получения оральной вакцины в России подразумевают еще более строгие меры (общение с привитыми ОПВ разрешается только после трех доз вакцины), но они, по словам специалистов, весьма спорные и трудновыполнимые, учитывая необходимость посещения детьми детских садов.
Наконец, чтобы сократить число случаев ВАПП из-за вакцинного вируса 2 типа, с 2016 года не используют трехкомпонентную ОПВ (от дикого полиовируса 2 типа защищаться больше не нужно, он был признан полностью истребленным в 2015 году). Но ВАПП не единственная причина отказа от трехвалентной живой вакцины.
Вторая проблема — вакцино-родственные полиовирусы, или ВРПВ.
Когда ОПВ дают ребенку, вакцинный вирус не вызывает болезни, но так же, как и дикий, размножается у ребенка в миндалинах и кишечнике и попадает в кровь, вызывая защитный иммунный ответ, а затем покидает организм.
Во время размножения, когда вирус создает множество собственных копий, часто происходят мутации, и в окружающую среду попадают уже немного измененные вакцинные штаммы — вакцино-родственные полиовирусы (ВРПВ) (видео 2). Некоторые ВРПВ могут снова оказаться опасными для человека и вызвать настоящий полиомиелит. Сегодня в мире циркулируют все три типа ВРПВ, но вирус 2 типа является причиной большинства случаев ВАПП.
Вакцинным вирусам легко распространяться, передаваясь от человека к человеку, в регионах, где много непривитых людей. Поэтому случаи ВАПП в основном наблюдаются именно там. Чем дольше ВРПВ живут, тем больше мутаций в них накапливается, и тем больше риск, что они вернут себе вирулентность (смогут вызвать заболевание).
Еще одна причина возникновения ВРПВ — длительное размножение вакцинного вируса в организме с ослабленным иммунитетом. Если иммунной системе не удается справится с ОПВ-вирусом за обычные 8–11 недель, он может жить в теле очень долго и постепенно мутировать, становясь опасным (такие ВРПВ называются иммунодефицит-ассоциированными).
Следует понимать, что ВРПВ — очень редкое явление. Дикие полиовирусы наносят несравнимо больший вред. За последние 10 лет и 10 млрд доз ОПВ было зарегистрировано около 1000 случаев полиомиелита, вызванного циркулирующими ВРПВ. Если бы ОПВ перестали использовать, за этот же срок от обычного полиомиелита пострадало бы примерно 6,5 миллионов детей. Иммунодефицит-ассоциированные ВРПВ вызывают полиомиелит еще реже: с 1962 года известно только 111 случаев [49].
Борьба со вспышками полиомиелита, вызванного циркулирующими ВРПВ, ничем не отличается от стратегии борьбы с диким полиомиелитом и заключается в усилении надзорных мер и повсеместной иммунизации детей в возрасте до пяти лет. Это помогает остановить передачу вирусов людям без специфического иммунитета (например, так была остановлена вспышка ВАПП в Сирии в 2017 году [50]). Как только дикие полиовирусы будут побеждены, оральные вакцины станут единственным источником живых полиовирусов, и мир постепенно полностью откажется от ОПВ, чтобы исключить риски новых случаев заболевания.
Несмотря на проблемы ВАПП и ВРПВ, важно понимать, что обе противополиомиелитные вакцины — ОПВ и ИПВ — необходимы, чтобы полностью ликвидировать инфекцию. ИПВ прекрасно зарекомендовала себя как вакцина для общества с высокой степенью иммунизации, а ОПВ — там, где передача дикого вируса еще сохраняется (табл. 1).
Новые стабильные вакцины
Ученые, стремясь снизить риски возникновения опасных штаммов вакцинных вирусов, продолжают работу по увеличению их генетической стабильности. Разработка новых живых вакцин уже ведется в нескольких крупных институтах США и Великобритании. Первые испытания двух кандидатных препаратов против полиовируса 2 типа, финансируемые Фондом Билла и Мелинды Гейтс, прошли в Бельгии в 2017 году (рис. 20). В исследованиях приняли участие 30 человек.

Подход, который используют ученые для получения генетически стабильных штаммов, основан на изменении некодирующей IRES-области вирусной РНК [51]. Среди других методов повышения стабильности полиовирусов: увеличение точности репликации полимеразы и деоптимизация кодирующих единиц в РНК вируса [52], [53]. О безопасности новых ОПВ пока судить рано, так как осложнения после ОПВ редки, а, значит, исследования новых вакцин должны быть очень масштабными.
| Оральная полиовакцина — ОПВ | Инактивированная полиовакцина — ИПВ | |
|---|---|---|
| Что в составе вакцины | Смесь живых ослабленных штаммов полиовируса:двухвалентная ОПВ: вирусы 1 и 3 типов;моновалентные ОПВ: отдельные типы вирусов. | Смесь убитых штаммов трех типов дикого (или ослабленного) полиовируса. |
| Как работает вакцина | Формируется как общий, так и местный иммунитет, что не дает диким полиовирусам размножаться в кишечнике и передаваться от человека к человеку. Вакцинный вирус может передаваться от человека к человеку, увеличивая число иммунизированных людей там, где вакцин не хватает. | Местный иммунитет в слизистых кишечника и носоглотки недостаточен, чтобы в дальнейшем предотвратить размножение дикого вируса и передачу его другим людям. |
| Особенности использования | Так как вакцину вводят орально, с ее распространением могут помогать добровольцы, что облегчает процесс иммунизации. ОПВ активно используют для борьбы как с диким вирусом, так и с ВРПВ. Стоимость ОПВ составляет менее $0,15 за дозу. | Инъекции ИПВ могут проводить только работники здравоохранения. Стоимость вакцины составляет от $1 за дозу и больше. |
| Риск развития ВАПП | 3–4 случая на 1 млн впервые привитых детей. ВАПП не может передаваться от человека к человеку и вызывать вспышки болезни. | Риск полностью отсутствует. |
| Риск появления ВРПВ | С 2000 года было использовано более 10 миллиардов доз ОПВ, что привело к возникновению порядка 1000 случаев полиомиелита, вызванного ВРПВ. | Риск полностью отсутствует. |
Свернуть
Графики вакцинации против полиомиелита
Графики вакцинации против полиомиелита в разных странах различаются (рис. 21), при этом государства стараются учитывать рекомендации ВОЗ, нацеленные на окончательную ликвидацию дикого полиовируса.
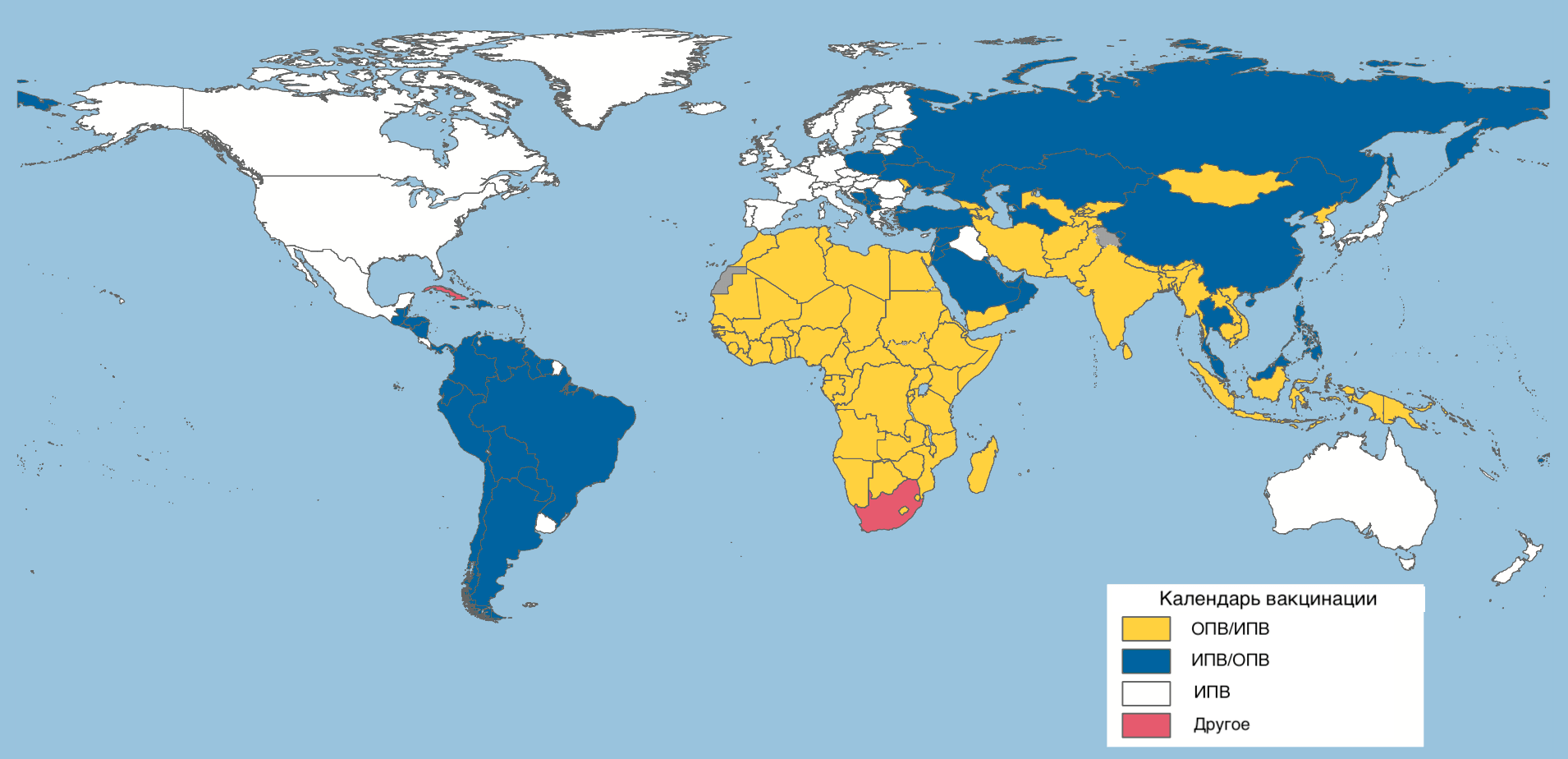
Выбор вакцины против полиомиелита в той или иной стране зависит главным образом от эпидемиологической ситуации и рисков распространения дикого вируса, а также ввоза вируса из эндемичных стран (рис. 22).
Во многих национальных календарях вакцинации (например, российском или китайском) ИПВ выступает в качестве первой дозы либо первых двух доз. В этом случае вакцинацию начинают в двухмесячном возрасте. Интервал между дозами ОПВ или ИПВ составляет 4–8 недель.
Взрослых обычно вакцинируют, только если они состоят в группе риска, а именно:
- собираются в эндемичный/опасный регион, где циркулируют вирусы или велик риск вспышек полиомиелита;
- работают в лаборатории с дикими вирусами полиомиелита;
- являются медицинскими работниками и сталкиваются с пациентами, больными полиомиелитом.
График вакцинации для взрослых из групп риска включает 3 дозы ИПВ с интервалом 1–2 и 6–12 месяцев между дозами для не привитых ранее, и 1 бустерную дозу для тех, кто прошел полный курс вакцинации в детстве.
Вакцинация против полиомиелита в России
В России вакцинация против полиомиелита входит в Национальный календарь профилактических прививок и включает 6 доз вакцины (табл. 2).
| Доза | Вакцинация | Ревакцинация | ||||
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | |
| Возраст | 3 мес. | 4,5 мес. | 6 мес. | 18 мес. | 20 мес. | 14 лет |
| Вакцина | ИПВ | ИПВ | дОПВ | дОПВ | дОПВ | дОПВ |
| дОПВ — двухвалентная ОПВ, защищает от 1 и 3 типов вируса. Для детей от ВИЧ-положительных матерей и детей, находящихся в домах ребенка, рекомендовано использование только ИПВ. |
ИПВ была выбрана в качестве первых двух доз исходя из низкого риска ввоза дикого полиовируса и высокого уровня охвата вакцинами в стране. Вероятно, в ближайшие годы в России произойдет полная замена ОПВ на ИПВ, которая позволит исключить риск ВАПП и обеспечит высокий уровень защиты против всех серотипов полиовируса (установлено, что 3 дозы ИПВ лучше защищают от вируса 2 типа, чем 2 дозы [54]). Уже сейчас все дозы ОПВ по желанию родителей можно заменить на ИПВ, но не наоборот.
Вакцинация по эпидемическим показателям включает одну дополнительную дозу вакцины. Детей в этом случае вакцинируют с помощью ОПВ, если угрозой является дикий вирус, и ИПВ — если причиной к иммунизации послужил вакцинный вирус. Взрослых прививают инактивированной вакциной.
Отечественную ИПВ «Полимилекс» производит ООО «Нанолек» (табл. 3). Сегодня это единственная широко доступная в стране моноИПВ. Она выпускается во флаконах, содержащих 5 доз препарата. Вскрытые флаконы пригодны для использования не больше суток.
В Центре исследований и разработки иммунобиологических препаратов им. М.П. Чумакова РАН ведутся клинические испытания новой инактивированной вакцины «ПолиовакСин» на основе штаммов Сэйбина (с-ИПВ). Ее производство должно начаться в 2021 году. В Центре планируют также создать комбинированную вакцину с ИПВ-компонентом, которая позволит делать один укол сразу против нескольких инфекций.
| Название вакцины | Производитель | Полио-компонент | Форма |
|---|---|---|---|
| Инактивированные вакцины, первые две дозы при детской вакцинации. Вакцинация взрослых | |||
| «Полимилекс» | ООО «Нанолек», Россия (производство — ООО «Нанолек», Bilthoven Biologicals, Нидерланды) | Инактивированный дикий вирус 1, 2 и 3 типа | Суспензия для внутримышечного и подкожного введения |
| «Инфанрикс Гекса» (защищает от дифтерии, столбняка, коклюша, полиомиелита, гепатита В, гемофильной инфекции) | ООО «СмитКляйн Бичем-Биомед», Россия (производство — Франция, Бельгия) | Суспензия для внутримышечного введения | |
| «Полиорикс» | ООО «СмитКляйн Бичем-Биомед», Россия (производство — Франция, Бельгия) | Раствор для внутримышечного введения | |
| «Имовакс Полио» | «Санофи Пастер» С.А., Франция | Суспензия для внутримышечного и подкожного введения | |
| «Пентаксим» (защищает от дифтерии, столбняка, коклюша, полиомиелита, гепатита В) | «Санофи Пастер» С.А., Франция; ООО «Нанолек», Россия | Суспензия для внутримышечного введения | |
| «Тетраксим» (защищает от дифтерии, столбняка, коклюша, полиомиелита) | «Санофи Пастер» С.А., Франция | Суспензия для внутримышечного введения | |
| Живые вакцины, вакцинация и ревакцинация детей | |||
| «БиВак полио» | ФГУП «ПИПВЭ им. М.П. Чумакова», Россия | Аттенуированные штаммы Сэйбина 1 и 3 типа | Раствор для приема внутрь |
| «МоноВак полио тип 2» | ФГУП «ПИПВЭ им. М.П. Чумакова», Россия | Аттенуированный штамм Сэйбина 2 типа | Раствор для приема внутрь |
Свернуть
Вакцинация ИПВ противопоказана, если до этого наблюдалась сильная реакция на вакцину или в случае аллергии на антибиотики стрептомицин, неомицин или полимиксин B (они могут содержаться в вакцине в следовых количествах).
Противопоказания к ОПВ включают: предыдущие негативные реакции на введение вакцины, иммунодефицитные состояния и наличие в окружении маленьких детей, не привитых против полиомиелита. Роспотребнадзор рекомендует непривитым детям избегать контактов с привитыми ОПВ в течение минимум 60 дней после ввода им вакцины. Острое заболевание (или обострение хронического) является только временным противопоказанием к вакцинации. Плановые прививки можно делать через 2–4 недели после выздоровления или сразу после нормализации температуры при не тяжелых болезнях.
Что нужно сделать, чтобы полиомиелит исчез навсегда
Широкое использование противополиомиелитных вакцин во всем мире привело к снижению глобальной заболеваемости полиомиелитом на 99% (рис. 23). Россия была признана свободной от полиомиелита в 1996 году. Последний случай полиомиелита, вызванного диким штаммом полиовируса 2 типа, произошел в Индии в 1999 году. Полиовирус типа 3 не проявлял себя с ноября 2012 года. Единственный дикий вирус, который осталось победить — полиовирус 1 типа.
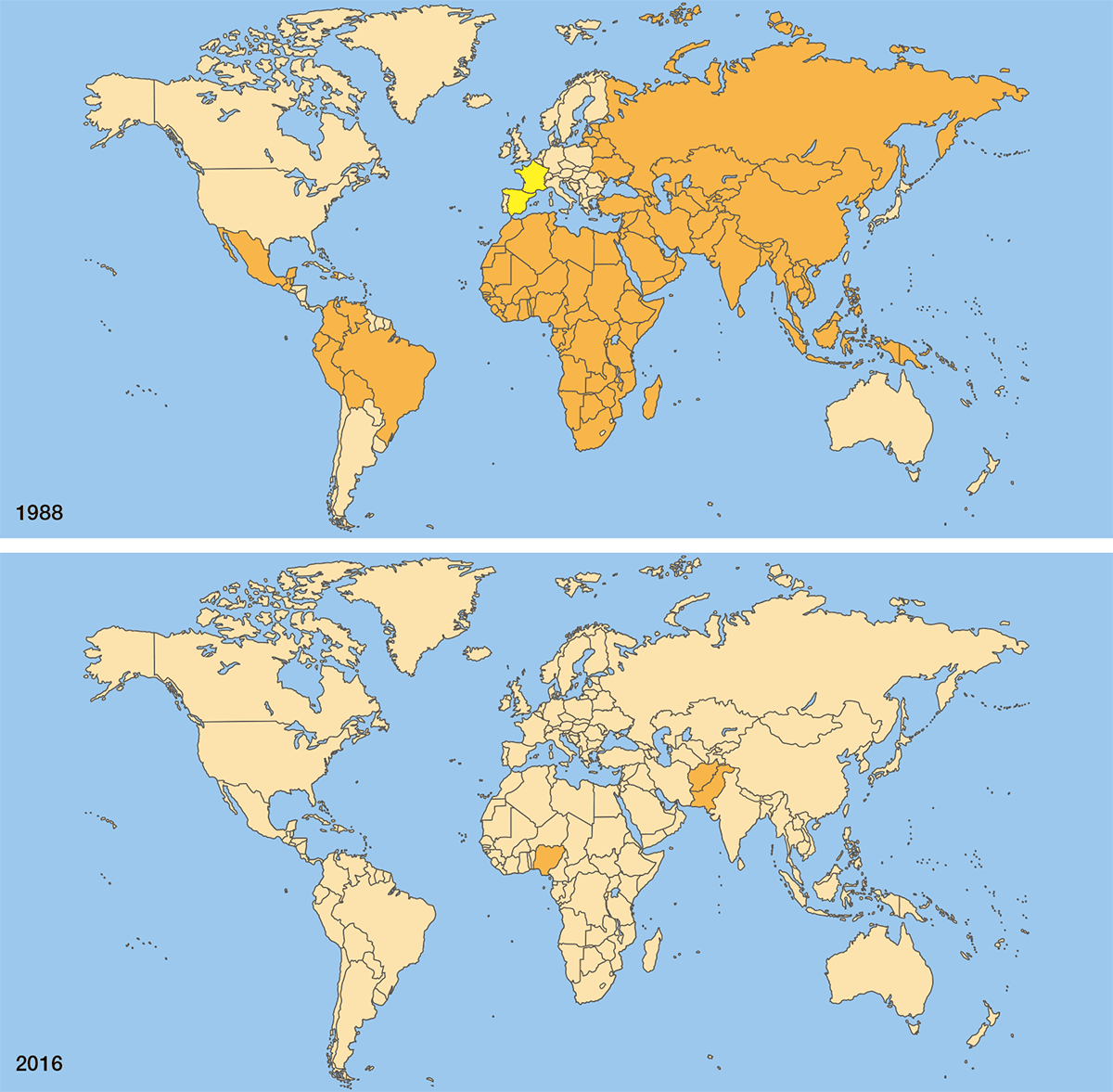
Однако пока передача дикого вируса в эндемичных регионах полностью не остановлена, риск новых вспышек болезни будет сохраняться. Полиомиелит может в любой момент попасть из очага распространения инфекции в страны, где болезнь давно побеждена, а иммунитет к вирусу у людей ослаблен или отсутствует, и тогда число новых случаев снова вырастет. В 2014 году из-за распространения полиомиелита за пределы эндемичных регионов ВОЗ объявила чрезвычайную ситуацию в области общественного здравоохранения, подразумевающую необходимость соблюдения дополнительных рекомендаций по борьбе с инфекцией, которые действуют до сих пор.
На сайте GPEI размещена онлайн-карта, где отображаются все новые случаи болезни. В 2019 году было зарегистрировано 176 случаев заражения диким полиовирусом (из них 29 в Афганистане и 145 — в Пакистане) и 364 — циркулирующими вакцино-родственными вирусами (из них 129 случаев в Анголе). В России крупные вспышки полиомиелита происходили в 1995 (154 случая) и 2010 годах (14 случаев).
Неблагополучными странами по полиомиелиту, где еще не удалось прервать циркуляцию дикого вируса, остаются Пакистан, Афганистан и Нигерия. Инфекция там всё еще встречается, виной тому недостаток квалифицированного медицинского персонала, недоверие людей к вакцинам и бедность [55]. Больше всего специалистов беспокоит возможность передачи полиомиелита в другие страны из Афганистана и Пакистана (рис. 24).
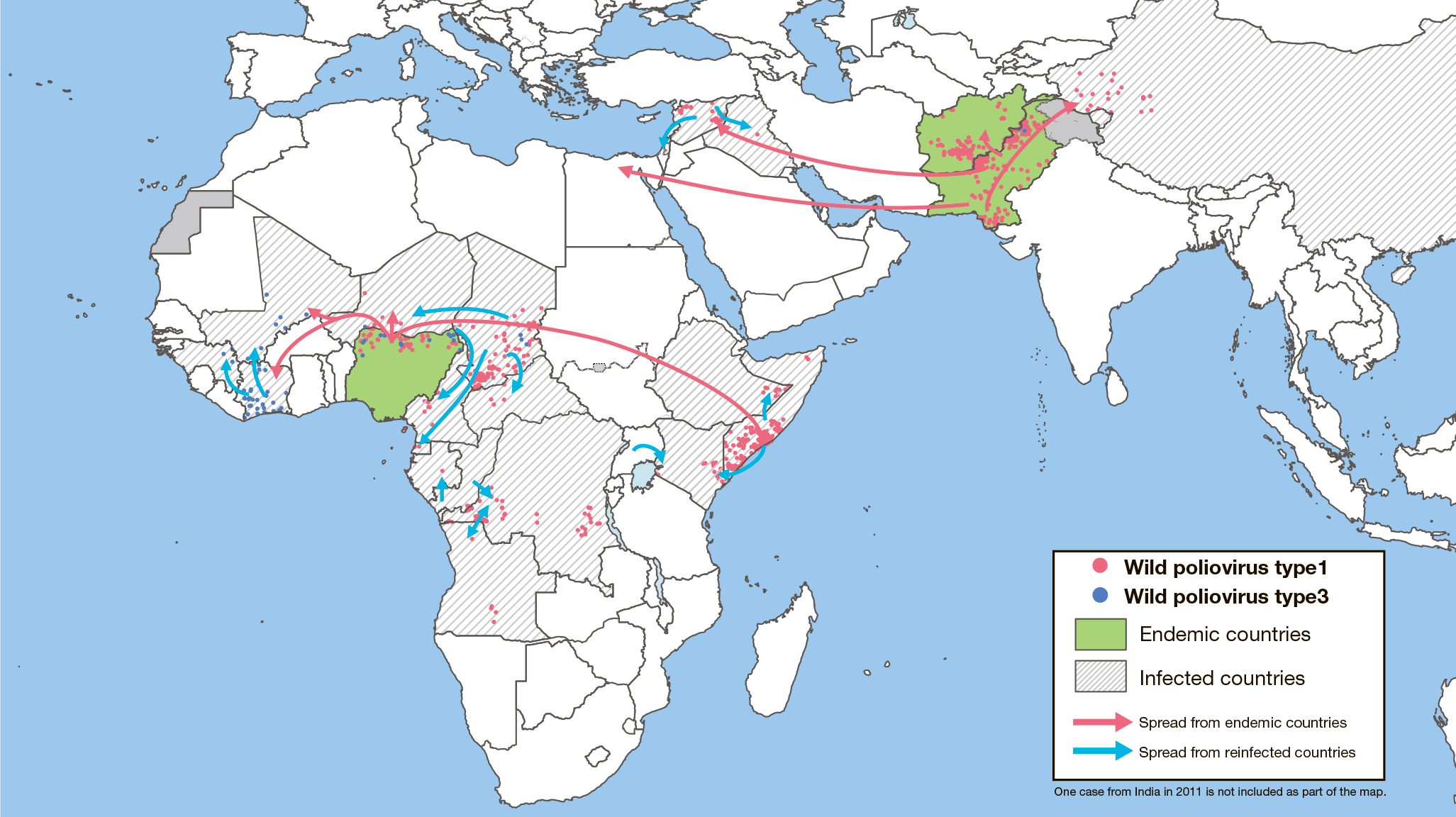
В ряде стран Африки (Анголе, Бенине, Буркина-Фасо, Республике Конго и др.), в Юго-Восточной Азии (Индонезии, Мьянме), в Западно-Тихоокеанском регионе (Китае, Малайзии, на Филиппинах) и в Восточном Средиземноморье (Сомали) периодически возникает угроза новых вспышек болезни из-за ввоза дикого или циркуляции вакцино-ассоциированного полиомиелита.
Поэтому вакцинация крайне важна для путешественников. Перед поездкой в страну, где есть риск столкнуться с полиовирусом, следует получить все необходимые дозы вакцины. Людям, которые не прививались больше года, нужно получить дополнительную бустерную дозу перед отъездом. Все выезжающие из эндемичных стран должны быть привиты должным образом и, кроме этого, получить дополнительную дозу живой или инактивированной полиовакцины как минимум за 4 недели (но не раньше, чем за 12 месяцев) до поездки, чтобы усилить защиту от инфекции и сократить возможность вывоза полиовируса в свободные от полиомиелита страны. В случае срочного выезда сделать прививку все равно нужно, даже не укладываясь в сроки. Для людей, которые ранее были привиты только ОПВ, в качестве бустерной дозы ВОЗ рекомендует использовать живую полиовакцину , [56].
Подробнее о вакцинации путешественников против полиомиелита можно узнать на сайте ВОЗ в разделе «Международные поездки и охрана здоровья». — Ред.
Правительства стран, где риск распространения полиомиелита все еще очень высокий, принимают специальные меры, чтобы обезопасить людей от инфекции. Например, при выезде за пределы Афганистана и Пакистана от постоянных жителей или туристов, находившихся в опасном районе более четырех недель, потребуют предъявить доказательство пройденной вакцинации. Некоторые страны, среди которых Египет, Индия, Марокко, Филиппины, Саудовская Аравия и Грузия, на въезде просят у людей, прибывающих из затронутых полиомиелитом стран, свидетельство о вакцинации. Если свидетельства нет, вам могут сделать прививку прямо на границе.
Победить болезнь можно, но для этого нужно продолжать поддерживать программы по иммунизации, рассказывая людям о важности профилактики полиомиелита и проявляя гибкость в вопросах вакцинации людей всех социальных групп. Стратегия ВОЗ по искоренению полиомиелита сегодня включает три шага. Сначала это вытеснение диких вирусов вакцинными штаммами (вакцинация ОПВ), затем — переход на ИПВ с целью исключения циркуляции вакцино-родственных вирусов (ВРПВ) и, наконец, постепенный отказ от вакцин ввиду отсутствия угрозы заражения. Сегодня этот план поддается критике, отказ от ОПВ активно обсуждается специалистами [57], [58]. Есть опасения, что тогда полиомиелит вернется, обесценив долгие годы усилий врачей по всему миру. Кроме того, ОПВ может играть значительную роль в снижении общей заболеваемости у детей благодаря ее неспецифическому защитному эффекту . Решение этой проблемы многие видят в разработке новых усовершенствованных вакцинных препаратов, имеющих все преимущества ИПВ и ОПВ и лишенных их недостатков.
Об этом и многом другом нам рассказал [59] Константин Чумаков, известный вирусолог, который много лет работает в Управлении по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США. Как и его отец, Михаил Чумаков, он является крупным специалистом по полиомиелиту. — Ред.
Между тем, победа над полиомиелитом близка как никогда, осталось сделать последний шаг.