Aннотация
После появления в китайском городе Ухань COVID-19 распространился по всему земному шару и оказал глубокое влияние на жизни и здоровье людей. На 21 сентября 2021 года по всему миру было более 228 миллионов подтвержденных случаев COVID-19, из них 4,69 миллионов окончились смертью. Недавно было показано, что после острой фазы инфекции SARS-CoV-2 ряд стойких симптомов может сохраняться длительное время, и такое состояние в общепризнанных институтах получило название постковидного синдрома (постковида). Исследования показали, что постковидный синдром может влиять на жизнь широкого спектра людей с COVID-19 — от тех, у кого острая форма протекает очень мягко, до лиц с наиболее тяжело протекавшим заболеванием. Как и и острый COVID-19, постковидный синдром может затрагивать множество органов и влиять на целый ряд систем, включая дыхательную, сердечно-сосудистую, нервную, пищеварительную и опорно-двигательную, и не ограничиваться ими. Симптомы постковида включают усталость, одышку, нарушения работы сердца, повреждение когнитивных функций, нарушения сна, симптомы посттравматического стрессового расстройства, проблемы с концентрацией, мышечную и головную боль. В данном обзоре обобщены долговременные эффекты COVID-19 у госпитализированных и амбулаторных пациентов и описаны стойкие симптомы, которым подвержены эти люди. Также обсуждаются факторы риска для острого COVID-19 и постковидного синдрома.
Введение
Новая коронавирусная инфекция-2019 (COVID-19 — Coronavirus disease 2019) распространилась по всему миру. На 21 сентября 2021 года ВОЗ сообщила о более 228 миллионах случаев заражения и 4,69 миллионах смертей [1]. Клинический спектр COVID-19 варьирует от бессимптомной инфекции до заболевания с летальным исходом [2, 3]. Вирус, вызывающий COVID-19, — коронавирус 2 острого респираторного синдрома (SARSCoV-2) — проникает в клетки через рецептор ангиотензинпревращающего фермента 2 (АПФ2) [4]. Оказавшись внутри клетки, вирус подвергается репликации и созреванию, провоцируя воспалительный ответ у некоторых пациентов, в котором участвует активация и инфильтрация иммунных клеток различными цитокинами [5]. Рецептор АПФ2 в теле человека присутствует у многих типов клеток, включая слизистую оболочку полостей рта и носа, легкие, сердце, пищеварительный тракт, печень, почки, селезенку, мозг, эндотелиальные клетки артерий и вен. Это подчеркивает вред, который SARS-CoV-2 может наносить различным органам [6, 7].
Влияние COVID-19 на жизни людей до сих пор не имеет себе равных, а
его долгосрочные симптомы могут обладать дальнейшим разрушительным
эффектом [8]. Недавно полученные данные показывают, что ряд симптомов
может сохраняться после завершения острой фазы заболевания, и такое
состояние известно как постковидный синдром. По определению
Национального института здоровья и улучшения медицинской помощи (NICE), в
широком смысле постковидный синдром — это симптомы, продолжающиеся или
развивающиеся после острой инфекции COVID-19 и которые нельзя объяснить
альтернативным диагнозом. Этот термин включает текущий симптоматический
COVID-19, период от 4 до 12 недель после инфекции и собственно
постковидный синдром — более 12 недель после заражения [9]. И наоборот,
Национальный институт здоровья (NIH) использует определение
постковидного синдрома, разработанное Центрами по контролю и
профилактике заболеваний США (CDC), которое описывает это состояние как
осложнения, продолжающиеся более четырех недель после первоначального
заражения [10]. В постковидный синдром вовлекается структура и функция
множества органов (рис. 1) [11–14].
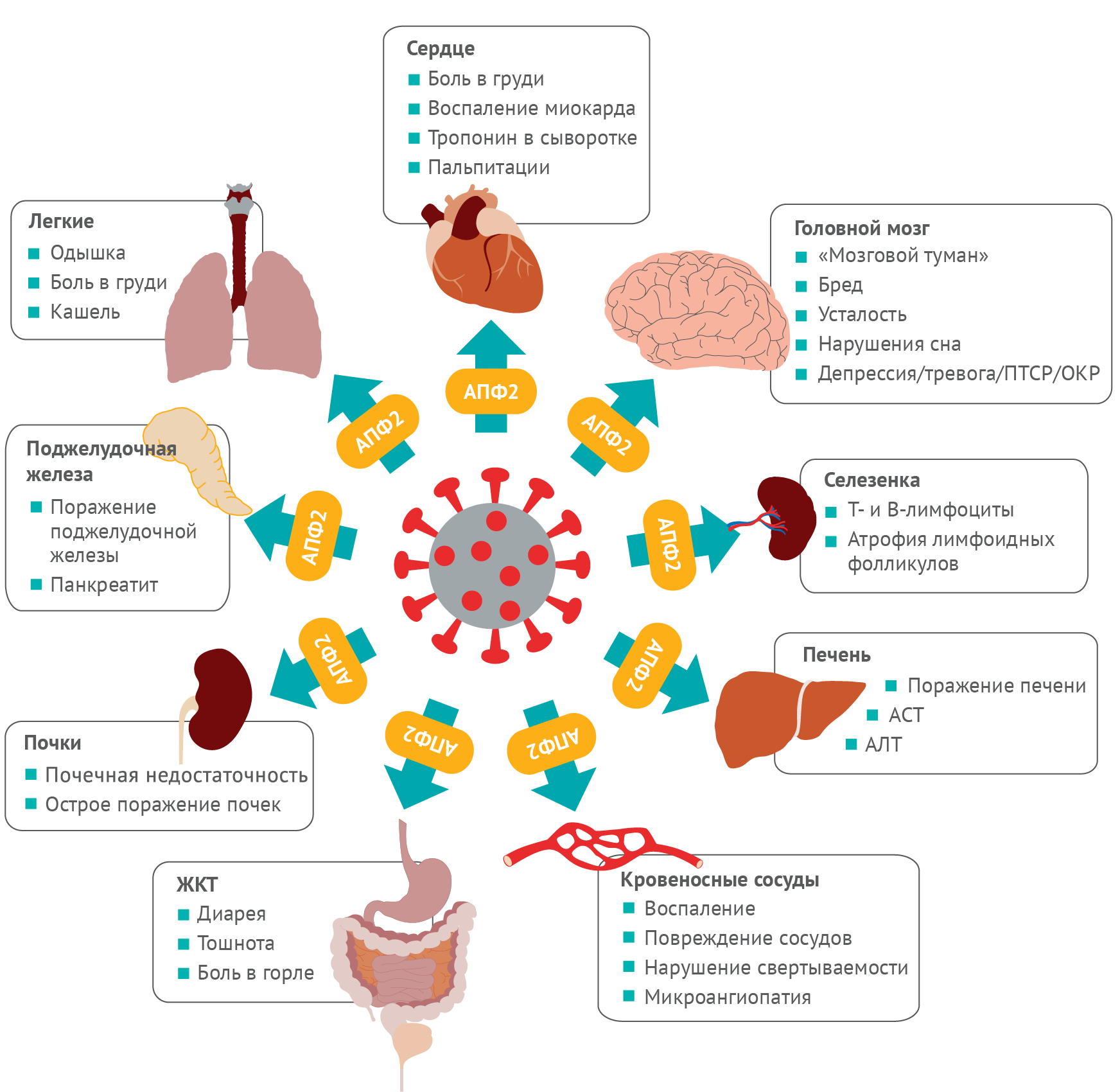
Рисунок 1 | Мультиорганные осложнения при COVID-19 и постковидном синдроме Вирус SARS-CoV-2 получает доступ в клетки множества органов через рецептор АПФ2. После проникновения вирус может вызвать множественные повреждения, которые в конечном счете вызывают многочисленные стойкие симптомы, некоторые из которых приводятся здесь.
Долговременные симптомы, следующие за COVID-19, обнаруживаются на протяжении всего течения этого заболевания. В данном обзоре исследуется долговременное влияние симптомов, появляющихся после заражения COVID-19, и обсуждается текущее эпидемиологическое понимание постковидного синдрома, факторы риска, которые могут предрасполагать человека к развитию этого состояния, а также руководства по лечению и ведению таких пациентов.
Meтоды
Авторы проводили поиск в базах данных PubMed и Embase. Объектом поиска были статьи, опубликованные между январем 2020 года и маем 2021 года. Термины для поиска включали «постковидный синдром» или «SARS-CoV-2» и «эпидемиология», или «слабость», или «синдром усталости», или «одышка», или «диспноэ», или «затруднение дыхания», или «сердечный», или «сердечно-сосудистый», или «сердце», или «когнитивная деятельность», или «нарушение когнитивной деятельности», или «ментальное здоровье», или «депрессия», или «тревожность», или «психиатрический», или «центральная нервная система», или «вегетативная нервная система», или «изоляция», или «одиночество», или «бессонница», или «запах», или «вкус», или «обонятельный», или «вкусовой», или «факторы риска», или «лечение». Для предотвращения ненамеренного устранения статей фильтры не применялись. Изначально авторы нашли 61 881 статей. Для отбора статей авторы сначала прочитывали заголовки, а затем аннотации, чтобы снизить число рассматриваемых работ. Чтобы избежать исключения исследований без необходимости, применялись ограниченные критерии включения и исключения. Авторы исключали статьи, не соответствующие теме постковидного синдрома или не упоминающие его, в то время как исследования с упоминанием постковидного синдрома в любом качестве были изначально включены из-за новизны исследования. Более того, авторы рассматривали исследования постковидного синдрома вне зависимости от количества участников или плана исследования. Авторы выбрали и прочитали полностью 227 статей, касающихся постковида, и обсудили каждую, чтобы определить, стоит ли ее включать в окончательный обзор, а также выполнили дальнейший поиск вручную дополнительных статей и терапевтических руководств, используя соответствующие базы данных, включая nice.org.uk и clinicaltrials.gov. Всего было включено 218 ссылок. Исследования, посвященные постковидному синдрому, ограничены, поэтому к ним применялись ограниченные критерии исключения.
Исследования постковидного синдрома
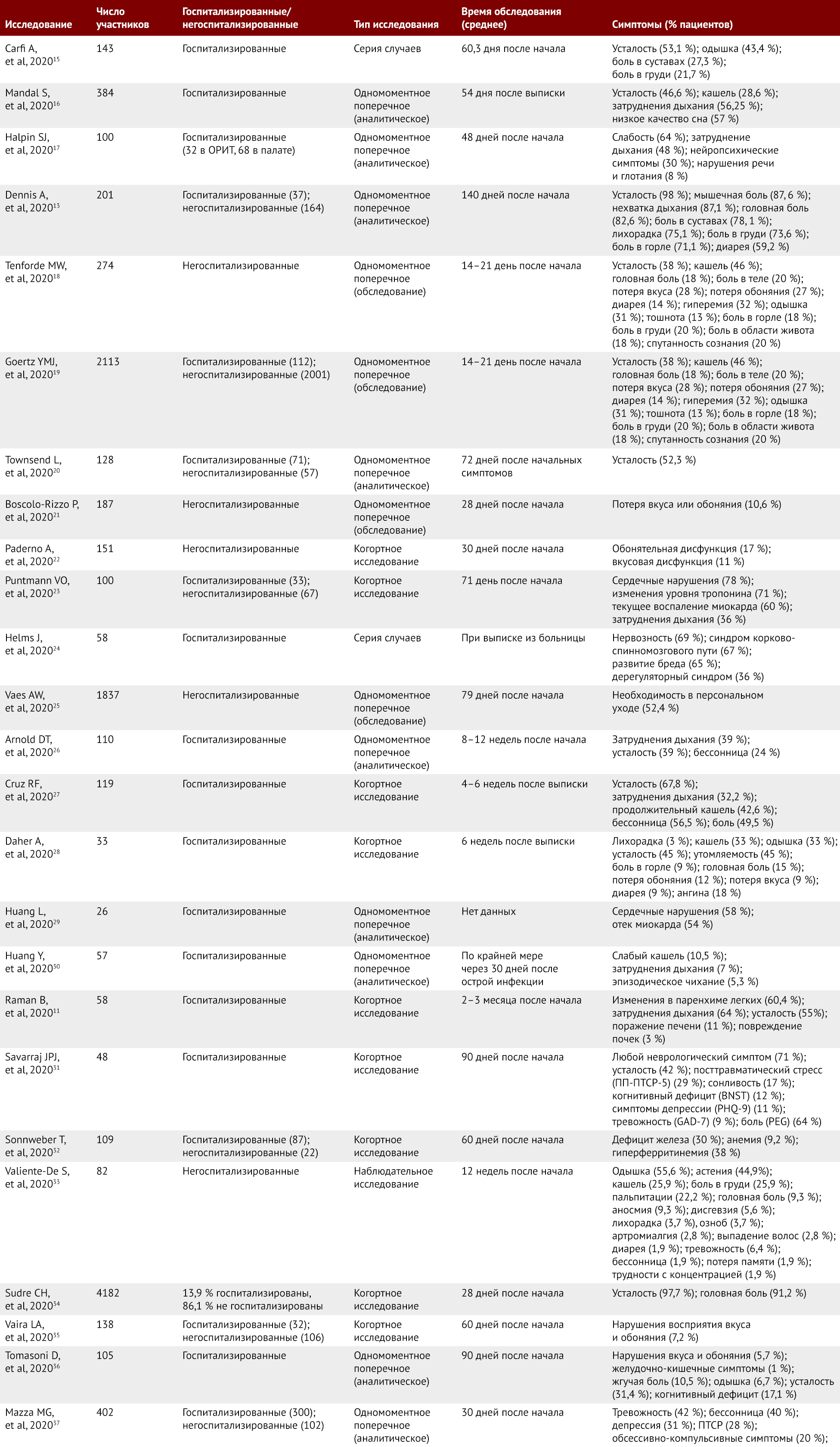
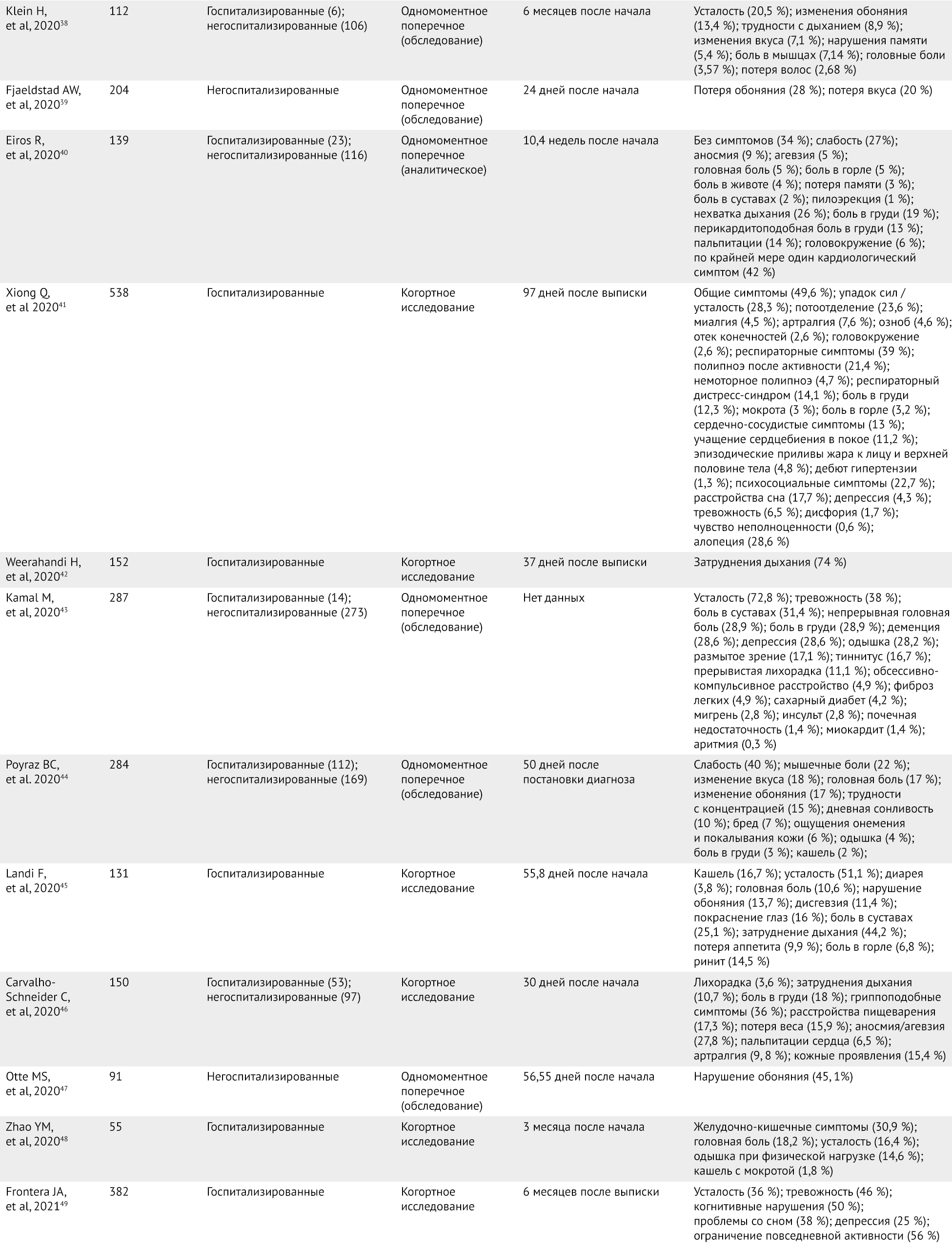
В исследованиях оценивали людей, перенесших COVID-19, чтобы изучить симптомы, связанные с постковидом. Данные этих исследований обобщены в таблице 1. Статьи, включенные в данный обзор, отбирались по качеству; наибольший интерес представляли крупные наблюдательные исследования. Большинство из статей написаны по результатам одномоментных поперечных или когортных наблюдательных исследований с крупными когортами; однако в силу новизны заболевания и недостатка данных исследования малых когорт и серии случаев также были включены в обзор. У любого пациента с COVID-19 может развиться постковидный синдром вне зависимости от тяжести заболевания и интенсивности полученного лечения. У пациентов, которые лечились в больничных палатах и отделениях реанимации и интенсивной терапии (ОРИТ), показано мало различий в частоте встречаемости долговременных симптомов, связанных с COVID-19 [17]. Доля людей, у которых развиваются клинические признаки постковидного синдрома, примерно одинакова вне зависимости от того, получают ли они при лечении только кислород, положительное постоянное давление в воздухоносных путях или же инвазивную вентиляцию легких [16]. У многих пациентов с легкими симптомами острой фазы также развиваются симптомы постковида [13]; фактически, в исследования показано, что разница в преобладании их у госпитализированных пациентов по сравнению с амбулаторными минимальна [19].
Таблица 1 | Краткая сводка исследований, посвященных изучению стойких симптомов постковидного синдрома
Эпидемиология
Уровень заболеваемости и смертности, о которых сообщается в различных странах, варьирует, что создает сложности для точного предсказания числа пациентов, у которых разовьется постковидный синдром. Аналогичным образом, трудности возникают при попытке точно оценить постковидный синдром. Такие расхождения в эпидемиологических данных представляются результатом действия нескольких факторов, включая различия в исходных популяциях, точность постановки диагноза, системы отчетности и возможности систем здравоохранения. Несмотря на то, что получение точных эпидемиологических данных по постковиду затруднено, эта информация необходима для оповещения систем здравоохранения и правительства при разработке алгоритмов поддержки и лечения. Объем опубликованной литературы, описывающей случаи пациентов с COVID-19, у которых в дальнейшем развиваются признаки постковидного синдрома, постоянно растет, что обеспечит лучшее понимание его эпидемиологии.
Текущая неоднозначность данных по эпидемиологии постковидного синдрома связана со многими причинами, включая продолжительность медицинского наблюдения, оцениваемые группы населения, точность сведений, предоставленных пациентом, и изученные симптомы. Во всем мире в исследованиях постковида сообщается о различной частоте встречаемости и разной длине периода дальнейшего медицинского наблюдения после острой фазы инфекции, включая 76 % человек через 6 месяцев [50], 32,6 % — через 60 дней [51], 87 % — через 60 дней [52] и 96 % — через 90 дней [52]. Эти данные нельзя назвать полностью подтверждающими, но они показывают, что у значительной доли людей с COVID-19 развивается постковидный синдром. Национальное статистическое управление Великобритании (ONS) опубликовало данные по частоте симптомов постковида [53]. По его оценкам, частота встречаемости любого симптома спустя пять недель после заражения среди изученных респондентов с положительным тестом на COVID-19 между 22 апреля и 14 декабря 2020 года составляла 22,1 %, а спустя 12 недель — 9,9 %. Эти цифры дают повод для беспокойства среди пациентов, работников сферы услуг и правительства, поскольку большому количеству пациентов с постковидным синдромом потребуется длительная поддержка и лечение. Для улучшения понимания эпидемиологии постковидного синдрома необходимы дальнейшие исследования.
Варианты SARS-CoV-2, вызывающие беспокойство
С начала пандемии возникло несколько вариантов вируса SARS-CoV, которые имеют повышенную заразность и могут приводить к более тяжелому острому заболеванию. В Великобритании одним из первых вариантов, вызывающих беспокойство, стал так называемый «вариант из Кента» линии B.1.1.7, называемый теперь α-вариантом. Этот вариант приблизительно на 50 % более трансмиссивен и, по-видимому, вызывает более тяжелое течение острой фазы заболевания [55]. На 30 июля в Великобритании было подтверждено более чем 275 000 случаев заражения α-вариантом [56], который распространился по крайней мере на 136 стран мира [57]. Другие исследуемые варианты, вызывающие опасения, включают β-, γ-, ζ-, θ- и κ-варианты [56]. CDC сообщает о появлении вариантов, вызывающих опасения и интерес, в США [58]. Новые варианты SARS-CoV-2 продолжат появляться и распространяться по мере течения пандемии. Например, появились η- и δ-варианты, и в Великобритании на 30 июня 2021 года подтверждено уже более 161 000 случаев заражения δ-вариантом [56]. Недавно возник λ-вариант, который требует пристального внимания. Необходимо полностью изучить способность данных штаммов вируса вызывать долговременные осложнения. Можно предположить, что один вариант вызывает более опасные долговременные эффекты, чем другие, и, таким образом, пациентам, инфицированным данным вариантом и страдающим от развившегося постковидного синдрома, требуется дополнительная поддержка, а также стратегии быстродействующего и интенсивного лечения для борьбы с долговременными симптомами.
Определение постковидного синдрома
Постковидный синдром привлек широкое внимание после отчета, опубликованного 5 мая 2020 года в BMJOpinion, в котором профессор-инфекционист поделился своим опытом семинедельных «американских горок здоровья» после COVID-19 [59]. Придуманный пациентом термин «длинный COVID» («постковидный синдром») приобрел популярность после появления хэштега #LongCovid [60]. Это, а также растущее количество рецензируемых статей заострило внимание на постковидном синдроме, который может продолжаться в течение многих недель после острой фазы инфекции. Теперь постковидный синдром — признанный термин в научной литературе. Руководства NICE по лечению долговременных эффектов COVID-19 [9], а также CDC [10] определяют пациентов с постковидным синдромом как лиц с симптомами COVID-19, сохраняющимися более четырех недель после первоначального инфицирования.
Симптомы
Усталость
Усталость более выраженная, чем при переутомлении; это непреходящее истощение и постоянное утомление, которое снижает энергию, мотивацию и концентрацию. После вспышки SARS до 60 % пациентов сообщали об усталости, продолжающейся в течение 12 месяцев после выздоровления после острой инфекции [61]. Усталость — одно из наиболее часто отмечаемых проявлений постковидного синдрома; ONS оценивает пятинедельную частоту усталости среди переболевших COVID-19 в 11,9 % [53]. Усталость является частым стойким симптомом вне зависимости от тяжести острой фазы COVID-19. В одном поперечном одномоментном исследовании было обнаружено, что 92,9 и 93,5 % госпитализированных и амбулаторных пациентов с COVID-19, соответственно, сообщали о сохраняющейся усталости через 79 дней после начала заболевания [19]. Во множестве других поперечных и когортных исследований сообщается, что хроническая усталость — наиболее часто встречающийся симптом, следующий за выздоровлением после острой фазы COVID-19 [15, 17, 20, 27, 43]; причем связи между тяжестью COVID-19 и долговременной усталостью не найдено [20]. Эти результаты показывают, что усталость — одно из основных проявлений постковидного синдрома.
Возможные механизмы
Хроническая усталость, следующая за вирусной инфекцией, может быть результатом нарушения взаимодействия в пути воспалительного ответа [62]; однако, в одномоментном поперечном исследовании не обнаружено связи между провоспалительными маркерами и долговременной усталостью у пациентов, перенесших COVID-19 и страдающих от стойкой усталости [20]. Вероятно, что в ее развитии играет роль ряд центральных, периферических и психологических факторов. В описательном обзоре объясняется, что застой в глимфатической системе и последующее накопление токсинов внутри центральной нервной системы (ЦНС), вызванные затруднением дренажа спинномозговой жидкости через решетчатую пластинку, который, в свою очередь, является следствием повреждения обонятельных нейронов, может участвовать в развитии постковидной усталости [63].
Гипометаболизм в лобной доле и мозжечке также может иметь место у пациентов с COVID-19 и, вероятно, скорее вызывается системным воспалением и клеточно-опосредованными иммунными механизмами, нежели прямой инвазией вируса в нервную ткань [64, 65]. Продолжается ли такое снижение обмена веществ при постковидном синдроме, неизвестно.
Неблагоприятные психологические и социальные факторы, связанные с пандемией COVID-19, также коррелируют с хронической усталостью [66, 67]. Наконец, свой вклад могут вносить периферические факторы, такие как прямое инфицирование вирусом SARS-CoV-2 скелетной мускулатуры, которое вызывает ее повреждение, слабость, воспаление мышечных волокон и нервно-мышечных контактов [68–71]. В целом, вероятно, что в развитии постковидной усталости принимают участие несколько факторов и механизмов, которые изображены на рисунке 2.
Постковидную усталость сравнивают с миалгическим энцефаломиелитом / синдромом хронической усталости (MЭ/CХУ), поскольку они имеют много общих черт [72]. Симптомы, общие для постковида и МЭ/СХУ, включают усталость, неврологические симптомы / боль, нейрокогнитивные/психиатрические симптомы, нейроэндокринные, вегетативные и иммунные симптомы; и у пациентов с постковидным синдромом, и у пациентов с МЭ/СХУ симптомы присутствуют долгое время, снижается повседневная активность, появляется недомогание после нагрузки [72]. МЭ/СХУ остается во многом загадкой, и исследования постковидного синдрома могут способствовать его пониманию; верно и обратное.
Одышка
Затруднение дыхания часто встречается у людей с постковидным синдромом. По оценкам ONS, его частота через пять недель после заражения COVID-19 составляет 4,6 % вне зависимости от присутствия острых респираторных симптомов или тяжести заболевания [53]. У госпитализированных с COVID-19 пациентов в момент выписки, приблизительно через месяц после появления симптомов, выявляются нарушения диффузии диоксида углерода, снижение общей емкости легких, объема форсированного выдоха, форсированной жизненной емкости легких, функции малых дыхательных путей. Это говорит о том, что людям, перенесшим COVID-19, может требоваться время на восстановление функции легких [73]. В ряде исследований обнаружено, что одышка является характерным проявлением постковида [16, 17]; в одном из них сообщается, что из 143 исследованных пациентов 43,4 % страдают от одышки спустя 60 дней от начала COVID-19 [15].
Возможные механизмы
Поскольку COVID-19 — прежде всего респираторное заболевание, острая
фаза болезни может вызывать значительное повреждение легких и
дыхательных путей вследствие репликации SARS-CoV-2 в клетках эндотелия,
результатом чего становится повреждение эндотелия и интенсивная иммунная
и воспалительная реакция [74, 75]. У лиц, преодолевших острую фазу
инфекции, могут развиваться долговременные поражения легких, которые
приводят к диспноэ [76]; однако у большинства людей, длительно
страдающих от затруднения дыхания, не выявляются признаки постоянного
или длительного повреждения легких [28, 77]. По-видимому,
фиброзноподобные изменения в легочной ткани склонны развиваться лишь у
тех, кто имеет высокий риск затруднения дыхания, включая пожилых людей,
тех, кто перенес острый респираторный дистресс-синдром, тех, кто
длительно пребывал в госпитализированном состоянии и тех, кто уже имел
поражение легких [78]. Фиброзное состояние, обнаруживающееся у некоторых
пациентов с одышкой, может провоцироваться цитокинами, такими как
интерлейкин 6, который вырабатывается при COVID-19 [79] и участвует в
формировании фиброза легких [80]. У пациентов с COVID-19 обнаруживается
тромбоэмболия легочных сосудов [81], которая может иметь пагубные
последствия при постковидном синдроме. Возможные механизмы развития
одышки показаны на рис. 2.
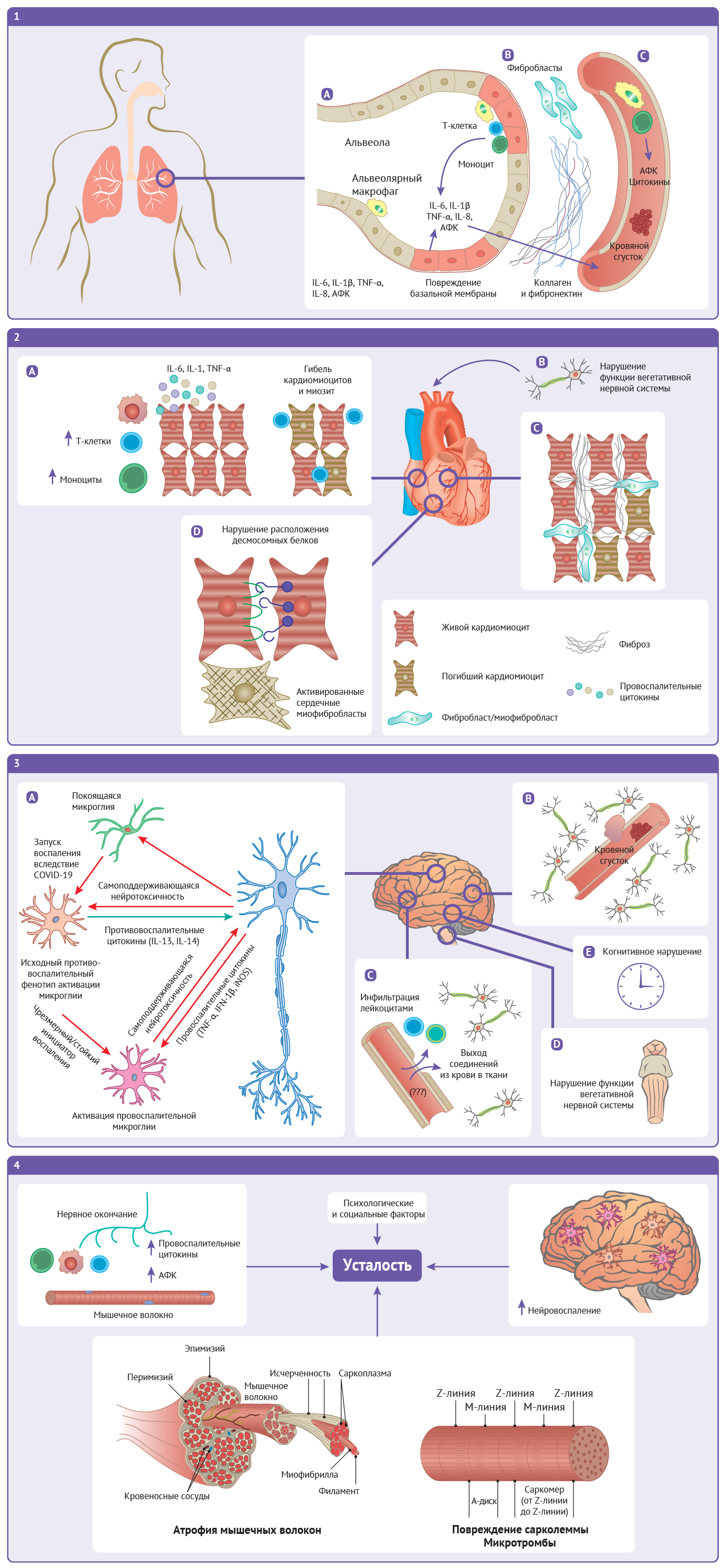
Рисунок 2 | Долгосрочные последствия COVID-19
1 | В альвеолах легких:
(A) Результатом хронического воспаления становится непрерывная
выработка провоспалительных цитокинов и активных форм кислорода (АФК),
которые выделяются в окружающие ткани и кровоток. (Б) Повреждение
эндотелия запускает активацию фибробластов, которые откладывают коллаген
и фибронектин, что приводит к фиброзным изменениям. (В) Повреждение
эндотелия, активация комплемента и взаимодействия между тромбоцитами и
лейкоцитами, выделение провоспалительных цитокинов, разобщение
нормальных путей свертывания крови и гипоксия могут приводить к развитию
пролонгированного гипервоспалительного состояния и гиперкоагуляции, что
увеличивает риск тромбозов.
2 | В сердце: (A)
результатом хронического воспаления кардиомиоцитов может стать миозит и
гибель кардиомиоцитов. (Б) Нарушение функции афферентной вегетативной
нервной системы может вызвать такие осложнения, как синдром постуральной
ортостатической тахикардии. (В) Пролонгированное воспаление и
повреждение клеток способствует тому, что фибробласты начинают усиленно
секретировать молекулы внеклеточного матрикса, в том числе коллаген, что
приводит к фиброзу. (Г) Фиброзные изменения сопровождаются увеличением
числа миофибробластов сердца, в то время как повреждения десмосомных
белков приводят к ослаблению межклеточных контактов.
3 | В центральной нервной системе:
(A) Длительный иммунный ответ активирует глиальные клетки, что приводит
к хроническому повреждению нейронов. (Б) Состояния гипервоспаления и
гиперкоагуляции ведут к повышению риска тромботических событий. (В)
Повреждение гемато-энцефалического барьера и нарушение его регуляции
приводят к патологической проницаемости, позволяя содержащимся в крови
соединениям и лимфоцитам проникать в паренхиму мозга. (Г) Хроническое
воспаление ствола мозга может приводить к нарушению функции вегетативной
нервной системы. (Д) Воздействие постковидного синдрома на мозг может
приводить к когнитивным нарушениям.
4 | Возможные механизмы развития постковидной усталости.
При постковидном синдроме хроническую усталость может вызывать ряд
центральных, периферических и психологических факторов. К длительной
усталости может приводить хроническое воспаление в мозге, а также в
нейро-мышечных контактах. В скелетных мышцах свой вклад в развитие
усталости могут вносить повреждения сарколеммы, поражение и атрофия
волокон, а также ряд психологических и социальных факторов.
Поражение сердечно-сосудистой системы
Повреждение сердца и повышенный уровень сердечного тропонина связаны со значительным повышением риска летального исхода у пациентов, госпитализированных с острой инфекцией COVID-19 [82, 83]. Люди с постковидным синдромом нередко обременены стойкими сердечно-сосудистыми нарушениями. В когортном исследовании у многих людей с COVID-19 через 71 день после постановки диагноза было показано поражение сердца, текущее воспаление миокарда и повышенные уровни тропонина в сыворотке [23], в то время как серии случаев свидетельствуют о том, что у пациентов спустя 60,3 дня после появления симптомов COVID-19 присутствует боль в груди — возможно, вследствие миокардита; при этом о боли в груди сообщали 21,7 % из 143 исследованных пациентов [15]. У лиц, для которых риск тяжелого COVID-19 считается низким — таких как молодые атлеты, участвующие в соревнованиях, — также был найден остаточный миокардит спустя долгое время после выздоровления от COVID-19 [84]. Помимо жалоб на проблемы с сердцем, в исследованиях людей после инфекции COVID-19 также обнаруживается тенденция к развитию отсутствовавшего ранее синдрома постуральной ортостатической тахикардии (ПОТ) вследствие нарушения функции вегетативной нервной системы [85–89].
Возможные механизмы
Рецепторы АПФ2 обильно экспрессируются в сердце [90], что предоставляет прямой путь для заражения SARS-CoV-2. В исследованиях было показано, что в кардиомиоцитах, инфицированных вирусом, происходят разрушение и фрагментация саркомеров, энуклеация, изменения транскрипции и интенсивный местный иммунный ответ [91, 92]. Патологический ответ на острое повреждение сердца и вирусный миокардит, такой как повреждение эндотелия и микротромбозы, может приводить к нарушениям свертываемости крови [93], в то время как хроническая гипоксия, повышение легочного артериального давления и напряжение желудочков могут еще сильнее повышать частоту сердечных нарушений у пациентов с COVID-19 [94]. Более того, устойчивая активация иммунной системы способна приводить к фиброзным изменениям [95] и нарушению расположения белков десмосом [96] — это может благоприятствовать развитию аритмии. Ранее было показано, что вирусная инфекция предшествует синдрому ПОТ [97], а учитывая экспрессию рецепторов АПФ2 нейронами, можно говорить о прямом негативном влиянии инфекции SARS-CoV-2 на вегетативную нервную систему [98]. Сложная комбинация инфекции, вызванного вегетативной нервной системой провоспалительного ответа и аутоиммунных реакций может способствовать возникновению вегетативной дисфункции и ПОТ [89]. Эти механизмы показаны на рисунке 2.
Когнитивные способности и психика
В исследованиях анализировали когнитивные функции и дефициты у пациентов с COVID-19. Предполагается, что вирус может вызывать септическую энцефалопатию, неиммунологические (гипотензия, гипоксия и тромбоз сосудов) и иммунологические эффекты (активация адаптивного иммунитета, микроглии и неадекватный цитокиновый профиль) [99]. Кроме того, пациенты, госпитализированные с COVID-19, жаловались на энцефалопатию, когнитивные нарушения, цереброваскулярные события/заболевания, припадки, гипоксические повреждения головного мозга, признаки нарушений в корково-спинномозговом пирамидном пути, дерегуляторный синдром, изменения ментального статуса и психиатрические состояния [24, 100, 101]. Эти результаты показывают, что неврологические симптомы, связанные с COVID-19, широко распространены, разнообразны и могут создавать существенные проблемы для реабилитации и медицинского ухода после выздоровления от COVID-19. Неизвестно, кто наиболее подвержен когнитивным нарушениям, вызываемым COVID-19, и как долго они сохраняются; тем не менее, в опыте пациентов и опубликованных кратких описаниях постковида «мозговой туман» фигурирует как частый и изнурительный симптом [102–104].
Известно, что критическое состояние, тяжелый острый респираторный синдром и длительная искусственная вентиляция легких имеют пагубные последствия в долгосрочной перспективе. До пандемии COVID-19 в ретроспективном исследовании пациентов ОРИТ с дыхательной недостаточностью, шоком или тем и другим вместе на протяжении срока госпитализации было показано, что у 71 % присутствовал бред, который продолжался около четырех месяцев после выписки [105]. В похожем исследовании обнаружили, что у 40 % пациентов ОРИТ после выписки когнитивные показатели соответствовали таковым у пациентов с умеренной черепно-мозговой травмой, в то время как у 26 % значения были близки к таковым при легкой форме болезни Альцгеймера. Также часто сообщалось о бреде, причем более длительный бред соответствовал худшим когнитивным способностям [106]. Учитывая, что многим пациентам с COVID-19 требуется помещение в ОРИТ и искусственная вентиляция легких, долгосрочные когнитивные нарушения и бред могут создавать значительные проблемы.
У лиц, перенесших острый COVID-19, встречаются инсульт и головная боль; по оценкам ONS, через пять недель частота головной боли составляет 10,1 % среди всех выживших после COVID-19 [13, 18, 34, 43, 53]. Повышенный уровень системного воспаления, проявляющийся у некоторых пациентов в виде «цитокинового шторма» в дополнение к активации глиальных клеток создает существенный риск для головного мозга и повышает вероятность неврологических проявлений, включая энцефалит и инсульт [74]. Такие проявления, как повышенная свертываемость крови [107] и кардиоэмболия, которые провоцируются повреждениями сердца, вызываемыми вирусом [108], могут приводить к повышению частоты инсультов после инфекции COVID-19. COVID-19 также связан с повышенным риском развития неврологических заболеваний, включая синдром Гийена — Барре [109] и нейродегенеративные состояния, такие как болезнь Альцгеймера [11].
Пандемия также оказывает негативное влияние на психику: люди, переболевшие COVID-19, демонстрируют длительные психические расстройства, включая посттравматическое стрессовое расстройство (ПТСР), депрессию, тревожность и обсессивно-компульсивные симптомы [36, 37, 111, 112]. Карантин, изоляция и социальное дистанцирование также оказывают повреждающее действие на психику и когнитивную деятельность. В обзоре утверждается, что чем дольше человек терпит карантинные ограничения, тем хуже это воздействует на психику [67], в то время как периоды изоляции и неспособности работать могут вызывать тревожность, одиночество и обеспокоенность финансовыми вопросами, а жизнь в период глобального кризиса может приводить к поведению избегания и поведенческим изменениям [113]. На психическое здоровье более крупных популяций влияют социальное дистанцирование и тому подобные меры. Оценивая взаимосвязь между одиночеством, физической активностью и психическим здоровьем до пандемии и во время нее, исследователи обнаружили, что пандемия в значительной степени усугубила негативные изменения на этой почве [114]. Люди, проживающие в домах престарелых, включая лиц с деменцией, уязвимы перед COVID-19 и другими последствиями пандемии. Показано, что люди с деменцией из домов престарелых становятся более депрессивными, тревожными, взволнованными и одинокими [115]. Длительная социальная изоляция у пациентов с деменцией, проживающих в домах престарелых, в большей степени приводила к обострению нейро-психиатрических и поведенческих нарушений, включая апатию, тревожность, волнение, скуку и замешательство, по сравнению с обитателями домов престарелых, у которых деменции не было [116, 117].
Сонливость также часто отмечается после выздоровления от COVID-19, и во многих исследованиях часто обнаруживается плохое качество и нарушения сна после завершения острой фазы инфекции [16, 25, 31, 44, 118, 119]. Более того, ретроспективное исследование медицинских наблюдений за лечением пациентов с COVID-19 в Сеуле, Южная Корея, выявило, что лекарственные препараты против проблем со сном были следующими по частоте выписки после средств для лечения лихорадки, кашля и насморка [120]. Осведомленность о смертности от COVID-19 также оказывает негативное влияние на качество сна, способствует стрессу, тревожности и другим отрицательным эмоциям [121]. Кроме того, показано, что нарушения сна могут быть связаны с одиночеством, вызванным мерами предосторожности против COVID-19 [122]. Все это приводит нас к вопросу, являются ли постковидные нарушения сна следствием коронавирусной инфекции, неблагоприятных эффектов пандемии или же всего в совокупности.
Возможные механизмы
Коронавирусы, в том числе SARS-CoV-2, могут инфицировать ЦНС через кровь или нейрональным ретроградным нейроинвазивным путем [123]. Механизм проникновения и последующее заражение ЦНС могут объяснить высокую частоту нейровоспаления у пациентов с COVID-19, что обусловливает развитие длительных повреждающих эффектов. Уже обнаружена связь вирусных инфекций и хронического нейровоспаления с нейродегенеративными заболеваниями и психическими расстройствами [123, 124]. SARS-CoV-2 может влиять на проницаемость гематоэнцефалического барьера, что позволяет периферическим цитокинам и прочим соединениям из крови проникать в ЦНС и способствовать нейровоспалению [125]. Тромбо-воспалительные пути могут служить причиной повышенной встречаемости инсульта при COVID-19 [126], в то время как «мозговой туман» может развиться из ПТСР или потери физической силы после критического заболевания и инвазивного лечения [127]. Данные позволяют предположить, что прямой вирусный энцефалит, системное воспаление, нарушение функции периферических органов и цереброваскулярные изменения могут способствовать развитию долговременных осложнений COVID-19 [128]. Потенциальные механизмы, затрагивающие ЦНС, показаны на рисунке 2.
Потеря обоняния и вкуса
После выздоровления от COVID-19 отмечаются стойкие нарушения обоняния и вкуса. Согласно оценкам ONS, частота потери обоняния и вкуса через пять недель среди всех людей, перенесших COVID-19, составляет 7,9 % и 8,2 %, соответственно [53]. В других исследованиях значения частоты обонятельной и вкусовой дисфункции среди всех групп пациентов, выздоровевших от COVID-19, варьировали от 11 дo 45,1 % [22, 39, 47].
Возможные механизмы
Экспрессия рецепторов АПФ2 вне нейронов может обеспечивать проникновение вируса SARS-CoV-2 в поддерживающие обонятельные клетки, стволовые и периваскулярные клетки. Tакая местная инфекция способна вызывать воспалительный ответ, который впоследствии снижает функцию обонятельных чувствительных нейронов. Кроме того, повреждая поддерживающие клетки, ответственные за локальный баланс воды и ионов, SARS-CoV-2 может косвенно ослаблять передачу сигналов от обонятельных нейронов к мозгу [129], результатом чего становится потеря способности воспринимать запахи.
Рецепторы АПФ2 также экспрессируются в слизистой оболочке полости рта, в частности, на языке [130]; таким образом, у SARS-CoV-2 есть прямой путь проникновения в ткани ротовой полости, что может приводить к повреждению клеток и нарушению функции. Более того, SARS-CoV-2 может связываться с рецепторами сиаловой кислоты [131], вызывая повышение вкусового порога и приводя к деградации вкусовых частиц до того, как они улавливаются [132]. Другой возможный механизм потери вкуса при COVID-19 и постковидном синдроме касается функциональной связи между обонянием и вкусом, благодаря которой восприятие вкуса ослабляется вследствие предшествующей обонятельной дисфункции [133].
Другие часто встречающиеся проявления
У людей с низким или высоким риском тяжелого острого заболевания результатом COVID-19 часто становится поражение многих органов [2, 13]. В исследованиях показано наличие острого поражения почек у пациентов, выздоровевших после COVID-19 и выписанных из больницы [134–136]. Хотя долгосрочное влияние COVID-19 на почки изучено неполно, в исследовании, в котором оценивалась функция почек у пациентов с COVID-19, обнаружилось, что у 35 % таких лиц функция почек была нарушена через шесть месяцев после выписки [50].
У людей с COVID-19 встречается острый панкреатит, вызванный SARS-CoV-2 [6, 137]; при этом уровень амилазы и липазы в сыворотке выше у людей с тяжелой формой заболевания по сравнению с таковыми у пациентов с легким COVID-19, а компьютерная томография показывает поражение поджелудочной железы [138]. В одномоментном поперечном исследовании обнаружилось, что через 141 день после заражения у 40 % пациентов, страдающих от COVID-19 и имеющих низкий риск развития тяжелой формы заболевания, присутствовало небольшое повреждение поджелудочной железы. Оно сопровождалось диареей, лихорадкой, головной болью и одышкой [13]. На основе отчетов о клинических случаях и вскрытий было выявлено влияние COVID-19 на селезенку, включая атрофию лимфоидных фолликулов и снижение количества T- и B-лимфоцитов, ведущее к лимфоцитопении, а также тромботические события, в том числе инфаркты [139–141]. В одномоментном поперечном исследовании у 4 % людей через 141 день после выздоровления от COVID-19 обнаружили небольшое поражение селезенки [13]. Рецептор АПФ2 экспрессируют и другие органы и ткани, такие как печень, желудочно-кишечный тракт, мышцы и кровеносные сосуды — все они восприимчивы к прямому поражению со стороны SARS-CoV-2 и непрямому повреждению через усиление системного воспаления [142–144]. После инфекции COVID-19 также обнаруживаются изменения кишечной микробиоты [145] и подострый тиреоидит [142].
Возможные механизмы
Поражение почек, связанное с COVID-19, может осуществляться несколькими механизмами, включая сепсис [143] и поражения легких, приводящие к изменениям гемодинамики и гипоксемии [144]. Рецептор АПФ2 в большом количестве экспрессируется в поджелудочной железе [4]; возможно, его уровень превышает таковой в легких [138]; однако неясно, является ли поражение поджелудочной железы прямым результатом проникновения в нее вируса или же вызывается системным воспалительным ответом, наблюдающимся при COVID-19 [146]. В селезенке также экспрессируются рецепторы АПФ2 [6], и основной причиной ее поражения может быть прямое заражение вирусом, а не только интенсивное системное воспаление [139]. Хроническое системное воспаление часто встречается спустя долгое время после окончания острой фазы инфекции COVID-19 [13]; таким образом, вероятно, что у людей с постковидным синдромом состояние усиленного воспаления вызывает длительные осложнения во множестве органов.
Факторы риска
Факторы риска тяжелого течения COVID-19 и госпитализации, а также летального исхода включают пожилой возраст, мужской пол, неевропеоидную этническую принадлежность, инвалидность и имеющиеся сопутствующие состояния, среди которых ожирение, сердечно-сосудистые заболевания, респираторные заболевания и гипертония [2, 13, 19, 147, 148]. Роль иммуносупрессии в риске тяжелого COVID-19 и возможного постковидного синдрома обсуждается. Иммуносупрессия может обладать защитными эффектами против долгосрочных последствий инфекции COVID-19 [149–151]; однако эти результаты противоречивы [152, 15].
Факторы риска развития постковидного синдрома недооцениваются. Для изучения характеристик, связанных с симптомами постковида, были опрошены 274 негоспитализированных пациента c COVID-19 в сроки между 14 и 21 днями после получения положительного результата теста. Факторы риска для невозврата к «обычному здоровому состоянию» включали возраст (P = 0,01) — возрастная группа ≥ 50 лет имеет наибольшее отношение шансов — и число имеющихся сопутствующих состояний (P = 0,003) — чем больше их количество, тем выше отношение шансов не вернуться в «обычное здоровое состояние». Наибольшее влияние на такие шансы оказывали гипертензия (отношение шансов [ОШ] = 1,3; P = 0,018), ожирение (OШ = 2,31; P = 0,002), психические расстройства (OШ = 2,32; P = 0,007) или состояние иммуносупрессии (OШ = 2,33; P = 0,047) [18].
В одномоментном поперечном исследовании была найдена связь между тяжестью острой инфекции COVID-19 и проявлений заболевания после выздоровления, демонстрирующая, что более тяжелая острая фаза может переходить в более тяжелые симптомы постковида [43]. Когортное исследование, тем временем, подтвердило этот вывод: пациенты с более чем пятью симптомами во время первоначальной инфекции COVID-19 и пациенты, которым требовалась госпитализация, с большей вероятностью страдали от проявлений постковидного синдрома [34].
Несмотря на то, что некоторые факторы могут повышать риск как тяжелого течения COVID-19, так и постковидного синдрома, ряд факторов, связанных с COVID-19, при этом не усиливают риск постковида. Мужской пол и пожилой возраст связаны с повышенным риском тяжелого COVID-19, однако ONS сообщает, что частота любых симптомов постковида выше у женщин по сравнению с мужчинами (23,6 % против 20,7 %), в то время как возрастную группу, наиболее подверженную постковидному синдрому, составляют люди в возрасте 35–49 лет (26, 8 %), за ними следуют люди в возрасте 50–69 лет (26,1 %) и люди в возрасте ≥ 70 лет (18 %) [53]. Более того, в перспективном когортном исследовании выздоровевших пациентов не было найдено базовых клинических характеристик, связанных с последующим развитием симптомов постковида [154]. На этот риск не влияют пол, возраст и сопутствующие заболевания, включая ожирение, диабет и сердечно-сосудистые патологии. Однако предсуществующая астма значительно связана с постковидным синдромом [34].
Лечение постковидного синдрома
ВОЗ и Группа форума постковидного синдрома соглашаются, что приоритет в изучении постковида должен отдаваться улучшению клинических характеристик, а также исследованию и разработке терапевтических подходов [155, 156]. Клиническая характеристика пациентов с постковидным синдромом необходима для обеспечения соответствующих вариантов лечения. Понимание того, почему определенные проявления заболевания присутствуют у различных индивидуумов — важный элемент в решении проблемы. Обзор пациентов с постковидным синдромом позволяет предположить, что это состояние может на самом деле быть четырьмя различными синдромами [102]. Отнесение таких пациентов в определенные подгруппы по проявлению постковида и понимание его патофизиологии будут важны для определения необходимого типа лечения.
Руководства
Различные руководства фокусируются на лечении и ведении пациентов с постковидным синдромом или включают рекомендации по постковиду в руководства по лечению COVID-19 [9]. В руководствах содержатся рекомендации, как выявлять, направлять и лечить пациентов с постковидным синдромом. Комплексные подходы к оценке, исследованию и лечению, предложенные NICE [9], представлены на рисунке 3. В январе 2021 года ВОЗ обновила руководства и включила в него разделы, посвященные медицинской помощи пациентам с постковидным синдромом [157], однако и они почти не касаются деталей постковида. Сходным образом NIH выпустил руководства по ведению пациентов с COVID-19 [158], лишь в малой степени затрагивающие постковидный синдром. Ожидается, что руководства по лечению постковидного синдрома в ближайшее время опубликует CDC [159]. Также руководство по диагностике и лечению сердечно-сосудистых заболеваний в ходе пандемии выпустило Европейское общество кардиологов [160]. С появлением новых данных, несомненно, руководства по лечению и ведению пациентов с постковидным синдромом будут совершенствоваться; так или иначе, для лечения постковида могут быть полезны и другие общие руководства — как, например, Руководство доказательной медицины по постинфекционным синдромам [161].
Легочные симптомы
Легочные симптомы обычны при постковидном синдроме. NICE рекомендует исследовать затруднения дыхания с помощью теста на толерантность к физической нагрузке, соответствующей возможностям пациента, например, одноминутной пробы с приседаниями. Лечение должно быть междисциплинарным, с советами и обучением. Более того, руководства предлагают пациентам с продолжающимися респираторными симптомами проводить рентгенографию грудной клетки через 12 недель после заражения [9]. Уровень кислорода в крови можно отслеживать с помощью пульсоксиметра.
В рекомендациях от клиники Мэйо предполагается, что с затруднением дыхания можно бороться самостоятельно, ограничивая действие факторов, усугубляющих одышку, включая прекращение курения, избегание загрязняющих веществ, чрезмерно высоких и низких температур и физических упражнений [162], однако хроническая одышка может потребовать дальнейшего вмешательства. Известные нефармакологические стратегии борьбы с одышкой включают дыхательные упражнения [163], легочную реабилитацию [164] и поддержание оптимальной осанки [165]. Между тем, в систематическом обзоре обнаружено, что для лечения диспноэ можно применять пероральные опиоиды [166]; таким образом, этот класс лекарственных препаратов может оказаться полезным для лечения дыхательных затруднений у людей с постковидным синдромом.
Пациентов с фиброзом легких вследствие COVID-19 следует вести в
соответствии с руководствами NICE по идиопатическому легочному фиброзу
[167]. В то же время может быть полезной противофиброзная терапия [168].
Обострения бронхоэктазии следует лечить с помощью антимикробных
препаратов [169]; можно рассматривать и применение других
терапевтических подходов, таких как очистка дыхательных путей [170].
Модифицированные практики реабилитации, такие как растяжка, повороты
тела, акупрессура и массаж, в небольшом клиническом испытании показали
долгосрочные благоприятные эффекты у пациентов с респираторными
симптомами вследствие COVID-19 [171].
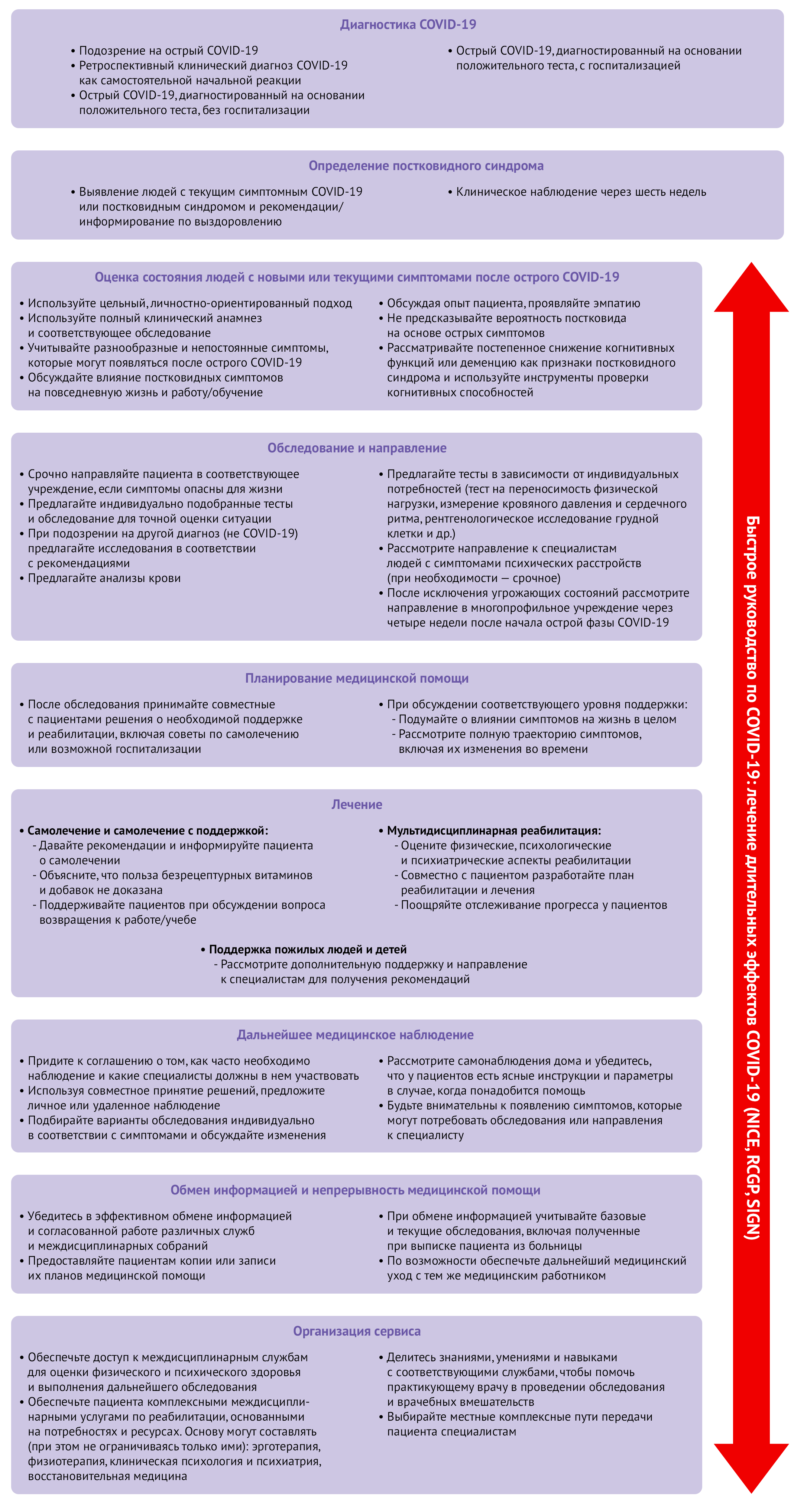
Рисунок 3 | Oбзор руководства NICE: лечение длительных эффектов COVID-19
Сердечно-сосудистые симптомы
В рекомендациях NICE по постковидному синдрому говорится, что для оценки функции сердца можно использовать тесты на переносимость физической нагрузки; при подозрении на синдром ПОТ следует регистрировать кровяное давление и ритм сердцебиения в положениях лежа и стоя [9]. Следует незамедлительно обследовать лиц с симптомами опасных для жизни осложнений, таких как боль в области сердца.
Европейское общество кардиологов выпустило исчерпывающее руководство по диагностике и лечению сердечно-сосудистых заболеваний во время пандемии COVID-19 [160]. Cпектр сердечно-сосудистых заболеваний, которые могут проявляться при постковидном синдроме, требует соответствующего разнообразия возможных терапевтических подходов. Таким образом, большое значение имеют текущее наблюдение и изучение сердечных биомаркеров. Руководства NICE рекомендуют применение β-блокаторов для терапии ряда сердечных состояний, включая стенокардию [172], нарушения ритма сердца [173] и острые коронарные синдромы [174]; таким образом, β-блокаторы могут быть полезны при лечении сердечно-сосудистых проявлений постковидного синдрома. Миокардит может естественным путем разрешиться с течением времени; тем не менее, поддерживающая и/или иммуномодулирующая терапия может улучшить процесс выздоровления, как описывается в систематическом обзоре [175]. В этом же обзоре предполагается, что для уменьшения рисков, связанных с повышенной свертываемостью крови, можно применять антикоагулирующие препараты [176]. Тем временем, как показано в рандомизированном контролируемом испытании и обсуждается в обзоре, пользу при лечении ПОТ могут принести советы и обучение; средства, поддерживающие сосудистый тонус, и средства, позволяющие контролировать пальпитацию [89, 177].
Лечение усталости, когнитивных и нейропсихиатрических симптомов
Хроническая усталость — частое проявление постковидного синдрома. Согласно рекомендациям NICE, для ее лечения важны самопомощь и поддержка, поскольку специфические к COVID-19 терапевтические средства труднодоступны [9]. МЭ/СХУ — состояние, которое может перекрываться с постковидной усталостью; таким образом, алгоритм лечения, разработанный для МЭ/СХУ, может оказаться полезным для борьбы с усталостью, возникшей после COVID-19. NICE выпустила специфические руководства по направлению и лечению пациентов с МЭ/СХУ; они включают когнитивно-поведенческую терапию (КПТ) и дифференцированную лечебную физкультуру (ДЛФК) [178]. Однако после негативной реакции со стороны Ассоциации МЭ [179] NICE планирует опубликовать руководства в пересмотренном варианте в августе 2021 года [180].
В рандомизированных контролируемых исследованиях было показана польза КПТ при лечении хронической усталости [181]. Тем не менее, этому противоречат результаты повторного анализа Кокрановского обзора, которые ставят под вопрос ее эффективность и демонстрируют высокую частоту побочных эффектов. В этом исследовании с повторным анализом утверждается, что если клиническое испытание лекарственного средства или хирургической процедуры продемонстрировало столь же высокие показатели побочных эффектов, его нельзя рассматривать в качестве безопасного варианта лечения, поэтому КПТ следует придерживаться такого же уровня проверки [182].
Другой стратегией борьбы с хронической усталостью служит пейсинг (равномерное распределение активности и знание своих границ — прим. перев.), при котором пациенты контролируют выполнение задач и проявления активности, чтобы избежать переутомления и изнуряющей усталости. В руководствах NICE по МЭ/СХУ [178] пейсинг описывается как стратегия самопомощи, однако рекомендации и обучение со стороны специалистов из сферы здравоохранения также могут быть полезны для пациентов. На сегодняшний день данных об использовании пейсинга при лечении постковидного синдрома, полученных на основании рандомизированных контролируемых исследований, нет.
Проведение групповой терапии для людей с ранними стадиями психоза в ходе пандемии COVID-19 дало многообещающие результаты; в пилотном исследовании показано уменьшение симптомов психоза и улучшение самооценки [183]. Там не менее, в обзорной статье приводится информация, которая позволяет предположить, что КПТ неэффективна для ослабления симптомов постковида, включая усталость: только 10 % участников достигают клинически значимого улучшения [184].
ДЛФК представляет собой структурированный план лечения, состоящий из форм физической активности для достижения терапевтических целей [185]. Систематический обзор лечебной физкультуры для пациентов с СХУ приводит к выводу, что лица с МЭ/СХУ по окончании курса ЛФК в целом ощущают меньшую усталость, и у них в большей степени улучшается сон и физическая форма по сравнению с теми, кто следовал программе адаптивного пейсинга или поддерживающего слушания [186]. ДЛФК рекомендуют руководства NICE по МЭ/СХУ; однако в июле 2020 года NICE выпустил заявление, призывающее использовать ДЛФК для людей, перенесших COVID-19, с осторожностью, утверждая, что после происходящих в настоящее время обновлений руководств эти рекомендации могут измениться [187]. Это заявление также сопровождается опасениями по поводу возможных отрицательных эффектов ДЛФК, в том числе недомогания после физических упражнений [188].
Конкретных данных относительно COVID-19 крайне недостаточно, поэтому при лечении когнитивных нарушений необходима поддержка, включая постановку конкретных достижимых целей и применение проверенных инструментов обследования [9]. Терапия когнитивных нарушений требует целостного подхода; так или иначе, пациентов следует информировать о том, что большинство людей постепенно выздоравливают после нарушения когнитивных функций вследствие тяжелых заболеваний [106, 189]. Комплексный подход к лечению должен распространяться на предлагаемые услуги с привлечением специалистов, включая профессиональных терапевтов, логопедов и лингвистов, занимающихся когнитивными изменениями [190]. Когнитивные нарушения при постковиде, иногда называемые «мозговым туманом», сравнивают с «химическим мозгом» (состояние угнетения когнитивных способностей у пациентов, проходящих курс химиотерапии, — прим. перев.) [191]. Рекомендации клиники Мэйо предлагают стратегии лечения «химического мозга», включая повторяющиеся упражнения, отслеживание факторов, влияющих на дефицит, применение психологической разгрузки и стратегий преодоления. Более того, можно рассмотреть применение лекарственных препаратов, таких как метилфенидат, донепезил, модафинил и мемантин [192]. Эти стратегии могут оказаться полезными при постковидном синдроме. Природный флавоноид лютеолин может специфически ослаблять когнитивные нарушения при постковидном синдроме путем подавления активации тучных клеток и микроглии [191], но необходимы клинические исследования. С нарушениями сна можно бороться, следуя соответствующим рекомендациям по бессоннице [193]; также можно рассмотреть ряд терапевтических стратегий [194–197]. Для лечения пациентов, имеющих проблемы с психикой вследствие постковидного синдрома или же в качестве сопутствующих состояний, можно использовать следующие руководства: по депрессии [198], по тревожности [199], по ПТСР [200], по обсессивно-компульсивному расстройству [201] и другим психическим проблемам [202]. Обитатели домов престарелых, включая лиц с деменцией, имеют особые потребности [116]. Обсуждение с пациентами их психических проблем требует сочувствия и понимания [203].
Лечение поражения прочих органов
Текущие данные о восстановлении функции почек после COVID-19 скудны. Учитывая, что ранние и пристальные медицинские наблюдения со стороны нефрологов ранее оказывались эффективными [204], для пациентов с постковидным нарушением функции почек ранний и постоянный мониторинг может быть весьма полезен. COVID-19 способен разобщать и изменять кишечный микробиом, что может способствовать развитию оппортунистических инфекций [145]. Связанный с COVID-19 деструктивный тиреоидит может приводить к случаям гипертиреоза, который можно лечить с помощью кортикостероидов [142]. В целом, пристальное наблюдение за пациентами с постковидным синдромом и соответствующие процедуры обследования следует поддерживать для точной диагностики и лечения характерных симптомов.
Применение лекарственных средств для лечения постковидного синдрома
В качестве возможного способа лечения COVID-19 были предложены антигистаминные препараты. Исследование, включавшее эксперименты на культурах клеток, позволило предположить, что антагонисты гистамина 1 могут быть способны снижать уровень возбудителя, ингибируя проникновение SARS-CoV-2 в клетки, экспрессирующие АПФ2 [205]. На основе систематических обзоров и молекулярных исследований предполагается, что антагонисты гистамина 1 и гистамина 2 — перспективные кандидаты для дальнейших клинических испытаний их эффективности для лечения COVID-19 [206–208]. Следует выяснить, обладают ли антигистаминные препараты потенциалом для лечения постковидного синдрома. Также для ослабления эффектов постковида предлагаются антидепрессанты. Применение антидепрессантов связано со снижением риска интубации и смерти при COVID-19 [209], а метаанализ терапии антидепрессантами, включая ингибиторы обратного захвата серотонина и норадреналина и селективные ингибиторы обратного захвата серотонина, при большом депрессивном расстройстве выявил снижение уровня маркеров периферического воспаления [210].
Новые методы лечения
В настоящее время продолжаются клинические испытания эффективности гипербарического кислорода (NCT04842448), монтелукаста (NCT04695704) и деупирфенидона (NCT04652518) для лечения респираторных заболеваний при постковидном синдроме. Также исследуется польза дыхательных упражнений и пения (NCT04810065).
На сегодняшний день продолжается исследование для оценки эффективности восьминедельной программы упражнений для пациентов с постковидным синдромом и усталостью (NCT04841759). Для лечения усталости у пациентов с постковидным синдромом могут оказаться полезными добавки витамина C; по данным систематического обзора, внутривенное введение больших доз витамина С может быть эффективным вариантом терапии [211]. LOVIT-COVID (NCT04401150) — текущее клиническое испытание, цель которого — оценка влияния внутривенного введения высоких доз витамина С на госпитализированных пациентов с COVID-19.
Tакже проводятся два клинических исследования эффектов пищевой добавки никотинамидрибозида (NCT04809974, NCT04604704). Ожидается, что данное соединение ослабит когнитивную симптоматику и усталость, регулируя провоспалительный ответ [212].
Еще в одном текущем клиническом испытании оценивается эффективность пробиотических добавок для нормализации состава кишечного микробиома и снижения воспаления при постковидном синдроме (NCT04813718). Со временем понимание долгосрочных влияний инфекции COVID-19 на желудочно-кишечный тракт будет развиваться, в том числе при участии текущих исследований (NCT04691895), что, с свою очередь, окажет влияние на лечение.
Другим возможным вариантом лечения может быть использование соединений, подавляющих интенсивный воспалительный ответ, который наблюдается при COVID-19. Леронлимаб — моноклональное антитело, которое блокирует функцию цитокина CCL-5. Показано, что оно эффективно и безопасно при ВИЧ [213] и понижает уровень интерлейкина 6 в плазме при COVID-19 [214]. В настоящее время проводятся клинические испытания для измерения эффективности леронлимаба при постковидном синдроме (NCT04343651, NCT04347239, NCT04678830). Еще одно антитело, тоцилизумаб, блокирует рецепторы интерлейкина 6 и показало свою эффективность в небольшом клиническом испытании на пациентах с COVID-19 [215]. Исследования эффектов тоцилизумаба продолжаются (NCT04330638). При лечении постковидного синдрома также могут быть полезны антиоксидантные и и противовоспалительные свойства мелатонина [216]. Наконец, исследуется эффективность лечения постковида адъювантами, такими как адаптогены (NCT04795557).
Заключение
Учитывая большое количество людей, перенесших COVID-19 и болеющих им в настоящее время, возрастает обеспокоенность его долгосрочными последствиями. В данной статье авторы рассмотрели исследования, в которых изучались стойкие симптомы постковидного синдрома, затронули вопрос о возможных факторах риска его развития и варианты лечения, которые могут быть полезны для облегчения симптоматики. На сегодняшний день постковидный синдром остается загадкой и, поскольку все более актуальными становятся вопросы влияния новых вариантов SARS-CoV-2 на частоту встречаемости и тяжесть постковида, важно продолжать его изучение. Для того, чтобы снизить нагрузку на людей с постковидным синдромом и системы здравоохранения, которые прикладывают усилия для их поддержки, необходимо углублять понимание его патогенеза, факторов риска, симптомов и методов лечения.
Вопросы для исследования
- Какова точная эпидемиология постковидного синдрома и как новые варианты SARS-CoV-2 будут влиять на эпидемиологию и тяжесть постковидного синдрома?
- Каковы основные факторы развития постковидного синдрома и как наилучшим образом снизить риск долгосрочных симптомов постковида у пациента?
- Какие симптомы или совокупность симптомов можно использовать для классификации постковида с целью улучшения диагностики и лечения?
- Какова оптимальная стратегия лечения и ведения пациентов с постковидным синдромом? Будет ли она неспецифичной или же потребует прицельного и и персонализированного подхода?





