Аннотация
В развитии атеросклероза участвует как врожденный, так и адаптивный иммунитет. Исследования на экспериментальных животных показали, что некоторые иммунные реакции защищают от атеросклероза, в то время как другие способствуют прогрессированию заболевания. Эти наблюдения позволяют предположить, что можно разработать новые методы лечения сердечно-сосудистых заболеваний путем селективной модуляции атеропротекторных и проатерогенных иммунных реакций. Недавние достижения в лечении рака с использованием ингибиторов иммунного контроля и CAR (chimeric antigen receptor, химерный антигенный рецептор) Т-клеточной терапии служат прекрасными примерами влияния на иммунную систему для борьбы с болезнью.
Накопившийся в стенке артерии ЛПНП (липопротеин низкой плотности) является ключевым аутоантигеном при атеросклерозе, и считается, что активация антигенспецифических Т-хелперов 1-го типа способствует воспалению бляшек. Исследования, направленные на подтверждение этой концепции путем иммунизации экспериментальных животных окисленными частицами ЛПНП, неожиданно привели к активации атеропротекторного иммунитета с участием регуляторных Т-клеток. Это побудило несколько исследовательских групп заняться разработкой вакцин против атеросклероза. В данном обзоре мы обсудим экспериментальные и клинические данные, подтверждающие возможность разработки иммунотерапии для снижения риска сердечно-сосудистых заболеваний. Мы также подведем итоги текущих клинических исследований и обсудим проблемы, связанные с разработкой эффективной и безопасной вакцины против атеросклероза.
Роль иммунной системы в развитии атеросклероза
Врожденные и адаптивные иммунные реакции при атеросклерозе
Иммунный ответ опосредует весь процесс развития атеросклероза. Атеросклеротическое поражение — это местное иммунное воспаление, провоцируемое и распространяемое медиаторами, которые вырабатываются макрофагами и Т-клетками [11]. Другие типы иммунных клеток, вовлеченных в патогенез атеросклероза, включают в себя дендритные клетки, натуральные киллеры и врожденные лимфоидные клетки [11,12].
Макрофаги бляшек необыкновенно пластичны: их фенотип варьирует от классических провоспалительных клеток M1, которые продуцируют множество воспалительных цитокинов и аутокоидов, до метаболически активных клеток M2 и липидных пенистых клеток [13]. Локальная активация этих клеток в очаге поражения зависит от врожденных иммунных механизмов, в которых поверхностные рецепторы распознавания паттернов связываются определенными молекулярными агентами в процессе, который запускает производство медиаторов воспаления (рис. 1). Среди лигандов для рецепторов распознавания мы находим модифицированные ЛПНП (липопротеины низкой плотности), а также кристаллы холестерина.
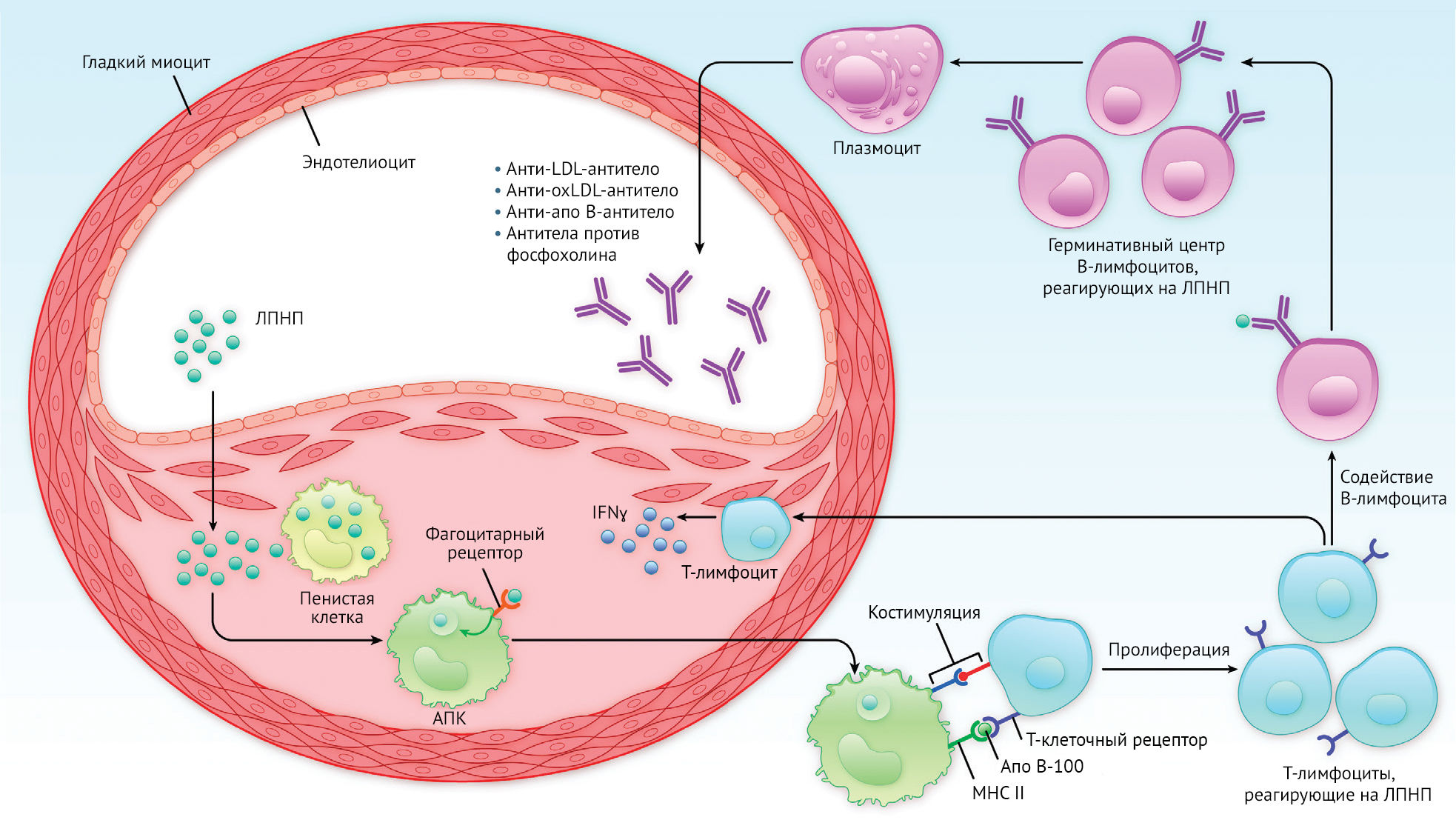
Рисунок 1 | Адаптивный иммунитет при атеросклерозеПатогенез заболевания запускается, когда ЛПНП (липопротеины низкой плотности) поступают в интиму артерии, накапливаются в сетке протеогликана, подвергаются различным химическим модификациям и могут усваиваться клетками. Макрофаги, которые накапливают ЛПНП таким путем, превращаются в пенистые клетки, содержащие липиды. К числу антигенпрезентирующих клеток (АПК) относятся специализированные дендритные клетки, которые могут представлять антиген de novo интактным Т-клеткам, а также макрофаги, которые презентируют антиген для активации эффекторных Т-клеток. Оба этих типа клеток могут усваивать ЛПНП через скавенджер-рецепторы и рецепторы ЛПНП. Презентация антигена происходит, когда пептиды апо B-100, полученные из усвоенных ЛПНП, появляются на поверхности АПК, связанные с белком главного комплекса гистосовместимости класса II (MHC).
Эти комплексы белка с MHC распознаются апо B-100-реактивными Т-клетками, ответ которых заключается в активации и пролиферации. Некоторые реактивированные эффекторные Т-клетки (Т-хелперы 1, Th1) индуцируют воспаление, выделяя цитокины, включая молекулу, активирующую макрофаги, интерферон γ, а также другие факторы. Другие эффекторные T-клетки (T-фолликулярные хелперные клетки) обеспечивают помощь в активации ЛПНП-реактивных B-клеток. Последние созревают в герминативных центрах лимфатических фолликулов и дифференцируются в плазматические клетки, которые продуцируют большое количество антител (IgG), реагирующих на различные части ЛПНП.
Иллюстрация: Бен Смит. Адаптировано из Gisterå и Hansson [11]. IFN — интерферон; oxLDL — окисленный ЛПНП; MHC II — молекула главного комплекса гистосовместимости класса II.
Врожденные иммунные реакции могут быть нацелены на блокирование антител к провоспалительным цитокинам. В исследовании CANTOS (Canakinumab Antiinflammatory Thrombosis Outcome Study) инъекции блокирующих антител к IL-1β снижали риск серьезных неблагоприятных сердечно-сосудистых событий [7]. Хотя в этом исследовании фигурировало введение рекомбинантных антител, теоретически возможно иммунизировать, то есть вакцинировать против такого типа цитокинов и создавать эндогенные блокирующие антитела. Однако такая стратегия означала бы отказ от части системы защиты организма-хозяина на постоянной основе и могла бы привести к повышенной склонности к приобретению тяжелых инфекций. Этот недостаток, очевидно, делает данную стратегию менее привлекательным способом профилактики сердечно-сосудистых заболеваний. Примеры исследований пассивной иммунизации при сердечно-сосудистых заболеваниях атеросклеротического генеза приведены в таблице 1.
Таблица 1 | Некоторые исследования пассивной иммунизации при сердечно-сосудистых заболеваниях атеросклеротического генеза
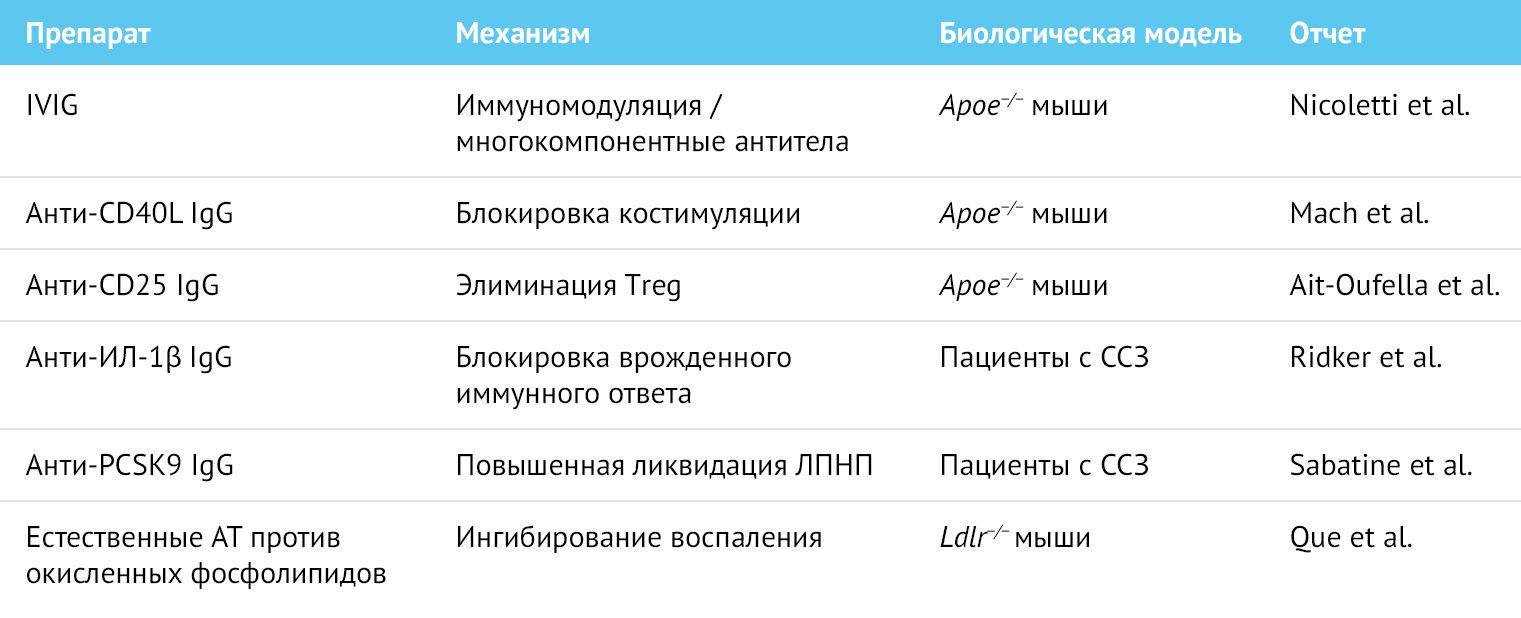
ИЛ – интерлейкин, IVIG – интравенозный иммуноглобулин, PCSK9 — Пропротеиновая конвертаза субтилизин-кексинового типа 9, Treg – Т-регуляторные клетки
Активация адаптивного иммунитета
Стратегии вакцинации обычно используют адаптивные иммунные ответы. Последние зависят от генерации уникальных клонотипических рецепторов антигена, которые развиваются в процессе созревания Т и В-клеток. Таким образом, каждый клеточный клон распознает специфическую молекулярную структуру, называемую эпитопом; это может быть пептидная последовательность или конформационная структура белков, углеводов или липидов. В то время как Т-клетки обычно распознают довольно четко определенные линейные олигопептидные последовательности от 8 до 17 аминокислот, В-клетки обладают способностью распознавать широкий спектр эпитопов, которые часто являются конформационными и не ограничиваются пептидами или белками.
Однако эти два типа клеток взаимосвязаны, поскольку для полной активации B-клеток требуется помощь специализированных T-клеток, которые распознают эпитопы на том же антигене, что и B-клетки. Кроме того, активация Т-клеток требует представления пептидных эпитопов на АПК, которые отображают их на белках MHC. Активация Т-клеток может привести к множеству различных результатов в зависимости как от существовавшего ранее фенотипа активированной клетки, так и от ее микроокружения во время активации. Т-клетки линии CD8 распознают антигенные эпитопы, представленные на белках MHC класса I, которые могут экспрессироваться большинством клеток. Эти антигены обычно продуцируются АПК и в типичных случаях включают компоненты вирусов. Эффекторный ответ клетки CD8 включает цитотоксическую атаку против АПК. Это важный компонент системы защиты организма-хозяина от вирусов, внутриклеточных бактерий и опухолей.
Т-клетки типа CD4 распознают антигены, представленные на белках MHC класса II, которые проявляют гораздо более ограниченную экспрессию. Белки MHC II конститутивно экспрессируются специализированными АПК, то есть дендритными клетками и макрофагами, и могут индуцироваться на некоторых других типах клеток путем стимуляции интерфероном-γ. Активация «необученных» Т-клеток требует представления антигена дендритными клетками, которые несут весь аппарат, необходимый для активации Т-лимфоцитов de novo. Помимо высокой плотности белков MHC II, он включает в себя набор ко-стимулирующих факторов, то есть белки клеточной поверхности, которые могут связывать свои аналоги на Т-клетке, а также Т-клеточные стимулирующие цитокины. После активации Т-клетки, ранее никогда не встречавшиеся с антигеном, превращаются в эффекторные клетки, которые могут стимулировать или регулировать иммунитет и воспаление. Точный путь, по которому идут Т-клетки, зависит от микроокружения. Например, в присутствии ИЛ-12 инициируется транскрипционный путь T-bet (транскрипционный фактор T-box), который ведет к дифференцировке в провоспалительные клетки Th1, тогда как TGF-β (трансформирующий фактор роста β) действует через FoxP3-транскрипционный фактор (forkhead box P3) и способствует дифференцировке в иммуносупрессивные Т-регуляторные клетки.
В-клетки и развитие гуморального иммунитета
Дифференцировка В-лимфоцитов — это даже более сложный процесс, чем дифференцировка Т-лимфоцитов. Он не только требует распознавания антигенов и помощи Т-клеток, но и включает в себя преобразование антигенных рецепторов в секретируемые антитела — иммуноглобулины. Первый этап активации приводит к выработке IgM-антител. Новая встреча с антигеном вызывает целый каскад реакций, опосредуемых Т-клетками. Ген антитела перестраивается, чтобы произвести меньшие антитела IgG (а также IgA и IgE), затем секретируется их большое количество, и клетка активно пролиферирует, чтобы сформировать клоны, продуцирующие то же самое антитело.
Если иммуностимуляция прекращается, В-клетки памяти сохраняют способность к выработке антител, если антиген появляется снова. С другой стороны, продолжающаяся антигенная стимуляция приводит к дальнейшей дифференцировке В-клеток в лимфатических узлах в плазматические клетки, специализирующиеся на производстве огромного количества специфических антител. Роль В-клеток в развитии атеросклероза является сложной: с одной стороны, они опосредуют защитные механизмы, с другой — способствуют развитию заболевания [18,19].
(Ауто)антиген(ы) атеросклероза
Т-клетки бляшки, как и другие Т-клетки, активируются локальными специфическими антигенами. В большинстве экспериментальных исследований были выявлены три типа антигенов: липопротеин плазмы (ЛПНП), белок плазмы β2-гликопротеин Ib и белки теплового шока, продуцируемые стрессированными сосудистыми клетками. Было показано, что иммунизация всеми тремя типами антигенов влияет на развитие поражения. Подавляющее большинство информации связано с ЛПНП, и именно им будет уделено основное внимание в данном обзоре. На рисунке 1 представлено схематическое изображение адаптивных иммунных механизмов развития атеросклероза.
Было обнаружено, что Т-клетки, выделенные из атеросклеротических бляшек человека, удаленных во время операции, представляют собой CD4+ Т-лимфоциты, рестриктированные по МНС класса II, которые распознают частицы ЛПНП и демонстрируют провоспалительный фенотип Th1 [22]. Кроме того, среди CD4+ лимфоцитов наблюдаются некоторые клетки Th2 и смешанные фенотипы. Меньшая часть популяции Т-клеток бляшки состоит из CD8+ Т-лимфоцитов.
На ЛПНП нацелены не только Т-клетки бляшки, но и циркулирующие антитела, генерируемые в ходе системного иммунного ответа, который сопровождает атеросклероз. В то время как Т-клетки распознают пептидные последовательности апо B-фрагмента ЛПНП, антитела, продуцируемые В-клетками, могут также связываться с другими структурами: липидными эпитопами; эпитопами, которые генерируются в ходе конформационных изменений белковой части, а также аддуктами, индуцированными окислением полипептидной цепи. Был обнаружен ответ антител на окисленные частицы ЛПНП [23]; позже было показано, что он частично обусловлен герминальными антителами, продуцированными B1-клетками [24].
Когда в 1980-х годах был обнаружен клеточный иммунный ответ в ходе патогенеза атеросклероза, он считался исключительно механизмом, способствующим развитию заболевания. Однако исследования по иммунизации в 1990-х годах показали, что это не так. Оказалось, что кролики с гиперхолестеринемией, иммунизированные окисленным ЛПНП, имеют меньшие, а не большие повреждения, чем животные контрольной группы [25–27]. Эти результаты позволяют предположить, что иммунный ответ направлен против прогрессирования заболевания и носит защитный характер. Авторы обзора предположили, что профилактики заболевания можно добиться путем мобилизации такого атеропротекторного иммунитета с помощью вакцинации [28,29].
Диссекция иммунных эффекторных функций в экспериментальных моделях
Когда для изучения атеросклероза стали доступны ген-таргетные модели мышей, появилась возможность разделить ассоциированный с болезнью иммунный ответ на части, задействуя все механизмы иммунологии мышей. Было обнаружено, что мышиные штаммы некоторых гаплотипов MHC, в частности, штамм C57BL/6, экспрессирующий класс MHC с I-Ab, особенно чувствительны к развитию атеросклероза. В то время как у мышей дикого типа этого штамма липидные полоски развиваются только при воздействии диеты с высоким содержанием жиров, у мышей C57BL/6, несущих таргетные гены apoe или ldlr, развивается тяжелая гиперхолестеринемия и полномасштабный атеросклероз.
Первые прямые доказательства наличия антительной защиты от атеросклероза были получены в результате исследований, в которых мышам apoe−/− вводили поликлональные иммуноглобулиновые антитела (по сути это было внутривенное лечение иммуноглобулином) [14]. Очаги поражения в результате уменьшились примерно на 50 %; это свидетельствует о том, что пассивная иммунизация путем переноса антител может снизить выраженность заболевания. Однако было неясно, была атеропротекция обусловлена иммунным распознаванием антител к иммуноглобулину или иммуномодулирующими свойствами, которые, как известно, проявляют внутривенные иммуноглобулиновые препараты. Последующие исследования показали, что в данных экспериментах важной причиной атеропротекции является иммуномодулирующее действие связывания Fc-рецепторов [30,31]. Однако пассивная иммунизация специфическими антителами к модифицированным частицам ЛПНП также способна ингибировать заболевание, демонстрируя защитную способность анти-ЛПНП-антител.
На мышиных моделях было выявлено несколько важных иммуномодулирующих эффекторных механизмов, действующих при атеросклерозе. Когда CD4+CD25+ T-регуляторные клетки истощаются, болезнь прогрессирует [16]. Также атеросклероз резко усиливается, когда дифференцировка Т-клеток в T-регуляторные лимфоциты блокируется путем направленного действия на транскрипционный фактор FoxP3 [33]. Объем повреждений также увеличивается, когда любой из цитокинов T-регуляторных клеток (ИЛ-10 и TGF-β) подвергается направленному действию или иным образом ингибируется [34,35]. Недавние исследования показывают, что антигензависимая активация T-регуляторных клеток MHC II класса имеет важное значение для их атеропротекторного действия [36]. Таким образом, дефицит MHC класса II приводит к появлению более крупных поражений, тогда как введение в организм дендритных клеток с MHC класса II вместе с CD4+ Т-клетками уменьшает размеры поражений.
Все эти исследования демонстрируют важную роль иммунитета в процессах атеропротекции, но не показывают конкретные антигены, способные вызывать такие иммунные реакции. Например, можно было бы создать механизм, посредством которого иммунные реакции, связанные непосредственно с патогенезом заболевания (например, реакция на компоненты ЛПНП), вступали бы во взаимодействие со множеством других иммунных реакций, а также с эндогенными или микробными антигенами для последующей активации популяций атеропротекторных T-регуляторных лимфоцитов.
Стратегии вакцинации при атеросклерозе
Активная иммунизация путем введения пептидов-производных ЛПНП или апо В значительно снижает интенсивность атеросклероза у мышей как с apoe−/−, так и с ldlr−/− [37–42]. Гуморальные иммунные реакции с участием специфических антител к иммунизирующим антигенам вовлекаются в эти процессы в качестве иммунорегуляторных клеточных реакций с участием T-регуляторных клеток. В этих исследованиях, как и практически во всех исследованиях иммунизации, для усиления иммунного ответа были использованы адъюванты. Они включают в себя минеральное масло, убитые микобактерии, соли алюминия и модифицированные белки, которые, как известно, стимулируют врожденные иммунные реакции.
Иммунолог Чарльз Джейнвей назвал потребность в адъювантах «маленьким грязным секретом» иммунологии из-за того, что для индуцирования адаптивного иммунитета используют адъювантные препараты, но редко упоминают о важности врожденной иммунной активности [43]. На самом деле, наиболее часто используемый адъювант в исследованиях на мышах, полный адъювант Фрейнда, содержит убитые горячим паром микобактерии и обладает сильным провоспалительным действием. Он обычно избирательно стимулирует Th1-реакции, а не регуляторный иммунитет [44]. Несмотря на свою информативность в отношении механизма действия, иммунологические исследования с использованием адъюванта Фрейнда не могут быть непосредственно проведены в рамках испытания схем вакцинации, предназначенных для клинического применения.
Квасцы, которые состоят из солей сульфата алюминия, имеют много преимуществ для трансляционной иммунологии [45]. Их легче синтезировать из-за ясности химической структуры, они обладают меньшим провоспалительным действием, индуцируют сильные реакции антител и используются во многих человеческих вакцинах. Парентеральная иммунизация пептидом-производным апо В в квасцах позволила уменьшить интенсивность проявлений атеросклероза на 40 % у мышей с apoe−/−, а это дает основания предположить, что этот подход может быть использован для разработки вакцин [46]. Интересно, что соли квасцов могут захватывать антигены ЛПНП in vivo, индуцировать регуляторный иммунитет и уменьшать выраженность атеросклероза [47].
Привлекательным для ученых средством индуцирования защитного иммунитета является введение антигенов через слизистую оболочку. Слизистая оболочка дыхательных путей и кишечника содержит компоненты лимфатической ткани с множеством дендритных и T-регуляторных клеток. Таким образом, воздействие антигена через дыхательные пути или желудочно-кишечный тракт приводит к активации регуляторного иммунитета с увеличением количества T-регуляторных клеток и продукцией ИЛ-10, TGF-β и других супрессивных медиаторов [48]. При определенных условиях пероральное введение антигена может привести к толерантности. Объяснение такой индукции регуляторного иммунитета или толерантности, вероятно, заключается в том, что внутренние поверхности организма постоянно подвергаются воздействию внешних антигенов. Если бы оно вызывало провоспалительный и цитотоксический иммунный ответ, последствия были бы пагубными для организма-хозяина. Вместо этого регуляторный иммунитет, который ослабляет или подавляет иммунные реакции, позволяет нам сосуществовать с микробами-симбионтами и жить в среде обитания, сложной с химической точки зрения.
Было показано, что иммунизация слизистых оболочек с помощью ЛПНП или белков теплового шока уменьшает проявления атеросклероза. Повторное введение hsp60 (белка теплового шока) или его микобактериального гомолога hsp65 интраназально или перорально значительно уменьшало атеросклероз у ldlr−/− мышей [49,50]. Защитный эффект был связан с повышением уровня ИЛ-10. В другом эксперименте пептид-производный апо В связывали с CTB (субъединицей B холерного токсина) и вводили интраназально apoe−/− мышам [51]. CTB связывался с ганглиозидами на эпителии слизистой оболочки и обеспечивал высокую антигенную нагрузку на ее иммунные клетки. Эта стратегия терапии привела к индукции T-регуляторных клеток, продукции IL-10, повышению титров антител к ЛПНП и защите от атеросклероза. Все эти исследования демонстрируют перспективность метода иммунизации слизистых оболочек для профилактики атеросклероза. Экспериментальные стратегии вакцинации с использованием антигена, полученного из ЛПНП, перечислены в таблице 2.
Таблица 2 | Экспериментальные стратегии вакцинации с использованием антигена-производного ЛПНП
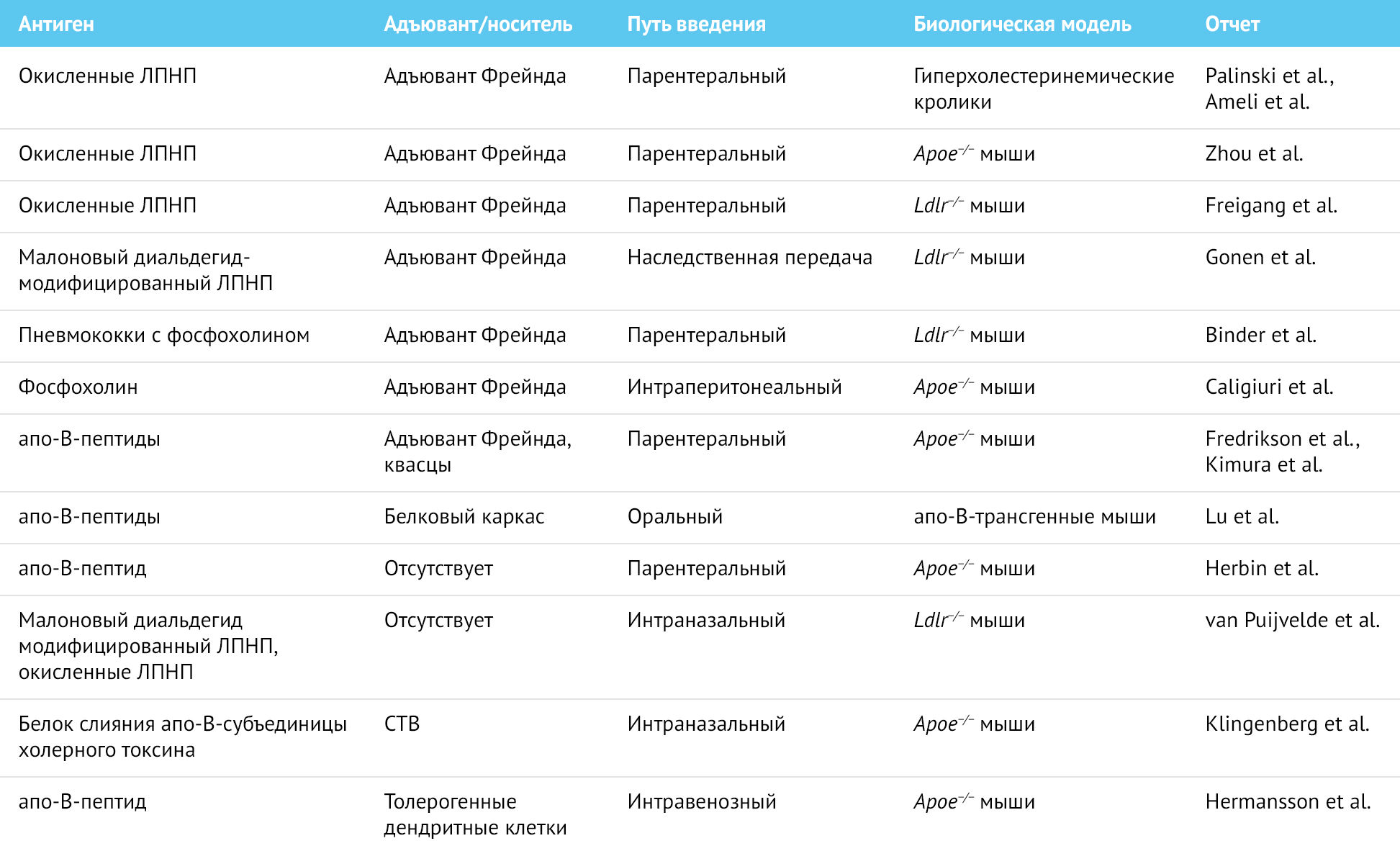
CTB — B-субъединица холерного токсина
Иммунный ответ на ЛПНП
Иммунизация ЛПНП вызывает экспансию CD4+ Т-клеток с характерными TCR (Т-клеточными рецепторами антигенов), которые могут связываться с пептидными последовательностями апо В [57]. Клеточный иммунный ответ усиливается, если частицы ЛПНП модифицируются таким образом, чтобы они могли проникать в дендритные клетки через скавенджер-рецепторы, например, путем окисления или образования аддукта с малоновым альдегидом [56]. Специфичные к ЛПНП Т-клетки распознают пептиды апо B, которые представлены на молекулах MHC класса II, как у мышей, так и у людей. У здоровых доноров крови большинство этих клеток были T-регуляторными. Смешанная картина с относительно меньшим количеством T-регуляторных лимфоцитов наблюдалась у пациентов с субклиническими проявлениями сердечно-сосудистых заболеваний [41].
TCR, которые распознают человеческие ЛПНП, были клонированы и использованы для создания трансгенных мышей, которые сверхэкспрессируют эти антигенные рецепторы на CD4+ Т-клетках [58]. Клеточный иммунный ответ на ЛПНП как аутоантиген может быть подробно изучен, когда таких апо В-реактивных TCR-трансгенных мышей разводят с мышами, несущими человеческий апо В в качестве трансгена и не имеющими рецепторов ЛПНП (HuBL [huApoBtg×ldlr−/−]). Как и ожидалось, подавляющее большинство апо В-реактивных Т-клеток было элиминировано в тимусе в раннем возрасте, однако несколько процентов из них выжили и обнаруживались в системе кровообращения и периферических лимфоидных органах. Когда эти мыши были иммунизированы ЛПНП, возникла сильная иммунная реакция с активацией, пролиферацией и дифференцировкой трансгенных Т-клеток [58]. Значительная часть из них дифференцировалась в Т-фолликулярные клетки-хелперы — подтип Т-клеток, который способствует активации В-клеток.
В лимфоидных органах формировались герминальные центры, причем Т-фолликулярные клетки-хелперы и дендритные клетки чередовались в них с В-клетками, подвергавшимися дифференцировке до плазматических клеток. Регистрировались высокие титры анти-ЛПНП антител, наблюдалась повышенная элиминация частиц ЛПНП из системного кровотока. Популяции Т-клеток в печени способствовали снижению уровня ЛПНП, опосредуя процесс их поглощения гепатоцитами. Также были задействованы другие популяции Т-клеток, находящиеся в аорте и периаортальной ткани, что приводило к уменьшению сосудистого воспаления. Комбинация ЛПНП-реактивных антител, иммуно-метаболических процессов в печени и снижения сосудистого воспаления привела к снижению интенсивности атеросклероза. Вполне вероятно, что вакцинация частицами ЛПНП также задействует данные механизмы, причем комбинированное действие клеточного и гуморального звеньев иммунитета приводит к снижению интенсивности заболевания.
Таким образом, экспериментальные исследования показывают, что атеросклероз может быть уменьшен с помощью иммуномодуляции и противовоспалительных иммунных реакций; что несколько специфических антигенов, включая ЛПНП, могут вызывать такие реакции и что для вакцинации можно использовать несколько разных подходов. Эти исследования дают возможность дальнейшей разработки вакцин против атеросклероза для защиты человека от опасных осложнений этого заболевания.
Клинические доказательства роли иммунной системы в развитии атеросклероза и сердечно-сосудистых заболеваний
Иммунные клетки в атеросклеротических бляшках
Впервые активированные Т-клетки в атеросклеротических бляшках человека были описаны в 1989 году [59]. Впоследствии было показано, что многие из этих Т-клеток реагируют на антигены, присутствующие в окисленных ЛПНП [22]. В последнее время характеристики иммунных клеток в атеросклеротических бляшках человека были более подробно описаны с помощью методов одноклеточного протеомного и транскриптомного анализа [13]. Эти исследования показали, что по сравнению с кровью атеросклеротические бляшки содержат больше макрофагов, CD4+ и CD8+ эффекторных Т-клеток памяти, а также CD4—CD8— Т-клеток. Т-клетки в бляшке экспрессируют больше маркеров активации и истощения. Анализ экспрессии генов активированных CD4+ Т-клеток бляшки показал, что они в основном являются Th1. Анализ экспрессии генов в макрофагах бляшки показал существование нескольких подтипов, включая АПК, провоспалительные, пенистые и М2-поляризованные клетки. Эти наблюдения подтверждают важную роль реакций адаптивного иммунитета в процессах формирования атеросклеротических бляшек и дают основание полагать, что с помощью модуляции этих реакций можно достичь снижения риска неблагоприятных сердечно-сосудистых событий.
Повышенная летальность от сердечно-сосудистых заболеваний на фоне аутоиммунной патологии
Многие аутоиммунные заболевания ассоциированы с более агрессивным течением атеросклероза и повышенным риском сердечно-сосудистых событий. Этот риск особенно высок при наличии системных аутоиммунных заболеваний, таких как ревматоидный артрит (РА), системная красная волчанка (СКВ) и псориаз. Пациенты с РА имеют на 50 % более высокий риск развития острых сердечно-сосудистых осложнений и сердечно-сосудистой смертности [60,61], причем с увеличением тяжести заболевания этот риск возрастает [62]. Также у таких пациентов отмечается двух-трехкратное увеличение степени кальцификации коронарных артерий [63,64]. Наличие СКВ ассоциируется с пяти-десятикратным повышением риска сердечно-сосудистых осложнений [65,66], а для женщин репродуктивного возраста риск возрастает пятидесятикратно [67]. Повышенный сердечно-сосудистый риск при СКВ связан с более тяжелым атеросклерозом как сонных и коронарных артерий [68,69]. При псориазе риск развития всех типов ишемических сердечно-сосудистых заболеваний возрастает на 40 %, риск ишемической болезни сердца — на 50 % [70].
Риск дополнительно возрастает, если пациент также страдает псориатическим артритом [71]. Эти наблюдения дают клинические доказательства связи между аутоиммунными заболеваниями, выраженностью атеросклероза и повышенным сердечно-сосудистым риском. Однако механизмы, связывающие аутоиммунные реакции с сердечно-сосудистыми заболеваниями, только предстоит полностью прояснить. Традиционные сердечно-сосудистые факторы риска, как правило, чаще встречаются у пациентов с аутоиммунными заболеваниями, но корректировка на них не в полной мере учитывает повышенный риск кардиоваскулярной патологии [66,72].
Предложены механизмы, ответственные за остальную часть повышенного сердечно-сосудистого риска при аутоиммунных заболеваниях, включающие усиление системного воспаления с повышенным уровнем провоспалительных цитокинов, нарушение регуляции функции Т-клеток, потерю толерантности В-клеток и образование аутоантител к сосудистым антигенам, усиление оксидантного стресса и нарушение способности элиминировать апоптотический материал [73–76]. У многих пациентов с аутоиммунными заболеваниями обнаруживаются аутоантитела против эндотелиальных клеток; они могут иметь особое значение в возникновении сердечно-сосудистых осложнений [77].
Васкулопатия сердечного аллотрансплантата или трансплантационный атеросклероз — еще один хороший пример последствий иммунной атаки на сосудистую стенку. Это основная причина позднего отторжения у реципиентов при трансплантации сердца [78]. Этот процесс инициируется распознаванием Т-клетками организма-хозяина чужой MHC на эндотелиальных клетках трансплантата, что приводит к субэндотелиальному накоплению макрофагов и Т-клеток [79]. Это сопровождается последовательным ростом микрососудов, а также инфильтрацией и пролиферацией гладкомышечных клеток, что приводит к гиперплазии интимы и уменьшению просвета артерий.
Интересное различие между васкулопатией аллотрансплантата и обычной атеросклеротической бляшкой заключается в том, что в первом случае воспалительные клетки остаются в субэндотелиальном слое и покрывают гладкомышечные клетки, которые находятся ближе к медии, тогда как во втором случае воспалительные клетки накапливаются вокруг липидов в ядре бляшки, а гладкомышечные клетки мигрируют к эндотелиальному слою, образуя фиброзное покрытие. Несмотря на это, основные элементы этих двух патологий очень схожи; это подтверждает идею о том, что иммунные реакции против модифицированных липопротеинов играют важную роль в развитии атеросклеротических бляшек в организме человека.
Эти сходства позволяют поставить интересный вопрос: следует ли также и атеросклероз рассматривать как аутоиммунное заболевание, вызванное неспособностью поддерживать иммунологическую толерантность к липопротеидам, которые были модифицированы окислением в артериальной стенке? Однако этот вариант развития событий представляется менее вероятным, поскольку риск инфаркта миокарда не имеет такой же ассоциации с определенными генотипами лейкоцитарного антигена человека (HLA), как, например, РА и СКВ [80]. Как уже обсуждалось выше, более вероятно, что презентация антигена на молекулах MHC-HLA активирует как защитные, так и патогенные иммунные реакции против большого числа различных нативных и модифицированных аутоантигенов в сосудистой стенке и что в долго существующей бляшке происходит сдвиг в сторону более патогенных реакций из-за наличия в ней хронического воспаления [81]. Интересно, что у мышей типа apoe−/−, которые полностью лишены способности представлять антигены на молекулах MHC класса II, атеросклероз развивается более активно, что указывает на важность атеропротекторных адаптивных иммунных реакций [36].
Иммуноопосредованные биомаркеры и риск сердечно-сосудистых заболеваний
Большинство аутоиммунных заболеваний характеризуется повышением уровня аутоантител. Они обычно специфичны для определенного числа заболеваний и представляют собой полезные диагностические инструменты [82]. Экспрессия аутоантител указывает на то, что не все аутореактивные В-клетки устраняются посредством механизмов центральной толерантности, и в подтверждение этого было установлено, что многие В1-клетки и В-клетки маргинальной зоны обладают аутореактивным потенциалом. Патогенетическая роль аутоантител пока не совсем ясна. В некоторых экспериментальных моделях СКВ было показано, что такие антитела усиливают воспалительный процесс в почках, но это было характерно не для всех аутоантител, ассоциированных с СКВ.
Таким образом, возможно, что по крайней мере некоторые из этих аутоантител являются следствием, а не причиной аутоиммунитета. При большинстве аутоиммунных заболеваний аутоантитела вступают в реакцию с внутриклеточными антигенами, причем ANA (антинуклеарные антитела) являются важным диагностическим признаком СКВ. Тот факт, что аутоантитела распознают внутриклеточные антигены, позволяет предположить, что последние могут возникать в результате гибели клеток; так, в случае СКВ было установлено, что нарушение элиминации апоптотического материала является важной причиной генерации ANA [75]. РА отличается от большинства других аутоиммунных заболеваний тем, что наиболее распространенные аутоантитела, АЦПА (антицитруллинированные белковые антитела), вступают в реакцию с внеклеточными антигенами [82]. Это говорит о том, что внеклеточная модификация белка также может привести к нарушению толерантности.
Наличие аутоантител против окисленных ЛПНП считается одним из самых весомых аргументов в пользу важной роли аутоиммунитета в развитии атеросклероза [83]. Образование иммунных комплексов с окисленными ЛПНП в артериальной стенке потенциально может активировать воспаление и способствовать либо развитию бляшек, либо их дестабилизации, в зависимости от условий микроокружения. Это предположение получило подтверждение в клинических исследованиях, демонстрирующих связь между уровнями циркулирующих IgG-антител к окисленным ЛПНП и тяжестью атеросклероза [84], а также риском сердечно-сосудистых заболеваний [85]. Однако роль окисленных аутоантител ЛПНП в развитии сердечно-сосудистых заболеваний оказалась гораздо более сложной, чем первоначально предполагалось. В отличие от ANA и ACPA, которые могут быть использованы в качестве диагностических критериев СКВ и РА, окисленные аутоантитела к ЛПНП далеко не специфичны для пациентов с распространенными сердечно-сосудистыми заболеваниями.
Они даже чаще встречаются у молодых людей, у которых уровень IgG к окисленным ЛПНП в плазме крови достигает максимума примерно через 20 лет, а затем снижается; также их уровень выше у женщин, чем у мужчин [86]. Исследования связи между IgG к окисленным ЛПНП и сердечно-сосудистой патологией дали противоречивые результаты, возможно, из-за трудностей стандартизации препаратов окисленных ЛПНП, используемых в качестве антигена для обнаружения в аналитических анализах. Одним из способов решить эту проблему оказался метод поиска аутоантител против специфических пептидных последовательностей в апо В. Аутоантитела IgG к нескольким частям белка апо B были обнаружены в плазме крови человека; среди наиболее важных таргетов выделяются аминокислоты 661–680 (p45) и 3136–3155 (p210) [87].
Интересно, что высокие уровни IgG против пептидов апо В были связаны с менее тяжелыми случаями атеросклероза и более низким риском развития инфаркта миокарда [88–90]. Эти наблюдения позволяют предположить, что антитела IgG, распознающие ЛПНП-ассоциированные аутоантигены, могут даже быть атеропротекторными. Эта гипотеза получила дальнейшее подтверждение в экспериментальных исследованиях, демонстрирующих ингибирование атеросклероза у apoe−/− и ldlr−/− мышей, которых лечили рекомбинантным антителом IgG к p45, модифицированному малоновым альдегидом; данное антитело связывается с окисленными, но не нативными ЛПНП [32,91].
Таким образом, существует слишком мало доказательств того, что аутоантитела IgG к ассоциированным с ЛПНП антигенам имеют такую же диагностическую ценность и патогенетическую роль при сердечно-сосудистых заболеваниях, как ANA и ACPA при СКВ и РА. Более вероятной представляется версия о том, что генерация этих антител отражает активацию защитных иммунных реакций, направленных на нейтрализацию токсического действия окисленных ЛПНП на сосудистую стенку. В соответствии с этим имеются значительные данные, подтверждающие атеропротекторную функцию IgM, распознающего окисленные ЛПНП [92]. Наиболее изученным типом IgM в этом отношении являются кодируемые герминальной линией естественные антитела, продуцируемые клетками В1, которые связываются с молекулами фосфохолина на окисленных ЛПНП, апоптотических клетках и некоторых микроорганизмах.
Помимо своей роли в защите от инфекций, они, по-видимому, выполняют бытовые функции, удаляя эндогенные макромолекулярные отходы. Инфузия этого типа антифосфохолиновых IgM уменьшает атеросклероз трансплантата у мышей apoe−/− типа. IgM обычно не являются оптимальными для активной иммунизации из-за их низкой специфичности и невосприимчивости во время активной иммунизации. Они также недостаточно эффективны при пассивной иммунизации из-за их низкой специфичности и трудностей получения препаратов, пригодных для инфузии. Однако при сердечно-сосудистых заболеваниях все еще могут существовать терапевтические возможности, поскольку продукция определенного типа естественного IgM, который реагирует с окисленными ЛПНП, может быть индуцирована пневмококковыми вакцинами и ассоциирована с умеренным снижением атеросклероза у ldlr−/− мышей с атеросклерозом.
Экспериментальные данные о важной и отчасти противоположной роли различных Т-клеточных субпопуляций в развитии атеросклероза указывают на возможность их использования в качестве биомаркеров сердечно-сосудистого риска. Однако до сих пор существует лишь несколько исследований, посвященных этому вопросу. Идентификация субпопуляций Т-клеток требует анализа методом проточной цитометрии живых клеток, что является относительно трудоемким процессом. К сожалению, немногие проспективные исследования ССЗ включали мононуклеарные клетки периферической крови, способ хранения которых обеспечивал бы хорошую жизнеспособность. Большинство исследований, отвечающих этим условиям, были опубликованы в исследовании MDC (Malmö Diet and Cancer).
В рамках базового исследования MDC с 1991 по 1994 год лейкоциты были выделены из крови 6000 испытуемых и сохранены в аутологичной сыворотке при температуре –140°C. При размораживании два десятилетия спустя >90 % клеток оставались жизнеспособными и могли быть проанализированы с помощью современной проточной цитометрической технологии. В соответствии с экспериментальными данными о защитной роли T-регуляторных лимфоцитов при атеросклерозе низкие уровни CD4+FoxP3+ Т-клеток были связаны с повышенным риском развития инфаркта миокарда в течение 15-летнего периода наблюдения. Однако это открытие необходимо интерпретировать с некоторой осторожностью из-за того, что у людей определить с помощью проточной цитометрии T-регуляторные клетки труднее, чем у мышей. Другие отчеты из этой когорты показали обратную связь между количеством циркулирующих Th2-клеток и тяжестью поражения сонных артерий, а также то, что низкий уровень Th2 связан с повышенным риском развития инфаркта миокарда у женщин. Примечательно, что авторы не обнаружили никакой связи между уровнем Th1-клеток и риском сердечно-сосудистых заболеваний.
Еще одна подгруппа Т-клеток, которая была отнесена к проатерогенной роли, — это CD4+CD28null-клетки. Это стареющие Т-клетки, которые выделяют провоспалительные цитокины и цитотоксические факторы. Удивительно, но Tomas et al. обнаружили, что высокие уровни CD4+CD28null-клеток были связаны с более низким риском инфаркта миокарда в когорте MDC.
Эти исследования показывают, что анализ Т-клеточных субпопуляций имеет ограниченное значение в прогнозировании сердечно-сосудистого риска. Возможно, прогностическая ценность анализа подгрупп Т-клеток может быть улучшена, если будут разработаны методы, позволяющие легко идентифицировать состояние активации антиген-специфических Т-клеток.
Клинические испытания
Существует два основных подхода, с помощью которых иммунизация может использоваться для снижения сердечно-сосудистого риска. Во-первых, это вакцинация для выработки антител, которые нейтрализуют фактор, способствующий развитию атеросклероза. Подобные эффекты также могут быть достигнуты путем пассивной иммунизации, то есть путем непосредственного введения антител (рис. 2). Последний подход был эффективен в клинических испытаниях, направленных на вирус гриппа, PCSK9 (пропротеиновая конвертаза субтилизин-кексинового типа 9) и ИЛ-1β. Второй подход заключается в использовании активной или пассивной иммунизации для подавления провоспалительных иммунных реакций в стенке артерии. Этот подход остается в значительной степени недоказанным, за исключением возможного подавления ИЛ-1β в исследовании CANTOS. Это резко контрастирует с недавним прогрессом в лечении рака, когда ингибиторы контрольных точек иммунного ответа и CAR-Т-клеточная терапия (CAR — химерный антигенный рецептор) стали ценными терапевтическими инструментами.
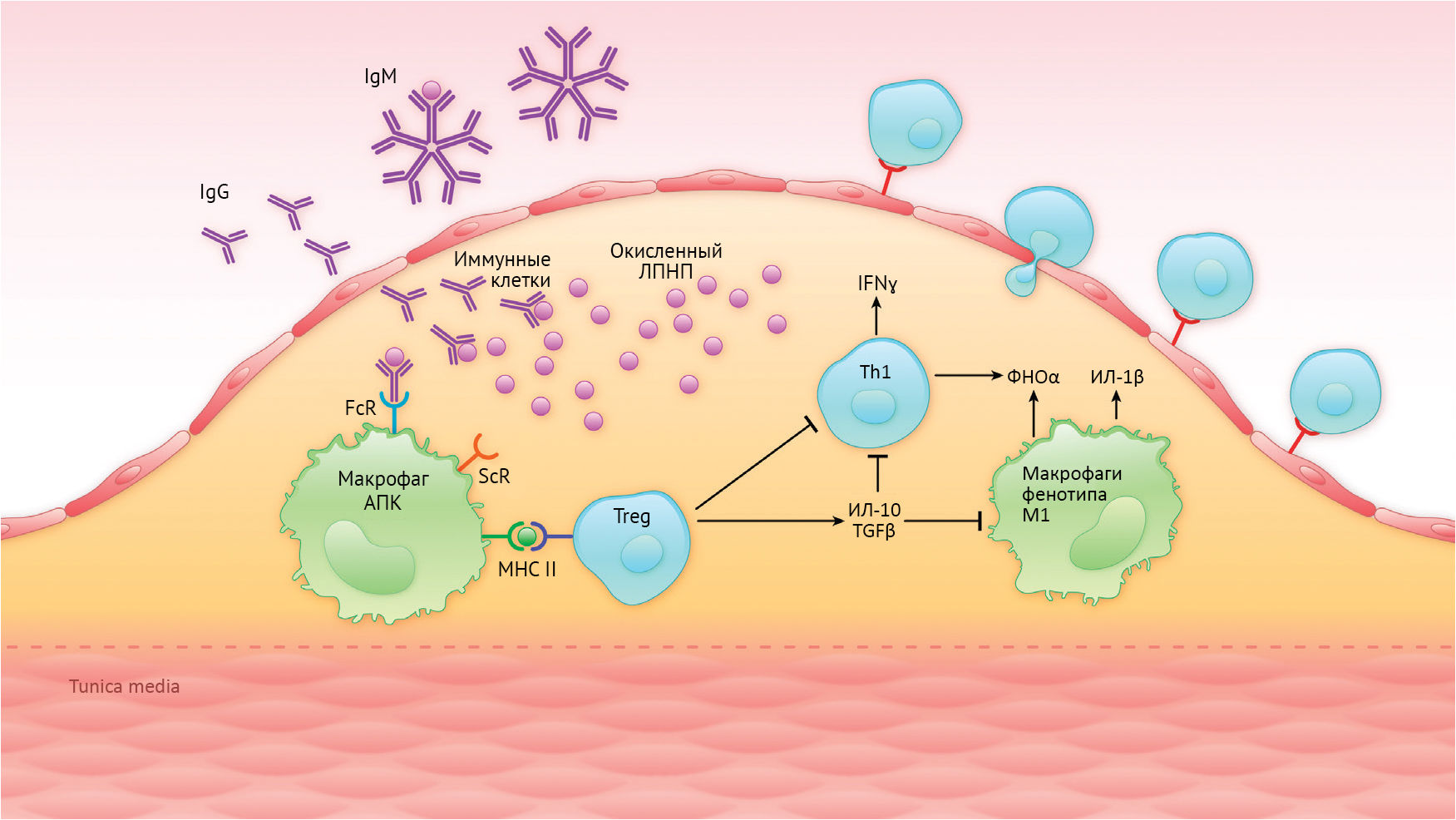
Рисунок 2 | Атеропротекторные механизмы активной и пассивной иммунизацииПредлагаемые ключевые механизмы атеропротекторного эффекта активной и пассивной иммунизации включают устранение окисленного липопротеина низкой плотности (oxLDL) антифосфохолином IgM, активацию FcRγIIb (Fc-фрагмент IgG-рецептора IIb) иммунными комплексами oxLDL/IgG и увелические количества специфических регуляторных Т-клеток (Tregs) к антигенам бляшки (например, в oxLDL). Антигенпредставляющие клетки (APC), такие как макрофаги, поглощают окисленные ЛПНП через ScR (фагоцитарные рецепторы) и представляют производные апо-B-антигены на MHC (главном комплексе гистосовместимости) класса II для Т-клеток.
Взаимодействие иммунных комплексов oxLDL / IgG с ингибитором FcRγIIb (Fc-фрагмент IgG-рецептора IIb) тормозит провоспалительное действие макрофагов бляшек. Представление АПО В-антигенов специфическим регуляторным Т-клеткам, специфичным для этого антигена, приводит к высвобождению противовоспалительных цитокинов и подавлению Т-хелперов (Th). Результатом этих процессов является уменьшение воспаления в бляшке.
Иллюстрация: Бен Смит. IFN обозначает интерферон; TGF – тромбоцитарный фактор роста, MHC II — молекула главного комплекса гистосовместимости класса II.
Активная иммунизация путем введения вакцин
Вакцинация против гриппа — это, безусловно, наиболее хорошо документированный пример активной иммунизации, которая снижает сердечно-сосудистый риск. Имеются убедительные эпидемиологические данные о повышенном риске инфаркта миокарда и инсульта в первые недели после заражения гриппом. Механизмы, ответственные за эту связь, остаются гипотетическими, но вполне возможно, что накопление вирусных частиц в уязвимых атеросклеротических бляшках может усугубить воспаление, тем самым увеличивая риск разрыва бляшки. Кроме того, острые инфекции, такие как грипп, вызывают системные воспалительные реакции, которые включают выработку провоспалительных медиаторов, активность которых может отражаться на стенке атеросклеротической артерии.
Метанализ исследований типа «случай-контроль», а также некоторые более мелкие проспективные рандомизированные клинические исследования продемонстрировали заметно сниженный риск острого инфаркта миокарда после вакцинации против гриппа. В настоящее время проводится регистровое рандомизированное клиническое исследование IAMI (вакцинация против гриппа после инфаркта миокарда) с участием 4400 пациентов с острым инфарктом миокарда, чтобы определить, снижает ли госпитальная вакцинация против гриппа риск рецидива сердечно-сосудистых заболеваний.
Пневмококковая вакцинация представляет собой еще одну интересную возможность использования иммунизации против инфекционного патогена для снижения сердечно-сосудистого риска. Как и при вакцинации против гриппа, пневмококковые вакцины могут работать за счет уменьшения воспаления бляшек, связанного с инфекцией, но они также могут действовать через свою способность активировать экспрессию естественного IgM, который реагирует с окисленными ЛПНП. Как и в случае вакцинации против гриппа, имеются обсервационные данные о снижении сердечно-сосудистого риска после пневмококковой вакцинации. Это будет проверено AUSPICE (австралийское исследование по профилактике сердечно-сосудистых заболеваний путем иммунизации).
AUSPICE рандомизирует ≈6000 пациентов высокого риска в возрасте от 55 до 60 лет без сердечно-сосудистых заболеваний в анамнезе для вакцинации пневмококковой 23-валентной полисахаридной вакциной (Pneumovax 23) или плацебо и контролирует изменение окисленных антител к ЛПНП, скорость пульсовой волны, толщину интимы сонных артерий и частоту развития сердечно-сосудистых заболеваний в течение 4-летнего периода наблюдения.
Лечение антителами против PCSK9 эффективно снижает уровень холестерина ЛПНП и, как было показано, дополнительно снижает сердечно-сосудистый риск при использовании в комбинации со статинами. Однако высокие затраты на лечение ограничивают применение антител к PCSK9 в более широких группах пациентов. Соответственно, возможность индуцировать подобные антитела путем вакцинации привлекла внимание как более экономичный подход. Безопасность, реакция на антитела PCSK9 и способность к снижению уровня ЛПНП двух вакцин на основе пептидов PCSK9 были протестированы в ходе испытания фазы I, но результаты еще не были опубликованы.
Другие исследования вакцинации, связанные с атеросклерозом, включают вакцинацию против CETP (белка-переносчика эфиров холестерина) для повышения уровня ЛПВП (липопротеинов высокой плотности), ангиотензина II для снижения артериального давления и пероральное введение антигенов жировой ткани у пациентов с избыточным весом для индуцирования более благоприятного липидного профиля. Клиническая разработка этих вакцин позже была прекращена, за исключением вакцины с содержанием антигена к жировой ткани, которая все еще находится в стадии исследования. Еще один интересный альтернативный подход к достижению атеропротекторной иммуномодуляции взят из исследования LILACS (низкодозированный интерлейкин-2 у пациентов со стабильной ишемической болезнью сердца и острым коронарным синдромом), целью которого является изучение эффекта увеличения Tregs при лечении низкими дозами ИЛ-2. Краткое описание вакцин, связанных с атеросклерозом, оцененных клинически, представлено в таблице 3.
Таблица 3 | Клинические испытания с использованием стратегий активной и пассивной иммунизации для предотвращения развития сердечно-сосудистых заболеваний
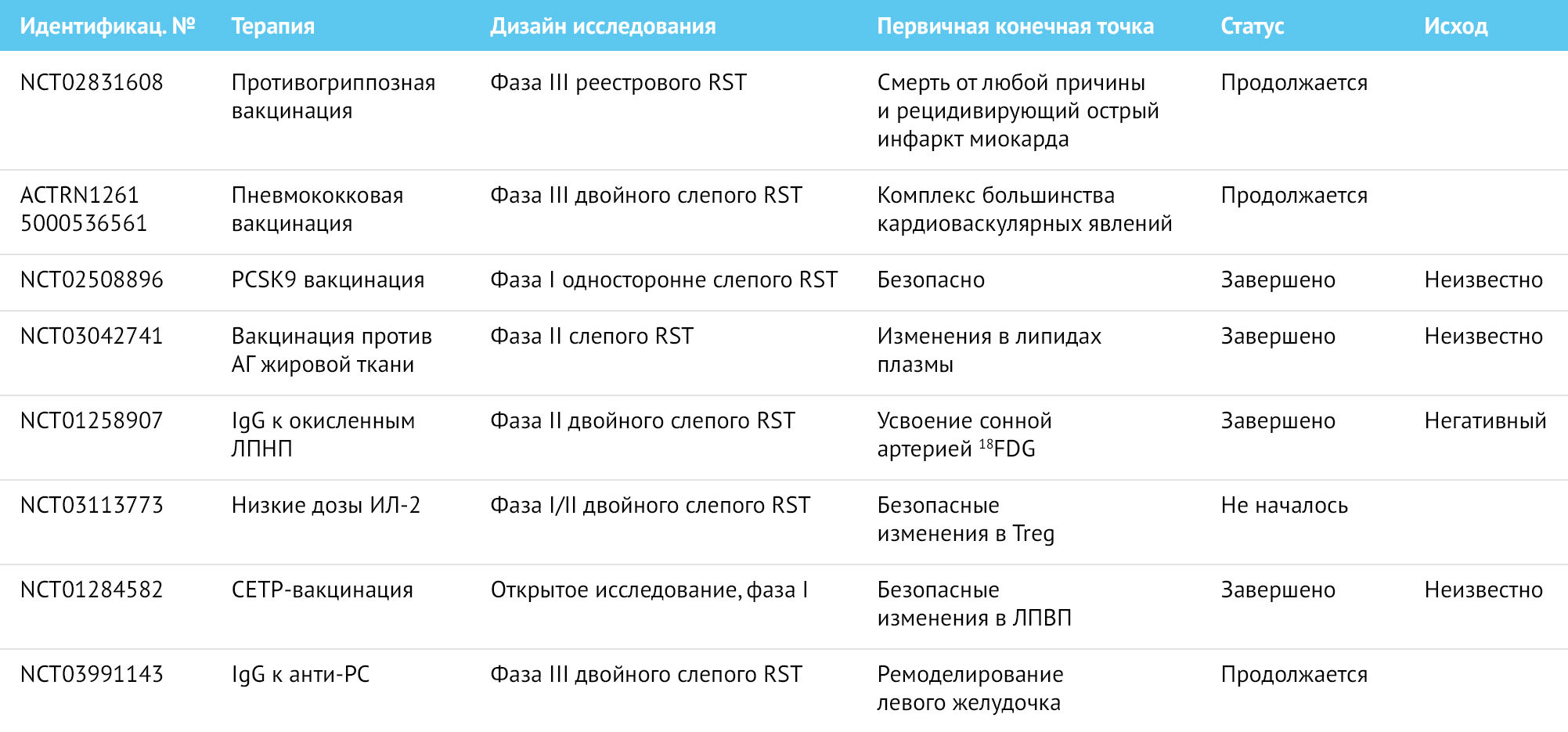
NCT обозначает клинический идентификационный номер на clinicaltrials.gov, ACTRN обозначает клинический идентификационный номер на australianclinicaltrials.gov.au
CETP — белок переноса эфиров холестерина; PC — фосфохолин; PCSK9 — Пропротеиновая конвертаза субтилизин-кексинового типа 9; RST — рандомизированное клиническое исследование; Tregs — T-регуляторные клетки
Вакцины против атеросклероза, основанные на принципе модуляции аутоиммунных реакций против ассоциированных с ЛПНП антигенов, еще не были испытаны в клинических испытаниях. Исходя из экспериментальных данных, основным способом действия таких вакцин было бы подавление Th1-зависимых провоспалительных иммунных реакций против антигенов, образующихся в модифицированных частицах ЛПНП (рис.2). Это подавление было бы опосредовано антиген-специфическими T-регуляторными клетками, которые активируются при воздействии их родственного антигена макрофагами и другими антигенпрезентирующими клетками в атеросклеротических бляшках. Теоретически эти антигенспецифичные T-регуляторные клетки не только подавляли бы активность Th1-Т-клеток с соответствующей антигенной специфичностью, но и могли бы ингибировать воспаление в бляшках за счет высвобождения противовоспалительных цитокинов, таких как ИЛ-10 и TGF-β.
Этот механизм действия имеет преимущество в виде более низкого риска неблагоприятных побочных эффектов, связанных с системной противовоспалительной терапией. Таким образом, не следует ожидать, что это приведет к незначительному увеличению частоты смертельных инфекций, подобных тем, которые наблюдались в ходе судебного разбирательства по делу клинических испытаний CANTOS. Показано, что введение пептидов апо-В в слизистую оболочку, а также подкожное введение пептидов апо-В с адъювантами на основе алюминия или без них ингибирует атеросклероз в экспериментальных моделях за счет активации T-регуляторных клеток.
В дополнение к регуляторному иммунитету вакцины против атеросклероза могут также индуцировать защиту от болезней, индуцируя выработку высокоаффинных антител к ЛПНП. Такие антитела способствуют выведению ЛПНП из системного кровотока. Они также могут нейтрализовать частицы ЛПНП во внеклеточном пространстве, предотвращая тем самым их связывание с паттерн-распознавательными рецепторами, в свою очередь снижая внутриклеточное накопление холестерина, а также ингибируя индукцию провоспалительных сигналов в макрофагах.
Спонсируемая Европейским Союзом программа вакцинации при атеросклерозе объединила группу академических институтов, малых и средних предприятий и промышленных партнеров целью внедрения вакцины против атеросклероза на основе ЛПНП в клинические испытания I фазы. The Vaccination in Atherosclerosis group разработала вакцинные препараты на основе различных пептидов апо-В и фосфолипидных антигенов, исследовала, как клинически одобренные адъюванты могут быть оптимизированы для связывания пептидов апо-В, сравнила различные пути введения на экспериментальных моделях животных, провела технические исследования, чтобы более точно охарактеризовать способ действия, оценила потенциально подходящие биомаркеры для мониторинга эффекта вакцинации в лимфоидных моделях ex vivo и изучила ассоциацию этих биомаркеров с риском сердечно-сосудистых заболеваний в проспективных популяционных когортах. Исследователи вакцинации при атеросклерозе также поддерживали постоянный контакт с регулирующими органами и фармацевтическими компаниями по вопросам безопасности и другим, которые необходимо было решить до начала клинической программы вакцинации.
В конце пятилетней программы the Vaccination in Atherosclerosis group пришла к выводу, что слишком много вопросов безопасности остались нерешенными, чтобы начинать фазу 1 тестирования вакцины против атеросклероза на основе пептидов апо-В. Было рекомендовано, чтобы клинические программы были сосредоточены на апо-В-специфических антителах. Если бы в ходе клинических испытаний было доказано, что такие антитела снижают сердечно-сосудистый риск, это открыло бы путь для разработки вакцин, индуцирующих экспрессию антител с той же специфичностью. Вакцины, которые индуцировали толерантность к ЛПНП именно в атеросклеротических бляшках, по-прежнему рассматривались как наиболее оптимальная терапевтическая альтернатива в долгосрочной перспективе, но клинические испытания таких вакцин потребуют лучшего понимания механизма действия, способа мониторинга реакции на вакцинацию, их эффективности на поздних стадиях атеросклероза, а также потенциальных проблем безопасности.
Пассивная иммунизация посредством введения антител
Использование антител против PCSK9 и IL-1β для снижения сердечно-сосудистого риска было широко рассмотрено в других местах и не будет далее обсуждаться здесь. Как описано выше, существуют как экспериментальные, так и эпидемиологические исследования, подтверждающие защитную роль антител, реагирующих с различными ЛПНП-ассоциированными эпитопами. Первое указание на то, что антитела против пептидных последовательностей в апо-В могут оказывать атеропротекторное действие, было получено в результате исследований на мышах apoe−/− типа, продемонстрировавших, что иммунизация альдегидной модифицированной формой пептида P45 апо-В (malondialdehyde-p45) привела к почти 50 %-ному снижению развития бляшек одновременно с 50-кратным увеличением уровня IgG к малондиальдегиду-p45. Последующие исследования показали, что аналогичное снижение развития бляшек может быть достигнуто при введении рекомбинантно продуцируемого IgG к малоновому диальдегиду-p45 и что на более поздних стадиях атеросклероза лечение лечение антителами может потенцировать регресс атеросклероза, вызванного снижением уровня холестерина.
Активация ингибирующего рецептора Fcy II на моноцитах окисленными иммунными комплексами ЛПНП/IgG к малоновому диальдегиду-Р45 , приводящая к ингибированию NF (ядерного фактора)-kB и высвобождению провоспалительных цитокинов, была идентифицирована как возможный механизм атеропротекторного действия IgG к малоновому диальдегиду-Р45. Противовоспалительное действие антитела было также подтверждено в исследованиях, проведенных на макаках-резусах с ожирением, вызванным диетой, и другие исследования подтвердили наличие эпитопа малонового диальдегида-Р45 в атеросклеротических бляшках человека. Прежнее исследование также выявило повышенную чувствительность к инсулину в ответ на лечение антителами.
Основываясь на этих обнадеживающих наблюдениях, было начато исследование GLACIER (цель ингибирования окисленных ЛПНП и активированных макрофагов путем воздействия рекомбинантного антитела), чтобы исследовать, может ли лечение рекомбинантным IgG к малоновому диальдегиду-P45 (MLDL1278A) ингибировать воспаление в бляшках у пациентов со стабильными сердечно-сосудистыми заболеваниями. В исследование были включены 147 пациентов, рандомизированных для инфузии (1) однократной дозы MLDL1278A, (2) многократной дозы MLDL1278A, или (3) многократных инфузий плацебо с оценкой воспаления в бляшке методом позитронно-эмиссионной томографии с 18F-фтордезоксиглюкозой в исходном состоянии и через 12 недель. Во время исследования не было никаких признаков проблем с безопасностью, но результаты не показали существенного влияния антитела на воспаление в бляшках в сонных артериях.
В своем отчете исследователи GLACIER подняли вопрос о том, удалось ли исключить вероятность обнаружения какого-либо эффекта антител в плане исследования с пациентами, стабилизированными с помощью современного регрессивного лечения, включая статины. Они также предположили, что исследование, возможно, было недостаточно мощным. Следует иметь в виду, что глюкоза также поглощается другими метаболически активными клетками в бляшке, такими как клетки гладких мышц. Соответственно, результаты GLACIER не исключают возможности того, что IgG к малоновому диальдегиду-p45 может оказывать атеропротекторное действие, но для решения этого вопроса необходимы дополнительные клинические исследования.
Первые доказательства in vivo атеропротектекторной роли IgM к окисленным ЛПНП были получены в исследованиях, демонстрирующих, что ингибирование атеросклероза у мышей с ldlr-/- после вакцинации пневмококковой вакциной было связано с повышенным уровнем IgM к антифосфохолину. Концепция получила дополнительную поддержку после обнаружения того факта, что антифосфохолиновый IgM уменьшает атеросклероз трансплантата у apoe−/− мышей. Влияние повышения антифосфохолинового IgM на атеросклероз сонных артерий с помощью пневмококковой вакцинации в настоящее время изучается в исследовании AUSPICE. Рандомизированная фаза II для изучения влияния антифосфохолинового IgG на ремоделирование левого желудочка у пациентов с острым инфарктом миокарда продолжается.
Трудности, связанные с клинической разработкой вакцин против атеросклероза
Учитывая многообещающие экспериментальные результаты с использованием нескольких различных типов вакцин, снижающих развитие атеросклероза, вызывает разочарование тот факт, что передача этих результатов в область клинического применения была столь медленной. Однако подобный опыт наблюдается и при других хронических воспалительных заболеваниях. Общим ограничением экспериментальных исследований вакцины против атеросклероза является то, что они фокусируются на влиянии профилактики на ранний атеросклероз. На этой стадии развитие поражения носит по существу линейный характер, что позволяет количественно оценить степень снижения заболеваемости, достигаемую с помощью протоколов лечения. Эта ситуация может напоминать ту, в которой относительно молодые люди проходят первичные профилактические испытания. Напротив, эта ситуация явно отличается от ситуации пациентов, у которых прогрессирующие бляшки привели к появлению клинических симптомов.
Следовательно, нет уверенности в том, что такие экспериментальные исследования могут быть переведены в протоколы стабилизации для развитых бляшек у человека. Кроме того, иммунные системы, которые опосредуют действие вакцин, также очень различны между экспериментальными животными, содержавшимися в свободной от патогенов среде с самого рождения, и людьми, которые имеют гораздо более развитую иммунную систему в результате воздействия чужеродных патогенов. Соответственно, трудно предсказать клиническую эффективность вакцины против атеросклероза на основе результатов, полученных на экспериментальных животных. Эта проблема, однако, присуща большинству исследований лекарственных препаратов, основанных на открытиях, сделанных на экспериментальных животных.
Особенно важной проблемой при использовании вакцин на основе пептидов является необходимость правильного подбора HLA класса II. Чтобы пептид был представлен на MHC (на человеческом HLA) класса II и активировал Т-клеточный ответ, он должен быть способен связываться с аллелем HLA класса II, экспрессируемым этим индивидуальным субъектом. В худшем случае это будет означать, что несколько пептидов, связывающихся с различными молекулами HLA, должны быть идентифицированы, протестированы на клиническую эффективность, и отдельный пациент должен пройти скрининг на наличие типов HLA, чтобы выбрать правильный пептид, который будет использоваться для вакцинации этого человека. Однако существуют способы решения этой проблемы, например, путем соединения пептида с белками, которые связывают все молекулы HLA высоким сродством. Кроме того, некоторые пептиды апо-B проявляют неразборчивость в связывании белков класса HLA II. Наблюдение за тем, что почти все люди экспрессируют аутоантитела IgG к пептидам P45 и P210 апо-В, позволяет предположить, что ограничение HLA является меньшей проблемой для этих пептидов.
Еще один вопрос, который необходимо решить до того, как вакцина против атеросклероза сможет пройти клинические испытания, — это как контролировать успешный иммунный ответ на вакцину. Для вакцины, предназначенной для индуцирования специфического ответа антител, это, скорее всего, будет прямолинейный контроль. Однако для вызывающей толерантность вакцины, предназначенной для активации T-регуляторных клеток, будет значительно сложнее контролировать реакцию. Количество T-регуляторных лимфоцитов, специфичных для вакцинного антигена, будет крайне низким даже после их возможного роста и трудным для измерения по имеющейся в настоящее время методике. Это также затруднит определение продолжительности иммунного ответа.
Выводы и перспективы
Несмотря на то, что атеросклероз не может быть классифицирован как аутоиммунное заболевание в классическом смысле, понятно, что иммунные ответы против аутоантигенов играют важную роль в процессе заболевания. Также ясно, что как защитные, так и патогенетические аспекты заболевания активизируются во время развития атеросклероза. Предстоит узнать многое о роли иммунной системы при атеросклерозе, но, исходя из современных знаний, складывается мнение, что защитные врожденные и адаптивные иммунные ответы, включая антитела, помогают нейтрализовать потенциально токсичные продукты жизнедеятельности, такие как окисленные ЛПНП; также T-регуляторные клетки, которые подавляют клеточный иммунный ответ против аутоантигенов в сосудистой стенке, могут защищать от атеросклероза.
У лиц с большим количеством факторов риска вследствие накопления токсичных отходов повреждение клеток становится более тяжелым, что приводит к активации Th1 иммунных реакций, которые способствуют атеросклерозу, а не защищают от него. Возможность избирательно стимулировать защитные иммунные реакции при одновременном ингибировании способствующих заболеванию иммунных реакций открывает новые и интересные терапевтические возможности. Терапия рака является прекрасным примером того, как наша иммунная система может быть нацелена на разработку новых и более эффективных методов лечения, и разработчики сердечно-сосудистых исследований могут многому научиться у онкологии в этом плане. Ключевой целью будущей иммуномодулирующей терапии для профилактики сердечно-сосудистых осложнений будет снижение воспаления в бляшки. Идея процесса воспаления в качестве значимой мишени для вмешательства у пациентов, уже получавших передовые профилактические методы лечения, поступила от CANTOS [7] и недавно опубликованного COLCOT (Colchicine Cardiovascular Outcomes Trial).
Однако оба исследования показали, что системная противовоспалительная терапия связана с повышенным риском инфекции, что позволяет предположить, что терапия, специально направленная на воспаление в бляшке, будет предпочтительнее.
Несмотря на все трудности, возникающие при попытках внедрения перспективных экспериментальных результатов с использованием вакцин против атеросклероза в клиническую практику, мы считаем, что в будущем эти проблемы можно будет преодолеть. При этом важно будет выявить пациентов с остаточным риском при текущем лечении, которые бы извлекли пользу от иммуномодулирующей терапии. Исходя из современных знаний, вполне вероятно, что пациенты с аутоиммунными заболеваниями, которые, как известно, связаны с повышенным сердечно-сосудистым риском и для которых традиционные профилактические методы лечения неэффективны, представляют собой одну из таких групп.