Стремительное старение населения во всем мире стало беспрецедентной проблемой. Старение связано с когнитивными нарушениями, включая деменцию и легкие когнитивные нарушения. Успешная разработка лекарственных средств для улучшения и поддержания когнитивных функций у пожилых людей имеет критическое значение. Несмотря на то, что четыре препарата для улучшения когнитивных функций при болезни Альцгеймера уже одобрены, множество потенциальных лекарств, направленных на связанные с возрастом когнитивные нарушения, пока находятся на стадии разработки. Кроме того, в последнее десятилетие для улучшения работы мозга также были предложены нефармакологические подходы, такие как лечение, направленное на когнитивные функции, неинвазивная стимуляция мозга, физические упражнения и изменение образа жизни. В настоящей статье авторы рассматривают современные данные, касающиеся фармакологических и нефармакологических подходов, направленных на улучшение и поддержание когнитивных функций у пожилых людей.
Введение
Население мира стареет. В 2020 году размер популяции людей в возрасте 65 лет и старше насчитывал 398 миллионов — это около 9,3% общемирового населения (United Nations, 2019). К 2050 году это число достигнет двух миллиардов (Clegg et al., 2013). Старший возраст ассоциирован с когнитивными нарушениями, в том числе с деменцией и легкими когнитивными нарушениями (ЛКН). Деменция характеризуется ухудшением памяти, мышления, восприятия, речи, способности к принятию решений, планированию и рассуждению (Power et al., 2019). Во всем мире насчитывается почти 50 миллионов человек с деменцией, а к 2050 году это число возрастет до 152 миллионов (World Health Organization, 2019). Деменция увеличивается с возрастом и составляет около 5,0% для людей в возрасте от 71 до 79 лет, 24,2% — для людей в возрасте от 80 до 89 лет и 34,7% — для людей в возрасте 90 лет и старше (Plassman et al., 2007). Чаще всего деменция связана с болезнью Альцгеймера (БА) (World Health Organization, 2019). ЛКН представляют собой стадию между старением с сохранением нормальных когнитивных функций и деменцией (Power et al., 2019), и, согласно различным диагностическим критериям, встречаются у 10–20% населения в возрасте 65 лет и старше; с возрастом этот процент увеличивается (Langa and Levine, 2014). Считается, что ЛКН предшествуют деменции; у лиц с ЛКН риск деменции выше, и приблизительно у 14,9% пожилых людей с ЛКН деменция развивается в течение последующих двух лет (Morley, 2018; Petersen et al., 2018).
Деменция вызывает ограничение возможностей и зависимость от других людей, поэтому является огромным экономическим и социальным бременем (Wimo et al., 2017). Существует возрастающая необходимость определения механизмов когнитивных нарушений, связанных с возрастом, с перспективой обнаружения потенциальных мишеней и поиска подходов, которые могли бы улучшать или поддерживать когнитивные функции и сдерживать прогрессирование деменции. В настоящей статье описываются механизмы старения и когнитивных нарушений, а также рассматриваются фармакологические и нефармакологические методы воздействия. Авторы надеются, что это может предоставить данные для будущих исследований.
Старение и когнитивные нарушения
Как сообщалось ранее (Satoh et al., 2017), старение приводит к снижению когнитивных функций и изменению структуры головного мозга. Происходит атрофия мозга, особенно в гиппокампе и префронтальной коре (Satoh et al., 2017). Атрофия мозга связана с возрастной утратой нейронов, снижением нейрогенеза, уменьшением ветвления дендритов и числа дендритных шипиков. Старение также затрагивает функцию синапсов и их плотность, что ведет к снижению синаптической передачи и пластичности (Bettio et al., 2017). В структурные и функциональные изменения вносит свой вклад множество факторов. Старение приводит к внутриклеточному накоплению АФК, что вызывает повреждение макромолекул и митохондрий в клетке (Castelli et al., 2019). Старение также индуцирует активацию микроглии и астроцитов, что приводит к обширному нейровоспалению и последующему повреждению нейронов (Clarke et al., 2018; Edler et al., 2021). В стареющем мозге также были найдены отложения β-амилоида и агрегаты тау-белка (Zhang et al., 2021). Нейротрофины связаны с нейрогенезом, выживанием нейронов и синаптической пластичностью (Sardar et al., 2021). Нарушение сигнальных путей нейротрофического фактора мозга (BDNF) и фактора роста эндотелия сосудов (VEGF) в стареющем мозге ассоциировано с когнитивными дефицитом (Bettio et al., 2017). Еще один фактор, связанный со старением мозга и нарушением когнитивных функций, — это падение уровня нейромедиаторов, таких как дофамин и серотонин (Peters, 2006). Старение вносит вклад в ослабление когнитивных функций, что приводит к развитию у здоровых людей нейродегенеративных заболеваний — в частности, БА. Все больше исследований указывают на то, что нормальное старение и нейродегенеративные состояния сопровождаются сходными функциональными, структурными и клеточными изменениями. Тем не менее, структурные изменения мозга при нейродегенеративных заболеваниях наиболее значительны (Yankner et al., 2008; Bettio et al., 2017).
Фармакологические подходы для улучшения когнитивной функции стареющего мозга
Успешная разработка лекарственных препаратов для улучшения или поддержания когнитивных функций у пожилых людей — критически важная задача. Хотя за последние два десятилетия изучалось множество новых мишеней для улучшения когнитивных функций, лишь несколько препаратов были одобрены для лиц с БА и ни одного — для пациентов с ЛКН (Fink et al., 2018; Petersen et al., 2018). Здесь авторы приводят клинические данные, касающиеся одобренных препаратов и перспективных мишеней лекарственного воздействия (тaблица 1).
Таблица 1. Данные по фармакологической терапии при когнитивных расстройствах у людей старшего возраста.
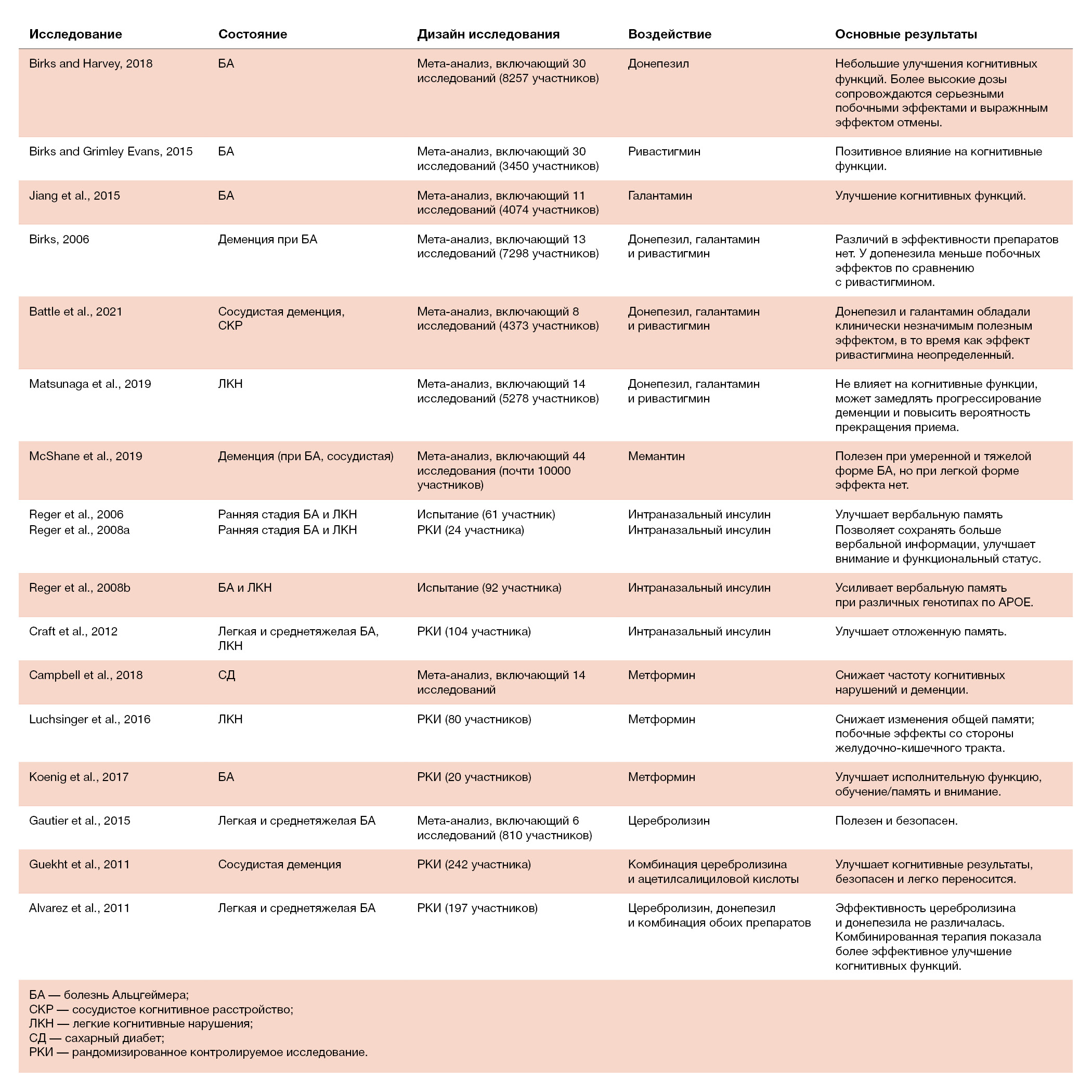
Ингибиторы холинэстеразы
Ацетилхолин связан с памятью, обучением, вниманием и другими существенными аспектами высшей нервной деятельности (Hampel et al., 2018). Старение и БА ассоциированы с утратой холинергических нейронов (Terry and Buccafusco, 2003; Haam and Yakel, 2017). Ингибиторы холинэстеразы (ИХЭ) задерживают распад ацетилхолина и усиливают холинергическую передачу. ИХЭ, включая донепезил, галантамин и ривастигмин, были одобрены для лечения БА (Oh and Rabins, 2019). Донепезил представляет собой неконкурентный ингибитор ацетилхолинэстеразы, который был одобрен в 1996 году. Прием донепезила в течение 12 или 24 недель приводит к небольшому улучшению когнитивных функций при БА. Благоприятные эффекты ежедневного приема 10 или 23 мг немного более выражены, чем при ежедневном приеме 5 мг. Однако с увеличением дозы усиливаются побочные действия и эффект отмены (Birks and Harvey, 2018). Ривастигмин способен ингибировать как ацетилхолинэстеразу, так и бутирилхолинэстеразу и был одобрен в 2000 году. Ривастигмин также может улучшать когнитивные функции при БА (Birks and Grimley Evans, 2015). Галантамин — конкурентный ингибитор ацетилхолинэстеразы. Ежедневный прием 16–40 мг галантамина в течение 8–28 недель может значительно улучшить когнитивные функции (Jiang et al., 2015). Хотя существуют небольшие вариации в способе действия, различий между данными препаратами в плане эффективности при БА практически нет (Birks, 2006). В сетевом мета-анализе эффективности ингибиторов холинэстераз при сосудистой деменции и других сосудистых когнитивных нарушениях было обнаружено, что донепезил и галантамин немного улучшают когнитивные функции, однако эффекты не были клинически значимыми. Данные по ривастигмину внушают меньше уверенности (Battle et al., 2021). Maцунаша с соавт. в 2019 году опубликовали мета-анализ, в котором они оценили клинические эффекты ИХЭ при ЛКН. Он включал 14 рандомизированных контролируемых исследований (РКИ), в которых приняли участие 5278 человек; шесть исследований включали донепезил, четыре — галантамин и четыре — ривастигмин. Результаты показали, что ИХЭ не улучшают когнитивные функции у взрослых с ЛКН, однако значительно замедляют прогрессирование деменции. Поскольку нередки случаи прекращения лечения вследствие побочных эффектов, включая тошноту, рвоту, аномальные сновидения, диарею, головокружение, брадиаритмию, обмороки и потерю веса, существующие ИХЭ не рекомендуются для терапии ЛКН (Matsunaga et al., 2019; Oh and Rabins, 2019). Сейчас разрабатываются новые ИХЭ, такие как октогидроаминоакридин и AD-35 (Cummings et al., 2021).
Мемантин
Помимо ингибиторов холинэстераз, для лечения БА был также одобрен мемантин — низкоаффинный антагонист NMDA-рецепторов (Huang and Mucke, 2012). В Кокрановском обзоре клинический эффект мемантина обнаруживался при БА средней и тяжелой степени, однако клинической пользы мемантина при легкой форме БА не наблюдалось. Еще только предстоит определить, будет ли мемантин обладать полезными эффектами при легкой форме БА в случае длительного приема. Данные о применении мемантина при ЛКН и других причинах деменции ограничены (Ferris et al., 2007; McShane et al., 2019). В настоящее время фазу II клинических испытаний проходит SAGE-718 — другой положительный аллостерический модулятор NMDA-рецепторов (Cummings et al., 2021).
Противодиабетические средства
Диабет — еще один фактор риска развития деменции, увеличивающий этот риск в 1,5–2 раза (Areosa Sastre et al., 2017). Сообщалось о связи между старением, деменцией и нарушением инсулинового сигналинга; резистентность к инсулину также предлагали в качестве механизма когнитивных нарушений. Восстановление инсулиновых сигнальных путей в головном мозге может стать потенциальным способом улучшения когнитивных функций (Boccardi et al., 2019; Erichsen et al., 2021).
Интраназальное введение инсулина
Интраназальное введение инсулина может повысить его уровень в центральной нервной системе (de la Monte, 2013; Erichsen et al., 2021). В предыдущих исследованиях было показано, что интраназальное введение инсулина оказывает потенциально благоприятные эффекты на когнитивные функции (Reger et al., 2006, 2008a,b). Острая терапия интраназальным инсулином (20 IU) улучшает вербальную память у пожилых людей с ЛКН или БА, и эти эффекты оказывались сильнее у пациентов, не имевших аллеля APOE-epsilon (Reger et al., 2006, 2008a,b). Крафт с соавт. (2012) сообщают, что хроническая терапия интраназальным инсулином может сохранять общие когнитивные функции и улучшать отложенную память у пациентов с ЛКН и БА. Эти результаты указывают на потенциальное полезное действие инсулина в отношении снижения когнитивных функций.
Метформин
Метформин — препарат против гипергликемии первой линии; его действие основано на снижении чувствительности к инсулину в периферических тканях и подавлении глюконеогенеза в печени (Boccardi et al., 2019). Хотя в мета-анализе с участием шести когорт было показано, что метформин может снижать частоту деменции у пациентов с диабетом (Campbell et al., 2018), данные по применению метформина у взрослых людей без диабета ограничены. В пилотном РКИ с участием 80 взрослых людей с ЛКН было обнаружено, что метформин улучшает вербальную память. Метформин хорошо переносили 92,5% участников, серьезных побочных эффектов не возникало (Luchsinger et al., 2016). В другом исследовании было обнаружено, что прием метформина в течение восьми недель был связан с улучшением исполнительных функций у пациентов с ЛКН или легкой деменцией (Koenig et al., 2017), что выявило возможный положительный эффект метформина у пожилых людей.
Церебролизин
Церебролизин представляет собой смесь нейропептидов и аминокислот, которая образуется при ферментативном расщеплении ткани мозга свиньи и действует как эндогенный нейротрофический фактор (Cui et al., 2019). В настоящее время церебролизин используется для лечения деменции в Европе и Азии (Cui et al., 2019; Gavrilova and Alvarez, 2021). В одном мета-анализе было сделано предположение, что церебролизин оказывает благоприятные эффекты на когнитивную функцию при БА умеренной и тяжелой степени (Gauthier et al., 2015). Полезное действие церебролизина на когнитивные функции было также обнаружено в случае сосудистой деменции (Guekht et al., 2011). Альварес с соавт. (2011) сравнили церебролизин и донепезил и выяснили, что церебролизин так же, как и донепезил, эффективен для улучшения когнитивных функций, а комбинированная терапия эффективнее, чем применение каждого из препаратов по отдельности. Стоит добавить, что остается неясным, оказывает ли прием церебролизина полезное действие на когнитивную функцию у лиц без когнитивных нарушений и пациентов с ЛКН; дальнейшего анализа требует и вопрос о том, может ли применение церебролизина замедлить прогрессирование деменции.
Потенциальные препараты с новыми механизмами
В течение последних двух десятилетий разработка лекарств от БА была сложной задачей, хотя было выявлено множество потенциальных лекарственных мишеней (Cummings, 2021; van Bokhoven et al., 2021). За последнее время не был одобрен ни один препарат для улучшения когнитивных функций при БА (Cummings, 2021; van Bokhoven et al., 2021). В таблице 2 показаны 13 препаратов для лечения когнитивных расстройств, проходящие клинические испытания. Среди них один препарат проходит фазу I, шесть препаратов — фазу II и шесть — фазу III (Cummings et al., 2021).
Таблица 2. Клинические испытания, направленные на улучшение когнитивных функций у пациентов с болезнью Альцгеймера (БА) в 2021 году, по материалам Clinicaltrials.gov.
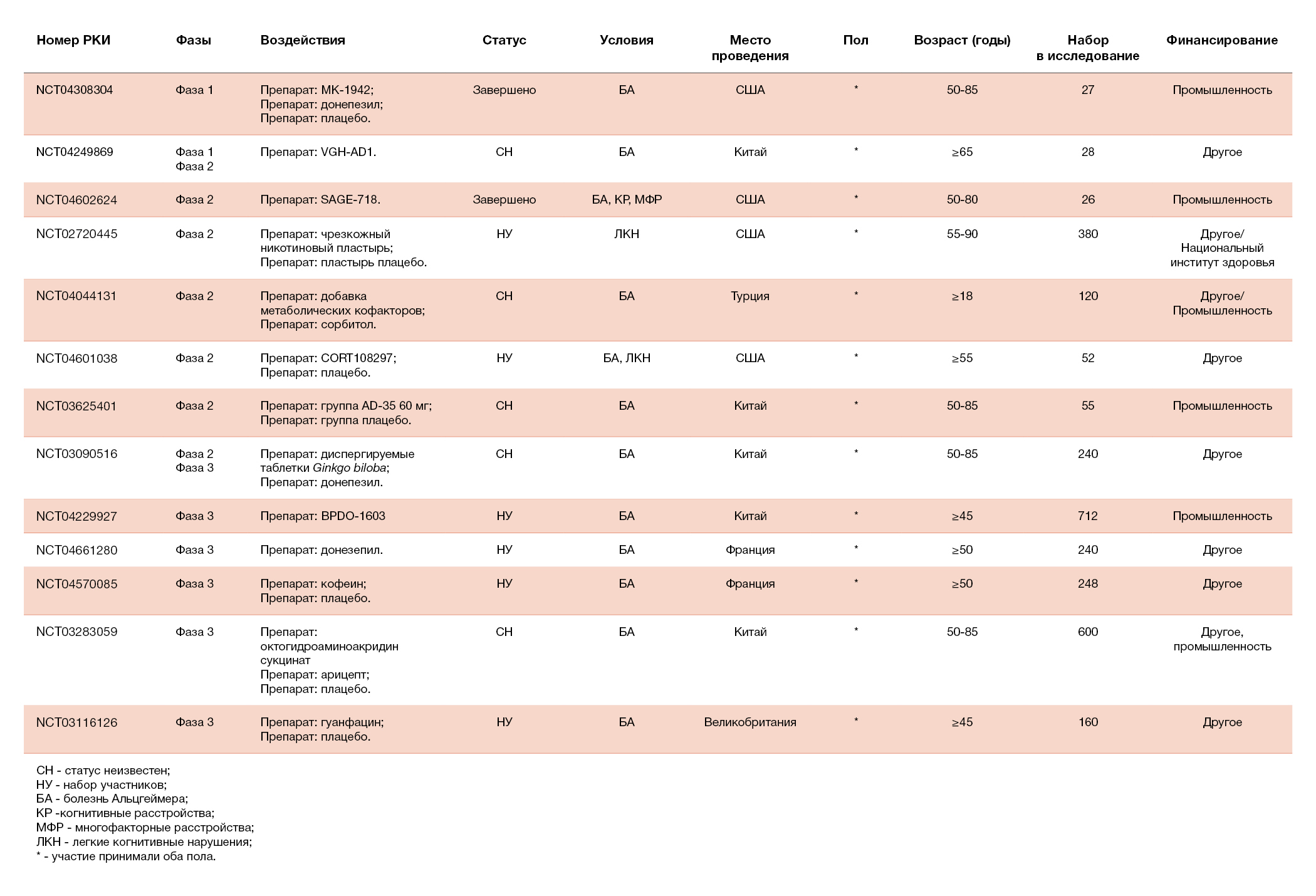
Ингибиторы фосфодиэстераз
Фосфодиэстеразы (ФДЭ) — суперсемейство ферментов (включающее 12 изоформ), которые могут катализировать расщепление фосфодиэфирной связи, в том числе во вторичных мессенджерах цАМФ и цГМФ, которые играют важную роль в обучении и памяти (Wu et al., 2018). Почти все изоформы ФДЭ экспрессируются в основном в головном мозге, особенно в регионах, ответственных за обучение и память (Wu et al., 2018). В доклинических исследованиях было показано, что ингибиторы ФДЭ вызывают значительные улучшения когнитивных функций (Bruno et al., 2011; Peters et al., 2014; Zhang et al., 2018), а некоторые из этих препаратов прошли клинические испытания. Большинство показало хорошую переносимость и безопасность в фазе I, и более десятка — в фазах II/III/IV клинических испытаний. Винпоцетин — классический ингибитор ФДЭ1, открытый около 40 лет назад (Prickaerts et al., 2017). Хотя в доклинических исследованиях показано положительное действие винпоцетина на обучение и память, у пациентов с БА благоприятного влияния на когнитивные функции обнаружено не было (Szatmari and Whitehouse, 2003). Цилостазол — селективный ингибитор ФДЭ3. Комбинированное применение цилостазола с донепезилом или галантамином эффективно смягчало снижение когнитивных функций у пациентов с умеренной формой БА (Arai and Takahashi, 2009; Hishikawa et al., 2017). В когортном исследовании с участием 9148 человек было показано, что применение цилостазола снижало риск развития деменции (Tai et al., 2017). Рофлумиласт — селективный ингибитор ФДЭ4, завершил фазу II клинических испытаний как средство для улучшения когнитивной функции у здоровых взрослых людей (Van Duinen et al., 2018). PF-04447943 — селективный ингибитор ФДЭ9A. Несмотря на то, что PF-04447943 оказался безопасным и хорошо переносимым, его прием не влиял на когнитивные функции по сравнению с плацебо (Schwam et al., 2014).
Агонисты мускариновых и никотиновых рецепторов ацетилхолина
Помимо холинэстераз, в качестве многообещающих лекарственных мишеней для улучшения когнитивных функций при БА были исследованы мускариновые (мРА) и никотиновые (нРА) рецепторы ацетилхолина. В фазе III клинических испытаний было продемонстрировано, что ксаномелин — агонист мРА первого поколения — улучшает когнитивные способности. Тем не менее, из-за относительно низкой селективности по отношению к рецепторам M1 ксаномелин может вызывать холинергические побочные эффекты, такие как усиленное пото- и слюноотделение и расстройства пищеварения вследствие активации периферических мРА M2 и M3 (Scarpa et al., 2020). К сожалению, созданные позже высокоселективные агонисты M1 мРА, такие как PF-06767832, MK-7622 иPF-06764427, вызывали холинергическую токсичность и судороги (Davoren et al., 2016; Voss et al., 2018). Агонисты нРА разработаны хуже по сравнению с таковыми для мРА. Существует несколько агонистов нРА, созданных в последние два десятилетия для улучшения когнитивных функций у пациентов с БА. Среди них — энцениклин (EVP-6124) и TC-1734 (AZD-3480). Энцениклин хорошо переносится здоровыми добровольцами при однократном введении, однако позже его испытания были приостановлены в фазе III из-за серьезных побочных эффектов со стороны желудочно-кишечного тракта у пожилых пациентов (Hoskin et al., 2019). TC-1734 представляет собой селективный агонист α4β2-нРА (Dunbar et al., 2011), действие которого на когнитивные способности было изучено в плацебо-контролируемом рандомизированном испытании. По сравнению с группой плацебо пациенты из групп TC-1734 (50 мг) демонстрировали более высокие показатели внимания и эпизодической памяти (Dunbar et al., 2011). Кроме того, в фазе II анализировали воздействие этого агента на когнитивные функции у взрослых с ЛКН (Cummings et al., 2021). Таким образом, агонисты мРА и нРА могут быть перспективными терапевтическими подходами, однако до их внедрения на рынок еще предстоит проделать долгий путь (Verma et al., 2018).
Миметики дофамина
Пониженное выделение дофамина и уменьшение уровня экспрессии его рецепторов связано с возрастным ослаблением когнитивных функций (Volkow et al., 2000). Существуют данные об участии дофамина в патогенезе БА. Восстановление дофаминовой передачи может улучшить обучение и память у людей с БА (Guzmán-Ramos et al., 2012; Martorana and Koch, 2014). В исследовании с участием 60 человек прием дофаминергического агониста пирибедила улучшил общую когнитивную функцию у пациентов с ЛКН (Nagaraja and Jayashree, 2001). Кох с соавт. (2020) изучали эффект дофаминергического агониста ротиготина по отношению к когнитивным функциям при БА легкой и умеренной степени тяжести и обнаружили, что он не влияет на общие когнитивные способности; тем не менее, ротиготин может улучшать когнитивные функции, связанные с лобной долей. Ингибирование моноаминоксидазы B (MAO-B) может повышать доступность дофамина (Koch et al., 2020). В фазе II клинических испытаний с участием 50 человек Мэттьюс с соавт. оценили потенциальные полезные эффекты разагилина (селективного ингибитора MAO-B) при легкой и умеренной БА. Результаты показали, что разагилин может улучшать метаболизм головного мозга, что было показано с помощью позитронно-эмиссионной томографии с фтордезоксиглюкозой, однако он не влиял на общую когнитивную функцию (Matthews et al., 2021). Для оценки влияния дофаминергической стимуляции на когнитивные расстройства необходимы более крупномасштабные исследования.
Препараты для усиления когнитивных функций здоровых взрослых людей
Существуют также препараты, улучшающие когнитивные функции у пожилых людей; они воздействуют на нейромедиаторы, гормоны, системы передачи, кровоснабжение и метаболизм головного мозга (Milić et al., 2021). Сообщалось, что стимулянты, такие как амфетамин и метилфенидат, улучшают исполнительную функцию и память у здоровых взрослых людей (Smith and Farah, 2011; Ilieva et al., 2015). Mодафинил — одобренный FDA препарат, способствующий поддержанию бодрствования, который позволяет длительно поддерживать внимание в условиях депривации сна с помощью повышения уровня катехоламинов в коре головного мозга. В большинстве исследований обнаружено, что модафинил усиливает исполнительную функцию, внимание, обучение и память (Battleday and Brem, 2015; Farah, 2015), однако его когнитивный эффект и безопасность для людей пожилого возраста требуют дальнейшего исследования. Более того, эти препараты часто применяются не по назначению и обладают потенциалом для злоупотребления, поэтому относиться к ним следует с большой осторожностью (Buccafusco, 2009; Milić et al., 2021).
Нефармакологические подходы к улучшению когнитивных функций стареющего мозга
В последнее десятилетие возросло количество исследований, которые показывают, что когнитивные способности можно улучшить нефармакологическими методами (Gavelin et al., 2020; Sikkes et al., 2021). К этим методам относится лечение, направленное на когнитивные функции, физические упражнения с неинвазивной стимуляцией мозга и изменение образа жизни (тaблица 3). Нефармакологическая терапия может быть благоприятна для различных клинических стадий когнитивных расстройств — от ЛКН до деменции. Такая терапия, по большей части, имеет мало побочных эффектов и может применяться в комбинации с фармакологическим лечением (Sikkes et al., 2021).
Таблица 3. Данные по нефармакологическим воздействиям при когнитивных расстройствах у людей старшего возраста
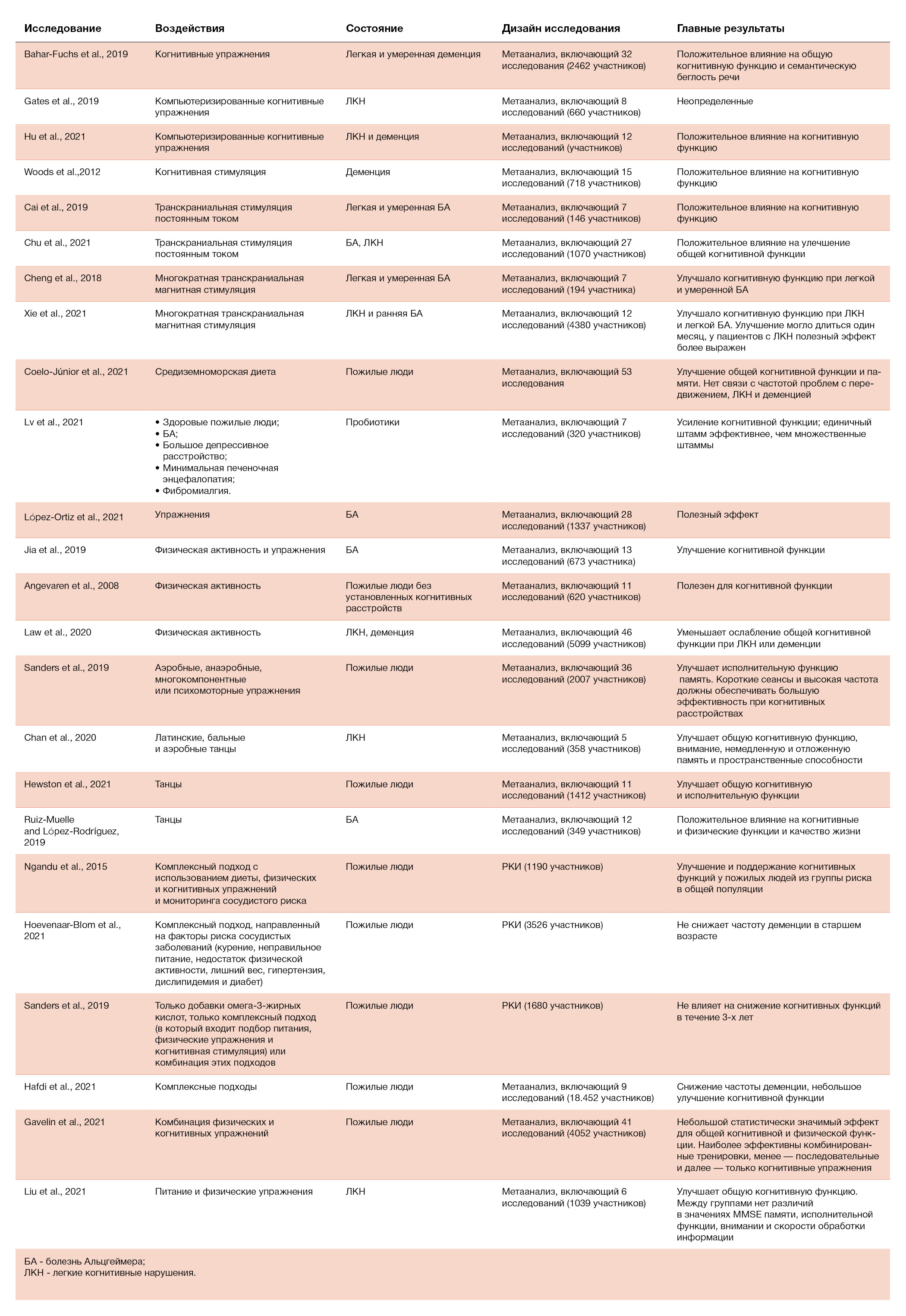
Когнитивно-ориентированные воздействия
Когнитивно-ориентированные воздействия, такие как когнитивные тренировки, когнитивная стимуляция и когнитивная реабилитация, представляют собой подходы для профилактики и терапии снижения когнитивных функций у пожилых людей (Gavelin et al., 2020). Они легкодоступны, а их внедрение не требует высоких затрат. Когнитивные тренировки состоят из повторяющихся практик выполнения стандартных задач, которые нацелены на улучшение или поддержание определенных аспектов когнитивных функций (Bahar-Fuchs et al., 2019). Сложность учебных заданий следует корректировать в зависимости от результатов участников, что особенно возможно при использовании компьютеризированного когнитивного обучения. Когнитивная стимуляция включает неспецифическое участие в активностях для улучшения когнитивного статуса (Bahar-Fuchs et al., 2019). Когнитивная реабилитация может помочь достичь оптимального уровня функционирования в повседневной жизни (Gavelin et al., 2020). Сообщалось также, что когнитивные тренировки оказывают небольшое или умеренное влияние на общие когнитивные способности и умеренное — на вербальную семантическую беглость при легкой и умеренной деменции (Bahar-Fuchs et al., 2019). Гейтс с соавт. с помощью метаанализа оценили эффект компьютеризированной тренировки. Но данные оказались низкого качества, а большинство результатов были неточными, поэтому сделать какой-либо вывод о полезном влиянии компьютеризированной когнитивной тренировки на когнитивную функцию не удалось (Gates et al., 2019). В 2021 году Ху с соавт. включили данные о компьютеризированной тренировке пациентов с ЛКН и деменцией в систематический обзор. В него вошло 12 исследований; было обнаружено, что компьютеризированные когнитивные тренировки могут улучшать общую когнитивную функцию, в особенности память. Анализ по подгруппам показал, что компьютеризированная когнитивная тренировка при деменции была почти вдвое эффективнее, чем при ЛКН (Hu et al., 2021). Когнитивная стимуляция также была связана с улучшением когнитивных функций, собственной оценки жизни, общения и социальных взаимодействий у людей с деменцией (Woods et al., 2012). Несмотря на то, что когнитивно-ориентированные воздействия показали положительный эффект по отношению к когнитивным функциям, требуются высококачественные исследования с большими размерами выборки; необходимо также изучение потенциальной пользы долгосрочных воздействий и их клинической значимости.
Неинвазивная стимуляция головного мозга
Основными техниками неинвазивной стимуляции мозга являются транскраниальная электрическая стимуляция (TЭС) и транскраниальная магнитная стимуляция (TMС). Обе методики безопасны и могут легко переноситься без седации или анестезии (Brunoni et al., 2019). Они действуют за счет модуляции синаптической эффективности и нейронных сетей и применяются в клинической практике.
Транскраниальная электрическая стимуляция
При ТЭС применяют электрический ток низкой интенсивности (1–2 мA) с помощью двух электродов (анода и катода); наиболее изучена транскраниальная стимуляция постоянным током (тСПТ). Эффекты тСПТ определяются направлением электрического тока. Анодная тСПТ увеличивает активность нейронов за счет деполяризации потенциала покоя, в то время как катодная тСПТ ингибирует активность нейронов за счет гиперполяризации потенциала покоя (Grimaldi et al., 2020). Кай с соавт. с помощью мета-анализа оценили влияние тСПТ на когнитивные функции у пациентов с БА легкой и средней степени тяжести. Результаты показали, что тСПТ может усиливать когнитивную функцию; кроме того, эффективен только единичный сеанс тСПТ, в то время как повторные сеансы неэффективны; когнитивные способности улучшаются при использовании только более низкой плотности тока (0,06 мA/см2), а более высокая плотность тока (0,08 мA/см2) не обладает такими эффектами. Недавно Чу с соавт. проанализировали когнитивные эффекты ТЭС при БА и ЛКН. После месяца наблюдений катодная тСПТ показала более значительное влияние на общую когнитивную функцию по сравнению с анодной тСПТ. Анализ по подгруппам выявил существенный ответ на катодную тСПТ только у пациентов с БА; у лиц с ЛКН эффект отсутствовал (Chu et al., 2021).
Транскраниальная магнитная стимуляция
При транскраниальной магнитной стимуляции применяют магнитное поле для индукции потенциалов действия. Эффекты ТМС определяются частотой стимуляции. Когда частота ниже или равна 1 Гц, возбудимость нейронов понижена. При частоте от 5 до 20 Гц возбудимость нейронов повышена (Cespón et al., 2018). При ТМС могут использоваться различные паттерны стимуляции, включая ТМС с одним импульсом (оТМС), ТМС с двойным (или парным) импульсом (дТМС) и повторяющуюся ТМС (пТМС). оТМС состоит из единичных импульсов с интервалами без стимуляции продолжительностью не менее 4 с, дТМС — из тестового импульса и предшествующего ему кондиционирующего импульса, к пТМС относят более чем два импульса, подаваемые в течение интервала не более 2 с (Valero-Cabré et al., 2017). пТМС обширно изучалась в контексте депрессии и была одобрена FDA для лечения депрессии, резистентной к лекарствам (Iriarte and George, 2018). В последние годы пТМС рассматривали как многообещающее средство для улучшения когнитивных функций (Iriarte and George, 2018). В двух систематических обзорах сообщалось, что высокочастотная пТМС может оказывать умеренное влияние на когнитивные функции у пациентов с БА и ЛКН (Cheng et al., 2018; Xie et al., 2021). Однако выводы ограничивались малым размером выборки включенных исследований. Чтобы определить влияние ТМС на пожилых людей с когнитивными нарушениями, необходимы более крупные РКИ и дополнительные исследования.
Питание и рацион
Питание — важный фактор, влияющий на здоровое старение. Здоровый рацион может благоприятно влиять на когнитивные функции (Jennings et al., 2020). Всемирная организация здравоохранения (2019) поддерживает идею, что здоровый рацион снижает риск снижения когнитивных функций и/или деменции. Некоторые, хотя и не окончательные данные свидетельствуют о том, что определенные питательные вещества, включая жирные кислоты омега-3 с длинной цепью, витамин B, витамин D, селен и т. д., способствуют поддержанию здоровья мозга у пожилых людей (Scarmeas et al., 2018). Также предполагается, что и режим питания обеспечивает здоровье мозга у пожилых людей (Scarmeas et al., 2018; Power et al., 2019; Flanagan et al., 2020). Наиболее изученной моделью питания является средиземноморская диета (Chen et al., 2019), которая включает в себя высокое потребление овощей, фруктов, бобовых, оливкового масла, цельного зерна, рыбы, низкое или умеренное потребление молочных продуктов, алкоголя, а также ограничение красного мяса (Power et al., 2019). Согласно мета-анализу, высокая приверженность средиземноморской диете связана с лучшей общей когнитивной функцией и памятью (Coelho-Júnior et al., 2021). Однако, вопрос о том, снижается ли при этом риск развития ЛКН или деменции, остается открытым (Coelho-Júnior et al., 2021; García-Casares et al., 2021). Кетогенная диета — еще один специфический рацион, который мог бы обеспечить лечебные преимущества для пациентов с БА. Тем не менее, существующие исследования ограничены небольшими размерами выборки и краткосрочными эффектами; необходимо проводить дальнейшую работу в этом направлении (Hersant and Grossberg, 2022). Регуляцию режима питания наряду с другими индивидуальными подходами можно рассматривать как способ улучшить когнитивные функции у людей старшего возраста.
В последнее десятилетие значительное внимание уделялось взаимодействию между кишечными микроорганизмами и мозгом (Martin et al., 2018; Willyard, 2021). Обнаружено, что кишечная микробиота связана с эмоциями, когнитивными функциями и социальным поведением (Sarkar et al., 2018). Воздействие пробиотиками обеспечивает доставку специфических штаммов бактерий, которые повышают число и разнообразие полезных микроорганизмов, изменяя таким образом кишечную микробиоту (Eastwood et al., 2021). Лв с соавт. в мета-анализе оценили влияние пробиотиков на когнитивные способности и обнаружили, что добавки с пробиотиками улучшают когнитивные функции. Далее анализ подгрупп показал, что эффект усиления встречается только у людей с когнитивными расстройствами. Более того, единичный штамм был более эффективен, чем множественные штаммы (Lv et al., 2021). Таким образом, было сделано предположение, что пробиотики могут служить эффективной и доступной когнитивной терапией; однако для подтверждения этого требуется больше РКИ.
Физические упражнения
Появляется все больше данных, которые указывают на то, что физические упражнения не только способствуют улучшению состояния здоровья, но и участвуют в сохранении когнитивных функций. Механизмы, ответственные за нейропротекторные эффекты физических упражнений по отношению к головному мозгу, включают повышение уровня нейротрофических факторов, усиление синаптогенеза, улучшение васкуляризации, уменьшение системного воспаления и снижение уровня аномального отложения белков (Kirk-Sanchez and McGough, 2014). Влияние физических упражнений на когнитивные функции изучалось в нескольких мета-анализах; внимание было преимущественно сфокусировано на аэробике (Jia et al., 2019; Sanders et al., 2019; López-Ortiz et al., 2021). Ангеварен с соавт. (2008) провели Кокрановский обзор пожилых людей без известных когнитивных расстройств. Они обнаружили, что аэробика улучшает когнитивные способности, включая моторную функцию, скорость восприятия и зрительное внимание. В другом мета-анализе сообщалось, что аэробика предотвращает снижение когнитивных функций у людей с ЛКН и деменцией. Значительно тормозилось ослабление рабочей памяти, но эффекты по отношению к прочим когнитивным аспектам по-прежнему остаются неясными. Умеренная и интенсивная аэробика лучше влияет на когнитивные функции (Law et al., 2020). В другом мета-анализе изучалась зависимость «доза — реакция» и было обнаружено, что более короткие сеансы и более высокая частота упражнений могут давать лучший когнитивный эффект (Sanders et al., 2019).
Танцы
Занятия танцами — другая стратегия, поскольку они требуют задействования физических, когнитивных и социальных способностей. Этой теме посвящено множество исследований. Результаты недавнего мета-анализа людей с ЛКН показывают, что танцы оказывают небольшое или умеренное влияние на когнитивные функции, такие как внимание, немедленная или отложенная память, зрительно-пространственные способности и общие когнитивные способности (Chan et al., 2020). В другом мета-анализе с участием здоровых людей старшего возраста и пожилых лиц с ЛКН также было обнаружено, что танцы улучшают общую когнитивную и исполнительную функции (Hewston et al., 2021). Положительное влияние танца на когнитивную функцию у взрослых с БА также подтверждается в систематическом обзоре (Ruiz-Muelle and López-Rodríguez, 2019). Таким образом, танцы можно предложить в качестве дополнительной терапии при когнитивных расстройствах у стареющего населения.
Комплексные подходы
Поскольку когнитивные нарушения представляют собой сложные многофакторные расстройства, в качестве новой стратегии можно рассматривать комплексные подходы (Kivipelto et al., 2018). За последние десятилетия сообщалось о трех крупных клинических испытаниях комплексных методик (FINGER, MAPT и PreDIVA). В исследовании FINGER для улучшения когнитивной функции у пожилых людей с риском когнитивных расстройств применяли диету, физические упражнения, когнитивные тренировки и мониторинг сосудистого риска (Ngandu et al., 2015). В исследовании preDIVA в течение 12 лет применяли комплексный подход, направленный на сосудистые факторы риска в связи с курением, нездоровым рационом, недостатком физической активности, избыточным весом, гипертензией, дислипидемией и диабетом, однако он не снижал риск деменции у пожилых людей (Hoevenaar-Blom et al., 2021). В испытании MAPT использовался комплексный подход и употребление омега-3-ненасыщенных жирных кислот, и результаты его не выявили значимого влияния на когнитивную функцию (Andrieu et al., 2017). Несмотря на эти исследования, влияние комплексного подхода на когнитивные расстройства также изучалось в ряде мета-анализов. В Кокрановском обзоре было обнаружено небольшое улучшение когнитивных функций. Тем не менее, может ли комплексный подход снижать частоту возникновения деменции, остается неясным (Hafdi et al., 2021). Гейвлин с соавт. (2021) сообщают, что комбинация физических и когнитивных упражнений оказывает небольшое положительное влияние на общую когнитивную функцию у пожилых людей. Общую когнитивную функцию у людей старшего возраста можно также улучшить с помощью комбинации правильного питания и физических упражнений (Liu et al., 2021).
Заключение
Таким образом, для улучшения когнитивных функций у пожилых людей были предложены разнообразные фармакологические (ингибиторы холинэстераз, мемантин, противодиабетические средства, пробиотики, церебролизин) и нефармакологические (когнитивно-ориентированные воздействия, неинвазивная стимуляция мозга, физические упражнения и изменение образа жизни) подходы. Хотя у людей старшего возраста были определены новые мишени лекарственного воздействия для улучшения когнитивных функций, продолжается разработка новых препаратов. Существующие потенциальные лекарственные мишени следует использовать в дальнейшем, а открытие новых мишеней может решить проблему нехватки эффективных лекарственных средств. Большинство нефармакологических подходов показали небольшое или умеренное положительное влияние на когнитивные функции у людей старшего возраста с когнитивными расстройствами. Таким образом, комбинации фармакологических и немедикаментозных вмешательств или комбинации различных типов немедикаментозных вмешательств могут быть более эффективными для улучшения или сохранения когнитивных функций.





