По календарю прививок вакцинация БЦЖ против туберкулеза проводится одной из первых в жизни. Это неудивительно, ведь туберкулезная палочка сегодня считается самым распространенным инфекционным агентом в мире. Но так ли хороша вакцина БЦЖ, раз болезнь все еще не удалось победить? Читайте об этом в статье, продолжающей спецпроект по вакцинации на «Биомолекуле».
Изобретение вакцин кардинально изменило жизнь человечества. Многие болезни, уносившие тысячи, а то и миллионы жизней ежегодно, теперь практически не встречаются. В этом спецпроекте мы не только рассказываем об истории возникновения вакцин, общих принципах их разработки и роли вакцинопрофилактики в современном здравоохранении (этому посвящены первые три статьи), но и подробно говорим о каждой вакцине, включенной в Национальный календарь прививок, а также вакцинах против гриппа и вируса папилломы человека. Вы узнаете о том, что собой представляет каждый из возбудителей болезней, какие существуют варианты вакцин и чем они различаются между собой, затронем тему поствакцинальных осложнений и эффективности вакцин.
Туберкулез вызывают микобактерии туберкулезного комплекса, которые относятся к роду Mycobacterium. Чаще всего это M. tuberculosis, или палочка Коха, названная так по фамилии открывшего ее знаменитого микробиолога [54]. К туберкулезному комплексу относятся также микобактерии M. bovis, M. africanum, M. microti, M. pinnipedii и M. caprae.
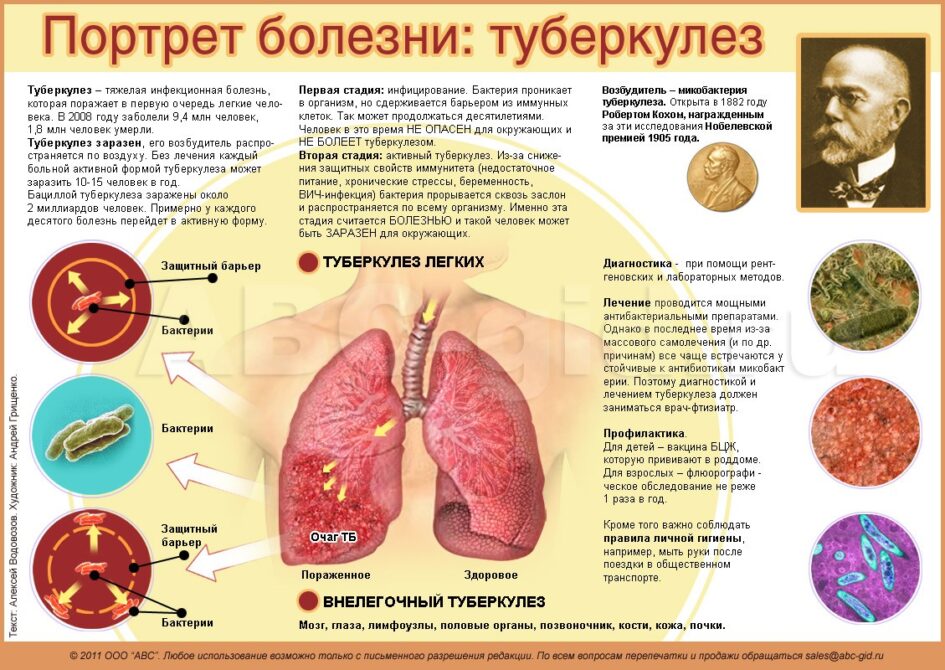
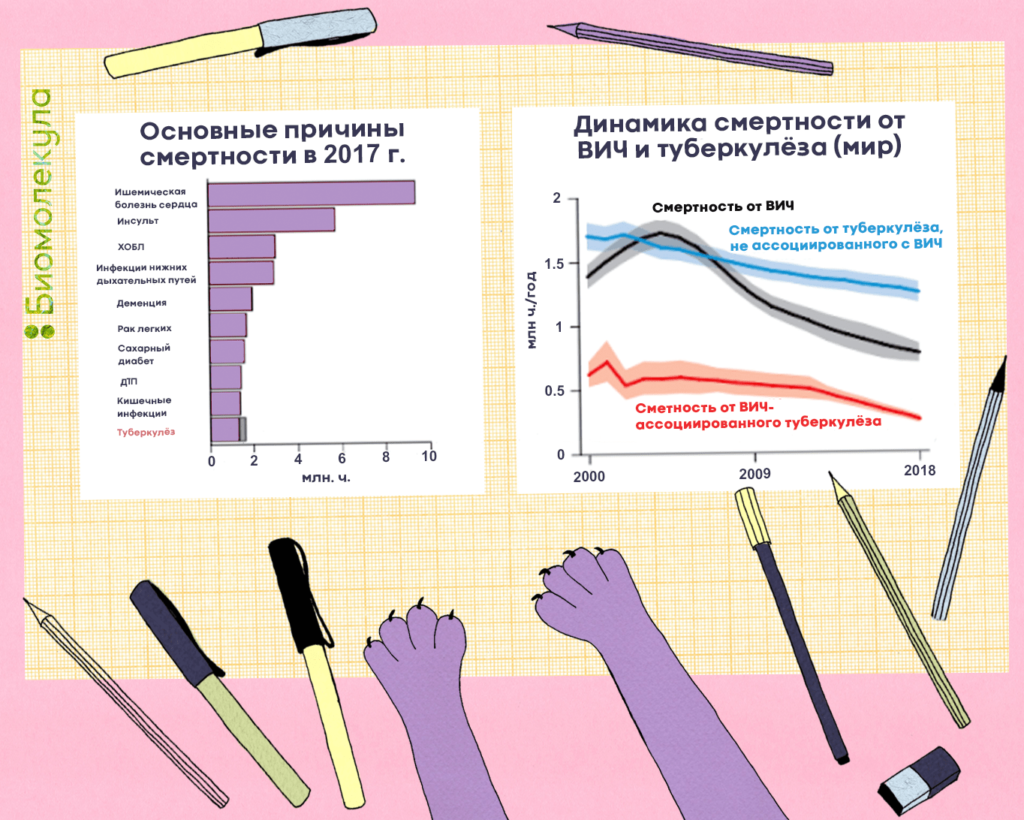
Туберкулез очень опасен, ведь в большинстве случаев он поражает легкие — жизненно важный орган человека. До сих пор его не удается победить: болезнь входит в десятку причин смертности и лидирует среди инфекционных заболеваний по количеству смертей от одного инфекционного агента, обгоняя ВИЧ (рис. 1). В 2018 году в мире им заболело около 10 млн человек, еще примерно 1,5 млн умерли. Всего же за последние 100 лет туберкулез унес жизни порядка 100 млн человек. Скрытая же форма болезни, которая может проявиться в любой момент, встречается минимум у четверти всего населения Земли [1]!
На карте, опубликованной ВОЗ (рис. 2), видно, что среди популярных у россиян туристических направлений смертность от туберкулеза выше, чем в России, только в Индии, Монголии, Индонезии и некоторых других странах Юго-Восточной Азии и Африки.
Туберкулез оставил заметный след в истории и произведениях искусства. Интересный факт: Симонетта Веспуччи, которая, будучи первой красавицей во Флоренции, позировала для картины Боттичелли «Рождение Венеры», была на тот момент больна милиарным туберкулезом, затрагивающим несколько органов одновременно. На картине у нее резко перекошено плечо, что может говорить о поражении плечевого сустава (рис. 3). Картина была закончена художником уже после смерти Веспуччи от туберкулеза.

Жертвами туберкулеза стали многие выдающиеся личности. Болезнь не щадила никого. Королева Франции Мария-Антуанетта (1755–1793 гг.) имела четырех детей, трое из которых погибли очень рано, заболев туберкулезом. В XIX веке смерть от туберкулеза приобрела оттенок благородства, так как симптомы болезни совпадали с чертами утонченных героев романтизма: бледная кожа, блеск в глазах, общая слабость. О туберкулезе говорили многие писатели и философы — Вольтер, Манн, Достоевский, Дюма.
Меж тем как это веселье, эта манера разговаривать и пить у
других, казалось, происходили от распущенности, привычки и избытка сил, у
Маргариты они производили впечатление потребности забыться,
лихорадочного состояния, нервной возбудимости. При каждом бокале
шампанского ее щеки покрывались нездоровым румянцем, и кашель, легкий в
начале ужина, усилился в конце и заставлял ее закидывать голову на
спинку стула и прижимать руки к груди всякий раз во время приступа. Мне
было больно думать, как это хрупкое создание должно было страдать от
постоянной невоздержанности. В конце концов произошло то, что я
предвидел и чего так боялся. К концу ужина у Маргариты случился особенно
сильный приступ кашля. Мне казалось, что грудь ее раздирает изнутри.
Бедная девушка побагровела, закрыла от боли глаза и поднесла к губам
платок, который окрасился кровью. Тогда она встала и побежала в уборную.Александр Дюма (сын).
Отрывок из романа «Дама с камелиями» (перевод: С.М. Антик).
Сейчас, в XXI веке, ни о какой романтизации туберкулеза речи не идет. Неизменным остается только стремление ученых и врачей обуздать наконец палочку Коха и победить болезнь. Это очень сложная задача. Несмотря на попытки уничтожить инфекцию, количество случаев туберкулеза в 1980-х годах возросло из-за пандемии ВИЧ, ухудшения качества жизни в городах и возникновения у бактерий антибиотикорезистентности. Кроме того, болезнь коварна тем, что на ранних этапах у нее нет никаких специфических симптомов, позволяющих однозначно отличить туберкулез от любой другой болезни.
Новой глобальной проблемой стала лекарственно-устойчивая форма туберкулеза — только в 2017 году в мире выявили около полумиллиона таких случаев. При этом в России она нередка и встречается у 28% впервые заболевших и у 47% повторно заболевших [2].
Поскольку лечение туберкулеза — очень долгий процесс, который далеко не всегда приводит к выздоровлению, особенное значение приобретает вакцинация. Но и тут не все так хорошо, как хотелось бы. Единственная противотуберкулезная вакцина БЦЖ была изобретена еще в начале XX века. Сегодня мы знаем, что ее недостаточно для полной победы над болезнью. В этой статье мы выясним, чем же плоха БЦЖ, и стоит ли ждать новых противотуберкулезных вакцин в ближайшем будущем.
Вехи истории
Туберкулез (или чахотка) был известен с древнейших времен, и в разное время подходы к его пониманию и лечению были совершенно разными. Человечество прошло путь от домыслов о происхождении болезни и смехотворных попыток ее вылечить исландским мхом, сваренным в молоке с сахаром, настоем дегтя, сном в коровнике и даже смехом [3] до открытия возбудителя инфекции, создания лекарственных препаратов и вакцины против него (рис. 4) .
Об истории туберкулеза подробно рассказано в статье «Болезнь, не думавшая сдаваться» [55]. — Ред.

Знакомство с туберкулезом
Возбудитель туберкулеза — палочка Коха
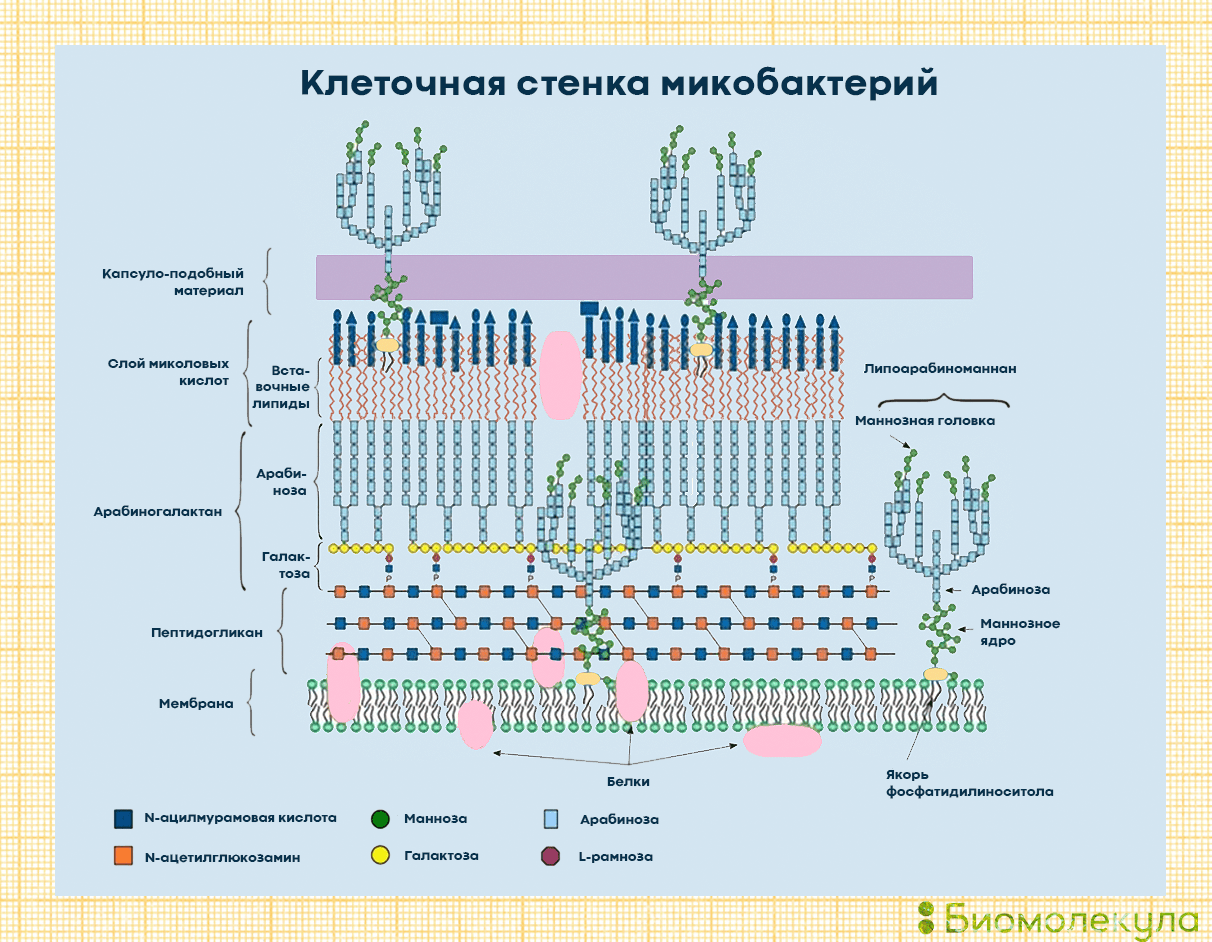
Строение палочки Коха — это ключ к ответу на вопрос, почему туберкулез настолько тяжело победить. Бактерии Mycobacterium tuberculosis отличаются сложнейшим строением клеточной стенки, которая делает их устойчивыми к кислотам, щелочам, спирту и многим другим веществам. Они не образуют спор и капсул: им это просто не нужно — они и без того имеют прочный «бронежилет». Благодаря ему даже поглощенные иммунными клетками микобактерии могут продолжать размножаться.
Что же представляет собой клеточная стенка микобактерий? Это самая сложная стенка среди всех прокариот (рис. 5). Поверх обычной для всех клеток живых организмов оболочки — липидной двухслойной мембраны — у микобактерий имеется внушительный «бронежилет», состоящий из нескольких слоев. Пептидогликаны (муреин) служат каркасом клеточной стенки и отвечают за осмотическую защиту клетки. Арабиногалактаны образуют полисахаридную основу стенки и связывают пептидогликановый слой и миколовые кислоты. Липоарабиноманнан пронизывает стенку бактерии и выходит на ее поверхность, обусловливая антигенные свойства бактерии. В клеточной стенке туберкулезной палочки есть и другие молекулы с антигенными свойствами, которые узнаёт иммунная система, — например белки туберкулопротеины. С внешней стороны клеточная стенка окружена слоем длинноцепочечных миколовых кислот. Гены их метаболизма занимают более 20% генома туберкулезной микобактерии. Сверху вся клетка покрыта полисахаридным капсуло-подобным материалом, на котором закреплено большинство антигенов и который обеспечивает взаимодействие с другими бактериями и клетками человека.
К слову, оболочка наших с вами — эукариотических — клеток состоит всего из одного слоя: клеточной мембраны. Подробнее о ее устройстве можно прочесть в статье «Липидный фундамент жизни» [56]. — Ред.
Миколовые кислоты находятся в бактерии в свободном виде и в виде так называемого корд-фактора (димиколата трегалозы). Это вещество — один из главных компонентов факторов вирулентности палочки Коха, который нужен ей для успешного заражения хозяина. Именно благодаря действию корд-фактора, бактерии, «склеиваясь» друг с другом, могут формировать нитевидный мицелий, как у грибов (рис. 6). Не зря в слове «микобактерии» есть греческая приставка «мико-», которая переводится как «гриб» [4].
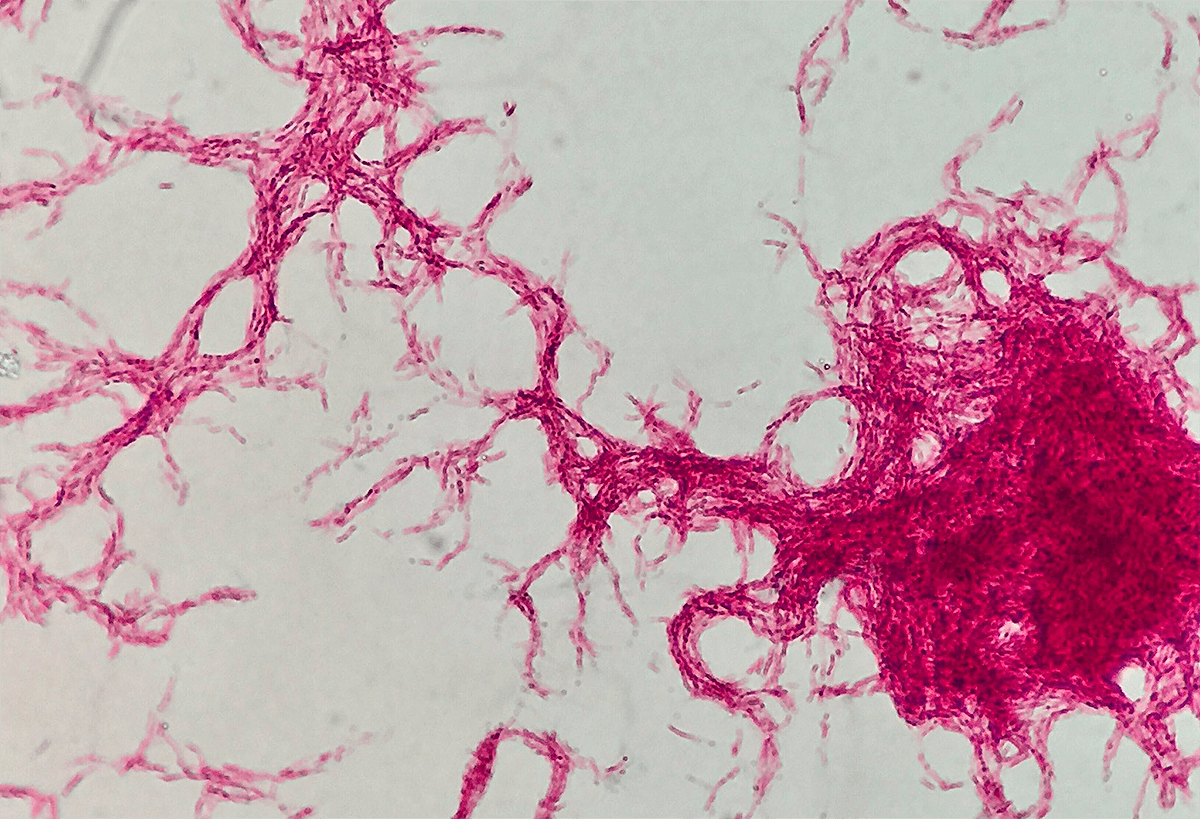
Туберкулезные бактерии способны сбрасывать с себя свою прочную клеточную стенку, образуя так называемые L-формы, которые имеют сниженный уровень обмена веществ и ослабленную вирулентность. L-формы микобактерий могут длительное время сохраняться в организме, поскольку они лишены почти всех своих наружных антигенов, из-за чего хуже узнаются иммунными клетками. Кроме того, такая бактерия, отбросив клеточную стенку, дезориентирует иммунные клетки, которые продолжают атаковать пустую оболочку (прямо как самолет, который выбрасывает тепловую ловушку для защиты от самонаводящихся ракет).
Исследователи не перестают искать уязвимые места у этих опасных и живучих микроорганизмов, но процесс этот медленный — один цикл деления микобактерий занимает 24 часа. Из-за этого проверка эффективности лекарств и новых вакцин на животных (в первую очередь, на мышах) может растягиваться до нескольких месяцев или даже лет.
Характерной особенностью палочки Коха, как и других микобактерий, является то, что у нее отсутствуют плазмиды, обеспечивающие другим микроорганизмам возможность обмена генетической информацией. На первый взгляд, из-за этого изменчивость генома палочки Коха должна быть меньше, чем у других бактерий, однако это не так. Изменчивость у них достигается за счет специальных участков генома, которые называются транспозонами [57], [58]. Эти мобильные элементы способны перемещаться по геному, выпетливаясь из одного участка геномной ДНК микобактерии и встраиваясь в другой. Таким образом, появление у туберкулезных бактерий новых признаков, таких как резистентность к антибиотикам, вызвано мутациями в ДНК нуклеоида, а не переносом плазмид от клетки к клетке, и, следовательно, может передаваться только потомкам клетки при делении [5].
Разнообразие палочек Коха в природе
Существует множество различных генетических линий туберкулезных бактерий, разнообразие которых объясняется, в первую очередь, мутационной изменчивостью. Штаммы, которыми заражены большинство больных туберкулезом, относятся к семейству Lineage-4. Наиболее широко штаммы линии Lineage-4 представлены в странах Европы и Нового Света, причем среди них есть как «глобальные штаммы», распространенные по всему миру, так и «штаммы-эндемики». Все они различаются по своему антигенному составу, что сказывается на разработке средств профилактики и лечения вызываемой ими инфекции [6].
В России и Украине господствующее положение занимают штаммы другой генетической линии Lineage-2, а именно семейство штаммов Beijing (найден в предместьях Пекина в 1956 году). Каждый год ими заболевают до 150 тысяч человек, причем по некоторым данным штаммы именно этого семейства чаще других вызывают туберкулез с лекарственной устойчивостью [7].
Как человек заболевает туберкулезом?
Передача возбудителя туберкулеза осуществляется воздушно-капельным путем. При кашле или чихании, разговоре или пении капельки слюны больного легочной формой инфекции вместе с бактериями попадают в воздух, и находящийся рядом здоровый человек может их вдохнуть. В связи с этим туберкулез часто бывает распространен в густонаселенных районах (видео 1).
В группу риска входят дети до 5 лет, молодые люди в возрасте 14–20 лет и пожилые, наркоманы, алкоголики, люди с хроническими заболеваниями (сахарный диабет, силикоз, болезни почек и т.д.), онкологией и сниженным иммунитетом (в том числе, из-за ВИЧ), а также представители некоторых профессий (медработники, сотрудники приютов для бездомных, исправительных учреждений, домов для престарелых) и бездомные [8]. CDC отмечают, что туберкулез легких не передается через рукопожатия, общие еду, напитки, постельное белье, зубные щетки и даже поцелуи. Развитие самой распространенной формы болезни — туберкулеза легких — происходит в три стадии (рис. 7).
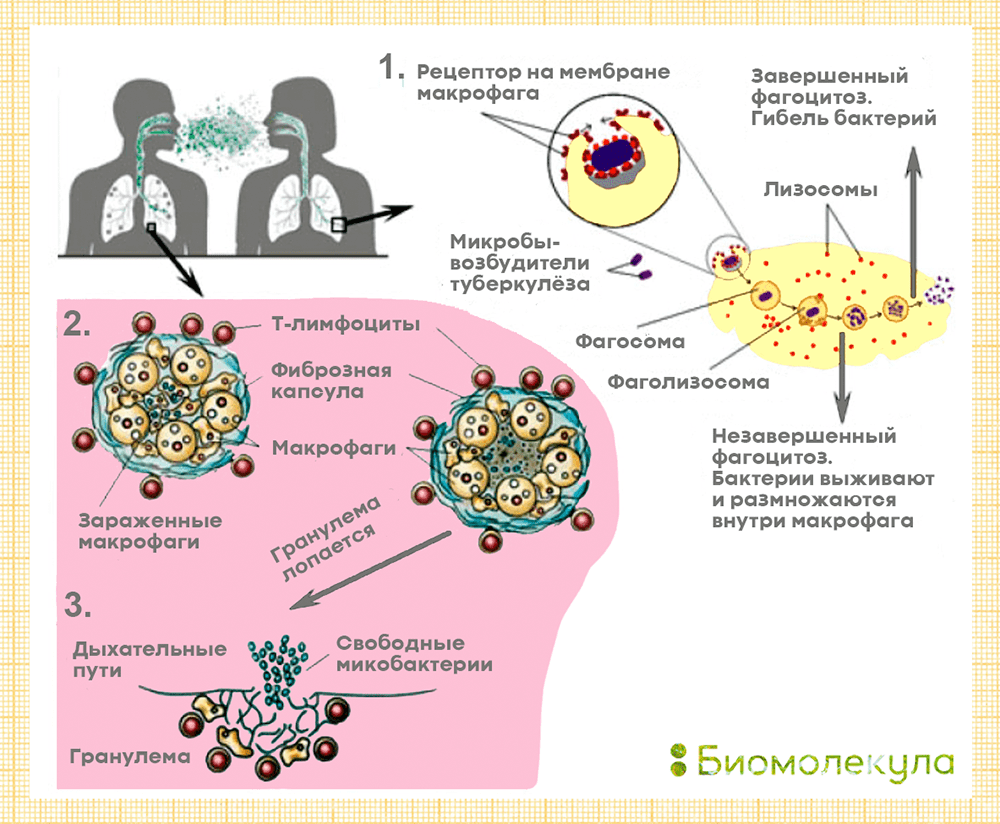
Сначала бактерии туберкулеза попадают в легкие, где медленно делятся и, пока их немного, остаются почти незаметными для иммунной системы. Туберкулез чаще поражает верхние доли легких, чем нижние, причина этого неясна. В самой ранней фазе инфекции туберкулезная палочка привлекает внимание клеток врожденного иммунитета — фагоцитов (в первую очередь, нейтрофилов и макрофагов), способных поглощать чужеродные бактерии и вирусы. Они захватывают бактерии извне, образуя фагосомы, после чего фагосомы сливаются с лизосомами, помогающими переварить врага . Если вирулентность бактерии невысока, то на этом ее жизнь заканчивается. Однако часто микобактерии беспрепятственно размножаются внутри фагоцитов благодаря специальным веществам, мешающим лизосомам сливаться с фагосомами. В этом случае зараженные фагоциты погибают, а микобактерии выходят наружу.
Подробнее о том, как работает иммунитет, читайте в статье «Иммунитет: борьба с чужими и… своими» [59]. — Ред.
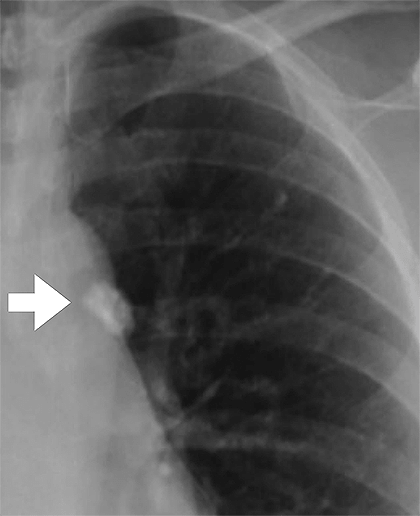
Когда макрофаги разрушаются, из них вытекают ферменты, повреждающие ближайшие клетки легкого. Если сразу разрушилось достаточно много макрофагов, в легких наблюдаются очаги распадающейся ткани, воспаление, а также туберкулы — узелки, где больше всего палочек Коха. На этой стадии заболевания иммунитет все еще может сдерживать инфекцию посредством образования гранулем. Часто, если человек заболел впервые в жизни, у него образуется одна гранулема размером с вишню, которую видно на рентгеновском снимке (рис. 8). Это первичное поражение легких при туберкулезе называют очагом Гона по имени профессора Антона Гона, впервые описавшего его в 1912 году [9], [10]. В большинстве случаев гранулема не перерастает в полноценный туберкулез и зарубцовывается, образуя капсулу с макрофагами (где по-прежнему могут продолжать жить микобактерии) и соединительной тканью. Инфекция в гранулеме сохраняется пожизненно, а это таит в себе риск активации туберкулеза в любой момент. Например, у героя операции в Перл-Харборе летчика Ричарда Беста латентный туберкулез «активизировался» из-за вдыхаемых им едких паров в самолете. Он вылечился, но стал инвалидом на всю оставшуюся жизнь. Поразительно, но зажившие очаги Гона встречаются у 97% трупов взрослых людей. Учитывая это, становится очевидным, что в ближайшее время туберкулез вряд ли удастся победить [11].
В 10% случаев иммунная система не в состоянии сдержать инфекцию. В этом случае гранулема прорывается, и микобактерии выходят на волю. Риск этого выше у людей со сниженным иммунитетом, например, у больных СПИДом и пациентов, проходящих иммуносупрессивную терапию.
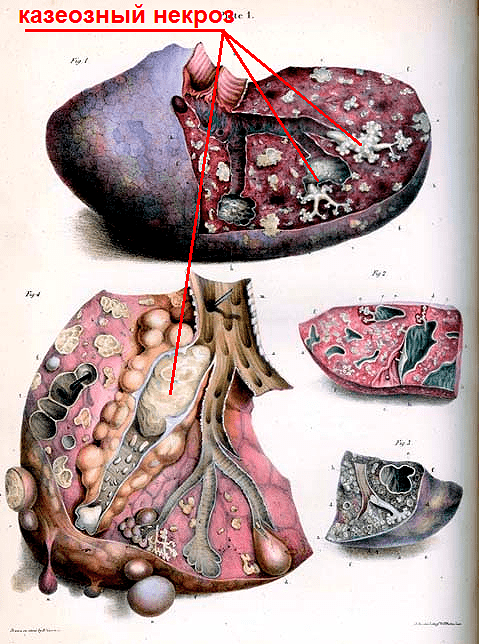
Если макрофаги не могут справиться с туберкулезной палочкой, размножение микобактерий становится неконтролируемым. Повреждения, вызванные ферментами погибших фагоцитов, становятся еще серьезнее. Это дает почву для еще большего размножения туберкулезных палочек, так как из клеток человека высвобождаются питательные вещества. Воспалительная реакция лавинообразно распространяется на все легкие, и очаг воспаления становится похож на однородную творожистую массу из иммунных клеток, погибших клеток легких и колоний бактерий (рис. 9). В результате орган перестает исправно выполнять свою жизненно важную функцию — газообмен, и человек гибнет.
Туберкулез может поражать различные части организма. В 90% случаев болезнь касается легких, но мишенью для заражения могут стать также нервная система, кости, мышцы и другие органы.
Туберкулез в других органах
Среди внелегочных форм туберкулеза распространена костная форма, когда разрушается губчатое вещество кости. Такая патология может закончиться инвалидностью или смертью. От туберкулеза костей страдает примерно 3% всего населения планеты, при этом чаще всего инфекция касается детей старше шести лет. В кости болезнь проникает из легких с током крови или лимфы. Чаще всего страдают те кости, которые наиболее активно кровоснабжаются, например, позвонки, кости голени и т.д. На первых этапах заражения болезнь почти не проявляет себя, только спустя несколько месяцев появляются общие признаки туберкулеза, а также боли, особенно после физических нагрузок [12]. Долгое время костный туберкулез не удавалось никак лечить. От него в 1931 году в возрасте 11 лет умерла младшая дочь Корнея Чуковского, которую он ласково звал Мурочкой и для которой писал свои знаменитые детские сказки.
Не менее опасен милиарный туберкулез, когда, из-за распространения микобактерий с кровью, страдает почти весь организм. В этом случае в инкубационном периоде нигде не возникают гранулемы, а очаги заражения со временем могут сливаться друг с другом. Сегодня при лечении антибиотиками милиарный туберкулез перестал быть смертельным, и пациенты получили шанс на выздоровление [13].
Наконец, наиболее тяжелой формой является туберкулез центральной нервной системы. Он практически не лечится [14], характеризуется очень высокой летальностью, но, к счастью, весьма редок, поэтому посвященных ему исследований не так много. Все авторы едины в том, что туберкулез ЦНС — заболевание трудно диагностируемое, его легко перепутать с другими болезнями. Симптомы туберкулеза ЦНС проявляются практически сразу после заражения и включают головные боли, вялость, рвоту, полное отсутствие аппетита, помутнение рассудка и нарушение рефлексов [15], [16].
Исследования, связанные с упрощением диагностики и лечения более редких, внелегочных форм туберкулеза, продолжаются по сей день.
Найти и обезвредить: как диагностируют и лечат туберкулез?
Диагностика и лечение туберкулеза — трудная задача. Основные лекарства — антибиотики. Туберкулез перестал быть приговором лишь в 1943 году с открытием Зельманом Ваксманом [60] антибиотика стрептомицина; до этого болезнь лечили исключительно хирургическим путем. К сожалению, с появлением лекарственно-устойчивых форм, хирургические пути лечения туберкулеза вновь становятся значимы.
Терапия при туберкулезе всегда комбинированная. Сначала пациенту назначают ряд препаратов первой линии (это пять антибиотиков — изониазид, рифампицин, пиразинамид, этамбутол и стрептомицин). Если оказывается, что туберкулез обладает множественной лекарственной устойчивостью, приходится переключаться на антибиотики второй линии. Всего в мире широко применяют около двадцати противотуберкулезных препаратов, курсы приема которых длятся месяцами.
Время от времени появляются новые методы лечения туберкулеза. Так, в начале XXI века разработали метод клапанной бронхоблокации (рис. 10), эффективный при лекарственно-устойчивых формах туберкулеза. Методика заключается в установке специального клапана, который создает искусственную гиповентиляцию в определенном участке легкого, где находятся микобактерии, что приводит к их гибели из-за недостатка кислорода. Пока метод не получил широкого применения в связи с достаточно сложной техникой выполнения, но применяется в клиниках с развитой хирургией и бронхоскопией [17]. Ведется разработка и новых противотуберкулезных антибиотиков. Так, в клинику внедрено применение бедаквилина и некоторых других препаратов, эффективных против бактерий, устойчивых к классическим препаратам [1]. 1/2
Рисунок 10а. Клапанная бронхоблокация. Аппарат для установки в бронхи специальных эндобронхиальных клапанов — бронхофиброскоп.
«Применение клапанной бронхоблокации при осложнённом туберкулёзе лёгких»
Для диагностики туберкулеза используется несколько основных подходов. Во-первых, это тестирование на наличие иммунного ответа против туберкулезных антигенов — всем известная проба Манту или ее аналоги. Во-вторых, это поиск очагов заболевания в легких при помощи флюорографии и рентгенографии. И, наконец, в третьих, это поиск непосредственно микобактерий в биоматериале пациента при помощи методов культуральной диагностики. В сфере диагностики туберкулеза наметилась положительная тенденция .
Подробно про методы диагностики туберкулеза рассказано в статье «Болезнь, не думавшая сдаваться» [55]. Прочтите также материал «Найти и заменить: существует ли альтернатива пробе Манту» [61]. — Ред.
Вакцина против туберкулеза — БЦЖ
Столетняя история одной вакцины
Предотвратить развитие туберкулеза намного лучше, чем долго и мучительно лечиться. Впервые об этом задумался в конце XIX века первооткрыватель туберкулезных микобактерий Роберт Кох [54]. Изучая коровью оспу в 1890 году, он обнаружил, что существует бактерия, вызывающая туберкулез у коров — M. bovis. Она сильно отличалась от ранее открытой им человеческой туберкулезной палочки, но имела с ней и ряд сходств. Кох предположил, что можно ввести эту бактерию человеку, и она будет способствовать выработке иммунитета против M. tuberculosis, не вызывая при этом активного заболевания. К сожалению, испытания этой вакцины обернулись катастрофой — M. bovis оказалась такой же опасной для человека, как и M. tuberculosis [18].
Спустя некоторое время, в 1908 году, начали работу над первой и на данный момент единственной противотуберкулезной вакциной — БЦЖ, в основе которой были «обезоруженные» бактерии M. bovis. Ее получили французские микробиолог Альбер Кальмет и ветеринар Камиль Герен (рис. 11), которые в это время работали в Институте Пастера в Лилле. В их честь вакцина и была названа: по-французски ее полное название Bacillus Calmette–Guérin, или BCG.

Кальмет и Герен выращивали бактерии на различных средах, чтобы понять, как это влияет на их поведение. Оказалось, что на среде на основе глицерина, коровьей желчи и экстракта картофеля вырастают наиболее безопасные для человека микобактерии. Если выращивать микобактерии на этой среде на протяжении длительного времени, они эволюционируют и становятся все менее и менее патогенными. Вакцины с такими бактериями называются аттенуированными , поскольку они содержат ослабленные бактерии, которые не могут вызвать болезнь, но способны запустить формирование эффективного иммунного ответа, включающегося при столкновении организма с естественной инфекцией. Для получения БЦЖ понадобилось около 230 пересевов микобактерий!
Подробнее о различных вариантах вакцин рассказано в статье «Разработка вакцин: чем и как имитировать болезнь» [26] нашего спецпроекта. — Ред.
В 1921 году вакцину против туберкулеза предложили использовать на людях. Дело осложнилось тем, что в немецком г. Любеке произошла массовая вспышка туберкулеза среди новорожденных, получивших вакцину, — заболел 251 человек, 72 умерло. Позже выяснилось, что вакцинный препарат по каким-то причинам содержал вирулентный штамм палочки Коха [19].
В 1925 году Кальмет передал штамм БЦЖ в СССР профессору Льву Тарасевичу. Это событие имело, помимо всего прочего, политическое значение, поскольку демонстрировало дипломатическое доверие между СССР и Францией: остальные страны поначалу отказались от исследования БЦЖ. Штамм БЦЖ, полученный в ходе работы группы Л.А. Тарасевича, был назван BCG-1 Russia. Тем не менее вплоть до окончания Второй Мировой войны эта вакцина практически не использовалась, поскольку старые трагедии, связанные с вакцинацией от туберкулеза, еще не были забыты [21].
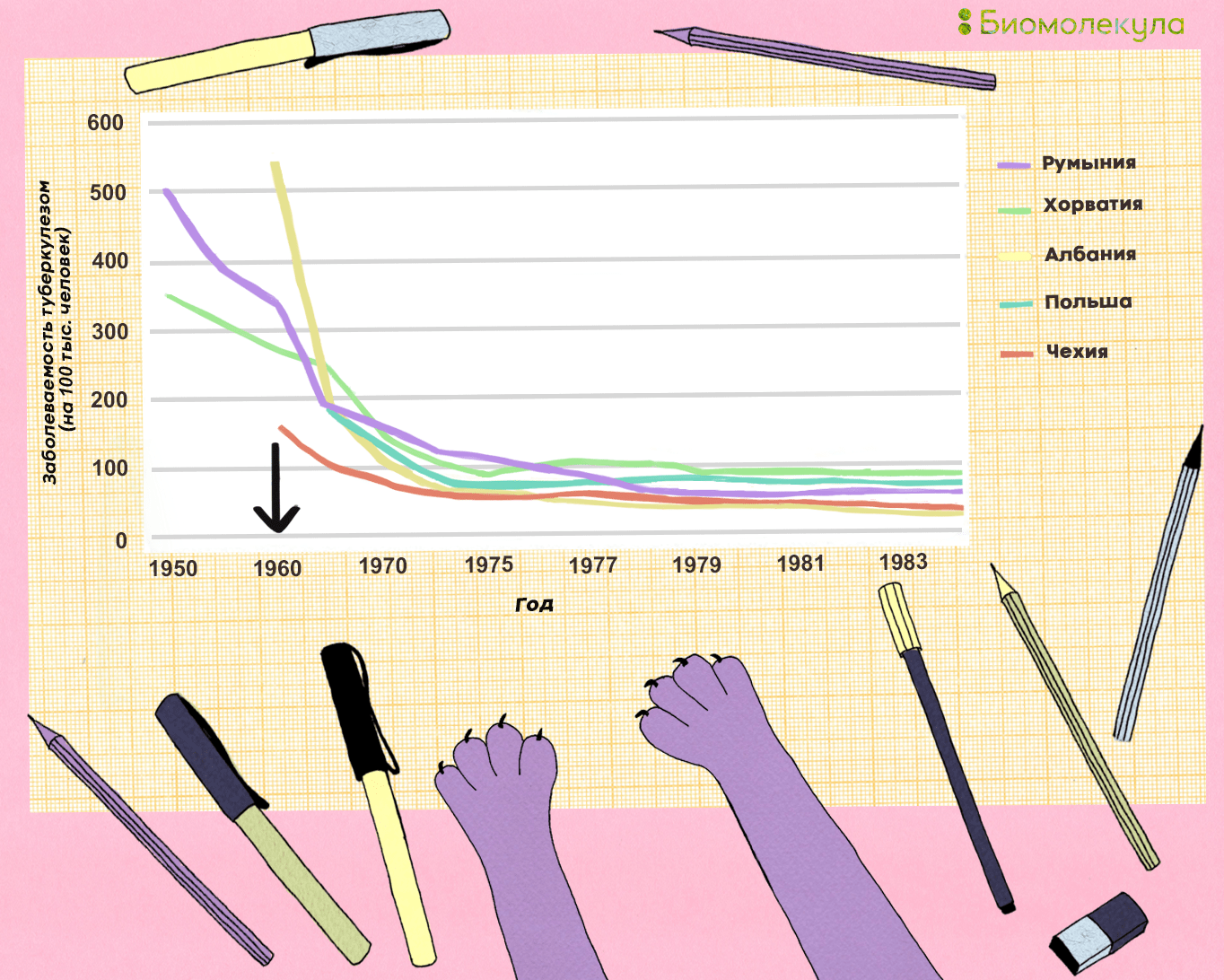
С середины 1950-х годов вакцинация новорожденных прививкой БЦЖ стала обязательной не только в Советском союзе, но и во многих странах мира. На рисунке 12 представлен график заболеваемости туберкулезом в Восточной Европе, по которому видно, насколько сильно снизилась смертность от туберкулеза в результате распространения вакцинации. К сожалению, в СССР соответствующую статистику начали вести только в 1975 году, когда резкий спад заболеваемости уже закончился, но пример соседних стран может быть экстраполирован и на Россию. Правда, нужно добавить, что по времени снижение заболеваемости и смертности от туберкулеза совпало с началом широкого использования в практике изониазида и рифампицина.
До 1962 года БЦЖ вводили новорожденным перорально (через рот), позже был принят внутрикожный метод введения, поскольку в этом случае может сформироваться более устойчивая иммуннологическая память. В 1985 году для вакцинации ослабленных (например, недоношенных) новорожденных в СССР была предложена более «щадящая» вакцина БЦЖ-М (о различиях БЦЖ и БЦЖ-М читайте далее), которая позволяет снизить риск возникновения возможных осложнений у вакцинируемых.
Сегодня вакцина является по-настоящему массовой: во всем мире ежегодно вакцинируется более 100 миллионов новорожденных [20].
Доступные штаммы БЦЖ
До второй половины XX века не было методов долгосрочного сохранения микроорганизмов, и отдельные лаборатории повторно изготавливали вакцину, культивируя «старые» штаммы БЦЖ, включая BCG-1 Russia, либо же создавали вакцину «с нуля». Это повлекло за собой появление новых БЦЖ-штаммов, названных по месту происхождения. Сегодня чаще всего, в зависимости от региона, используются шесть из них: BCG-1 Russia (наиболее близкий к созданному Кальметом и Гереном), BCG Pasteur 1173 P2, BCG Danish 1331, BCG Glaxo 107, BCG Tokyo 172-1 и BCG Brazil.
Все штаммы БЦЖ обладают различной реактогенностью, то есть инициируют разную по интенсивности реакцию иммунитета и, следовательно, побочные эффекты. Штаммы Pasteur 1173 P2 и Danish 1331 приводят к большему количеству побочных реакций, чем Glaxo 1077, Tokyo 172-1, BCG-1 Russia или Moreau RDJ. Так, сообщения о массовых случаях осложнений после БЦЖ, поступавшие в конце 2010-х годов из Украины, были связаны с применением там датского штамма, и от его использования отказались практически везде. Количество живых бактерий в дозе каждой вакцины также различается в пределах от 50 тыс. до 3 млн бактериальных клеток на дозу [21], [22].
В России используют только один штамм — BCG-1 Russia. Он обладает высокой иммуногенностью и малой реактогенностью. Это означает, что на него в полной мере реагирует иммунная система, однако побочные реакции достаточно редки. Препараты отечественных вакцин БЦЖ и БЦЖ-М (производитель — НПО «Микроген») представляют собой живые микобактерии, лиофилизированные в 1,5%-ом растворе глутамата натрия. В обеих вакцинах используются одни и те же микроорганизмы, разница лишь в том, что в БЦЖ в два раза больше живых микобактерий (0,05 мг), и, следовательно, она вызывает меньше побочных эффектов [24], [25].
Изменчивость микобактерий, из-за которой возникло множество штаммов БЦЖ, вызывает беспокойство [21]. Дело в том, что некоторые вакцины могут вновь стать вирулентными, а некоторые — перестать быть полезными. Чтобы предотвратить дальнейшее накопление генотипических и фенотипических различий при производстве вакцин, ВОЗ и национальные органы здравоохранения принимают меры по контролю над разнообразием штаммов.
Порядок вакцинации
Согласно рекомендациям ВОЗ, в странах, где наблюдается высокий уровень заболеваемости туберкулезом (Россия к таким странам, к сожалению, относится), привить ребенка необходимо как можно раньше, сразу после рождения. По национальному календарю профилактических прививок в РФ вакцинация от туберкулеза проводится единоразово в роддоме на 3–7 дни жизни [23]. Инъекцию БЦЖ делают внутрикожно в районе дельтовидной мышцы (на плече), причем достаточно важно попасть на правильную глубину, поскольку в случае неправильного введения высока вероятность возникновения осложнений (о них — далее). Именно поэтому прививку важно делать в роддоме, где у медсестер «набита рука» на такое введение. Это единственная вакцина, входящая в Национальный календарь, которая вводится внутрикожно. Характерный приподнятый рубец, который оставляет БЦЖ, используется для подтверждения иммунизации: такой шрам есть у всех привитых. В Японии разработали специальное устройство (рис. 13), которое помогает не промахнуться и попасть точно на правильную глубину. К сожалению, сегодня оно применяется только в Японии и Ирландии.
У БЦЖ есть противопоказания [24]:
- недоношенность (масса тела менее 2500 г.);
- острые заболевания и обострения хронических;
- ВИЧ-инфекция матери (от введения БЦЖ следует воздержаться до возраста 18 месяцев, когда будет уточнен ВИЧ-статус младенца);
- опухоли;
- иммунодефициты.
Если ребенка нельзя привить стандартной БЦЖ-вакциной, ему вводят «щадящую» БЦЖ-М [25].
Вакцинация взрослых не так эффективна, как вакцинация детей, но допустима, например, если человек не получил прививку БЦЖ в детстве, но ему предстоит контакт с больными, например, поездка в страны, в которых туберкулез встречается часто. Перед иммунизацией взрослому обязательно нужно поставить туберкулиновую пробу, и, если она положительна, вакцинацию придется отменить, поскольку это значит, что взрослый уже является носителем микобактерий, и вакцинация бессмысленна [23].
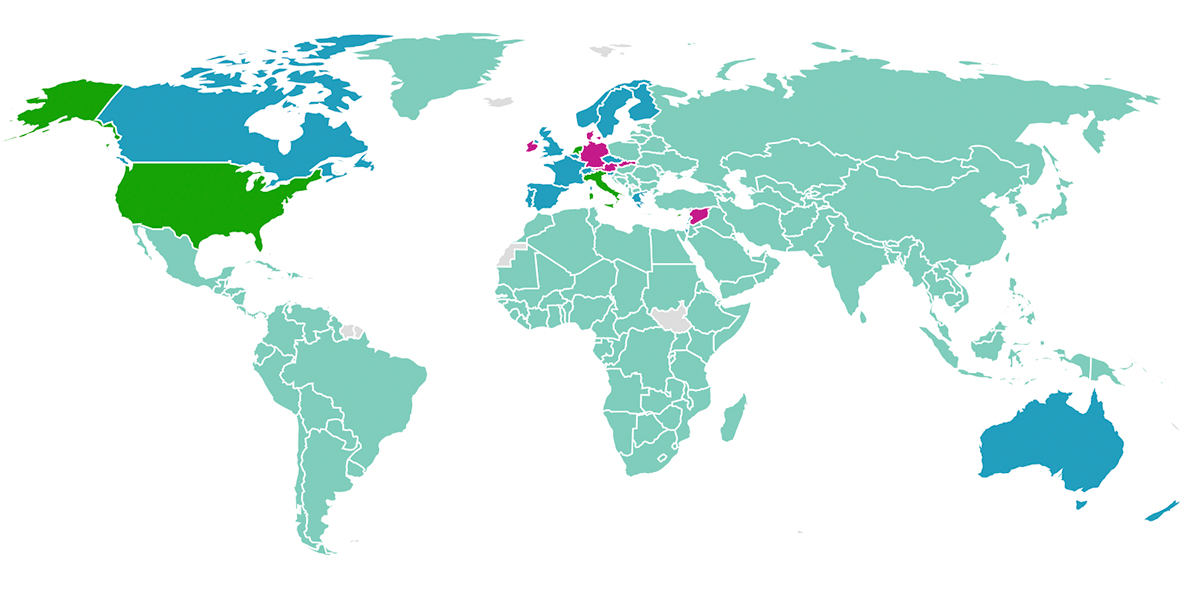
В других странах есть свои особенности, касающиеся вакцинации от туберкулеза. Например, в некоторых странах в связи с чрезвычайно высоким уровнем заболеваемости туберкулезом применяют ревакцинацию — всего таких стран 30. Напротив, если уровень заболеваемости низок, то такие страны от обязательной вакцинации отказываются. Это произошло, например, в большей части стран Западной Европы, США, Австралии, Новой Зеландии и Канаде [1]. Современная практика применения БЦЖ проиллюстрирована на карте на рисунке 14.
Манту + БЦЖ = ?
Проба Манту, поставленная вскоре после введения БЦЖ, покажет ложноположительный результат. Это связано с тем, что у недавно привитого ребенка развивается сильный иммунный ответ к антигенам палочки Коха, в том числе — к туберкулину, входящему в состав смеси для кожных проб. Однако со временем этот эффект слабеет, аналогично ситуации, когда человек выздоравливает: иммунных клеток против болезни в крови становится значительно меньше. Поэтому кожные пробы имеет смысл делать только спустя год после вакцинации БЦЖ.
Безопасность вакцинации
Основной вопрос любой вакцинации — ее безопасность. В случае БЦЖ он также чрезвычайно актуален.
Достаточно часто за побочные реакции принимаются изъязвления и папулы диаметром не более 10 мм, которые появляются через 4–6 недель после вакцинации. Через 5–6 месяцев у большинства детей остается небольшой рубчик, который говорит об адекватном формировании противотуберкулезной защиты у организма. Место введения вакцины нельзя обрабатывать йодом и другими дезинфицирующими растворами, а также выдавливать содержимое пузырька — в этом случае вакцина не будет эффективной, поскольку все микобактерии умрут.
Однако иногда, когда организм ослаблен или иммунная система не способна функционировать нормально, бактерии могут выйти из-под контроля и вызвать побочные реакции, которые требуют вмешательства врача. К основным осложнениям после БЦЖ относятся местные поражения разной степени опасности — холодные абсцессы и БЦЖ-лимфадениты (БЦЖ-иты), язвы на коже, а также БЦЖ-оститы. Все они в большинстве случаев связаны с нарушением методики введения вакцины, а также с вакцинацией новорожденных из групп риска. Следовательно, более педантичное выполнение иммунизации может и должно снижать частоту нежелательных эффектов.
Статистики осложнений от БЦЖ по России нет. Исследования [27], проведенные в Москве с 2004 по 2014 годы, показали, что:
- частота холодных абсцессов — 10 случаев на 100 тыс. вакцинированных детей;
- частота лимфаденитов — 5 случаев;
- частота БЦЖ-оститов — 4 случая.
Наиболее распространены местные, или холодные абсцессы (рис. 15), которые, в свою очередь, грозят язвами. Чаще всего они возникают через 3–6 недель после прививки из-за того, что БЦЖ случайно вводится не внутрикожно, а подкожно. Холодный абсцесс выглядит как подкожное уплотнение, которое со временем размягчается, а кожа над ним пигментируется и становится тонкой. Такой абсцесс может самопроизвольно вскрыться с образованием незаживающего свища, при этом из ранки выделяется жидкий, крошковидный гной. Лечат холодные абсцессы антибиотиками, часто гнойник иссекают, а рану зашивают. Если абсцесс не лечить, дело может закончиться распространением инфекции и серьезными повреждениями жизненно важных органов. Когда в гное отсутствуют необычные бациллы, абсцесс, как правило, заживает в течение нескольких недель [28].
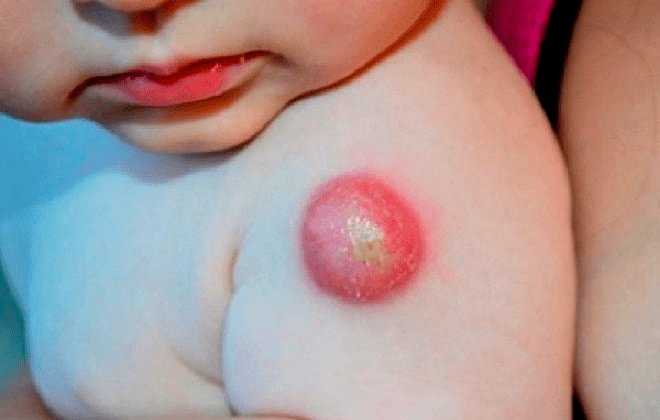
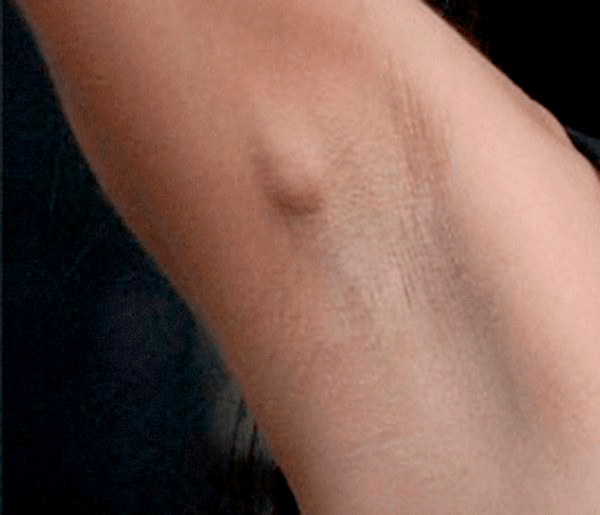
В 5 случаях на 100 тыс. вакцинированных детей после БЦЖ в левой подмышечной области возникают региональные лимфадениты (рис. 16), которые начинают беспокоить пациента через 4–8 недель после вакцинации. В этом месте возможно нагноение вплоть до свища, а также отложение солей кальция. Если такое произошло, следует показаться врачу: возможно, потребуется хирургическое вмешательство и прием антибиотиков.
БЦЖ-остит — это самое серьезное, хотя и редкое (4 на 100 тыс. инъекций) осложнение, в ходе которого поражается костная ткань в различных частях тела. Остит развивается очень медленно, явные симптомы возникают через 3 месяца — 5 лет. Видимый тревожный сигнал — это повышенная температура, хотя даже она может отсутствовать. Вокруг очага поражения при остите могут опухать мягкие ткани, а сустав может начать хуже работать. Иногда уже при первичном осмотре доктор находит абсцессы и свищи. Лечение БЦЖ-оститов чаще всего очень трудное и длительное (не менее 3 лет): оно сочетает в себе хирургическое вмешательство и использование антибиотиков [29].
Эффективность БЦЖ
Наиболее спорный вопрос при обсуждении БЦЖ — это ее эффективность. В различных клинических испытаниях данные о ней существенно разнятся и зависят от количества человек в выборке, а также места проведения исследования. Так, исследования, проводимые в Европе, последовательно показывают защитный эффект вакцинации на уровне 60–80%, но те, что проводились в странах Африки, не фиксируют никакого эффекта.
Эффективность вакцин от туберкулеза, судя по всему, зависит от географического положения территории — на экваторе эффективность в среднем ниже, чем в средней полосе [30]. Вероятно, это связано с тем, что в жарком климате живет больше нетуберкулезных микобактерий (например, M. avium, M. marinum и M. intracellulare), которые имеют схожие с палочкой Коха и БЦЖ антигены и поэтому играют роль природной «вакцины» [31]. В наших широтах БЦЖ снижает риск заболеть туберкулезом примерно на 50% [32]. Некоторые ученые считают, что причина различной эффективности БЦЖ в разных странах кроется также в разнообразии вакцинных штаммов или генетических особенностях людей разных национальностей. Была даже прослежена связь заболеваемости с группой крови .
О связи заболеваемости различными заболеваниями с группой крови читайте в статье «Кровавая работа врачей, ученых и природы» [63]. — Ред.
У БЦЖ есть и другие недостатки. Например, вакцина БЦЖ не предотвращает первичного инфицирования и не исключает, хотя и снижает, вероятность реактивации латентного туберкулеза, основного источника распространения болезни.
Вакцина БЦЖ производится не из M. tuberculosis, а из другого вида микобактерий — M. bovis, — и поэтому в ней нет некоторых важнейших антигенов туберкулезной палочки, которые характерны исключительно для нее (но не для других микобактерий) [33].
Одной из самых острых проблем вакцины является то, что иммунитет, сформированный БЦЖ, со временем сильно снижается и через 7–25 лет практически исчезает. Повторное введение БЦЖ (ревакцинация) помогает далеко не всегда, поскольку иммунная система к этому времени уже «привыкает» к постоянному контакту с различными микобактериями. В результате взрослое население оказывается уязвимо как к первичному заражению туберкулезом, так и к реактивации его латентной формы [34–36].
По мнению ученых [37], причина недостаточной эффективности БЦЖ кроется в особенностях иммунного ответа на эту вакцину. Как мы помним, при первичном заражении туберкулезом первыми на помощь приходят клетки врожденного иммунитета, которые выделяют всевозможные сигнальные молекулы, активирующие адаптивный иммунитет. При введении БЦЖ происходит то же самое.
В результате вакцинации в организме появляются Т-клетки, которые «помнят врага в лицо» и могут быстро запустить иммунный ответ при повторном появлении палочки Коха. Это так называемые T-клетки памяти. Они бывают нескольких типов: долгоживущие «центральные» и относительно короткоживущие «эффекторные». Если основная функция «эффекторных» T-клеток — быстро передать сигнал об атаке патогеном другим иммунным клеткам, тем самым запустив иммунный ответ, то «центральные» способны уничтожать патоген собственными силами. Так вот, при вакцинации или инфекции микобактериями туберкулеза вырабатываются первые, которые по прошествии 20 лет отмирают «за ненадобностью»; образование же вторых, «центральных», для туберкулеза не доказано. Таким образом, миру необходимо разработать новую вакцину (или поработать над старой), такую, чтобы она мобилизовала более «долгоиграющие» T-клетки памяти и активировала больше уровней иммунитета, чем современная БЦЖ. Такая вакцина будет более надежно и долго защищать организм от туберкулеза.
Новое применение старого препарата
Вполне возможно, что для формирования более адекватного иммунного ответа важно не только, что вводят человеку, но и куда. Так, в недавнем исследовании ученых из Нидерландов [38] на обезьянах макаках резус было показано, что введение препарата «нестандартным» методом (а именно — через слизистую легких) защищает от туберкулеза намного лучше классической подкожной инъекции, причем даже в тех случаях, когда стандартная внутрикожная инъекция не дает результатов. В этом случае маркеров противотуберкулезного ответа обнаруживалось гораздо больше; кроме того, вакцина мобилизовала куда больше типов иммунных клеток, среди которых были T-киллеры и долгоживущие T-клетки памяти, которых не хватало при введении вакцины обычным путем.
С другой стороны, БЦЖ не стоит недооценивать. Пусть она не может полностью защитить от туберкулеза, вакцина заметно снижает риск развития осложнений (частота случаев туберкулезного менингита после внедрения БЦЖ снизилась на 73%). Кроме того, уже давно известно, что живые вакцины против туберкулеза и кори обладают «перекрестной защитой», то есть способны защищать от широкого круга заболеваний. Сегодня это свойство стало особенно актуальным в связи с предположением о возможной эффективности БЦЖ против вируса SARS-CoV-2, вызывающего заболевание COVID-19, хотя данные остаются противоречивыми.
БЦЖ против COVID-19
Традиционно иммунитет человека разделяют на врожденный и адаптивный. При попадании инфекции в организм, врожденный иммунитет реагирует очень быстро, но не различает патогены между собой, а лишь узнает так называемый «образ патогенности» — отличительную черту, характерную для вируса или бактерии. Его главное преимущество в скорости, часто позволяющей победить болезнь практически сразу после заражения. Адаптивный иммунный ответ (он осуществляется Т- и В-лимфоцитами), наоборот, включается не сразу, но работает целенаправленно, кроме того, лимфоциты способны запомнить патоген и при повторном заражении быстро защитить организм от них .
О том, как устроена наша иммунная система, рассказано в статье «Иммунитет: борьба с чужими и… своими» [59]. — Ред.
Действие вакцин опирается, в основном, на второй, адаптивный, тип иммунитета. Однако для того чтобы он работал как надо, необходимо участие врожденного иммунитета. Поэтому бывают случаи, когда введение живой вакцины против конкретного патогена способствует борьбе не только с ним, но и с другими инфекциями. Так, вакцинация БЦЖ может способствовать защите от вторичных инфекций, вызываемых Candida albicans, Schistosoma mansoni и другими патогенами [39], [40], например вирусом желтой лихорадки [41], [42]. По этой же причине БЦЖ помогает организму бороться с раковыми клетками, из-за чего уже сейчас используется в лечении поверхностных форм рака мочевого пузыря и кишечника [43], [44].
Сейчас многие специалисты изучают, способна ли БЦЖ защищать от новой вирусной инфекции COVID-19 (возбудитель — коронавирус SARS-CoV-2) .
О коронавирусе SARS-CoV-2 можно узнать в статьях «2019-nCoV: очередной коронованный убийца?» [65], «COVID-19: отвечаем на вопросы» [66] и «COVID-19: что мы знаем и чего не знаем» [67]. — Ред.
Мы знаем, что дети несколько чаще, чем взрослые, болеют COVID-19 бессимптомно или в легкой форме [45]. Не исключено, что это в том числе обусловлено вакцинацией против туберкулеза. Когда пандемия еще только набирала обороты, было замечено, что страны, где нет повсеместной иммунизации от туберкулеза (Италия, Нидерланды, США), страдают от вируса больше других (рис. 17). Тем не менее это нельзя рассматривать как прямую взаимосвязь, поскольку есть страны, сильно пострадавшие от коронавируса, в которых повсеместно применяется БЦЖ (например Китай и Россия) [46]. Сегодня есть как оптимистичные исследования (где показано, что БЦЖ снижает смертность от COVID-19), так и работы, в которых разницы в заболеваемости COVID-19 между группами людей, привитых и не привитых БЦЖ, не обнаружено [47].
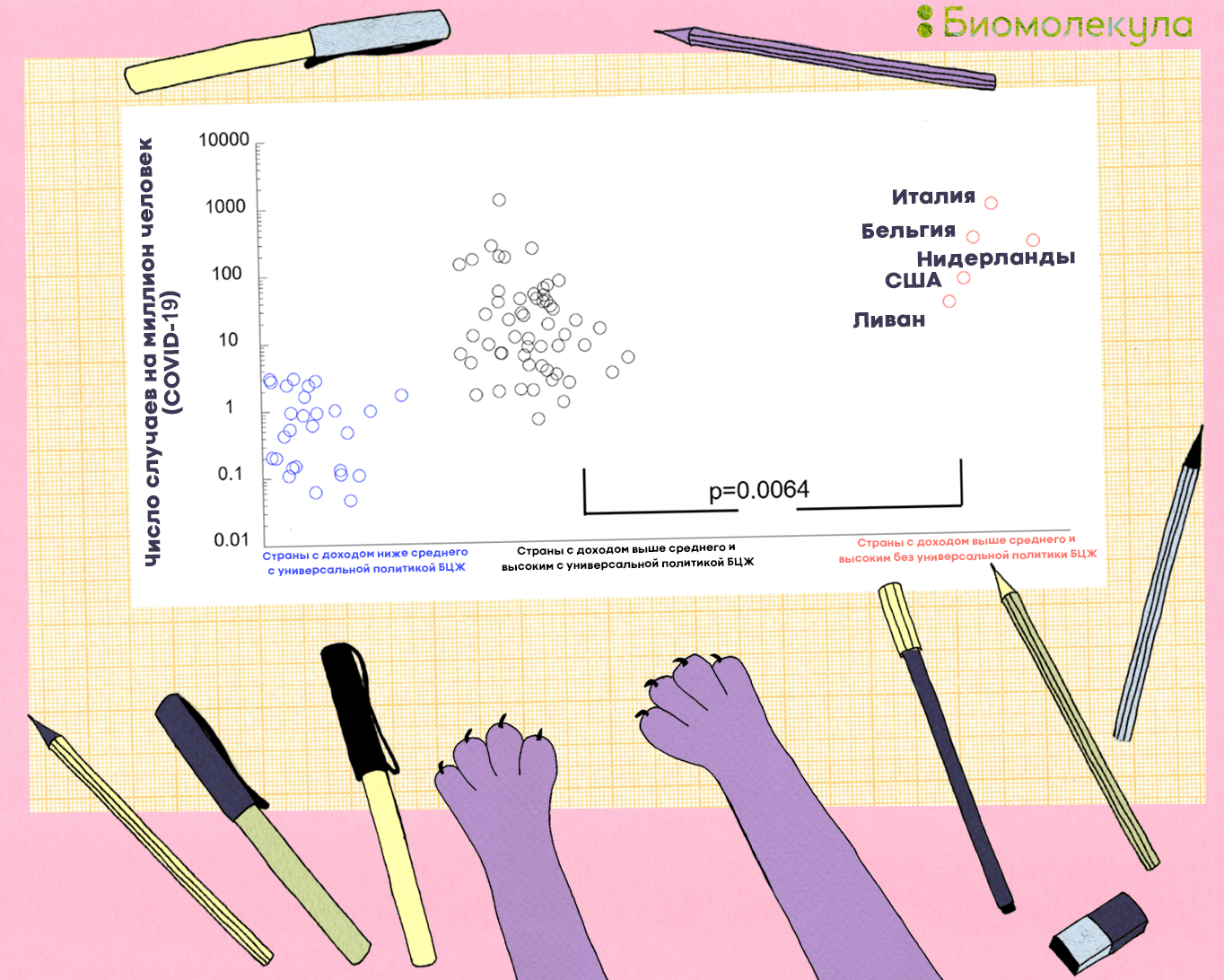
Очевидно, что эпидемиологических исследований мало, необходимо эмпирическое подтверждение или опровержение эффективности БЦЖ против коронавирусной инфекции. Сразу несколько групп ученых из Австралии и Нидерландов начали проводить клинические испытания на медработниках, призванные доказать или опровергнуть защитный эффект от БЦЖ. Медикам собираются вводить вакцину БЦЖ или плацебо в соотношении 1:1, после чего тщательно следить за их состоянием [48]. Ученые из Греции и Нидерландов также планируют выяснить, может ли БЦЖ повысить иммунитет к вирусу у пожилых людей [49]. Вопрос о протективной роли вакцинации БЦЖ по отношению к COVID-19, несомненно, требует дальнейшего изучения [68].
Как бы то ни было, мировой спрос на вакцину продолжает расти: если в 2015 году он составлял 152,2 млн доз [50], то уже в 2019 году достиг отметки в 325 млн доз [51]. Это говорит о том, что, пока туберкулез не ликвидирован, человечество будет нуждаться в вакцине, будь то БЦЖ или новый, более действенный препарат. В связи с этим, сегодня особую роль в профилактике туберкулеза играет поиск новых противотуберкулезных вакцин.
Новые вакцины
Бесспорно, вакцина БЦЖ спасла множество жизней, но нельзя отрицать, что ее эффективность оставляет желать лучшего.
Активная работа по созданию новых вакцин против туберкулеза ведется давно, но, к сожалению, пока не привела к практическим результатам. Требования к вакцинам-кандидатам высоки: они должны вызывать стойкий специфический иммунитет, иметь минимум побочных эффектов и низкую цену. Последнее особенно актуально, учитывая, что 80% всех новых случаев туберкулеза приходится на бедные страны. Кроме того, новые вакцины должны эффективно защищать все группы населения: как ранее вакцинированных людей, так и инфицированных микобактериями туберкулеза и/или ВИЧ, и предупреждать реактивацию латентной формы туберкулеза.
Сегодня существует три основных направления разработки новых противотуберкулезных вакцин.
Во-первых, ученые стремятся модифицировать уже известные на сегодня вакцинные штаммы БЦЖ, добавляя в них рекомбинантные антигены микобактерий туберкулеза либо вещества, стимулирующие иммунный ответ (адъюванты).
Во-вторых, большие надежды возлагались на ДНК-вакцины [69]. Их разработка связана с введением нуклеотидных последовательностей, кодирующих определенные антигены патогена, в состав специальной генетической конструкции. Такие препараты весьма перспективны, но в сравнении с цельноклеточными вакцинами обладают значительно меньшей иммуногенностью и нуждаются в особых условиях хранения. До конца не решенным остаются вопросы о контроле синтеза антигенов внутри организма человека после инъекции и судьбе ДНК-вектора. На данный момент нет ни одной зарегистрированной ДНК-вакцины, использующейся у человека.
Среди ДНК-вакцин больше всех продвинулась вакцина MVA85A (Modified Vaccinia Ankara, консорциум «Оксфорд-Эмерджент»). Это — ген белка 85А туберкулезной микобактерии, вставленный в генетическую конструкцию на основе генома поксвируса. При введении вакцины происходит синтез антигена, закодированного в гене 85А. В 2012 году прошли клинические испытания MVA85A в Южной Африке. Исследование проводили на нескольких тысячах ранее вакцинированных БЦЖ 4–6-месячных детей. Половина из них получила одну дозу вакцины, а остальные — плацебо (препарат, несущий вместо антигена палочки Коха белок, не имеющий к ней никакого отношения). В результате были продемонстрированы безопасность и хорошая переносимость нового препарата. Эффективность же вакцины составила всего 17,3%. Возможно, это связано не с тем, что вакцина плоха, а с тем, что дети уже имели иммунитет к туберкулезу, обусловленный действием вакцины БЦЖ [52].
Самый широко распространенный класс разрабатываемых вакцин против туберкулеза — субъединичные, то есть состоящие из полученных генно-инженерным способом очищенных бактериальных белков. Такие препараты наиболее перспективны, поскольку содержат антигены с известными свойствами, а также лишены посторонних белков, которые могут вызывать побочные эффекты.
В НИИ особо чистых биопрепаратов ФМБА в России закончены доклинические исследования вакцины-кандидата на основе рекомбинантных белков TB10.4 и Ag85B палочки Коха. В ближайшее время ученые планируют перейти к клиническим испытаниям.
Особые надежды ВОЗ возлагает на субъединичную вакцину M72/AS01E, она находится в фазе клинических испытаний. Основа этой вакцины — связанные с адъювантом AS01E два антигена микобактерий туберкулеза. Результаты испытаний в Замбии, Кении и Южной Африке показали, что введение двух доз M72/AS01E снижает риск развития туберкулеза более чем в два раза. Если вакцина в ходе дальнейших исследований, запланированных на 2022 год, оправдает ожидания, она может стать достойной заменой БЦЖ [53].
Надежды на будущее
Очевидно, что полностью ликвидировать туберкулез чрезвычайно сложно. Это связано как с трудностями диагностики и лечения заболевания, так и с отсутствием надежной вакцины, значимо снижающей вероятность заболеть. К сожалению, единственная имеющаяся сегодня на вооружении вакцина против туберкулеза — БЦЖ — далеко не всегда эффективна. Кроме того, она, как и другие живые вакцины, время от времени становится причиной поствакцинальных осложнений. Это дает повод ученым всего мира стремиться к созданию новых препаратов. Нам остается ждать разработки новых лекарств и вакцин и надеяться, что туберкулезные микобактерии не придумают обходные пути раньше нас.