Эволюция иммунной системы млекопитающих демонстрирует развитие устойчивого сосуществования (переносимости, в определенном смысле) с микроорганизмами-комменсалами, населяющими слизистые оболочки. В двух недавних исследованиях продемонстрировано, как достигается такое состояние толерантности иммунной системой кишечника. Также ученые показали, что IgA способствуют комменсализму патобионтов разных видов рода Candida.
Грибы — обычные компоненты микробиоты кишечника млекопитающих, иначе
называемые микобиотой [1]. У здоровых людей такие грибы активно
взаимодействуют со слизистой оболочкой кишечника, являя собой пример
непатогенных комменсальных микроорганизмов [2]. Однако несколько
исследований показали, что некоторые грибы, включая виды рода Candida (spp.),
могут усугублять течение серьезных хронических воспалительных
заболеваний кишечника (ВЗК), таких как болезнь Крона (БК) и
неспецифический язвенный колит (НЯК) [2]. Также кишечных комменсалов Candida spp.
можно обнаружить в крови, что вызывает смертельно опасные системные
инфекционные заболевания, особенно у людей с ослабленной иммунной
системой (например, у лиц, перенесших трансплантацию органов) [3]. До
сих пор не было ясно, как потенциально патогенные виды грибов могут
мирно населять слизистую кишечника, не причиняя вреда. В двух статьях
выпуска журнала Nature Microbiology Дорон с соавт. [4] и Ост с
соавт. [5] представляют новый взгляд на этот вопрос, демонстрируя, что
слизистая оболочка кишечника индуцирует антительный ответ в виде
иммуноглобулина А (IgA), специфической целью которого являются
патогенные грибки Candida spp. (рис. 1). Согласно результатам,
полученным на мышиной модели колита, в здоровой слизистой оболочке
кишечника существует противогрибковая защита, которая способствует
поддержанию гомеостаза и комменсализму, а также помогает уменьшить
патологическое воздействие Candida на ткани.
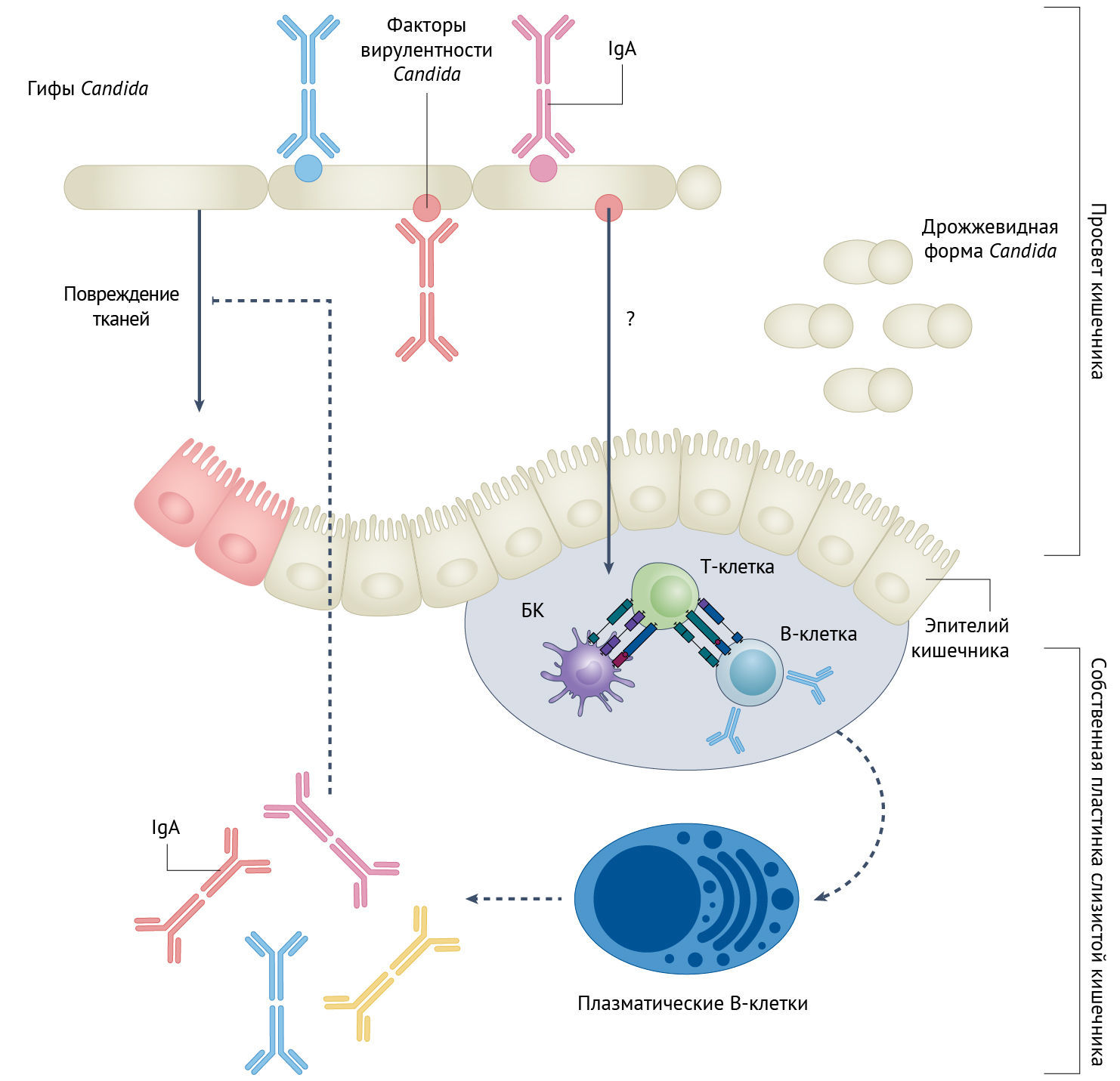
Рисунок 1 | IgA против факторов вирулентности, ассоциированных с гифами Candida Виды рода Candida — широко распространенные представители микобиоты млекопитающих в просвете кишечника, обычно взаимодействующие со здоровой слизистой оболочкой кишечника в виде непатогенных дрожжевидных форм. Слизистая оболочка кишечника может индуцировать антительный IgA-ответ, специфической целью которого являются гифы Candida, что ведет к комменсализму Candida (т. е. грибки могут мирно существовать в кишечнике только в дрожжевидной форме). Факторы вирулентности, повреждающие ткани, экспрессируемые гифами, — это мишени для антикандидных IgA, а образование последних зависит от присутствия В- и Т-клеток в собственной пластинке слизистой кишечника. Как гифы индуцируют Т- и В-клеточные реакции, пока что неясно. Кроме того, IgA может ограничивать повреждение тканей кишечника, вызываемое гифами Candida; однако регуляция этого процесса нарушена при ВЗК, например при БК.
IgA продуцируется B-лимфоцитами и представляет собой наиболее распространенный иммуноглобулин в слизистых оболочках, который обеспечивает защиту от токсинов и патогенного проникновения в слизистые. Несколько исследовательских групп продемонстрировали, что IgA покрывает значительную часть кишечных бактерий и выполняет функцию как предотвращения инфекции, так и поддержания гомеостаза бактериальной микробиоты [6]. Примечательно, что нарушение взаимодействия кишечных IgA и микробиоты сейчас считается одним из основных факторов, влияющих на здоровье, что связано с повышенным риском тяжелого течения ВЗК, аллергии и астмы [6]. Дорон с соавт. [4] и Ост с соавт. [5] показывают, что часть грибков-комменсалов в кишечнике также покрыта IgA. В образцах фекалий мышей и человека Candida spp. оказались среди доминирующих видов грибов, связанных с IgA, при этом самая высокая реактивность на IgA была выявлена у C. albicans. Ни IgM, ни IgG не связывают кишечные грибки, что позволяет предположить, что IgA является основным иммуноглобулином, способствующим поддержанию гомеостаза кишечника и мирного сосуществования с бактериями и грибами. Чтобы проверить, индуцирует ли C. albicans этот антительный IgA-ответ, авторы провели эксперименты по колонизации кишечника мышей без микробиоты (т. н. стерильных линий мышей — генетически выведенных в лабораторных условиях линий мышей без кишечной микробиоты) известными видами грибов-комменсалов. В то время как C. albicans и другой патогенный вид, Candida glabrata, оказались в числе главных индукторов синтеза IgA, такие непатогенные виды, как Saccharomyces cerevisiae, не вызвали стойкий антительный ответ. Поскольку у мышей, лишенных B- и T-лимфоцитов, не наблюдался синтез специфических для грибов IgA, был сделан вывод о зависимости этого специфического IgA-ответа на Candida от присутствия этих иммунокомпетентных клеток. Интересно, что IgA, вырабатываемые на каждый конкретный вид Candida spp., оказались уникальными, и не наблюдалось перекрестной реакции с другими Candida spp.; эта реакция не изменялась даже в присутствии бактерий.
C. albicans — это диморфный гриб, то есть он может существовать в виде дрожжевидных форм или нитей, называемых гифами [7]. Переход от первой ко второй форме является ключевым в реализации патогенного потенциала C. albicans. Согласно результатам предыдущих исследований, не гифы, а дрожжевидная форма C. albicans имеет преимущество в выживании в микроокружении кишечника [8, 9], хотя основные причины такового не ясны. Гифы экспрессируют несколько факторов вирулентности, включая деструктивные ферменты, порообразующий токсин (кандидализин) и адгезины клеточной поверхности (например, Als3), связанные с тканевой инвазией [7]. Оба исследования демонстрируют, что связывание IgA с C. albicans оказалось специфическим для формы гиф, в то время как блокированная дрожжевидная форма Candida индуцировала и связывала небольшое количество IgA [4, 5]. Интересно, что Ост с соавт. [5] выявили, что после колонизации кишечника в отсутствие зрелого адаптивного иммунного ответа усиливается экспрессия специфических для формы гиф факторов вирулентности C. albicans. Это позволяет предположить, что адаптивный иммунный ответ активно способствует подавлению вирулентности грибов. Действительно, в обоих исследованиях было показано, что содержание гиф C. albicans было значительно выше в кишечнике у мышей, у которых генно-инженерным путем было нарушено функционирование адаптивного иммунитета.
Определение участков белков, которые распознаются иммунной системой (так называемых эпитопов), — краеугольный камень в процессе разработки вакцины. В данном конкретном случае, чтобы определить эпитопы, связанные с выявленным в эксперименте антительным IgA-ответом, Ост с соавт. [5] провели скрининг мутантных форм C. albicans и обнаружили, что те из них, у которых отсутствуют факторы, способствующие адгезии энтероцитов и образованию биопленок и гиф, характеризуются незначительным связыванием IgA. Соответственно, IgA специфически воздействует на факторы вирулентности, характерные для гиф грибка. Действительно, когда Ост с соавт. [5] провели оценку колонизации кишечника, используя мутантную форму, не способную к адгезии (форма ahr1Δ/Δ, у которой отсутствуют адгезия и регулятор роста гиф 1), было выявлено значительно меньшее количество производимого IgA, хотя клетки мутантных грибов ahr1Δ/Δ способны к образованию гиф. Это свидетельствует о том, что не морфология самих гиф, а факторы, синтезируемые клетками гиф, являются основными мишенями IgA. Фактически, адгезины Als3 и Als1 оказались доминирующими эпитопами, являющимися основными целями для связывания противогрибковыми IgA. В подтверждение этому авторы приводят следующее: когда эти адгезины экспрессировались непатогенными S. cerivisiae, IgA связывались с ними [5].
Чтобы определить возможность клинического применения этих наблюдений, Дорон с соавт. [4] проанализировали смывы со слизистых оболочек пациентов с БК. Они обнаружили нарушение регуляции продукции антикандидных IgA и большое количество гиф. Было предположено, что механизмы, индуцирующие синтез IgA против Candida, могут быть нарушены при БК. Помимо этого Ост с соавт. [5] на мышиной модели колита продемонстрировали, что введение вакцины [10], в основе которой лежит эпитоп адгезина Als3, может смягчить степень повреждений кишечной ткани, вызываемых C. albicans. Следовательно, это открывает широкие перспективы использования таких вакцин для лечения ВЗК.
Таким образом, исследования Дорон с соавт. [4] и Ост с соавт. [5] являют собой важный шаг вперед в понимании того, как жизнедеятельность кишечного комменсала грибка Candida регулируется иммунной системой млекопитающих посредством иммунного ответа слизистой. Авторы также проливают свет на то, как контролируется активность потенциально патогенных микробов, а также на то, как происходит их изоляция в просвете кишечника. Однако необходима более полная картина основных иммунологических механизмов. Например, неясно, воспринимают ли эпителиоциты кишечника комменсальные грибы в стационарном состоянии, а также какова роль эпителиоцитов в этих иммунных реакциях. Неясно также, как индуцируются и поддерживаются на должном уровне В- и Т-клеточные противогрибковые реакции в здоровом состоянии и при болезни. Наконец, остается открытым вопрос о том, является ли воспаление при ВЗК основным фактором индукции непротективных антител против других видов грибов-комменсалов, также называемых ASCA (с англ. — антитела против S. cerevisiae), и как эти антитела влияют на защитные IgA, синтезируемые на эпитопы гиф Candida. Несомненно, ответы на эти важные вопросы еще предстоит найти.





