Как остановка клеточного цикла, так и секреция стареющих клеток подлежат метаболическому контролю. В этом выпуске журнала Nature Metabolism Ро с соавт. показали, что лизосомное разделение холестерина усиливает воспалительную секрецию во время старения.
Стареющие клетки способствуют развитию многих возрастных дегенеративных состояний [1, 2] — вероятно, вследствие секреции множества биологически активных молекул, известных под общим названием секреторного фенотипа, ассоциированного со старением, или СФАС/SASP [3, 4]. SASP сложен и может варьировать в зависимости от типа клеток и индуктора, но часто включает воспалительные цитокины, факторы ремоделирования внеклеточного матрикса, факторы роста, внеклеточные везикулы и оксилипины [4–7]. Так как SASP и другие фенотипы старения (такие как остановка клеточного цикла) имеют разные метаболические потребности по сравнению с нестареющими клетками того же типа, стареющие клетки часто обнаруживают метаболические изменения, которые усиливают остановку пролиферации, в то же время обеспечивая повышенную секрецию [8]. Накопленные данные литературы указывают на то, что измененный метаболизм стареющих клеток способствует их повреждающим эффектам, но он также может быть использован для устранения многих из их вредных свойств [8]. В этом выпуске журнала Nature Metabolism Ро с соавт. определяют роль метаболизма холестерина в контроле воспалительного компонента SASP [9].
Ро с соавт. изучали, как изменяется локализация холестерина во время старения, и оценивали последствия этого in vivo. Они наблюдали увеличение содержания множественных белков, участвующих в метаболизме холестерина; истощение холестерина снижало экспрессию нескольких факторов SASP, при этом восполнение запасов холестерина увеличивало SASP, не влияя на другие маркеры, такие как остановка клеточного цикла или активность β-галактозидазы. Если судить с точки зрения механизмов этого процесса, активация GATA4 и NF-κB после старения активирует экспрессию белка — транспортера холестерина ABCA1, который в норме связан с транспортом холестерина за пределы клетки, но в стареющих клетках направляется в лизосомы, где действует как импортер холестерина. Последующее накопление холестерина в лизосомах приводит к образованию микродоменов, обогащенных осевым комплексом для сборки mTORC1, что способствует активации mTORC1 и усилению провоспалительного SASP. Таким образом, это изменение локализации и активности mTORC1 служит ключевой движущей силой разрушительного влияния стареющих клеток — эту область авторы изучили далее.
Предыдущие исследования показали, что элиминация стареющих клеток ослабляет развитие посттравматического остеоартрита (ОА), уменьшая боль и дегенерацию в суставных соединениях у мышей [10]. Ро с соавт. показали, что индукция ABCA1 и связанное с ней повышение уровня лизосомного холестерина и активация mTORC1 регулируют хроническое воспаление, связанное с прогрессированием ОА у мышей [9]. В этой модели воздействия, которые усиливают накопление холестерина в лизосомах (такие как пробукол), способствуют воспалению и утрате хрящевой ткани. И наоборот, ингибирование ABCA1 глибуридом снижало SASP и замедляло прогрессирование ОА. Эти результаты демонстрируют роль холестерина в развитии дегенеративной патологии за пределами сердечно-сосудистой системы с помощью стимуляции SASP.
Это исследование было проведено после того, как предыдущая работа выявила роль p53 в изменении локализации холестерина и инактивации мевалонатного пути [11] и позволяет предположить, что холестериновый ответ в стареющих клетках контролирует более чем один механизм старения. Как активация p53, так и ингибирование мевалонатного пути, вышележащего по отношению к синтезу холестерина, ограничивают SASP [4, 12]; это говорит о том, что, возможно, p53 может ограничивать SASP отчасти путем контроля локализации холестерина. В настоящее время представляется вероятным, что другие пути клеточного старения, такие как активация GATA4, также участвуют в регуляции холестерина. В совокупности эти исследования указывают на то, что метаболизм холестерина может стать ключевой мишенью для модуляции старения в будущем (рис. 1). К счастью, на разработку лекарств, снижающих уровень холестерина, таких как статины и пробукол, которые оказывают противоположное влияние на старение, было направлено много усилий. В будущем авторы надеются наблюдать неожиданные преимущества этих соединений благодаря модуляции старения и SASP.
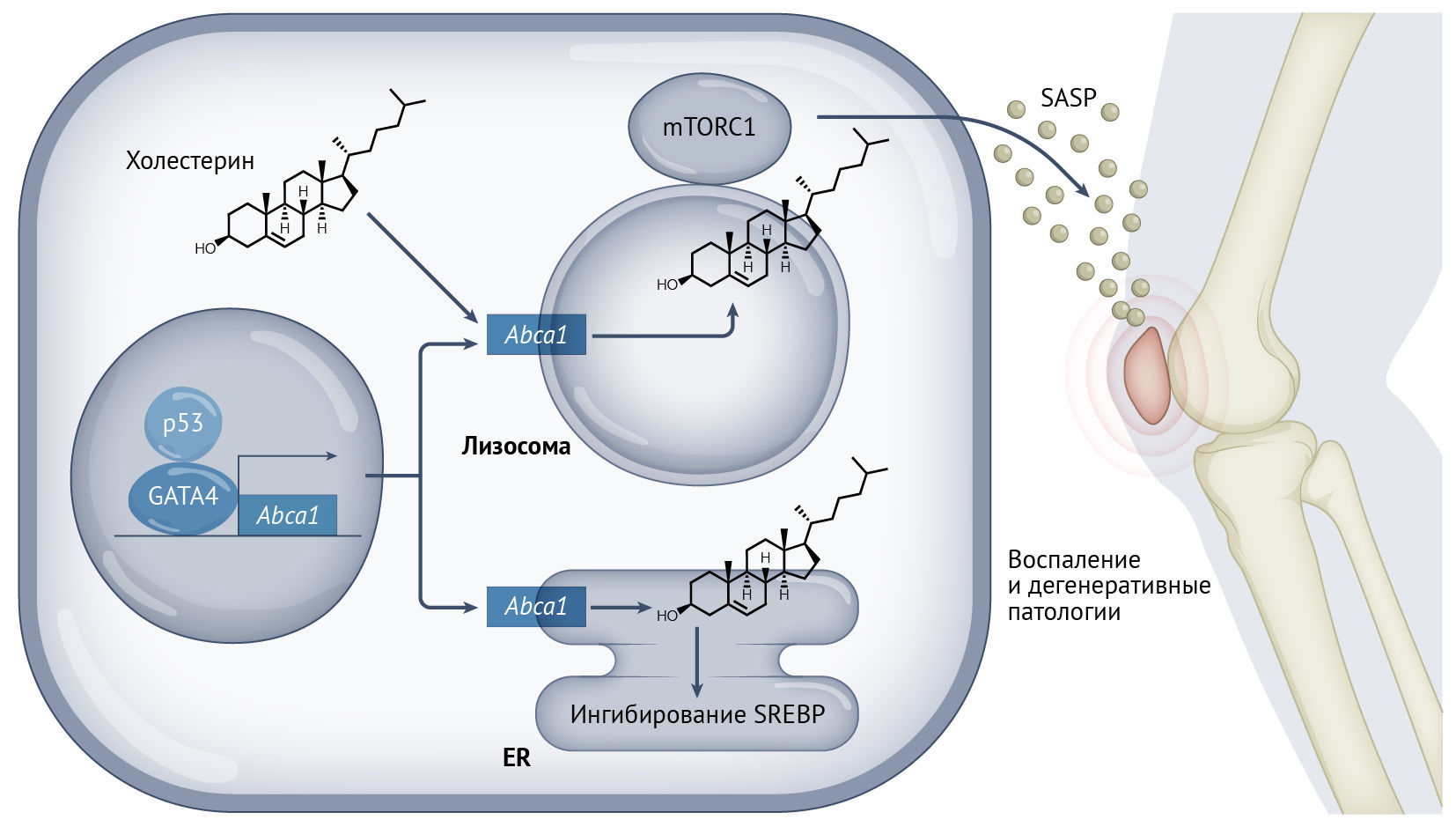
Рис. 1 | Распределение холестерина контролирует фенотипы старения.Старение сопровождается активацией GATA4 и p53, которые способствуют транскрипции Abca1. ABCA1 направляет холестерин в лизосомы, что активирует комплекс mTORC1 и способствует SASP. ABCA1 также увеличивает содержание холестерина в эндоплазматическом ретикулуме (ЭПР), ингибируя активность белка, связывающего регуляторный элемент стероидов (SREBP). Активация SASP лизосомным холестерином способствует развитию воспаления и дегенеративных патологий, таких как остеоартрит.
Важно оговорить, что в каждом из этих исследований стареющие клетки сравнивали с пролиферирующими клетками. Поскольку во многих тканях большинство клеток пребывает в состоянии покоя, еще предстоит выяснить, нарушается ли регуляция и накопление холестерина при других формах остановки клеточного цикла. Так как активация GATA4 (по крайней мере, отчасти) зависит от активации программы клеточного старения, возможно, что этот эффект специфичен для этого процесса. Сходным образом, поскольку Ро с соавт. наблюдали потерю SASP при холестериновом голодании, было бы интересно определить, происходит ли она in vivo в условиях голодания или ограничения калорий, или же активация регуляторного элемента стероидов поддерживает уровень холестерина — и, как следствие, SASP — при голодании. Таким образом, остается неясным, какие условия, помимо фармакологического воздействия, могли бы влиять на метаболизм холестерина и секрецию при клеточном старении in vivo. Действительно, поскольку лекарственные препараты, понижающие уровень холестерина в сыворотке путем подавления его синтеза (например, статины), ослабляют SASP, а препараты, снижающие уровень холестерина путем его переноса в клетки (например, пробукол), усиливают SASP, при начале терапии, направленной на снижение уровня холестерина, может быть важно учесть возможные патогенные последствия, связанные с клеточным старением.
Какие дополнительные последствия могут проявиться в результате потери холестеринового гомеостаза в стареющих клетках? Холестерин необходим во многих структурных и сигнальных аспектах жизни клеток, поэтому нарушение регуляции его метаболизма, помимо влияния на секрецию, может иметь дополнительные эффекты. Например, внутриклеточная локализация холестерина может определять чувствительность к апоптозу [13], поэтому нарушение регуляции метаболизма холестерина способно влиять на устойчивость клеток к гибели — как это наблюдается в стареющих клетках [14, 15]. Эти аспекты метаболизма стареющих клеток являются благодатной почвой для будущих исследований и, возможно, для новых методов терапии заболеваний, вызванных стареющими клетками.





