Появление в середине 1950-х годов хлорпромазина, представляющего новый класс антипсихотических препаратов, ознаменовало значительный прогресс в психиатрической помощи. Эти соединения, получившие название «нейролептики» — от греческого neuron (нерв) и lepsis (захватывать) — были обнаружены случайно в ходе поиска вспомогательных препаратов для анальгетиков и общей анестезии [1]. Нейролептические препараты блокируют рецепторы дофамина или изменяют его уровень в центральной нервной системе; они стали основным средством лечения психозов и, в частности, шизофрении [2]. Препараты, блокирующие действие дофамина, также используются при расстройствах, связанных с делирием [3], при тревожном расстройстве [4], синдроме Туретта [5] и расстройствах ЖКТ нейрогенного происхождения [6].
На ранних этапах разработки этих препаратов было обнаружено, что галоперидол вызывает не только гипокинетические и гиперкинетические двигательные расстройства, но и потенциально смертельный синдром мышечной ригидности и гипертермии, который стал известен как злокачественный нейролептический синдром (ЗНС). Психиатр Жан Деле, изучавший галоперидол для компании Janssen Pharmaceuticals, указывал, что применение препарата связано с риском dérèglements végétatifs (вегетативных расстройств или дисфункции вегетативной нервной системы) [7].
Чаще всего ЗНС был связан с применением высокоэффективных антипсихотических препаратов первого поколения (типичных), таких как галоперидол, флуфеназин и пимозид; однако эти препараты до сих пор применяются, поскольку они все же эффективны, а также дешевле более новых антипсихотических препаратов. Согласно анализу австралийской базы данных побочных реакций на лекарственные препараты, этот синдром возникал при приеме антипсихотиков как первого поколения, так и второго (атипичных), но в случае приема препаратов второго поколения синдром развивался реже [8]. Более того, когда синдром был связан с приемом клозапина, наблюдаемая у пациентов ригидность была слабее, чем в случае приема других препаратов. Клинические исследования показали, что при применении препаратов второго поколения этот синдром встречался реже и протекал легче, чем при использовании препаратов первого поколения. Другие препараты, блокирующие дофаминовые рецепторы, такие как метоклопрамид, дроперидол, прохлорперазин, и препараты, разрушающие снижающие уровень дофамина, например тетрабеназин, также могут вызывать ЗНС, но, по-видимому, с меньшей вероятностью. Есть данные о том, что после резкой отмены дофаминергических препаратов, используемых для лечения болезни Паркинсона, развивается синдром паркинсонизма-гиперпирексии — редкое расстройство, напоминающее ЗНС [9], а стимуляция субталамического ядра для лечения болезни Паркинсона после отмены леводопы в редких случаях сопровождается ЗНС. Более того, при данных состояниях глубокая стимуляция мозга может маскировать мышечную ригидность, затрудняя выявление синдрома [10].
Поскольку антипсихотические препараты широко используются в больничной и амбулаторной практике, врачи многих специальностей, помимо психиатрии, в том числе семейные врачи, врачи отделения неотложной помощи, анестезиологи, реаниматологи, врачи скорой медицинской помощи и персонал домов престарелых, могут столкнуться со злокачественным нейролептическим синдромом. Это заболевание было подробно рассмотрено в журнале The New England Journal of Medicine в 1985 году [11].
В настоящем обзоре рассматриваются современные методы лечения, с акцентом на оказание неотложной медицинской помощи.
Ключевые моменты
- ЗНС проявляется лихорадкой, ригидностью мышц и нарушением деятельности вегетативной нервной системы после приема антидофаминергических препаратов, особенно антипсихотиков.
- Клинические критерии диагностики варьируют и могут включать нарушения сознания, однако этот синдром является редким и непредсказуемым осложнением приема антипсихотических препаратов.
- ЗНС может привести к серьезным осложнениям, которые врачи могут предупредить.
- Лечение является эмпирическим и включает миорелаксанты и тщательное наблюдение, как правило, в отделении интенсивной терапии.
- Риск рецидива после повторного приема препарата невелик, но определенный риск сохраняется.
Эпидемиология
Согласно различным данным, ЗНС развивается примерно у 0,02–3 % пациентов, получавших соответствующие препараты. Данные различаются в зависимости от изучаемой популяции, препарата, длительности применения и способа введения, а также классификации побочных эффектов [12]. Как в японском исследовании [13], так и в вышеупомянутом австралийском исследовании [8] смертность от ЗНС была ниже при применении атипичных антипсихотических средств, чем при использовании более старых препаратов, однако эта разница могла быть обусловлена улучшением качества медицинской помощи в период между эпохами лечения типичными и атипичными препаратами. Факторы риска ЗНС, которые были зарегистрированы в исследованиях с участием нескольких пациентов, включают обезвоживание, прием нескольких антипсихотических препаратов, высокие и возрастающие дозы препаратов, предшествующий эпизод синдрома и внутримышечное введение препарата, однако редкость этого расстройства не позволяет установить однозначные ассоциации [14]. Тем не менее даже пероральное применение одного препарата в стандартной дозе во многих случаях приводило к ЗНС. Возможно, склонность к появлению признаков синдрома может наблюдаться у пациентов с анти-NMDA-рецепторным энцефалитом, которым назначают антагонисты дофамина; в одном из исследований такая «непереносимость нейролептиков» (и несколько вероятных случаев явного ЗНС) была отмечена у 47 % пациентов. Однако врачам по-прежнему сложно дифференцировать побочные эффекты нейролептиков и некоторые проявления этого аутоиммунного энцефалита [14].
Генетические полиморфизмы ферментов, метаболизирующих лекарственные препараты, переносчики лекарств и молекулы-мишени могут влиять на реакцию организма на лекарственные препараты и повышать риск развития ЗНС, но эти данные получены только для небольших, преимущественно японских популяций. Например, варианты гена CYP2D6, кодирующего цитохром P-450 2D6, которые приводят к замедлению метаболизма этих препаратов в печени, по-видимому, не повышают риск развития ЗНС. В одном из исследований было показано, что у пациентов со злокачественным нейролептическим синдромом преобладает аллель A1 гена DRD2, кодирующего дофаминовый рецептор D2 [16]. Однако исследования DRD2, генов серотониновых рецепторов HTR1A и HTR2A, а также гена, кодирующего рианодиновый рецептор 1 (RYR1, связанный с предрасположенностью к злокачественной гипертермии, о чем речь пойдет ниже), не выявили различий в частоте возникновения ЗНС между пациентами с этими генетическими особенностями и контрольной группой [17].
Описано несколько полиморфизмов в генах CYP1A2, CYP2D6, CYP3A4, CYP3A5 и ABCB1 и их влияние на фармакокинетику и уровень в плазме крови оланзапина, клозапина, арипипразола, рисперидона и кветиапина, но ни один из этих полиморфизмов не был четко связан со злокачественным нейролептическим синдромом [18]. В одном клиническом случае описан получавший рисперидон пациент с шизофренией, у которого была «атипичная» форма ЗНС без ригидности. У пациента были варианты обоих аллелей CYP2D6. Последующее лечение оланзапином, который в основном не метаболизируется CYP2D6, не вызвало никаких побочных эффектов [19].
Клинический синдром
В пятом издании «Диагностического и статистического руководства по психическим расстройствам» критерии диагностики ЗНС включают воздействие лекарственного препарата, блокирующего дофамин, сильную мышечную ригидность, лихорадку и минимум два из следующих признаков: профузное потоотделение, дисфагию, тремор, недержание мочи, нарушение сознания, мутизм, тахикардию, повышенное или лабильное артериальное давление, лейкоцитоз или повышенный уровень креатинкиназы в сыворотке крови [20]. На практике определить синдром легче, чем можно предположить по этому списку. По истории болезни, списку назначенных препаратов и контексту обычно понятно, что пациент принимал препарат, связанный с развитием ЗНС, но это не всегда очевидно, особенно в случае препаратов, которые не используются в первую очередь для лечения психоза или делирия.
Типичными проявлениями ЗНС являются нарушение деятельности вегетативной нервной системы, в частности тахикардия и резкие колебания артериального давления в сторону гипер- или гипотензии; повышение температуры до 40 °C и выше; делирий, в тяжелой форме переходящий в кататонию; повышенный мышечный тонус. Как правило, первыми признаками расстройства являются изменения артериального давления и мышечный гипертонус, хотя в некоторых сообщениях подчеркивались ранние особенности поведения. Мышечная ригидность описывается по-разному, но, по сути, это экстрапирамидный признак «свинцовой трубы», который воспринимается обследуемым как равномерное сопротивление движению при различных пассивных движениях конечностью и который можно тактильно дифференцировать от спастичности, дистонии и спазма. Ригидность может прерываться феноменом зубчатого колеса, как при болезни Паркинсона, однако неясно, является ли это паркинсоническим эффектом препарата, вызывающего синдром, или же неотъемлемым признаком ригидности, характеризующей ЗНС. Как уже упоминалось в австралийском обзоре и в других публикациях, ригидность при приеме препаратов второго поколения была менее выражена, чем при приеме препаратов первого поколения [8]. Сильная ригидность может привести к рабдомиолизу, значительному повышению уровня креатинкиназы в сыворотке крови и почечной недостаточности. Часто наблюдается лейкоцитоз. Выраженная ригидность при экстрапирамидных расстройствах, таких как болезнь Паркинсона, редко вызывает такую степень повреждения мышц, предположительно потому, что при этих расстройствах ригидность менее выражена, чем при ЗНС, и, возможно, потому, что она не связана с гипертермией.
Средний интервал между воздействием препарата и появлением симптомов в серии опубликованных случаев составлял 4 дня, а средняя продолжительность заболевания — 9 дней, но некоторые случаи произошли в течение одного дня после приема препарата, а другие — более чем через 30 дней. Большинство пациентов в этой серии случаев принимали только один препарат [21]. Полный синдром или любой из его компонентов сохраняется в течение нескольких дней или более и обычно достигает пика интенсивности на второй или третий день после начала заболевания.
Клиницисты сталкиваются со злокачественным нейролептическим синдромом гораздо реже, чем с паркинсонизмом, вызванным нейролептиками. Подсчитано, что признаки паркинсонизма с ригидностью или дистонией развиваются у 30 % пациентов, получавших антипсихотические препараты [22], и эти проявления могут быть ошибочно приняты за начинающийся ЗНС.
Патогенез
Биологическая основа ЗНС неизвестна, но нейролептические антипсихотические средства блокируют дофаминовые D2-рецепторы — семейство ассоциированных с G-белками рецепторов, которые связывают внеклеточный дофамин, и эта блокада предположительно связана с синдромом. Эти рецепторы являются ингибирующими и, предположительно, выступают основными терапевтическими мишенями нейролептических препаратов, используемых для лечения шизофрении и других нервно-психических расстройств [22]. D4-рецептор дофамина также связан с действием препаратов этого класса, но неизвестно, воздействуют ли в какой-либо степени на этот рецептор нейролептики, отличные от атипичных антипсихотических средств [23]. Записи с дофаминергических нейронов в мозге крыс показали, что несколько недель лечения галоперидолом приводили к инактивации возбуждения нейронов — этот эффект известен как деполяризационный блок [24]. Повторный деполяризационный блок, индуцированный антипсихотическими препаратами, был связана с повышением клинической эффективности препарата, а блокада активации нигростриатной системы — с экстрапирамидными побочными эффектами [25]. Эти данные, по-видимому, имеют некоторое отношение к ЗНС, но они не были тщательно изучены.
Другая гипотеза, основанная на исследованиях начала 1990-х годов, предполагает, что вегетативные симптомы при ЗНС обусловлены гиперактивностью симпатоадреналовой системы, которая приводит к повышению внутриклеточной концентрации ионов кальция в мышцах и способствует повышению мышечного тонуса. Согласно этой гипотезе, блок дофаминовых рецепторов в гипоталамусе приводит к нарушению теплоотдачи, а блок дофаминовых рецепторов в хвостатом ядре, скорлупе и вентральном стриатуме — к мышечной ригидности. Избыточная теплопродукция в сочетании с уменьшением теплоотдачи приводит к гипертермии — основному признаку синдрома [26]. В этой модели изменения психического статуса предположительно обусловлены истощением дофамина в проводящих путях среднего мозга, коры головного мозга и лимбической системы.
Нет никаких доказательств наличия первичного дефекта скелетных мышц или прямого токсического влияния препаратов, блокирующих дофамин, на скелетные мышцы. Однако в модели на животных было показано, что повышение температуры окружающей среды после внутримышечного введения галоперидола увеличивало электромиографическую активность (интерпретируемую как ригидность) и повышало уровень креатинкиназы в сыворотке крови, которые можно было смягчить с помощью дантролена [27].
Другие синдромы острой гипертермии и ригидности
Отличить ЗНС от других состояний ригидности и гипертермии может быть непросто, но обстоятельства, в которых возникает каждое расстройство, обычно указывают на соответствующий диагноз (Таблица 1). Злокачественная гипертермия, вызванная общими анестетиками, имеет общие черты с ЗНС — повышенную температуру и мышечную ригидность, но обстоятельства возникновения этих двух расстройств и временной промежуток от момента воздействия препарата различаются. Однако выявление различий может оказаться затруднительным, если нейролептические средства использовались для введения в наркоз или недавно применялись для лечения психического или другого расстройства. С ЗНС внешне сходны тепловой удар, синдромы отмены и острая интоксикация наркотиками, такими как амфетамины, кокаин, МДМА (3,4-метилендиоксиметамфетамин) и фенциклидин. Резкое прекращение приема миорелаксантов, например баклофена, может вызвать мышечную ригидность и психические изменения, которые имитируют признаки ЗНС.
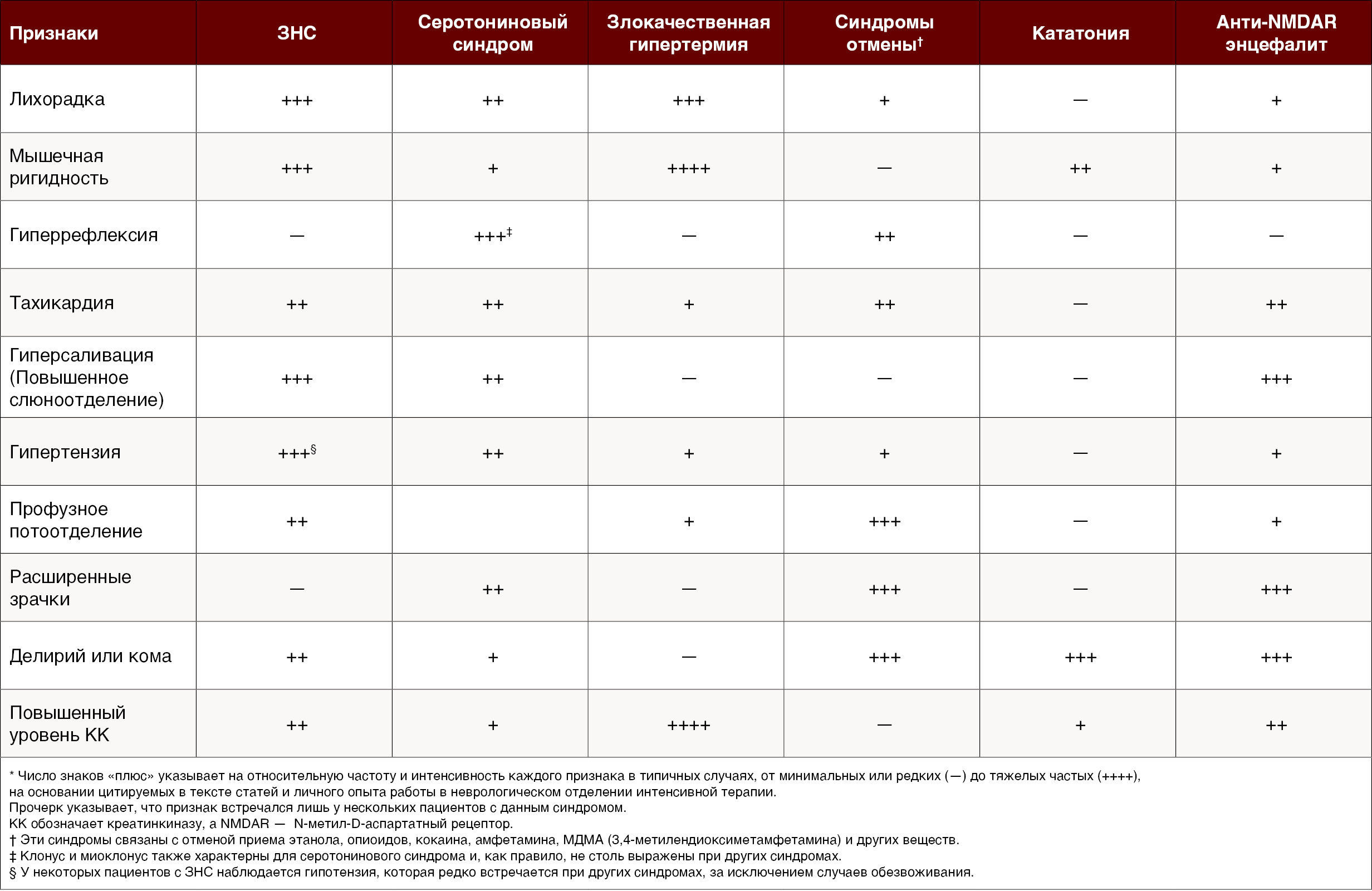
Что касается дифференциальной диагностики ЗНС, то в обучающих заданиях акцент делается на исключении острого серотонинового синдрома, поскольку он тоже может вызывать нарушение деятельности вегетативной нервной системы, но в отличие от ЗНС, для него характерны гиперрефлексия, клонус, миоклонус и дрожь. Состояние мышц при серотониновом синдроме ближе к спастичности и гиперрефлексии, чем к ригидности «свинцовой трубы» и сниженных или нормальных сухожильных рефлексов, что более характерно для ЗНС. Другой отличительной особенностью серотонинового синдрома является миоклонус ног, который может распространяться на грудную клетку, живот и руки и даже может влиять на подвижность глаз, как описано в обзоре, опубликованном в журнале The New England Journal of Medicine [28]. Сиалорея встречается при обоих синдромах. Любопытно, что метоклопрамид, который может вызывать ЗНС, также способен усугублять серотониновый синдром. Одновременное проявление этих двух синдромов было описано в клинических случаях, когда применяемый препарат (например, тефлудазин) обладал как антидофаминергической, так и серотонинергической активностью.
Крайняя степень кататонии, так называемая летальная кататония, может имитировать ЗНС (особенно в случае пациента без недавней истории болезни, поступающего в отделение неотложной помощи) и вызвать диагностическую путаницу из-за повышения уровня креатинкиназы в сыворотке крови, как отмечается в обзоре по кататонии в The New England Journal of Medicine [29]. Различие между этими расстройствами размывается в тех случаях, когда злокачественный нейролептический синдром вызывает состояние, подобное кататонии. Такие признаки, как стереотипия, катаплексия и манерность, помогают отличить кататонию от ЗНС.
Наконец, ЗНС был указан в качестве причины лихорадки неясного происхождения [30], поскольку характерной чертой обоих заболеваний является лейкоцитоз. Таким образом, ЗНС может быть ошибочно принят за инфекцию, но в данном случае различие должно быть четким, поскольку лихорадка и инфекция сами по себе не похожи на ЗНС.
Лечение
Лечение ЗНС, как и любого другого критического состояния, требует пристального клинического внимания и сосредоточенности на факторах риска осложнений и смерти. Помимо отмены препарата, когда это возможно, лечение включает многоуровневый подход к основным признакам синдрома: нестабильности артериального давления, гипертермии и рабдомиолизу на фоне выраженной ригидности, а также возможности развития дыхательной недостаточности [31]. Данные проспективных исследований по применяемым в настоящее время методам лечения отсутствуют, и может существовать несколько эффективных методов лечения.
Предлагаемый подход к интенсивной терапии представлен на Рисунке 1. Пациенты могут поступать в состоянии острого респираторного дистресса из-за ригидности мышц верхних дыхательных путей, дыхательной мускулатуры и диафрагмы. Кроме того, из-за неэффективного кашля пациенты могут аспирировать выделения или содержимое желудка. В этом случае необходимы интубация и искусственная вентиляция легких. Может наблюдаться выраженная сиалорея, которую можно купировать муколитическими средствами или антихолинергическими препаратами, такими как гликопирролат [32].
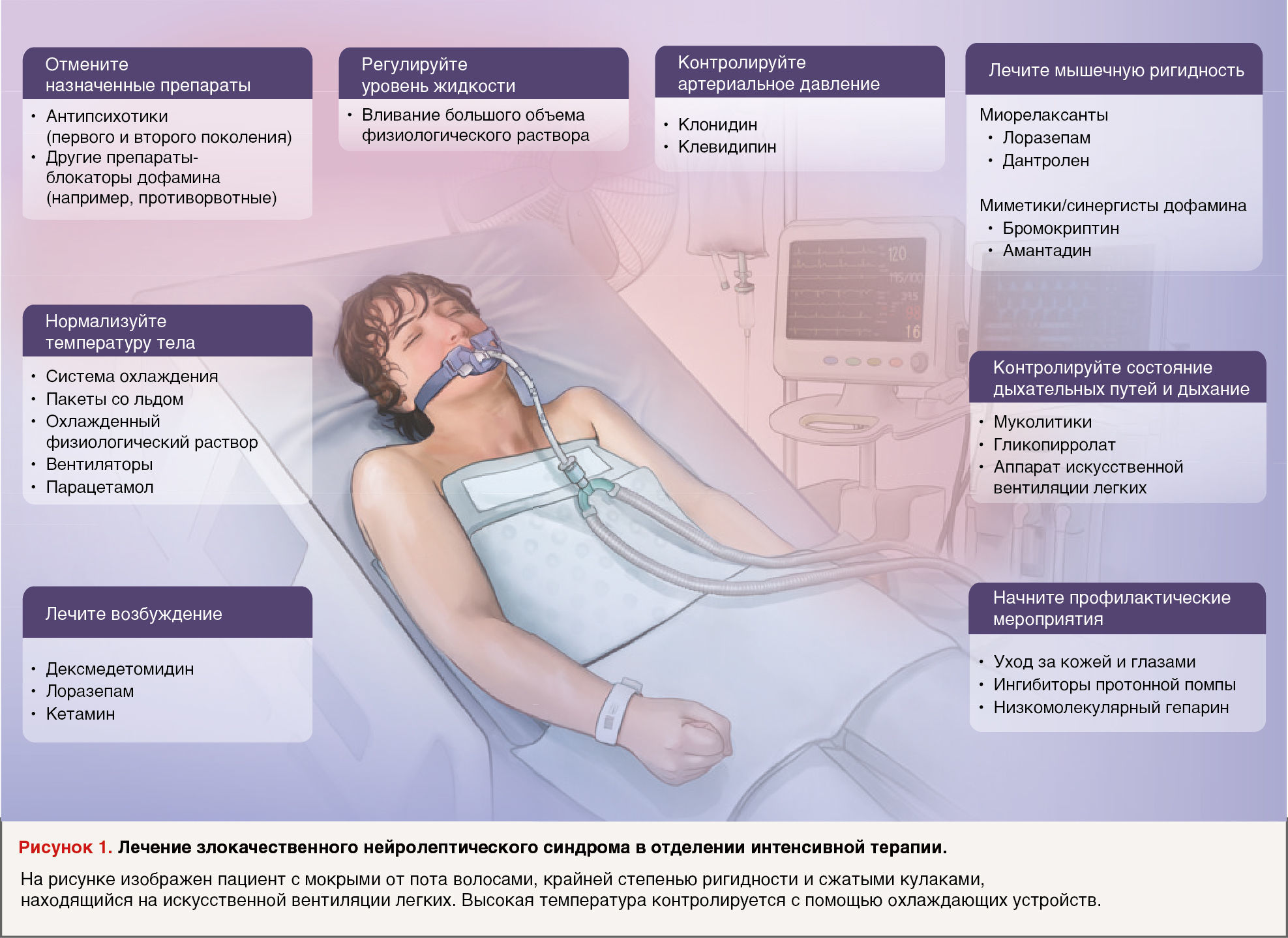
У большинства пациентов наблюдается тахикардия с колебаниями артериального давления, что может считаться допустимым побочным явлением у молодых людей, но может вызвать ишемию ввиду повышенной потребности сердца в кислороде (инфаркт миокарда 2 типа) и повышение уровня тропонина в сыворотке крови у пациентов с ишемической болезнью сердца. Неизвестно, могут ли нейролептики непосредственно повреждать сердечную мышцу [33]. У пациентов может наблюдаться ступор и мутизм или возбуждение и делирий — клинические проявления, которые можно купировать с помощью селективного α2-адреномиметика дексмедетомидина, препарата короткого действия с седативно-снотворным и анксиолитическим действием, что позволяет избежать повторного введения антипсихотического средства.
Тяжелые случаи ЗНС вызывают гипокальциемию, гипомагниемию, гипонатриемию или гипернатриемию, гиперкалиемию и метаболический ацидоз, которые требуют коррекции. Нередко наблюдаются транзиторные отклонения в уровнях лактатдегидрогеназы, щелочной фосфатазы и аминотрансфераз печени в сыворотке крови. У большинства пациентов с лихорадкой наступает обезвоживание, а мышечная ригидность разрушает мышцы, что приводит к повышению уровня креатинкиназы в сыворотке крови до 10 000 Ед/л или выше, часто через несколько дней после начала заболевания. В самом начале заболевания, напротив, могут наблюдаться нормальные значения, создающие ложную уверенность в том, что состояние не является серьезным.
Для поддержания нормоволемии и купирования рабдомиолиза может потребоваться внутривенное введение значительного объема жидкости, с целевым объемом выделяемой мочи примерно 200–300 мл/час [34]. Диализ можно рассматривать для пациентов с тяжелой гиперкалиемией, гипокальциемией, азотемией или гиперволемией в результате лечения. Гипокальциемия, частое осложнение рабдомиолиза, возникает из-за поступления кальция в поврежденные мышечные клетки и осаждения фосфата кальция в некротизированных мышцах. В исключительных случаях тяжелый локальный рабдомиолиз вызывает компартмент-синдром, который лечится фасциотомией. Гипертермию лечат жаропонижающими средствами, например, пероральным приемом парацетамола в рекомендуемой дозе 1000 мг каждые 6 часов, а также испарительным охлаждением с помощью аэрозолей и вентиляторов или, что более эффективно, терморегуляцией поверхности тела. В тяжелых случаях высокая температура, тахикардия и выраженная нестабильность артериального давления поддаются лечению клонидином, агонистом α2-адренорецепторов, или блокаторами кальциевых каналов, такими как клевидипин или никардипин [35].
Ригидность отслеживается при осмотре. В легких случаях расслаблению мышц способствует лоразепам. Однако если мышечные признаки ЗНС сохраняются или усугубляются, можно назначить дантролен, релаксант прямого действия для скелетных мышц, который ингибирует высвобождение кальция в саркоплазматическом ретикулуме. Снижая ригидность и, предположительно, оказывая воздействие на центральные зоны терморегуляции, дантролен смягчает гипертермию и снижает повышенный уровень креатинкиназы в сыворотке крови [36]. При приеме высоких доз препарата существует риск гепатотоксических эффектов, поэтому их назначение обычно сопровождается мониторингом функций печени. В качестве альтернативного препарата были предложены бромокриптин или амантадин; оба препарата являются дофаминомиметиками, вытесняющими антипсихотики — антагонисты дофамина — и связаны с небольшим числом краткосрочных побочных эффектов [37].
Эти специфические дофаминергические вмешательства обычно оправданы, когда температура тела достигает 38–40 °C, а ригидность является умеренной или тяжелой, что выражается в переходе от пальпируемой легкой ригидности с феноменом зубчатого колеса к устойчивой ригидности. Сообщалось, что в случаях, угрожающих жизни, быстрый эффект дает электросудорожная терапия (ЭСТ), но ее применяют только для пациентов, которые не отвечают на другие методы лечения [38]. Механизм, лежащий в основе влияния ЭСТ на ЗНС, неизвестен, что также относится к влиянию ЭСТ на депрессию и кататонию.
Оптимальная продолжительность каждого из этих вмешательств и методы их коррекции или отмены не установлены. Практика их применения в разных отделениях интенсивной терапии также различается; в одних отделениях медикаментозное вмешательство продолжается в течение нескольких дней, в других — в течение нескольких недель, особенно если препарат, вызвавший нарушение, имеет длительный период полуэлиминации. При этом соблюдаются общие принципы интенсивной терапии, в частности профилактика стрессовых язв у пациентов, находящихся на искусственной вентиляции легких [39], и профилактика тромбоза глубоких вен с помощью подкожного введения гепарина или эноксапарина [40].
После отмены препарата (или препаратов), вызвавшего нарушение, его, как правило, не повторно не используют. Это может затруднить контроль за основным заболеванием, для лечения которого использовался препарат. Также по возможности отменяются другие психотропные препараты, такие как литий, антихолинергические и серотонинергические препараты, чтобы избежать появления симптомов, затрудняющих оценку признаков ЗНС. В случае инъекционных средств длительного действия из-за их пролонгированного высвобождения немедленное устранение эффекта антипсихотического препарата невозможно. В отношении некоторых антипсихотических препаратов требуется интервал до 60 дней, чтобы их уровень в крови стал неопределяемым. В случае пероральных антипсихотических препаратов более короткого действия спонтанное снижение до низких уровней в сыворотке крови обычно происходит в течение 3–5 дней.
Маргарита и Майкл Вудбери разработали трехступенчатую систему классификации тяжести ЗНС с акцентом на кататонию у подростков [41]. Эта система классификации часто упоминается в литературе и применяется ко взрослым пациентам. Тяжелая стадия включает выраженную ригидность, кататонию или спутанность сознания, температуру 40 °C или выше и частоту сердечных сокращений 120 ударов в минуту или выше. Каких-либо общепризнанных рекомендаций по лечению от научных обществ нет, но Ассоциация злокачественной гипертермии США предлагает помощь в решении вопросов, связанных с лечением (https://my.mhaus.org/page/contactmhaus).
Исход заболевания
Время восстановления варьирует, но обычно составляет от 7 до 11 дней и может быть приблизительно предсказано на основании периода полувыведения соответствующего нейролептического препарата [42,43]. Относительное влияние различных методов лечения на исход заболевания оценивается путем сравнения времени, необходимого для полного выздоровления — например, в среднем 15 дней при поддерживающей терапии по сравнению с 9 днями при использовании дантролена и 10 днями при использовании бромокриптина. В анализе «случай-контроль», основанном на опубликованных данных, смертность среди пациентов, получавших дофаминергические препараты, оказалась ниже, чем среди тех, кто их не получал [44].
Были зарегистрированы редкие случаи, когда длительность синдрома достигала нескольких месяцев, с остаточной кататонией и двигательными симптомами. Смертность, которая в прошлом составляла от 20 до 30 %, в более поздних исследованиях колебалась от 4,7 % в течение 30 дней до 9,9 % в течение 90 дней и до 15,1 % в течение 1 года, что говорит о поздних осложнениях, таких как аспирационная пневмония или почечная недостаточность, которые могут привести к летальному исходу [44]. Длительный период восстановления повышает риск развития ИВЛ-ассоциированных пневмонии и сепсиса. Однако пациента можно отключить от аппарата искусственной вентиляции легких, если механика дыхания восстановилась до безопасного уровня, уменьшилась секреторная нагрузка и снизилась осевая ригидность, затрудняющая дыхание. В общенациональной выборке стационарных пациентов с неуточненным диагнозом ЗНС рабдомиолиз и острое повреждение почек наблюдались в 30 % случаев [45]. Острая дыхательная недостаточность, сепсис и сопутствующая застойная сердечная недостаточность (как ни странно) не были признаны независимыми предикторами смерти, но тем не менее являются потенциально модифицируемыми факторами риска неблагоприятного исхода.
По некоторым данным, возобновление лечения антипсихотическими препаратами гипотетически может привести к рецидиву ЗНС даже через 2 года после первого применения [46]. Однако основное психическое заболевание может потребовать продолжения лечения, и некоторые группы экспертов рекомендуют подождать примерно 2 недели или дольше, прежде чем возобновлять терапию, если сохраняются какие-либо признаки ЗНС, а затем начать лечение слабодействующими препаратами [47].
Еще одним предложением по предотвращению рецидива является назначение низких начальных доз антипсихотических препаратов с медленной корректировкой в сторону увеличения. Переход на атипичные нейролептики, включая клозапин, не обязательно предотвращает рецидив ЗНС, но может быть связан с низким риском тяжелого или фатального рецидива. Несмотря на очевидный риск повторного введения антипсихотических препаратов, в общенациональном исследовании только у 5 из 119 пациентов с шизофренией, которые прошли повторный курс лечения этими препаратами, произошел рецидив; риск все же остается низким [48]. В систематическом обзоре, посвященном рискам лечения различных расстройств клозапином, повторное лечение было успешным у всех 7 пациентов с клозапин-ассоциированным ЗНС, но не предотвратило рецидива агранулоцитоза или миокардита, связанных с приемом препарата [49]. В медицинской карте пациента рекомендуется указать злокачественный нейролептический синдром как серьезную побочную реакцию на препарат.
Заключение
Злокачественный нейролептический синдром — это характерный и вызывающий тревогу синдром, который возникает у некоторых людей, принимавших препараты, блокирующие дофамин, в частности (но не исключительно) антипсихотические препараты. Неясно, какие клинические признаки имеют наибольшее значение для диагностики синдрома и не является ли это состояние недостаточно диагностированным или же гипердиагностированным. Причины большинства признаков синдрома не выяснены, и кажущаяся низкая вероятность рецидива при повторном воздействии на организм противоречит простому объяснению. Интенсивная терапия направлена на устранение таких основных симптомов, как лихорадка, нарушение деятельности вегетативной нервной системы и мышечная ригидность, и дополняется препаратами, повышающими активность дофамина, или ЭСТ. Лечение носит поддерживающий и эмпирический характер. Распространенность геномных вариантов, риск возникновения и рецидива заболевания, а также проведение интенсивной терапии требуют дальнейшего изучения в различных группах пациентов со злокачественным нейролептическим синдромом.





