Побочные ноцебо-реакции могут нанести вред пациентам и повлиять на снижение приверженности лечению, отражаясь как на клинической практике, так и на клинических испытаниях. Ноцебо-реакции относят к негативным результатам лечения, которые нельзя объяснить его фармакологическими эффектами. Ожидания негативных исходов и эффекты ноцебо изучены меньше, чем плацебо-реакции. Ноцебо-эффекты могут быть спровоцированы вербальными внушениями, предыдущим негативным опытом, наблюдением за негативными реакциями других людей и другими факторами контекста и окружающей среды. По мере развития исследований накапливаются механистические знания о нейробиологических механизмах ноцебо-эффектов. В этом обзоре суммированы исследования различных аспектов ноцебо-эффектов и реакций, а также обсуждаются их клинические последствия, этические вопросы и направления для будущих исследований.
Вопрос в том, как часто потенциально полезный препарат
был отвергнут из-за «токсического эффекта» в начальных испытаниях,
который был обусловлен случайным наличием достаточного
количества ноцебо-реакторов среди испытуемых.
— Уолтер Кеннеди, 1961
1. ВВЕДЕНИЕ
Пациенты, получающие плацебо в рандомизированных клинических исследованиях, часто сообщают о побочных эффектах, аналогичных тем, что описывают пациенты, получающие активное лечение. Эти явления называются ноцебо-реакциями и упоминаются в обсуждении потенциальных побочных эффектов в процессе получения информированного согласия на лечение. Термин «ноцебо» был введен Уолтером Кеннеди в 1961 году непосредственно для обозначения ноцебо-реакции как негативного аналога позитивной плацебо-реакции или ответа.
Ноцебо-ответы представляют собой неблагоприятные реакции на плацебо-вмешательства в плацебо-контролируемых исследованиях. Ноцебо-эффекты — это нейробиологические феномены, связанные с реальным или предполагаемым вредом.Подобные отрицательные последствия могут быть обусловлены негативными ожиданиями, формируемыми вербальными установками, предшествующим опытом обучения, социальным наблюдением, феноменом массового психогенного моделирования (подражания, наблюдательного научения), негативной трактовкой коммуникации в системе врач-пациент и особенностями клинических взаимодействий. Ноцебо-реакторы — это участники, демонстрирующие негативную реакцию на плацебо-вмешательство. Таким образом, концепция ноцебо-эффектов в последнее время привлекает внимание как фундаментальных, так и клинических исследований.
В данном обзоре рассматриваются результаты исследований механизмов ноцебо-эффектов и ответных реакций, а также обсуждаются их клинические последствия и этические аспекты. Кроме того, анализируется, как вербальная коммуникация, факторы окружающей среды и предыдущий неудачный опыт лечения могут формировать негативные ожидания, вызывающие ноцебо-эффекты. Ноцебо-эффекты имеют биологическую природу, а поведенческие, нейровизуализационные и фармакологические исследования помогли выявить ответственные за них механизмы. Нейробиологические основы ноцебо-эффектов пока не до конца понятны, но существует несколько теорий, объясняющих их работу. Согласно одной из наиболее распространенных, ноцебо-эффект опосредован теми же нейробиологическими путями, что и плацебо-эффекты. Ноцебо-эффекты возникают как реакция мозга на ожидание и предвосхищение негативных исходов, что запускает выброс гормонов стресса и других нейротрансмиттеров, приводя к различным физическим и психологическим симптомам. Кроме того, социальные и культурные факторы также могут влиять на ноцебо-эффекты.
2. НОЦЕБО-РЕАКЦИИ В РАНДОМИЗИРОВАННЫХ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЯХ
В ранних исследованиях ноцебо-реакции порой рассматривались как неудобный феномен, затрудняющий валидацию лекарственных средств из-за возникновения побочных эффектов в группах плацебо. В рандомизированных клинических испытаниях (РКИ) ноцебо-реакции могут снижать приверженность лечению, приводить к прекращению терапии, увеличивать потребность в более высоких дозах и/или расширять размеры выборки для демонстрации эффективности лечения.
Прекращение терапии — распространенное явление как в РКИ, так и в клинической практике, часто связанное с нежелательными явлениями, о которых сообщают пациенты. Майерс и соавт. показали, что информирование пациентов со стенокардией напряжения о возможных желудочно-кишечных побочных эффектах аспирина и сульфинпиразона приводит к выходу из исследования. Кэрнс и соавт. провели вторичный ретроспективный анализ данных для количественной оценки влияния простого упоминания желудочно-кишечных побочных эффектов в форме информированного согласия. Это исследование проводилось в рамках рандомизированного двойного слепого плацебо-контролируемого испытания, оценивающего пользу аспирина, сульфинпиразона или их комбинации при нестабильной стенокардии. Пациенты, проинформированные о возможных желудочно-кишечных эффектах, столкнулись с шестикратным увеличением частоты желудочно-кишечных симптомов и более высоким процентом самостоятельного прекращения лечения.
Ретроспективные анализы ноцебо-реакций (и показателей отсева) проводились для РКИ при различных заболеваниях, включая рассеянный склероз, нейропатическую боль, фибромиалгию, болезни двигательных нейронов, депрессию, мигрень, головную боль (в т.ч. напряжения) и остеопороз.
Лекарства для лечения мигрени, депрессии и гиперхолестеринемии (например, статины) изучались на предмет высоких показателей побочных явлений в группах плацебо. Систематические обзоры рандомизированных двойных слепых плацебо-контролируемых исследований антимигренозных препаратов указывают на то, что побочные явления, связанные с плацебо-вмешательствами, часто совпадают с таковыми в группах, получающих исследуемый препарат. Аманцио и соавт. провели систематический анализ побочных эффектов в плацебо-группах 69 исследований антимигренозной терапии, включая 56 исследований триптанов, 9 исследований противосудорожных средств и 8 исследований нестероидных противовоспалительных препаратов (НПВП). Высокие показатели побочных явлений в плацебо-группах этих испытаний соответствовали показателям побочных явлений, описанных в группах, получавших лекарственные препараты. Плацебо-формы противосудорожных вызывали анорексию, нарушения памяти, парестезии и инфекции верхних дыхательных путей — все эти явления типичны для антимигренозной терапии. Выявленная корреляция между регистрируемыми побочными явлениями в группах плацебо и известными побочными явлениями исследуемых препаратов подтверждает наличие истинного ноцебо-ответа, спровоцированного информацией, предоставляемой при получении информированного согласия.
Риф и соавт. сравнили побочные явления в плацебо-группах исследований двух классов антидепрессантов: трициклических антидепрессантов (ТЦА) и селективных ингибиторов обратного захвата серотонина (СИОЗС). Этот систематический обзор и мета-анализ включили 143 плацебо-контролируемых рандомизированных клинических испытания с участием 12 742 пациентов. В исследованиях ТЦА по сравнению с СИОЗС в плацебо-группах чаще регистрировались такие побочные явления, как сухость во рту, сонливость, запоры и сексуальные дисфункции. Более высокая частота побочных явлений также была связана с систематическим (в отличие от несистематического) подходом к их оценке, что указывает на влияние ожиданий пациентов и исследователей.
В гиполипидемической компоненте недавнего кардиологического исследования ASCOT (ASCOT-LLA) рассматривались побочные явления аторвастатина. В исследование были включены 10180 пациентов с гипертонией, тремя факторами риска сердечно-сосудистых заболеваний с уровнем общего холестерина натощак в пределах 5–6 ммоль/л. Среди принимавших статины и фибраты участников не было инфаркта миокарда в анамнезе, и они не получали лечение от стенокардии. В двойном слепом плацебо-контролируемом исследовании III фазы участники были рандомизированы для получения либо аторвастатина 10 мг ежедневно, либо плацебо. В последующей нерандомизированной открытой IV фазе всем пациентам был предложен аторвастатин в дозировке 10 мг ежедневно. Слепым образом анализировались четыре типа побочных явлений: относящиеся к мышцам, нарушения сна, эректильная дисфункция и когнитивные нарушения. Как аторвастатин в дозировке 10 мг, так и плацебо привели к увеличению частоты побочных явлений, связанных с мышцами, но только в трехлетней нерандомизированной открытой фазе последующего наблюдения. В течение первых пяти лет рандомизированного двойного слепого плацебо-контролируемого исследования у участников не наблюдалось увеличения частоты побочных явлений. Таким образом, авторы предположили, что избыточная частота побочных явлений, связанных с мышцами (хорошо известное побочное явление статинов), возникала только тогда, когда пациенты и их врачи знали, что принимался аторвастатин.
Общественное восприятие побочных явлений препаратов также может способствовать ноцебо-реакциям на антидепрессанты и тироксин, используемый для лечения гипотиреоза. В 2007 и 2008 годах аптеки Новой Зеландии перешли на новую формулу тироксина под торговой маркой Eltroxin. С 1973 года Eltroxin, производимый GlaxoSmithKline, был единственным одобренным и финансируемым правительством Новой Зеландии препаратом гормона щитовидной железы. В 2007 году компания перенесла производство Eltroxin из Канады в Германию. Активный ингредиент (тироксин) продолжал производиться в Австрии без изменений. Однако вспомогательные компоненты (т.е. инертные ингредиенты таблетки) изменились по цвету, размеру, маркировке, вкусу и скорости растворения на языке. После внедрения новых таблеток частота побочных явлений возросла почти в 2000 раз: с 14 жалоб за 30 лет до более чем 1400 за 18 месяцев. Подобные массовые психогенные явления регистрировались у населения Новой Зеландии, жаловавшихся на головную боль от ветрогенераторов.
Обобщая сказанное, ноцебо-реакции, представляющие собой негативные ответы на неактивные методы лечения или вмешательства, сопровождающиеся информацией о возможных негативных эффектах, способны снижать приверженность лечению, увеличивать требуемый размер выборки для демонстрации эффективности терапии и приводить к прекращению лечения. Данные реакции были выявлены в рандомизированных клинических исследованиях различных заболеваний, включая рассеянный склероз, нейропатическую боль, фибромиалгию, депрессию и мигрень. По-видимому, с возникновением ноцебо-реакций связаны подробности, раскрываемые в формах информированного согласия. Регистрируемые побочные явления в группах плацебо часто соответствуют известным побочным действиям исследуемых препаратов, что свидетельствует о подлинном ноцебо-эффекте. Общественное восприятие побочных действий лекарственных средств также может способствовать развитию ноцебо-реакций. Забегая вперед, ноцебо-реакции могут также влиять на решения об использовании биоаналогичных препаратов.
Читайте также → Ноцебо, плацебо и боль
Новое направление исследований ноцебо открылось с введением биоаналогичных продуктов. Биоаналоги — это биологические медицинские продукты, содержащие тот же активный ингредиент, что и оригинальные биологические препараты (первоначальные), но произведенные другой компанией. В настоящее время в ревматологии и онкологии ноцебо-реакции могут препятствовать переходу пациентов с оригинальных препаратов на биоаналоги.
В реестре DANBIO ревматологи собирают данные в течение рутинной практики. Статус заболевания был схожим до и после перехода пациентов с ревматическими заболеваниями с оригинального инфликсимаба на его биоаналог CT-P13. Однако скорректированный показатель удержания через год был значительно ниже, чем показатель удержания тех, кто получал оригинальный инфликсимаб. Что свидетельствует о возможной ноцебо-реакции.
Аналогичным образом Боон и соавт. исследовали негативные терапевтические исходы после перехода с оригинального инфликсимаба на биоаналог CT-P13, а также эффекты возобновления оригинального инфликсимаба при хронических иммуноопосредованных воспалительных заболеваниях, таких как синдром раздраженного кишечника (СРК) и ревматические заболевания. Профили эффективности, иммуногенности и переносимости оригинального и биоаналогичного инфликсимаба были сопоставимы, но негативные исходы наблюдались у 13 % пациентов, перешедших с оригинала на биоаналог. Как пациенты с СРК, так и ревматологические пациенты жаловались на реакции при инфузии и головную боль, что позволяет предположить: немедицинская (медицински необоснованная) замена моггла вызвать ноцебо-реакции.
В двух проспективных наблюдательных исследованиях пациентов с ревматическими заболеваниями, согласившихся перейти с оригинального инфликсимаба на биоаналог CT-P13, улучшение состояния заболевания через год после перехода было сопоставимо между терапиями. Однако в одном исследовании 15 % пациентов прекратили лечение CT-P13, несмотря на отсутствие ухудшения заболевания. В другом исследовании 25 % пациентов прекратили прием биоаналога из-за субъективного ухудшения состояния и/или проблем с переносимостью. Аналогичным образом, недавний систематический обзор, сравнивающий исходы при переходе с оригинала на биоаналоги в открытых и двойных слепых условиях, показал более высокие показатели прекращения лечения, побочных явлений и отсутствия эффективности в открытых исследованиях биоаналогов инфликсимаба по сравнению с двойными слепыми исследованиями.
Эти исследования показывают, что прекращение лечения при смене лекарственной формы выглядит более сложно, чем это обычно происходит в рандомизированном контролируемом исследовании. Основания для прекращения лечения в этих исследованиях варьировались и могли быть связаны с субъективным ухудшением состояния и/или проблемами переносимости, а не с объективным ухудшением заболевания. Поэтому важно учитывать эти факторы при оценке эффективности и безопасности биоаналогов и других лекарственных средств.
Профессиональные сообщества, такие как Европейское общество медицинской онкологии и Американское общество клинической онкологии, подчеркивают важность образования и диалога между врачом и пациентом для принятия биоаналогов. В руководстве для медсестер, участвующих в переходе пациентов между схожими биологическими препаратами, Европейская организация специализированных медсестер отдельно рассматривает проблему ноцебо-реакций, предоставляя информацию о том, как отвечать на вопросы пациентов о стоимости/качестве биоаналогов, потенциальных ноцебо-эффектах и как консультировать пациентов в вопросах доверия и убеждений в эффективности.
В целом эти исследования показывают, что прекращение лечения при смене лекарственной формы более комплекстное явление, чем то, что мы обычно наблюдаем в рандомизированном контролируемом исследовании, и может быть обусловлено субъективным ухудшением состояния и/или проблемами переносимости, а не объективным ухудшением заболевания. Образовательные программы способны помочь минимизировать ноцебо-реакции, акцентируясь на методе и содержании стратегий коммуникации. Исследования по фреймингу сообщений (способ подачи информации, ракурс, акцент на чем-либо, — прим. ред.) и восприятия их пациентами могут способствовать развитию образовательных программ параллельно с разработкой новых пациенто-ориентированных правил.
3. МЕХАНИЗМЫ НОЦЕБО-ЭФФЕКТОВ
Наблюдение того, что участники могут испытывать побочные эффекты после получения плацебо-таблеток, инъекций или проведения ложных процедур и операций, вызвало интерес к пониманию механизмов ноцебо-эффектов. К их возникновению приводят внутренние и внешние факторы. Отрицательные ожидания могут быть связаны с негативными вербальными внушениями (например, «лечение было прекращено»), предыдущим опытом (например, повышение интенсивности болезненного воздействия) и наблюдением за окружением (например, как кто-то страдает от побочного эффекта). Массовое психогенное моделирование (например, убеждение, что ветрогенераторы вызывают головную боль), информационные материалы для пациентов (например, списки побочных эффектов), общение между врачом и пациентом (например, «эта процедура будет болезненной») и клинические ситуации также могут вызывать ноцебо-эффекты. Внутренние факторы включают индивидуальные ожидания пациентов, генетическую предрасположенность, когнитивные оценки, а также негативное настроение и эмоции (Рисунок 1).

Рисунок 1Схематическое представление потенциальных внешних и внутренних факторов, провоцирующих ноцебо-реакции. Вербальные внушения (например, сообщение о прекращении лечения), предшествующий опыт (например, болезненные воздействия с повышаемой интенсивностью), наблюдение за окружением (например, за тем, как кто-то страдает от побочного явления), массовое психогенное моделирование (например, вера в то, что ветряные турбины вызывают головную боль), описания препаратов (например, перечни побочных эффектов), общение между врачом и пациентом (например, фраза «эта процедура будет болезненной»), контекстуальные сигналы (например, запах химиотерапии) и клинические ситуации в целом представляют собой примеры внешних факторов, провоцирующих ноцебо-реакции. В противоположность этому, к внутренним факторам, которые могут определять приверженность к ноцебо-реакциям, относятся негативное настроение и эмоции, негативные факторы, дезадаптивная когнитивная оценка, черты личности, соматосенсорные особенности и омиксные данные (геномные, протеомные и другие).
Механизмы, ответственные за ноцебо-эффекты, исследовались в клинических и экспериментальных условиях с некоторыми этическими ограничениями из-за негативных и потенциально вредных условий. В клинических испытаниях и экспериментальных исследованиях ноцебо-эффектов с участием добровольцев, ноцебо-реакторы — это те, кто негативно реагирует на позитивные внушения и/или плацебо, предназначенные для улучшения результата. Ноцебо-реакторы также те, кто негативно реагируют на вербальные внушения, негативное моделирование и обучающие мероприятия, предваряющие ожидания.
У плацебо- и у ноцебо-эффектов, пропорция и характеристики плацебо/ноцебо-реакторов остаются неизвестными. Эти вопросы также применимы к ноцебо-эффекту. Недавнее исследование с участием 624 здоровых участников, прошедших процедуру плацебо и ноцебо (тепловая боль), показало связь ноцебо-эффектов и некоторых характеристик: ноцебо-реакции были связаны с невротизмом и порогом тепловой боли.
В каждом исследовании есть некоторые участники, реагирующие на плацебо негативным образом. В перекрестном исследовании со здоровыми участниками без боли и участниками с хронической болью авторы оценили долю ноцебо-реакторов. Ноцебо-реакторы — это те, кто негативно отреагировал на позитивную плацебо-манипуляцию, состоящую из вербальных внушений и обусловливания (выработке научения по Павлову). Исследователи обнаружили, что 7,8 % и 11,6 % участников соответственно сообщили о сильной боли после плацебо-манипуляции (Рисунок 2). Ноцебо-реакторы характеризовались более высоким уровнем страха перед болью, катастрофизацией и эмоциональным дистрессом. Этот результат согласуется с долей прекращения лечения (выбывания), наблюдаемой в клинических испытаниях, описанных выше.
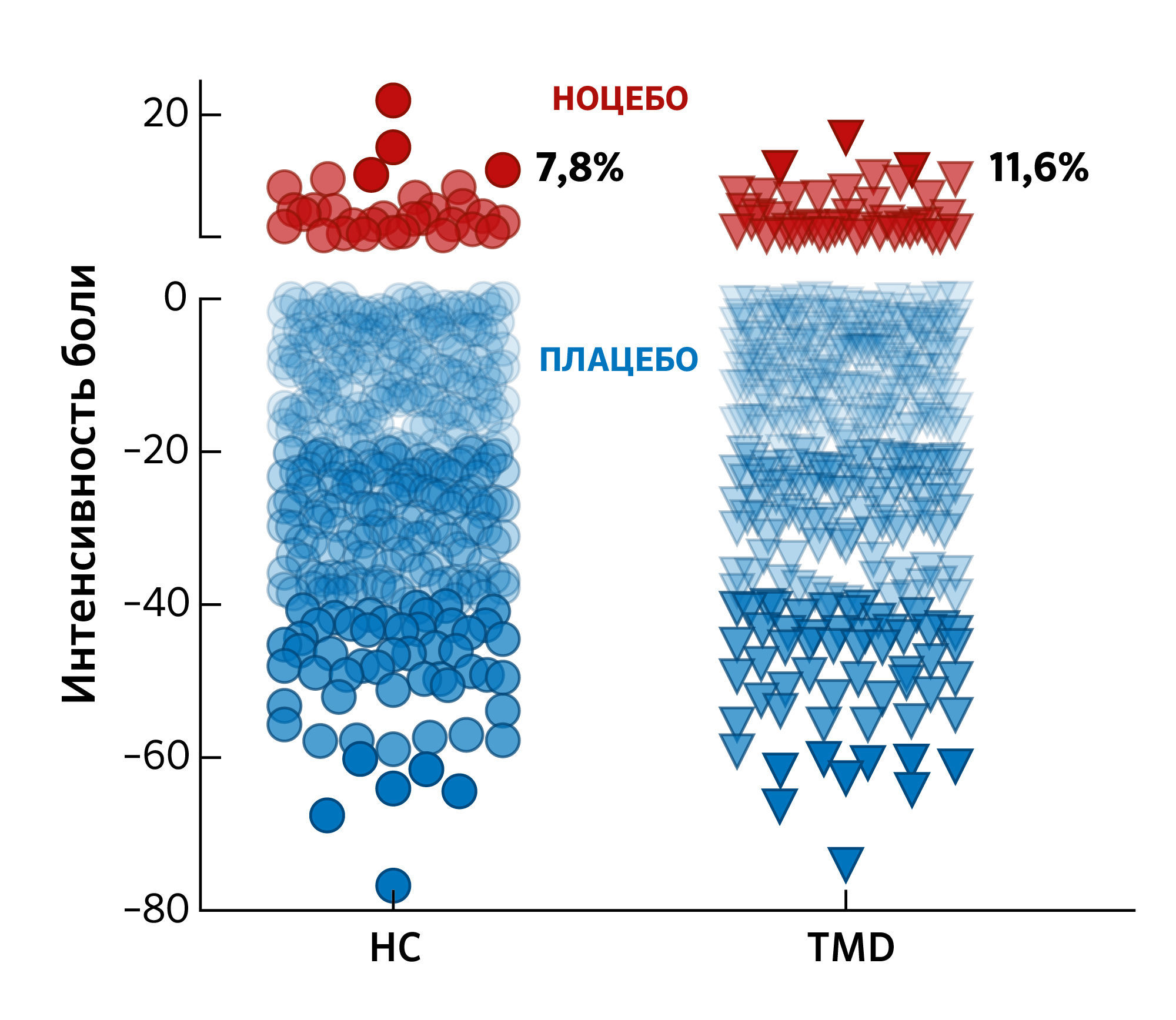
Рисунок 2На рисунке показано распределение плацебо-реакций (синим цветом) и ноцебо-реакций (красным цветом) у участников, прошедших плацебо-процедуру. В исследовании участвовали здоровые испытуемые (HC) и пациенты с хронической болью, страдающие от лицевой боли вследствие височно-нижнечелюстных расстройств (TMD). Плацебо-манипуляция включала: вербальные внушения о снижении боли и обусловливание, при котором одинаковый болевой термический стимул сочетался с различными визуальными сигналами для оценки плацебо-эффектов. Ложный электрод прикреплялся к предплечью для придания участникам уверенности в возможном снижении болевых ощущений. Различия в субъективных отчетах о боли операционально определялись как плацебо-ответы (снижение боли) и ноцебо-ответы (усиление боли). Каждая точка на графике представляет собой изменение уровня боли, выраженное как разница между контрольными и тестовыми испытаниями, для 400 здоровых участников (кружки) и 363 участников с хронической болью (треугольники). Процент респондентов для каждого диапазона изменения уровня боли показан справа от индивидуальных данных. Каждая точка (кружки и треугольники) представляет собой среднюю дельту между шестью контрольными и шестью плацебо-испытаниями.
В контексте демографических характеристик сообщалось, что пол был предиктором ноцебо. Существующие данные о половых различиях в ноцебо-эффектах часто противоречивы. Кроме того, несколько важных факторов не были учтены в предыдущих систематических обзорах и мета-анализах по этой теме (т.е. отсутствуют исследования, сообщающие о половых различиях). Один обзор, который объединил исследования со здоровыми участниками и участниками с СРК и социальной фобией, показал, что мужчины чаще испытывали плацебо-эффекты, а женщины — ноцебо-эффекты. Тип манипуляции, используемый для индукции плацебо-эффектов в лаборатории, казался значимым для наблюдения половых различий: на мужчин эффективнее воздействовали вербальные внушения, а на женщин — обусловливание. Подобные наблюдения стимулировали интерес к определению механизмов ноцебо-эффектов и потенциальных факторах риска, связанных с этими эффектами, как будет описано ниже.
Читайте также → Плацебо: иммунитет и гомеопатия
3.1. Поведенческие механизмы ноцебо-эффектов
В области поведения, для определения психологических механизмов ноцебо-эффектов, были исследованы классическое обусловливание, частичное подкрепление, а также обучение через наблюдение и вербальные внушения (или предположения).
В качестве модели для изучения механизмов плацебо использовалась ноцебо-индуцированная гипералгезия — повышенное субъективное восприятие боли после того, как пациент или участник исследования получает плацебо (например, имитацию крема), подвергается ложной операции (например, надрезу на коже) или просто слышит упоминание о возможном усилении боли. Коллока и соавт. сравнили эффекты только вербальных внушений (т.е. без предшествующего болевого опыта) и классического обусловливания (т.е. с предварительным воздействием) сильных болевых стимулов. Негативные внушения о предстоящем сильном болевом воздействии сочетались либо с едва заметными, либо со слабыми болезненными электрическими разрядами. Результаты показали, что участники, которых просто проинформировали о предстоящей сильной боли, получившие едва заметные стимулы, воспринимали их как более болезненные по сравнению с теми, кто предварительно подвергался сильным болевым воздействиям (Рисунок 3). Когда использовались болевые стимулы, то вербальные внушения сами по себе и вербальные внушения в сочетании с обусловливанием вызывали ноцебо-гипералгезию сходной величины. Этот вывод о том, что ноцебо-эффекты имеют сопоставимую величину при использовании вербальных внушений и обусловливания, отличается от вывода о плацебо-эффектах, где обусловливание оказывает более сильное воздействие, чем вербальные внушения. Эти результаты были воспроизведены в последующих исследованиях.
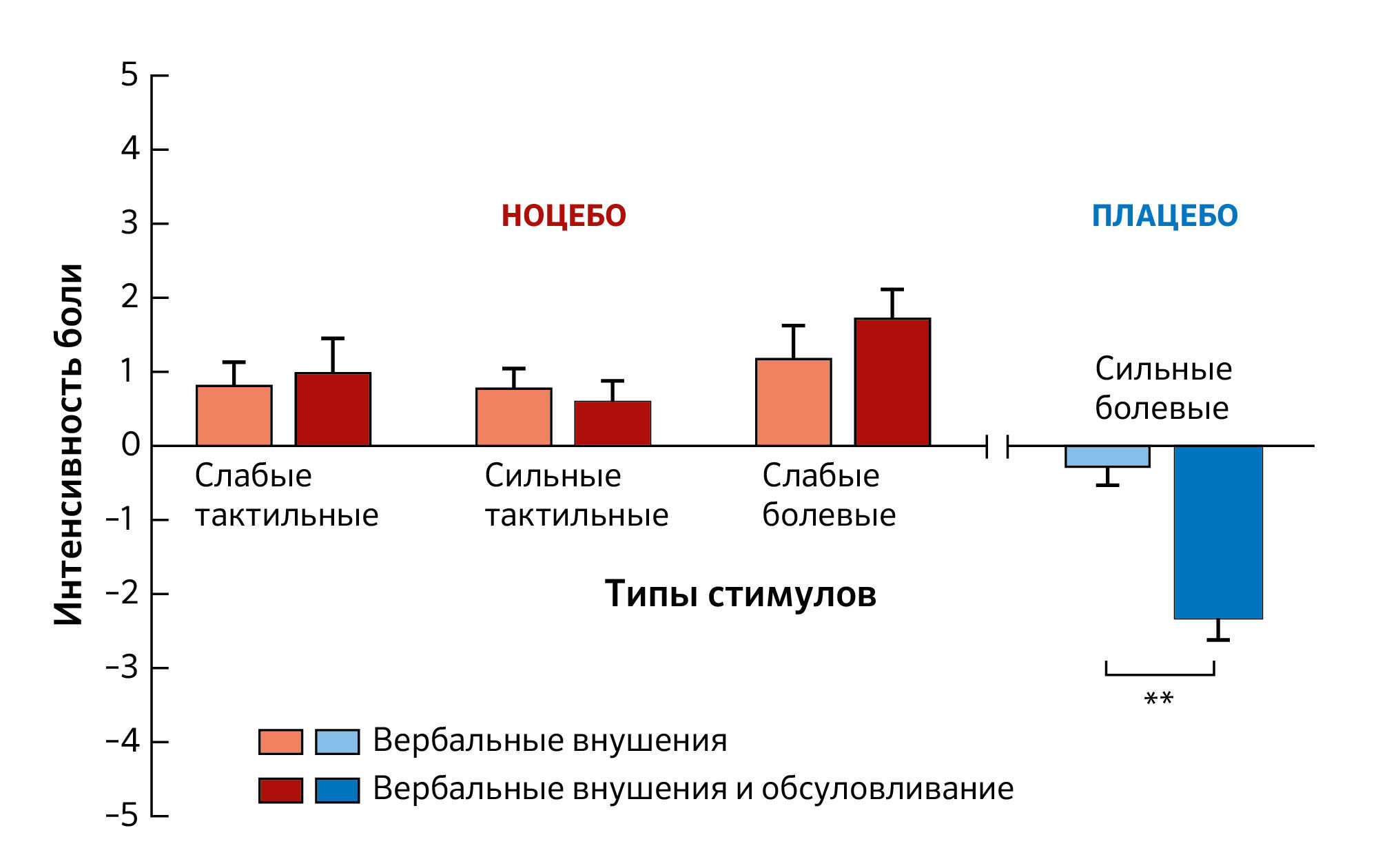
Рисунок 3На графике представлены средние значения и стандартное отклонение у участников, получивших только вербальные внушения, по сравнению с участниками, прошедшими процедуру обусловливания, в трех экспериментальных условиях ноцебо (разные типы стимулов). Три условия ноцебо включали: слабые тактильные, сильные тактильные и слабые болевые стимулы. Обособленно вербальные внушения и процедура обусловливания вызывали ноцебо-ответы одинаковой величины во всех трех условиях. Тактильные стимулы воспринимались как болезненные (аллодиния). Слабые болевые стимулы воспринимались как сильные болевые стимулы (гипералгезия) в результате ноцебо-эффектов. Напротив, в условиях плацебо вербальные внушения и обусловливание показали значимые различия (обозначено звездочками **, p < 0,01). Данные представлены со стандартным отклонением среднего.
Что касается обусловливания, для индукции ноцебо-эффектов, которые сопоставимы с эффектами от четырех сеансов, достаточно и одного сеанса. Поэтому предварительный опыт гипералгезии не является необходимым для возникновения ноцебо-гипералгезии. Также было показано, что ноцебо-эффекты могут вызываться только обусловливанием, то есть без каких-либо вербальных внушений.
В прошлом исследовались эффекты частичного и непрерывного подкрепления на ноцебо-гипералгезию. Частичное подкрепление относится к режиму, в котором некоторые, но не все предъявления подкрепляются безусловным стимулом. Поведение, обусловленное частичным подкреплением, имеет тенденцию угасать медленнее, чем поведение при непрерывном подкреплении — феномен, известный как эффект угасания при частичном подкреплении. В случае ноцебо-гипералгезии частичное подкрепление вызывает меньшие реакции по сравнению с непрерывным подкреплением, но эти реакции оказываются более устойчивыми к угасанию. Более того, предварительное воздействие боли снижает ноцебо-эффекты.
Наблюдение за окружением (например, просмотр видео или наблюдение за другим человеком или группой, испытывающими негативные последствия) также может вызывать устойчивые ноцебо-эффекты. Напротив, оперантное обучение (форма ассоциативного научения, при которой частота поведения изменяется под влиянием его последствий (подкрепления или наказания) — прим. ред.) не приводило к ноцебо-реакциям, когда в целях обучения использовалось оперантное избегание (поведение совершается, чтобы предотвратить появление аверсивного стимула, и укрепляется чувством облегчения, когда неприятность не случается).
Важный вопрос заключается в том, обобщаются ли ноцебо-эффекты в пределах (например, от термической к механической ноцицепции) модальностей и между (например, от боли к зуду) ними. Ноцебо-гипералгезия, индуцированная вербальными внушениями, обобщается от одной формы ( термической боли) к другой ( механической боли), но не от одной модальности (боли) к другой (зуду).
В целом, люди могут испытывать ноцебо-индуцированную гипералгезию в результате простого предупреждения о возможных болевых стимулах, в результате обусловленных реакций (например, ассоциаций цветного света с сильными болевыми стимулами) и/или характеристик маркировки (например, цены, этикетки и представления в целом). С эволюционной точки зрения, ноцебо- (аверсивные реакции) и плацебо- (реакции безопасности) пути могут представлять две противоположные системы обучения, сосуществующие в организме. Ноцебо-эффекты могут вызывать краткосрочные защитные реакции, которые усиливают перцептивную обработку и негативные исходы, в то время как плацебо-эффекты представляют собой долгосрочные реакции, которые могут способствовать позитивным исходам.
3.2. Исследования ноцебо-эффектов путем нейровизуализации
Поведенческие манипуляции помогли выявить механизмы обучения, лежащие в основе ноцебо-эффектов. Для сопоставления поведения с нейронными изменениями в головном мозге сочетали поведенческие процедуры и функциональную магнитно-резонансную томографию (фМРТ). Это помогло пролить свет на пути, связанные с усилением боли (и других симптомов), негативными ожиданиями и ноцебо-зависимыми результатами.
Ноцебо-эффекты, к примеру, могут зависеть от порядка, в котором назначаются методы лечения. Кесснер и соавт. показали, что начало приема нового лекарства после предыдущего неудачного лечения вызывает ноцебо-эффект (т.е. усиление боли) и связано с активацией задней части островковой доли — области, связанной с ноцицепцией и усилением боли.
Тиннерман и соавт. продемонстрировали, что маркировка инертного вмешательства как дорогостоящего приводит к более выраженным ноцебо-гипералгезическим эффектам, по сравнению с маркировкой его как дешевого. Ноцебо-эффекты были связаны с изменениями функциональной связности между префронтальными областями, стволом мозга и спинным мозгом. Результаты показали, что префронтальная кора была более активна, когда участники считали лечение дорогостоящим. Кроме того, ростральная передняя поясная кора (rACC) и околоводопроводное серое вещество (PAG) демонстрировали большую активность, когда участники верили, что более дорогое лечение будет иметь больше побочных эффектов, связанных с болью (негативные ожидания). Этот процесс мог усиливать ноцицепцию в ранних подкорковых областях и спинном мозге, который также вовлечен в плацебо-индуцированное снижение боли. rACC предсказывала величину ноцебо-гипералгезических эффектов и демонстрировала деактивацию, способствуя последующей активации PAG и спинного мозга, что приводило к усилению ноцицептивных сигналов. Таким образом, исследование предполагает, что ось rACC-PAG-спинной мозг может быть ответственна за воздействие цены на ноцебо-гипералгезию. Эти результаты расширяют данные предыдущего исследования, показавшего потенциальное влияние механизмов спинного мозга и нисходящих модулирующих систем на негативные ожидания и, как следствие, на ноцебо-гипералгезию. Люди с негативными ожиданиями в отношении лекарства из-за его характеристик, их прошлого опыта неудачного лечения или из-за наслышанности о неблагоприятных эффектах, рискуют переживать ноцебо-эффекты. Эти эффекты могут влиять на поведение человека и приводить к негативным клиническим исходам.
Задние рога спинного мозга получают ноцицептивные сигналы, которые регулируются областями нисходящего контроля, такими как rACC, гипоталамус, миндалевидное тело и PAG. Сигналы с этих областей объединяются в ростровентральная части продолговатого мозга (RVM), чтобы влиять на обработку ноцицепции, а результат определяется поведенческими обстоятельствами и подключает эндогенную опиоидную систему. Это может оказывать либо антиноцицептивное действие, либо способствовать ноцицепции. Высокий уровень тревоги и ожидания может усилить болевые ощущения из-за повышенная активности в сети парагиппокампальной, энторинальной и стволовой коры. Согласно новаторскому нейровизуализационному исследованию, гиппокамп вовлечен в ноцебо-реакции. Именно гиппокамп и области, связанные с тревогой ожидания, связаны также с ноцебо-эффектами. То есть ноцебо-эффекты опосредованы функциональной связностью между гиппокампом и задней островковой долей, первичной соматосенсорной/моторной корой и PAG — областями мозга, участвующими в обработке сенсорно-дискриминативных аспектов боли. Ноцебо-индуцированная связность пропорциональна индивидуальному усилению тревоги. Связность между гиппокампом и миндалевидным телом отрицательно коррелировала с интенсивностью боли. Ноцебо-индуцированная тревога усиливала ноцицептивные сигналы через изменения в нисходящих модулирующих областях боли.
Специфические паттерны мозговой активности, связанные с ноцебо-эффектами, были зарегистрированы у зуда и одышки. Зуд, индуцированный негативными ожиданиями, связан с изменениями функциональной связности между островковой долей и PAG. Одышка, вызванная устройством, вставленным в дыхательную систему при ноцебо-вербальном внушении, связана с активацией области PAG.
В целом, эти исследования показали, что ноцебо-эффекты могут зависеть от порядка назначения методов лечения и могут вызывать усиление боли, зуда и одышки (и других симптомов). Модуляторные паттерны мозговой активности были связаны с этими ноцебо-эффектами (Рисунок 4). Недавнее исследование использовало повторяющуюся транскраниальную стимуляцию постоянным током (tDCS) и фМРТ для определения модулирующих эффектов анодной и катодной tDCS, применяемой на уровне правой дорсолатеральной префронтальной коры (области, вовлеченной в плацебо-анальгезию) на ноцебо-ответы. tDCS уменьшала ноцебо-ответы, индуцированные моделью манипуляции ожиданиями. Эти результаты предполагают модулирующую роль этой области в ноцебо-болевых ответах.
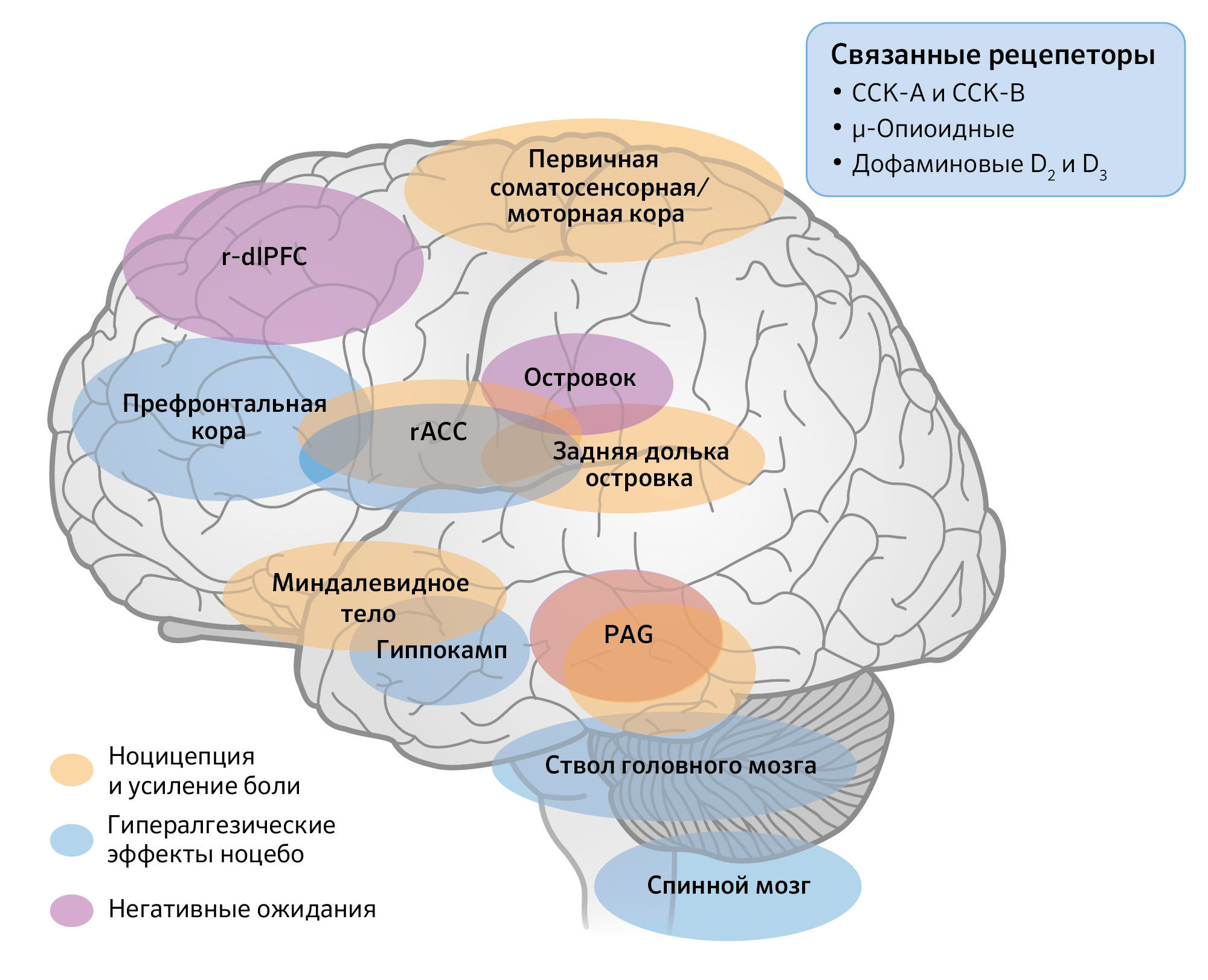
Рисунок 4Нейронные пути, участвующие в нисходящей модуляции (облегчении) ноцицепции, негативных ожиданиях и ноцебо-ассоциированных эффектах. Задние рога спинного мозга получают ноцицептивные входные сигналы, которые регулируются нисходящими контрольными областями, такими как ростральная передняя поясная кора (rACC), гипоталамус, миндалевидное тело и околоводопроводное серое вещество (PAG). Ростральное вентральное продолговатое вещество в стволе мозга объединяет эти области для влияния на обработку ноцицептивной информации. Префронтальные области, ствол мозга и спинной мозг ассоциируются с эффектами, связанными с ноцебо. Гиппокамп и области, связанные с тревогой ожидания, такие как задняя островковая доля, первичная соматосенсорная/ моторная кора и околоводопроводное серое вещество, опосредуют эффекты ноцебо. Островковая доля и периакведуктальное серое вещество также были связаны с негативными ожиданиями. Сокращения: холецистокинин (CCK); правая дорсолатеральная префронтальная кора (r-dlPFC).
3.3. Фармакологические исследования ноцебо-гипералгезии
Ноцебо-эффекты с помощью позитронно-эмиссионной томографии были связаны со связыванием углерода-11 [11C]-меченного раклоприда и [11C]-карфентанила с деактивацией D3/D4 дофаминовых рецепторов и высвобождением опиоидов. Холецистокинин (CCK) является пептидом, участвующим в процессах тревоги и паники. Бенедетти и соавт. показали, что антагонист CCK A/B рецепторов проглумид блокирует ноцебо-гипералгезию. Авторы использовали тест с ишемической болью в руке и негативные вербальные внушения об усилении боли для индукции ноцебо-гипералгезии у здоровых участников. Вербально-индуцированная гипералгезия была связана с повышением концентраций адренокортикотропного гормона (АКТГ) и кортизола в плазме. Бензодиазепин диазепам блокировал как ноцебо-гипералгезию, так и повышение АКТГ и кортизола. В отличие от этого, проглумид блокировал ноцебо-гипералгезию, но не влиял на повышение АКТГ и кортизола. Для определения, участвует ли CCK также в ноцебо-эффектах у пациентов с хронической болью и в других группах, необходимы дальнейшие исследования.
В целом, ноцебо-эффекты могут активировать стрессовую реакцию организма, приводя к высвобождению гормонов стресса, таких как кортизол и адреналин. Эти гормоны могут вызывать различные физические симптомы, такие как учащенное сердцебиение, потливость и мышечное напряжение. Ноцебо-эффекты также могут изменять способ восприятия боли мозгом. Исследования показали, что ожидание боли может активировать те же области мозга, которые участвуют в обработке реальной боли, что приводит к ее усиленному восприятию. Ноцебо-эффекты были связаны с уровнями нейротрансмиттеров, таких как μ-опиоиды, дофамин и холецистокинин. Нейробиологические механизмы ноцебо-эффектов могут оказывать сильное влияние на организм и мозг и приводить к различным негативным симптомам и результатам.
4. ТРАНСЛЯЦИОННЫЕ ИССЛЕДОВАНИЯ ЭФФЕКТА НОЦЕБО
Трансляционные исследования необходимы для преодоления разрыва между фундаментальной наукой и клинической практикой. Клинические исследования эффекта ноцебо помогают понять значимость этого феномена. Для развития текущих и будущих исследований необходимо учитывать этические аспекты.
4.1. Клинические исследования эффекта ноцебо
Клинические исследования продемонстрировали влияние негативных ожиданий и ноцебо-реакций на медицинские исходы и восприятие симптомов. Пионерское исследование Дэниэлс и Сэлли показало, что ожидания связаны с побочными эффектами люмбальной пункции. Из 15 пациентов, которым сказали о предстоящей головной боли после процедуры,она возникла у семерых. Из 13 пациентов, которых не предупреждали, головная боль ни у кого не возникла.
Другие исследования помогли проверить, может ли информация о побочных эффектах, предоставленная перед лечением, вызывать парадоксальные реакции на терапию, появление новых нежелательных эффектов и ухудшение симптомов. Например, у пациентов с астмой, получивших бронхоконстриктор, но уверенных, что им ввели бронходилататор, наблюдалось расширение бронхов. Аналогично, бронходилататор вызывал сужение бронхов, если его представляли как бронхоконстриктор. Еще один пример парадоксальной реакции описан при использовании мышечных стимуляторов: участники испытывали мышечное напряжение, когда им говорили, что введен стимулятор (поддерживающий мышечный тонус), хотя на самом деле вводили миорелаксант (расслабляющий мышцы).
Подобно тому, как информированное согласие может вызывать побочные эффекты у группы, получающей плацебо в клинических испытаниях (см. Раздел 2), пациенты могут ощущать ухудшение симптомов от одной информации о возможных побочных эффектах лечения. У пациентов с болезнью Паркинсона, которым проводили глубокую стимуляцию субталамического ядра, ослабевала брадикинезия (замедленность движений), когда им говорили, что стимуляция включена, даже если она была выключена. Напротив, если стимулятор включали, но пациентам сообщали, что он выключен, это вызывало ухудшение брадикинезии и снижение скорости движений.
Пациенты с доброкачественной гиперплазией предстательной железы, получавшие финастерид, в зависимости от предоставленной информации испытывали побочные эффекты с разной частотой. Половине пациентов сказали, что финастерид может вызывать снижение либидо, эректильную дисфункцию и проблемы с эякуляцией, хотя эти эффекты встречаются редко. Другой половине не предоставили информацию о побочных эффектах. У информированных пациентов побочные эффекты возникли в 43 % случаев, а у неинформированных — только в 15,3 %.
Женщинам во время родов вводили эпидуральную анестезию, описывая ее двумя разными способами. Одним говорили: «Мы введем вам местный анестетик, который обезболит область, и вы будете чувствовать себя комфортно во время процедуры». Другим сообщали: «Вы почувствуете сильное жжение, как от укуса пчелы; это самая неприятная часть процедуры». Женщины, предупрежденные о «жжении» и «самой неприятной части», испытывали более сильную боль во время процедуры. Те, кто ожидал позитивного эффекта анестетика, воспринимали боль как менее интенсивную.
Открыто-скрытое прерывание лечения — это процедура, позволяющая оценить влияние информирования на медицинские исходы в клинических условиях. Лечение проводилось с помощью компьютерного инфузионного насоса, и послеоперационным пациентам либо сообщали о времени прекращения введения диазепама и морфина, либо нет (Рисунок 5). У пациентов, которых открыто предупредили о прерывании, наблюдался резкий рост тревожности и боли, тогда как при скрытом прерывании, контролируемом компьютером, симптомы не изменялись.
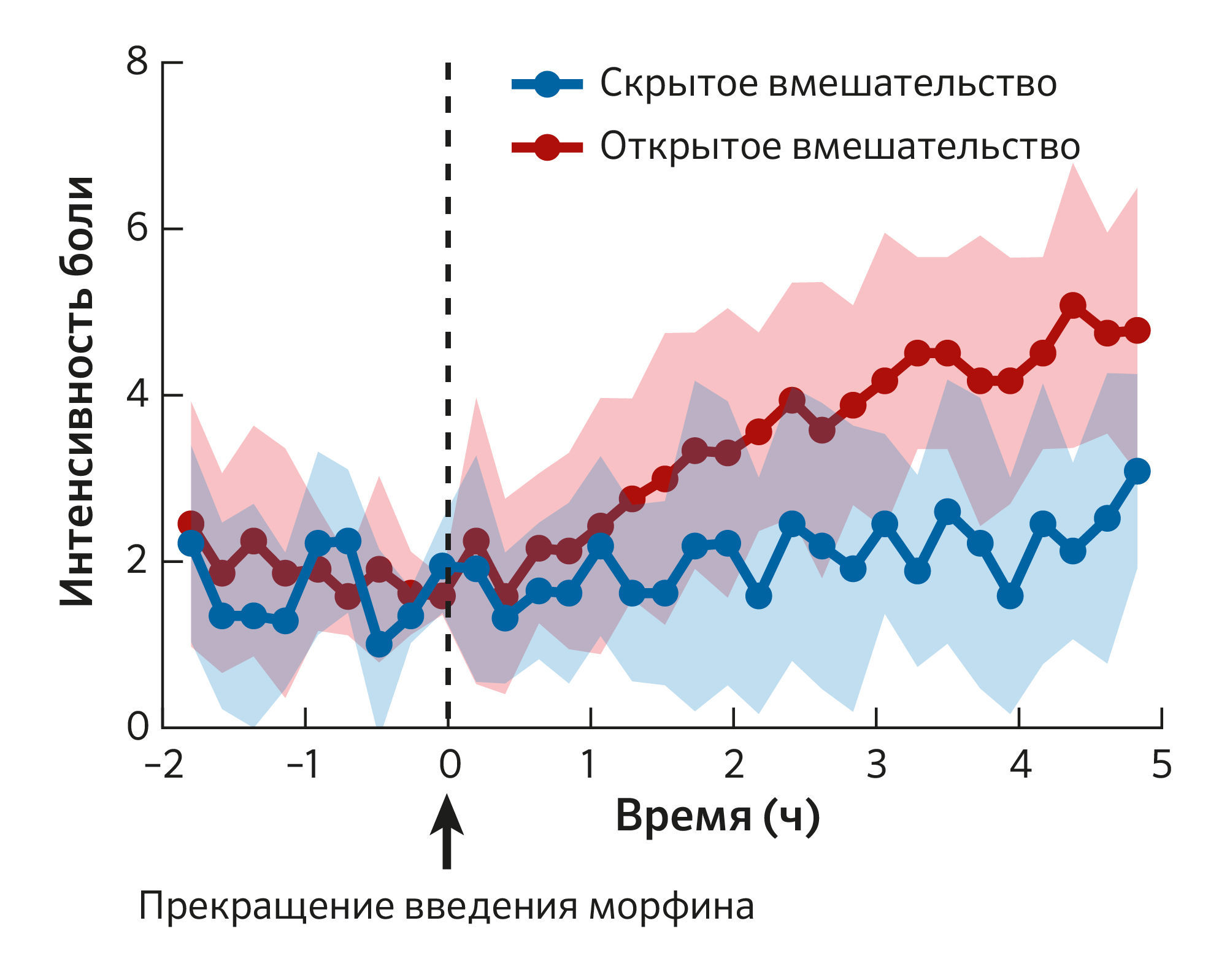
Рисунок 5Влияние открытого и скрытого прекращения введения морфина на послеоперационную боль. При открытом вмешательстве пациенты были проинформированы о прекращении введения морфина, тогда как при скрытом вмешательстве им не сообщали, что введение остановлено. При открытом вмешательстве (красные точки) прекращение введения морфина (пунктирная линия) боль усилилась, при скрытом вмешательстве (синие точки) — нет. Интенсивность боли оценивалась по числовой рейтинговой шкале от 0 (отсутствие боли) до 10 (максимально вообразимая боль).
На ранних этапах жизни ноцебо-эффекты могут быть связаны с уровнем кортизола у матери и младенческим стрессом. Младенцы от матерей с диабетом подвергаются многократным венепункциям для контроля уровня глюкозы в первые 24–36 часов жизни. При проведении забора крови для скрининга новорожденных такие младенцы демонстрировали больше болевых реакций во время подготовки к инъекции по сравнению с детьми от здоровых матерей. Вероятно, предвосхищение боли стало стимулом для ноцебо-реакций.
В целом, эти клинические наблюдения показывают, что ноцебо-эффекты могут значительно влиять на реакцию на лечение, медицинские процедуры и на возникновение побочных эффектов. Эти исследования также указывают на то, что общение между пациентами и медицинскими работниками может непреднамеренно вызывать нежелательные последствия (см. врезку «Влияние ноцебо на клиническое лечение и практику»). В более широком смысле, взаимодействие между врачом и пациентом и условия клинического приема могут способствовать как позитивным, так и негативным исходам, как описано выше.
ВЛИЯНИЕ НОЦЕБО НА КЛИНИЧЕСКОЕ ЛЕЧЕНИЕ И ПРАКТИКУ
Ноцебо-реакции негативно влияют на приверженность лечению, провоцируют побочные эффекты и отказы от участия в клинических испытаниях. Клинические наблюдения показывают, что ноцебо-эффекты могут значительно влиять на реакцию на лечение, терапевтические решения и возникновение побочных эффектов. Общение между пациентом и врачом может непреднамеренно вызывать нежелательные ноцебо-эффекты.
4.2. Эффект ноцебо и COVID-19
Неблагоприятные последствия приема плацебо часто встречаются в рандомизированных клинических испытаниях. Это стало особенно актуально во время испытаний вакцин против COVID-19 и могло способствовать сомнениям в отношении вакцинации. Более того, восприятие симптомов (включая симптомы «длительного COVID») и их контроль могут ухудшаться из-за негативных ожиданий и убеждений.
Пандемия COVID-19 стала важным этапом для исследований ноцебо, поскольку в испытаниях вакцин наблюдались неблагоприятные последствия после введения плацебо. Например, в испытаниях вакцины Pfizer-BioNTech, где 22 578 участников получали плацебо и 22 802 получатели вакцину, среди группы плацебо после первой дозы возникали такие побочные эффекты, как головная боль (19,3 %) и усталость (16,7 %), что указывает на нефизиологические причины. Это важно, поскольку такие события могли способствовать скептическому отношению к вакцинации и искаженному восприятию симптомов.
Гирс и соавт. провели исследование, показавшее, что ожидание побочных эффектов до вакцинации, беспокойство по поводу COVID-19 и депрессивные симптомы были наиболее сильными предикторами побочных эффектов, независимо от исходной симптоматики, возраста, типа вакцины и опыта заражения COVID-19. Дополнительные анализы данных касались намерения получить бустерную дозу. Желание ревакцинироваться было связано с доверием к разработке вакцин, позитивным отношением, обеспокоенностью пандемией, низкой тревогой по поводу побочных эффектов и политическими предпочтениями (демократическими). Эти результаты показывают, что правильное использование информационных каналов может минимизировать ожидание побочных эффектов от широко обсуждаемых вакцин и препаратов против COVID-19 и других заболеваний. Пандемия COVID-19 также изменила восприятие хронических симптомов во время карантина: внимание сместилось с хронической боли на тревогу и депрессию, что подчеркивает необходимость заботы о психическом здоровье и более комплексного контроля над болезнями и симптомами. Это согласуется с наблюдениями при «длительном COVID» — постинфекционном синдроме, который включает усталость, «туман в голове», хроническую боль и другие симптомы. Таким пациентам необходимы образовательные и реабилитационные программы, которые помогут сократить ноцебо-эффекты и способствовать восстановлению.
4.3. Этические соображения
Ноцебо-эффекты могут возникать в клинической практике и быть связаны с раскрытием информации о возможных побочных действиях назначаемого лечения. Например, предупреждение пациентов о том, что лекарство может вызвать головную боль, способно спровоцировать этот симптом независимо от фармакологических свойств препарата. Такие нежелательные ноцебо-эффекты ставят врачей перед дилеммой: с одной стороны, информирование может вызвать побочные реакции, с другой — медицинские работники обязаны предоставлять пациентам правдивую информацию, чтобы те могли принимать осознанные независимые решения о лечении.
Можно ли в рамках закона и медицинской этики пользоваться привилегией скрывать информацию? Миллер и Коллока описали этот подход как «санкционированное утаивание», которое может применяться к пациентам, не желающим знать о возможных побочных эффектах конкретного лечения. В таких случаях пациентам можно объяснить суть ноцебо-эффекта и дать возможность согласиться на отказ от получения информации о легких, временных и неопасных побочных действиях. Однако серьезные, длительные или угрожающие здоровью последствия должны раскрываться в обязательном порядке, независимо от предпочтений пациента. С этической точки зрения, процесс информированного согласия может включать оптимальные стратегии коммуникации между врачом и пациентом и эффекты фрейминга для снижения непреднамеренных ноцебо-эффектов. Медикам следует тщательно подбирать слова при информировании о побочных действиях. Вероятность нежелательных реакций можно представлять в качественной или количественной форме, чтобы скорректировать их восприятие. Например, акцент можно делать на том, что большинство пациентов не сталкивается с определенными побочными эффектами, а не на том, что их испытывает меньшинство. Тверски и Канеман продемонстрировали, что пациенты чаще соглашаются на операцию, если хирург говорит о 90 % успеха, а не о 10 % вероятности неудачи. Разные формулировки формируют разное восприятие рисков. Таким образом, правдивую информацию о побочных эффектах следует подавать в подходящем балансе объяснений пользы и вреда, учитывая отношение пациента.
Еще один предлагаемый подход — персонализация процесса информированного согласия под индивидуальные потребности пациентов, склонных к ноцебо-реакциям. Этот метод выглядит перспективным, и исследования на основе таких данных способны помочь в его реализации. Клеменс и соавт. проверили желание пациентов получать достоверную информацию о возможных побочных эффектах в двух сценарных экспериментах с участием 999 человек с хроническими заболеваниями. Когда участникам рассказывали о лечении болей в спине и связанных с ним побочных эффектах (их тяжести, частоте и продолжительности), они выражали повышенную заинтересованность в такой информации. Однако желание разбираться в побочных действиях проявлялось менее охотно, если участникам говорили, что эти эффекты слабо выражены и возникают редко.
5. ЗАКЛЮЧИТЕЛЬНЫЕ ЗАМЕЧАНИЯ И ПЕРСПЕКТИВЫ
Механистические исследования должны глубже изучить факторы, вызывающие ноцебо-эффекты в различных условиях, их фенотипы и нейробиологические основы. Это может совершенствовать результаты лечения. Восприимчивость к ноцебо зависит от множества факторов, включая генетические вариации (и потенциальную экспрессию генов), процессы обучения, а также личностные и психологические особенности. Кроме того, контекст и негативные ожидания динамически меняются, что затрудняет разработку методов выявления людей, склонных или устойчивых к ноцебо-эффектам.
Трансляционные исследования помогают преодолеть разрыв между фундаментальной наукой и клинической практикой. Вмешательства, направленные на ноцебо-факторы (например, обучение пациентов, психологическая поддержка, тренировка внимания), показали потенциал в снижении ноцебо-эффектов в клинических условиях. Однако их эффективность и применимость в реальной практике требуют дальнейшего изучения. Трансляционные исследования также могут способствовать разработке персонализированных подходов, учитывающих индивидуальные различия в восприимчивости к ноцебо. В конечном итоге, лучшее понимание механизмов ноцебо-эффектов приведет к улучшению результатов лечения и повышению качества медицинской помощи. Есть несколько рекомендаций для будущих исследований. Во-первых, изучать ноцебо-эффекты нужно в разрезе всей жизни человека, включая детство и старость. Помимо этого, необходимы исследования на животных для раскрытия молекулярных основ этих эффектов. Наконец, будущие исследования следует фокусировать на идентификации клинических фенотипов и других индивидуальных факторов, связанных с ноцебо, чтобы совершенствовать дизайн исследований. Работа в этих направлениях позволит глубже понять эффект ноцебо и его влияние на здоровье человека.
ОСНОВНЫЕ ПОЛОЖЕНИЯ
- Ноцебо-реакции — это негативные эффекты, наблюдаемые у пациентов, получающих плацебо в клинических испытаниях; они могут необоснованно усиливать симптомы и негативно влиять на отношение к лечению.
- Значительная часть пациентов (около четверти), принимающих плацебо в клинических испытаниях, прекращают участие из-за побочных эффектов, вызванных ноцебо-реакциями.
- Ноцебо-эффекты могут провоцироваться такими факторами, как маркировка препаратов и их продвижение, что влияет на исходы клинических испытаний.
- Возникновению ноцебо-эффектов способствуют негативная информация, предыдущий отрицательный опыт, влияние социума и другие механизмы, обостряющие признаки и симптомы.
- Нейровизуализационные исследования связывают ноцебо-эффекты с активацией нисходящих модуляторных систем, включающих префронтальные зоны, ствол мозга и спинной мозг.
- Важно учитывать этические аспекты ноцебо-реакций и минимизировать их в клинической практике и при коммуникации с пациентами (например, через персонально адаптированное информированное согласие).
- Образовательные и пациентоориентированные программы помогают правильно преподносить информацию о побочных эффектах, снижая влияние описаний препаратов и медиа-фона на восприятие симптомов.





