Сахарный диабет (СД) набирает обороты с начала XXI века и прочно занимает позицию одного из бичей человечества. Несмотря на то, что люди давно научились ее контролировать, ежегодно болезнь снижает качество жизни множеству людей и вызывает осложнения. И казалось, что спасения от нее нет, но на помощь пришел Китай. Вернее, его ученые. Представляем вам первый клинический отчет о лечении СД 2-го типа с применением персонализированной клеточной линии.
Дебют СД 2-го типа обычно сопровождается снижением чувствительности периферических тканей к инсулину или уменьшению его продукции островковыми клетками поджелудочной железы (ПЖ) вследствие падения их числа или потери ими специализации (дедифференцировка). Пересадка донорских островков Лангерганса приводила к облегчению течения СД, обеспечивая одновременно нефропротекцию и улучшая долгосрочную выживаемость, однако в последнее время она ограничена снижением доступности донорских органов.
При тестировании на животных моделях клеток-предшественников инсулоцитов ПЖ — одной из разновидностей человеческих полипотентных стволовых клеток (чПСК) — наблюдалось устранение гипергликемии и симптомов СД, а другие эксперименты показали возможность развития из чПСК зрелых клеток, подобных β-клеткам островков Лангерганса со сниженной секрецией инсулина, при подкожном введении в неиммуннопротекторной оболочке (то есть, без защиты от иммунитета, см. PEC-direct — прим. ред.). До данного случая попыток клинического введения полученных на основе чПСК клеточных линий не предпринималось ввиду потенциальной онкогенности и сложного процесса клеточной специализации. В предыдущих экспериментах в качестве подходящих предшественников для массового воспроизводства островковой ткани определили неонкогенные стволовые клетки эндодермы (СКЭ). Соответствующая статья описывает внутрипеченочное введение островковой ткани (ОТ), дифференцированной in vitro из аутологичных СКЭ у пациента с СД.
Пациентом был мужчина в возрасте 59 лет, 25 из которых с он жил с СД 2-го типа с терминальной стадией диабетической нефропатии, окончившейся пересадкой почки в июне 2017 года. С ноября 2019 года у пациента наблюдалось выраженное снижение гликемического контроля с показателями 3,66–14,6 ммоль/л. Средняя амплитуда гликемических экскурсий (MAGE/САГЭ) составляла 5,54 ммоль/л, а доля времени нахождения в узком целевом диапазоне (TITR) (3,9–7,8 ммоль) — 56,7 %, с ежедневными гипергликемическими (> 10,0 ммоль/л) и гипогликемическими (<3,9 ммоль/л) явлениями количеством в 0,7 и 0,3 события в сутки соответственно. ОТ в два этапа создавалась из аутогенных СКЭ в модифицированной среде, отвечающей стандарту GMP (Good Manufacturing Practice — международный стандарт качества фармацевтического производства). ОТ была свойственна идентичная естественной морфология, состав эндокринных клеток, нормы экспрессии генов и функциональность, проверенная на мышах и обезьянах с индуцированным стрептозоцином СД. Отклонений от целевой клеточной линии или опухолевых образований (за исключением иммунокомпрометированных животных) обнаружено не было.
Пациенту была проведена чрескожная чреспеченочная трансплантация ОТ с 1,2 миллионами IEQ (Islet equivalent — островковая эквивалентность) в области воротной вены. После трансплантации авторы оценивали функции эндокринной системы и СД-специфические параметры в виде глюкозотолерантного теста (ГТТ). ГТТ проводили в исходной точке, через 4, 8, 12, 16, 20, 24, 36 и 48 недель и до 116 недели. Гликемический контроль пациента осуществлялся установленной круглосуточной системой мониторинга глюкозы.
В течение 116 недель не было обнаружено антигенных маркеров в крови и опухолевых образований на МРТ верхней части живота. В ходе этого исследования осуществлялся контроль гликемических показателей, снижения применения препаратов инсулина и уровень С-пептида и инсулина, выделяемых в ответ на потребление пищи. К 32 неделе САГЭ и TITR пришли в норму для здорового организма, полностью исчезли гипо- и гипергликемические события. Препараты инсулина были полностью отменены к концу 11 недели, противодиабетические медикаменты акарбоза и метформин были отменены к концу 48 и 56 недели соответственно. Соотношение С-пептид/инсулин утроилось.
Таким образом, первая аутологичная клеточная заместительная терапия ОТ оказалась клинически эффективной у пациента с нестабильным течением СД 2-го типа с применением препаратов инсулина, вернув в норму базовые показатели секреции и гликемического контроля. Сообщения о тяжелых побочных эффектах и осложнениях после операции отсутствовали.
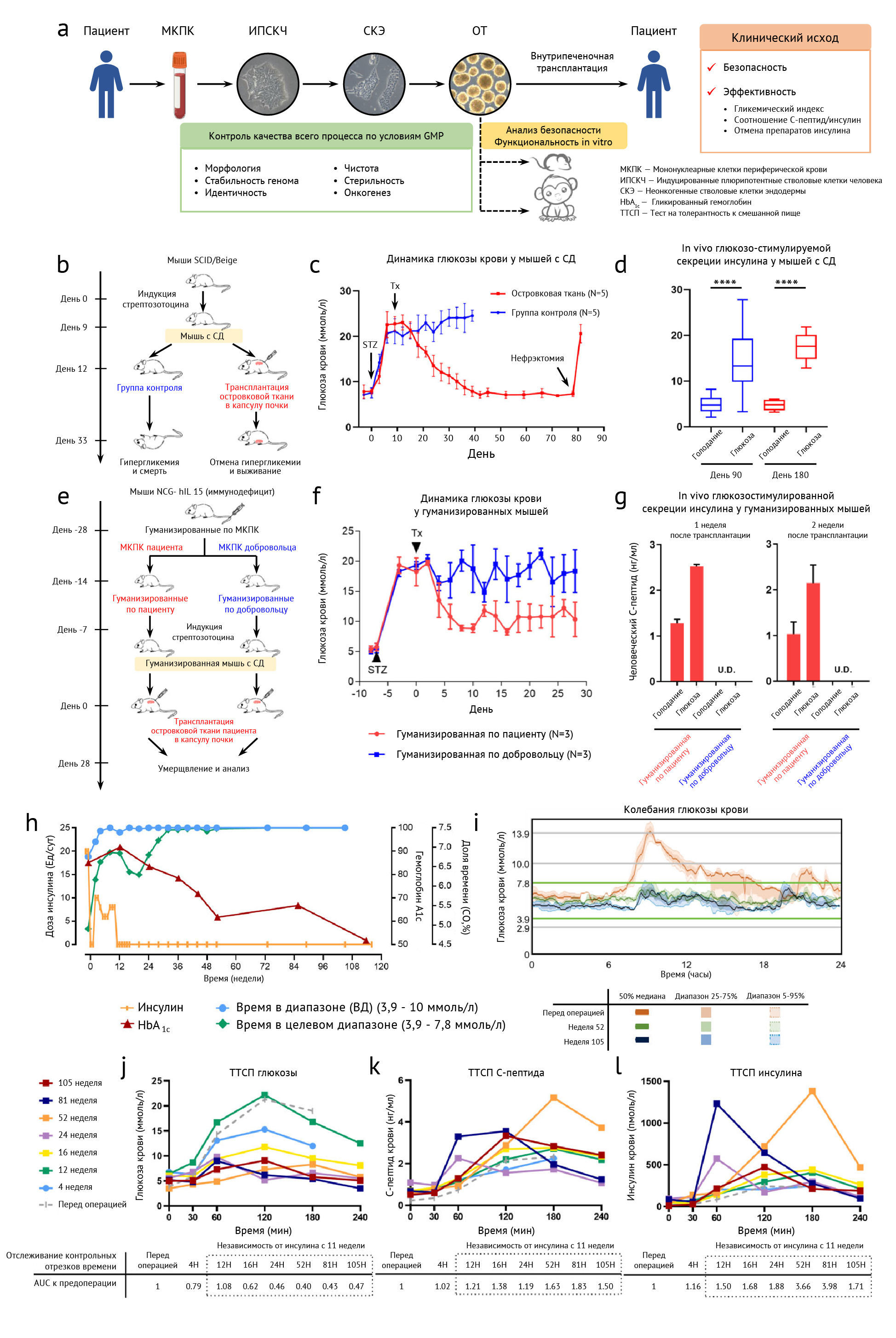
Рис. 1: Доклинические исследования и клинический исход транспланатции аутологичной ОТ пациенту с СД 2 типаa. Сводная схема главных (макро) процедур в производстве и контроле качества ОТ (отсровковой ткани) и оценки безопасности/эффективности трансплантации ОТ.b-d. ОТ редуцирует гипергликемию у иммунокомпрометированных мышей с СТЗ (стрептозоцин)-индуцированным диабетом. Схематическая транспланатции ОТ в почеченую капсулу (b). Динамика глюкозы натощак (голубая линия: группа лже-пересадки, красная линия: группа трансплантации ОТ, c.) Секреция человеческого С-пептида после голодания и 30 минут после болюсной инъекции глюкозы I.p. (перевду в контексте) на 90 т 180 день после трансплантации (d).e-g. Имунногенность ОТ в гуманизированных мышах. Схематическая иллюстрация сингенной и аллогенной трансплантации пациент-специфической ОТ в капсулу почки у гуманизированных по мононуклеарам (мононуклеарные клетки переф. крови) пациента и здоровых добровольцев мышей NCG-hIL 15 с диабетом (е).
e. Динамика гликемии (голубая линия- контрольная группа из 3 гуманизированных по мононкулеарам (МКПК) добровольцев мышей с диабетом с транспатированной ОТ пациента и ; красная линия- группа из 3 гуманизированных по мононкулеарам (МКПК) пациента мышей с диабетом и трансплантированной ОТ пациента,
f. Секреция человеческого С-пептида после голодания и последовавшие за болюсным интраперитонеального введением глюкозы на 7 и 14 дни после транспланатции ОТ. (U.D. не обнаружены, g).
h. Клинические измерения TITR (Время в целевом диапазоне), TIR (Время в диапазоне, ВД) и HbA1c и дозировок инсулина в течение 116 недель.
i. Длящиеся кишечные колебания уровня глюкозы, полученные из СМГ (суточного мониторинга глюкозы) на 52 и 105 неделях в сравнении с предоперационным периодом.
J-l. Сывороточная концентрация глюкозы при голодания и приеме пищи (j), С-пептида (k) и инсулина (l) из данных теста на толерантность к смешанной пище (ТТСП)





