Такие инструменты, как CRISPR, которые разрезают ДНК и изменяют ее последовательность, все ближе к внедрению в клиническую практику в качестве метода лечения некоторых генетических заболеваний. Но вдали от всеобщего внимания исследователи все больше интересуются альтернативой, которая оставляет последовательность ДНК неизменной. Эти молекулярные инструменты нацелены на эпигеном, химические метки, «украшающие» ДНК и окружающие ее белки, которые управляют экспрессией гена и, в конечном итоге, его поведением.
Шквал исследований, проведенных в последние несколько лет на мышах, свидетельствует о том, что редактирование эпигенома является потенциально более безопасным и гибким способом включения или выключения генов, чем редактирование ДНК. В одном примере, описанном в прошлом месяце (в мае 2022 – прим.перев.) на совещании по генной терапии в Вашингтоне, округ Колумбия, итальянская команда уменьшила экспрессию гена у мышей, чтобы на несколько месяцев снизить их уровень холестерина. Другие группы изучают редактирование эпигенома для лечения любых заболеваний — от рака до боли и болезни Гентингтона, смертельного заболевания головного мозга.
В отличие от редактирования ДНК, при котором изменения являются постоянными и могут приводить к непредвиденным результатам, эпигеномные изменения с меньшей вероятностью могут вызывать вредные побочные эффекты, а также являются обратимыми. Кроме того, они могут действовать более мягко, слегка повышая или понижая активность гена, а не запускать его на полную мощность или полностью подавлять. «Самое интересное, что с помощью этой технологии можно сделать очень много разных вещей», — говорит давний исследователь редактирования эпигенома Чарльз Герсбах (Charles Gersbach) из университета Дьюка.
Добавление или удаление химических меток на ДНК и гистоновых белках, вокруг которых она наматывается (см. рисунок), может либо заглушить ген, либо открыть доступ к соответствующей последовательности оснований ДНК (первичной структуре гена — прим.перев.) для других белков, которые «включают» ген. Некоторые лекарства от рака удаляют или добавляют эти химические метки, но их успех в качестве средств борьбы с болезнью ограничен. Одна из проблем заключается в том, что эти препараты действуют на многие гены одновременно, а не только на гены, связанные с раком, а это означает, что их действие сопровождается токсичными побочными эффектами.
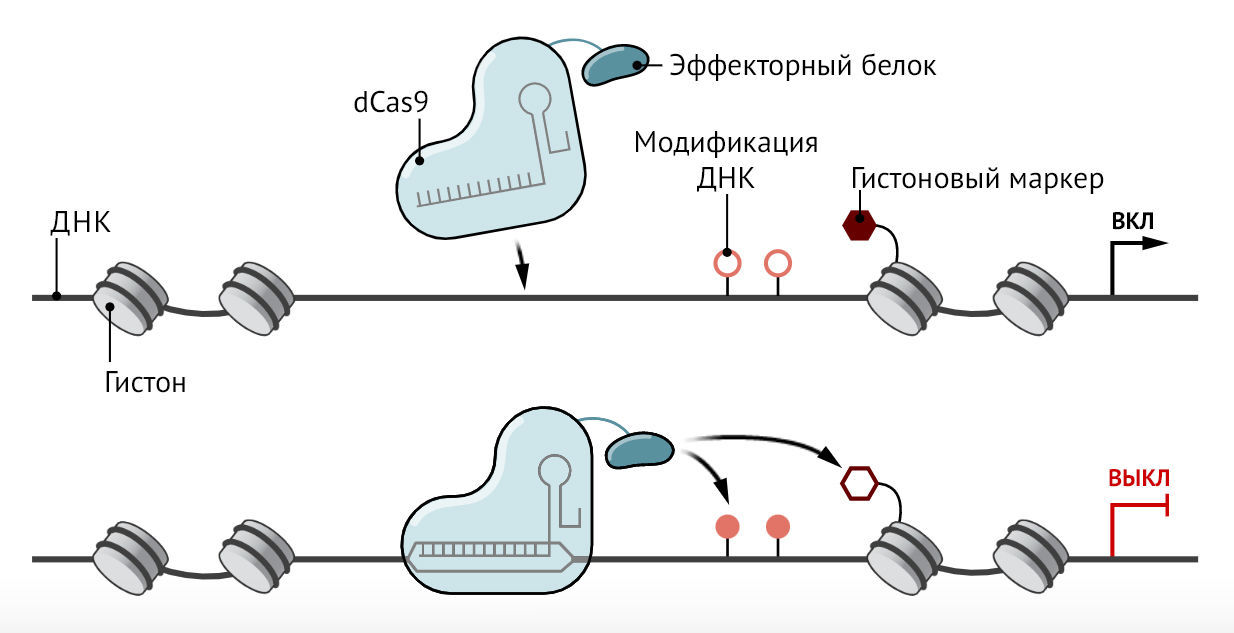
Рисунок | Установление контроляПри редактировании эпигенома инструмент редактирования генов, такой как «мертвая» версия белка CRISPR Cas9, нацеливается на ген. Затем присоединенный белок-эффектор добавляет или удаляет химические метки на ДНК и белках гистонов, вокруг которых она наматывается, повышая или снижая активность гена.
Однако редактирование эпигенома можно сделать точным, используя те же ферменты, которые клетки используют для включения и выключения своих генов. Исследователи присоединяют ключевые компоненты этих белков к белку для редактирования генов, например, к «мертвой» версии белка CRISPR Cas9, способной нацеливаться на определенное место в геноме, но не способной разрезать ДНК. Их действие может быть различным: один редактор может удалить метки с гистонов, чтобы включить ген, тогда как другой может добавить метильные группы к ДНК, чтобы заглушить его.
Два десятилетия назад биотехнологическая компания Sangamo Therapeutics, используя этот метод, разработала редактор эпигенома, который включал ген VEGF, способствующий росту кровеносных сосудов, в надежде восстановить кровоток у людей с диабетической невропатией. В ходе клинических испытаний ДНК, кодирующую редактор, вводили в мышцы ног примерно 70 пациентов, но лечение не дало положительных результатов. «Мы не смогли эффективно доставить препарат в мышечную ткань», — говорит Федор Урнов, бывший научный сотрудник Sangamo, ныне работающий в Институте инновационной геномики Калифорнийского университета в Беркли.
Поэтому компания переключилась на использование аденоассоциированного вируса (AAV) — безвредного вируса, который долгое время используется в генной терапии для эффективной доставки ДНК в клетки. Предполагалось, что белок-синтезирующий механизм клетки будет использовать ДНК, кодирующую редактор эпигенома, для обеспечения его постоянного восполнения. Эта стратегия выглядит более обнадеживающей: за последние три года Sangamo сообщила о снижении в мозге мышей уровня тау-белка, участвующего в развитии болезни Альцгеймера, а также уровня белка, вызывающего болезнь Гентингтона.
Другие исследовательские команды, работающие с мышами, используют метод доставки с использованием AAV для повышения аномально низкого уровня белка в ходе лечения наследственной формы ожирения, а также синдрома Драве — тяжелой формы эпилепсии. В прошлом году одна из команд использовала редактирование эпигенома, чтобы на несколько месяцев отключить ген, участвующий в восприятии боли, что является потенциальной альтернативой опиоидным препаратам. Другая команда недавно включила ген с помощью редактора эпигенома, доставляемого вирусом, отличным от AAV. Они вводили его молодым крысам, подвергшимся воздействию алкоголя; алкоголь подавлял активность гена, что, в свою очередь, вызывало у животных тревожность и склонность к выпивке. Редактор эпигенома вновь «включил» ген и облегчил наблюдаемые симптомы, что сообщается в майском выпуске журнала «Science Advances».
AAV, изучаемые многими группами, стоят дорого; также эти носители ДНК вместе с чужеродными белками, которые они кодируют, могут вызывать иммунный ответ. Другой недостаток заключается в том, что петля ДНК, кодирующая редактор эпигенома, постепенно утрачивается клетками при их делении.
В прошлом месяце (в мае 2022 – прим.перев.) на ежегодном собрании Американского общества генной и клеточной терапии в Вашингтоне, округ Колумбия, эксперты по редактированию генов предложили альтернативу, позволяющую избежать недостатков AAV. Ключевым шагом для группы, возглавляемой Анджело Ломбардо (Angelo Lombardo) из Института генной терапии Сан-Раффаэле Телетон, стала публикация в журнале «Cell» в 2016 году, где Ломбардо, Луиджи Нальдини и их соавторы показали, что добавление к клеткам коктейля из трех различных редакторов эпигенома подавляет экспрессию генов, и этот эффект сохраняется по мере деления клеток.
Следовательно, вместо того, чтобы полагаться на AAV как способ доставки ДНК для редакторов эпигенома и запуска их бесконечной экспрессии, исследователи могут использовать липидные наночастицы, своего рода жировые пузырьки для переноса инструкции по синтезу редакторов в виде матричной РНК (мРНК). Таким образом, клетки производят белок только в течение короткого времени, что с меньшей вероятностью вызовет иммунный ответ или внесет непредусмотренные изменения в эпигеном. Такие наночастицы считаются безопасными, особенно после применения их для доставки мРНК -вакцин от COVID-19, которые за последние два года были введены сотням миллионов людей.
Итальянской команде потребовалось еще несколько лет, чтобы их лабораторные исследования достигли успеха в испытаниях на животных. На совещании по геномике научный сотрудник Мартино Каппеллути (Martino Cappelluti) из лаборатории Ломбардо подробно рассказал, как команда вводила мышам липидные частицы, несущие мРНК, кодирующую редакторы эпигенома, которые предназначены для подавления гена PCSK9, влияющего на уровень холестерина. Стратегия сработала: одна инъекция уменьшала уровень белка PCSK9 в крови на 50 % и снижала уровень липопротеинов низкой плотности (или «плохого» холестерина), по крайней мере, на 180 дней.
«Я считаю это огромным достижением», — говорит Урнов, который надеется, что подход с использованием липидных наночастиц вскоре будет распространен и на другие генные заболевания. «Ключевым моментом здесь является то, что вам не обязательно поддерживать постоянную экспрессию редактора эпигенома», — говорит Джонатан Вайсман (Jonathan Weissman) из Института Уайтхеда. В прошлом году под руководством Вайсмана в журнале «Cell» была опубликована работа, в которой сообщалось об улучшенных редакторах эпигенома на основе CRISPR, которые вносят долгосрочные изменения.
По словам исследователей, редактирование эпигенома может быть особенно полезно для контроля более чем одного гена, поскольку при редактировании ДНК это сложно и небезопасно. Редактирование эпигенома может помочь в лечении таких заболеваний, как синдром Драве, когда у человека не вырабатывается достаточного количества необходимого белка. Подобно плавному переключателю, эта стратегия может регулировать экспрессию генов, не включая или не выключая ее полностью. Несколько новых компаний надеются коммерциализировать методы лечения с помощью редакторов эпигенома. (Герсбах и Урнов основали одну — Tune Therapeutics; Ломбардо, Налдини и Вайсман входят в число основателей другой — Chroma Medicine).
Несмотря на воодушевление, исследователи предупреждают: для того, чтобы редактирование эпигенома оказало широкое влияние, потребуется время. По словам Дэвида Сигала (David Segal), исследователя эпигенетики из Калифорнийского университета в Дэвисе, с некоторыми генами редакторы не всегда работают так, как заявлено. Отчасти это может быть связано с тем, что исследователи не совсем понимают, что именно делают редакторы, когда они проникают в клетки, как утверждает другой исследователь эпигенетики Джон Стаматояннопулос (John Stamatoyannopoulos) из Вашингтонского университета в Сиэтле. По его словам, это «черный ящик».
Тем не менее, Стаматояннопулос согласен с тем, что редактирование эпигенома имеет «огромные перспективы». Теперь исследователям необходимо точно отрегулировать свои редакторы эпигенома, опробовать их на других генах заболеваний и тканях-мишенях, а также исследовать их безопасность на более крупных животных, прежде чем переходить к людям.





