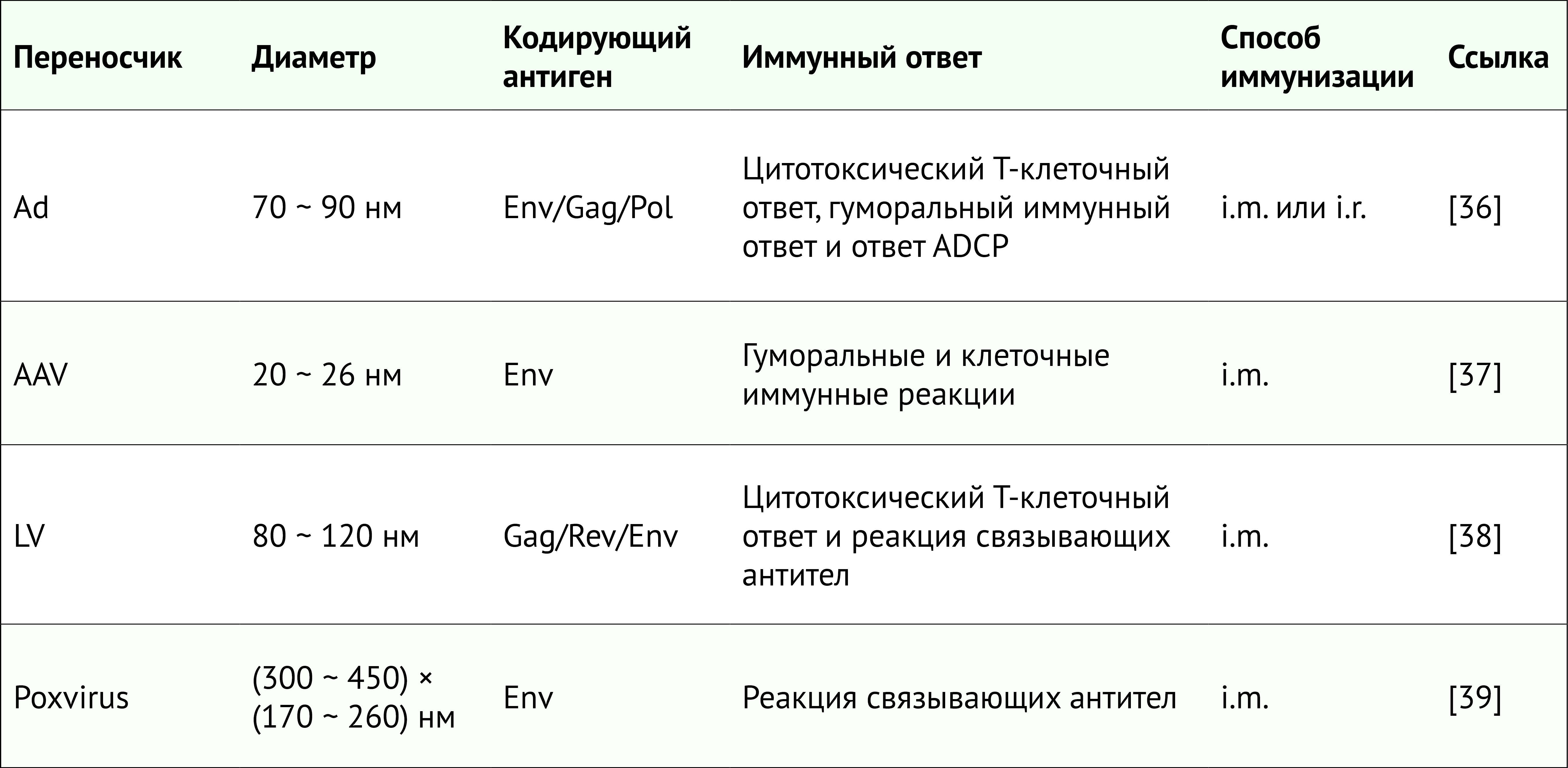
ВИЧ-1 был обнаружен в 1983 году и впоследствии было показано, что он является причиной синдрома приобретенного иммунодефицита (СПИД). В 1986 был открыт ВИЧ-2. Он менее распространен, обладает более низкой вирулентностью и не опасен для жизни. Эффективная антиретровирусная лекарственная терапия превратила СПИД из смертельного заболевания в хроническое с почти нормальной продолжительностью жизни. Тем не менее около 1,5 миллиона человек ежегодно заражаются ВИЧ-1. Эффективное лечение и профилактика ВИЧ-1 требуют строгих режимов дозирования и пожизненного приема лекарств. Кроме того, у некоторых ВИЧ-1-инфицированных лиц неизбежно происходит рецидив вируса с развитием лекарственной устойчивости [2]. Таким образом, даже при использовании антиретровирусной лекарственной терапии в качестве профилактики или лечения существует настоятельная потребность в безопасной и эффективной вакцине против ВИЧ-1.
Разработка эффективной вакцины против ВИЧ-1 является особенно сложной задачей из-за исключительного и растущего генетического разнообразия лентивируса ВИЧ-1 [3,4], его механизмов уклонения от иммунитета [5–8] и способности вируса интегрироваться в иммунные клетки хозяина, становясь устойчивым к иммунитету и схемам лечения [9–10]. После почти четырех десятилетий исследований безопасная и эффективная вакцина против ВИЧ-1 остается недостижимой.
Классические вакцины
В первом поколении вакцин, протестированных в клинических испытаниях, в качестве антигена для выработки нейтрализующих антител использовался gp120, тогда как в более поздних работах были протестированы вакцины, предназначенные для выработки ответов CD8+ Т-клеток и нейтрализующих антител[11–13]. Из восьми завершенных к настоящему времени испытаний эффективности вакцины против ВИЧ-1 все, кроме одного, завершились неудачей.
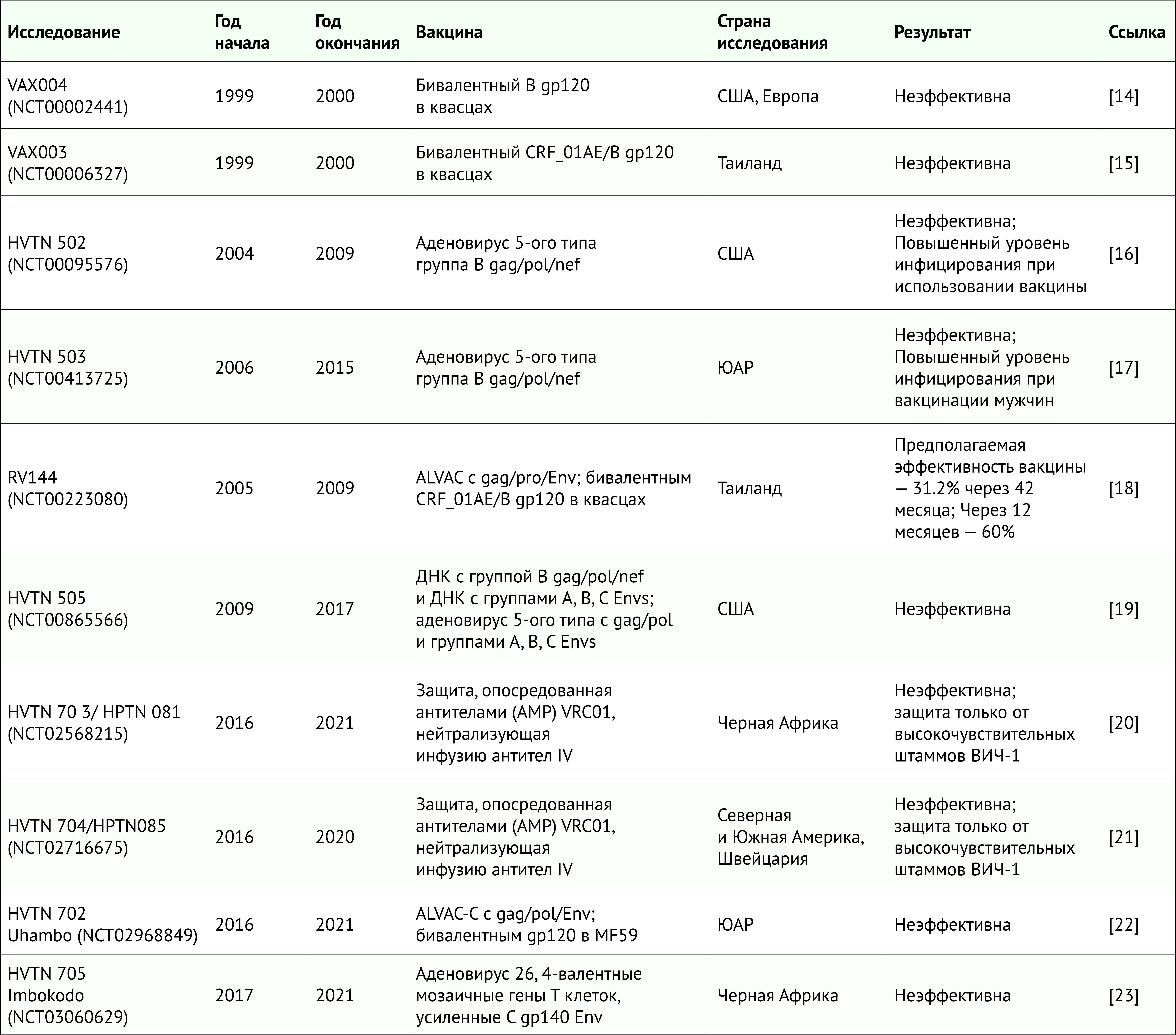
*HVTN — HIV Vaccine Trials Network, RV — ретровирус
В настоящее время наиболее успешные вакцины в клинической практике используют нейтрализующие антитела как основной способ защиты. Для разработки вакцины против ВИЧ-1 повышение индукции широко нейтрализующих антител (bNAbs) является основной целью [24]. При этом не все пациенты, инфицированные ВИЧ-1, вырабатывают необходимые для индуцированного вакциной ответа антитела bNAbs.
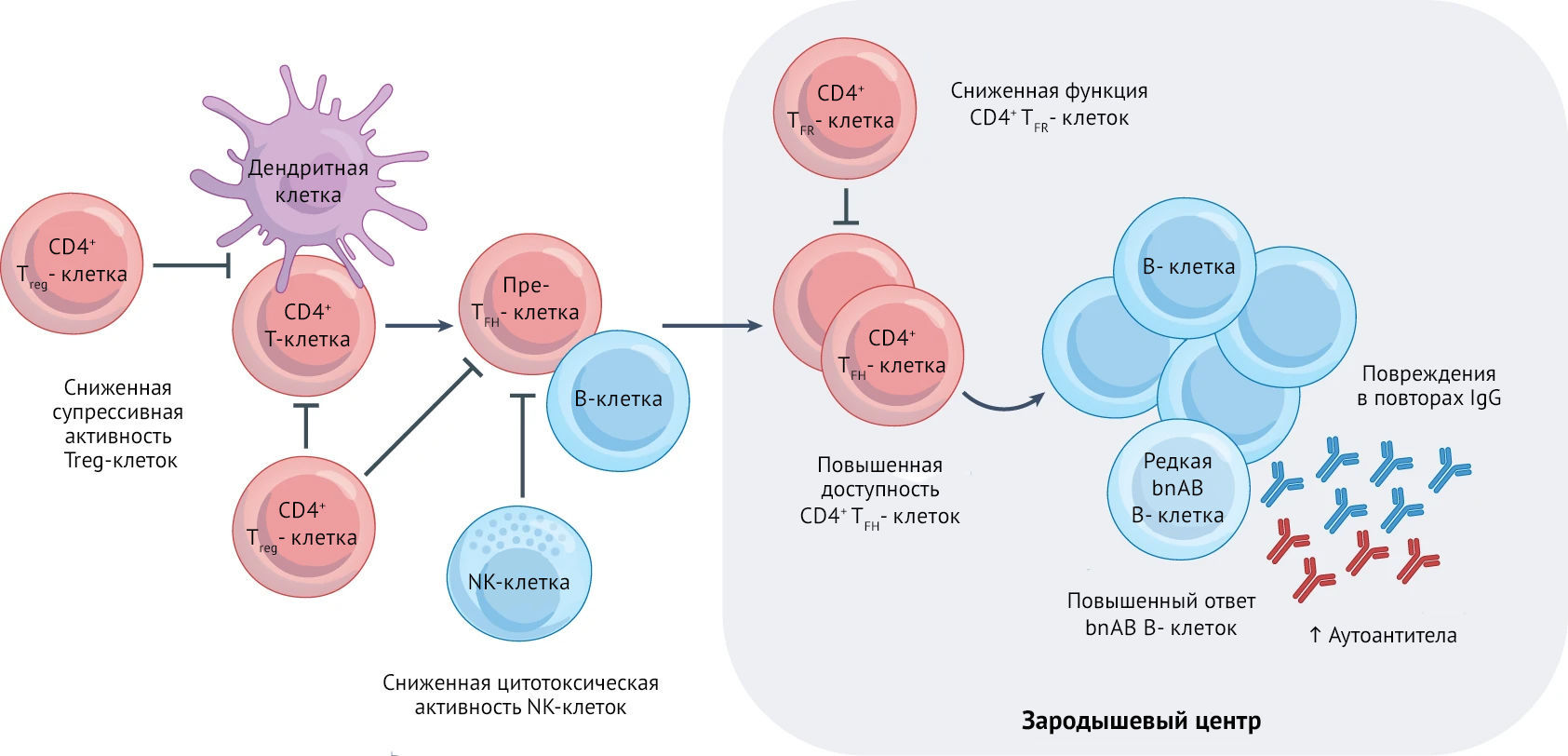
Рисунок 1. Нарушения иммунорегуляторного контроля у лиц, инфицированных ВИЧ-1, которые вырабатывают широко нейтрализующие антитела.
В исследованиях среди пациентов с ВИЧ-1 было показано, что при активной выработке bNAb пациенты имеют вирусную нагрузку от умеренной до высокой [25], а также высокий уровень циркулирующих CD4+ Т-фолликулярных хелперных клеток (TFH), низкий уровень CD4+ регуляторных Т-клеток (Treg) и циркулирующих Т-фолликулярных регуляторных клеток (TFR), высокий уровень аутоантител в плазме и низкий уровень функциональных естественных клеток-киллеров [26].Основной мишенью для bNAb является белок оболочки ВИЧ-1 (Env), который сильно гликозилирован, при этом эпитопы bNAb скрыты как высоким содержанием маннозы, так и сложными гликанами, которые слабо иммуногенны. Преодолеть эти сложности на сегодняшний день не удалось.
Испытание RV144 было единственным клиническим испытанием, продемонстрировавшим значительную защиту у людей [27]. Но получить действующую вакцину против ВИЧ-1 так и не удалось.
Нановакцины
Нановакцины могут повысить эффективность доставки антигена ВИЧ-1 и увеличить индукцию врожденных и адаптивных иммунных реакций [28].
Невирусные нановакцины
Неорганические наночастицы (железо, диоксид кремния, кальций, золото и серебро) используются в качестве носителей для нановакцины. Они подходят для доставки генов в качестве вакцин против вирусной инфекции. Большинство неорганических наночастиц обладают малым гидродинамическим размером, контролируемым образом действия, высокой антигенной нагрузкой, улучшенной стабильностью, минимальной иммунотоксичностью и гибким профилем высвобождения. Эти неорганические нановакцины могут облегчить доставку иммуногена для модуляции эффективной иммунной активации [29].
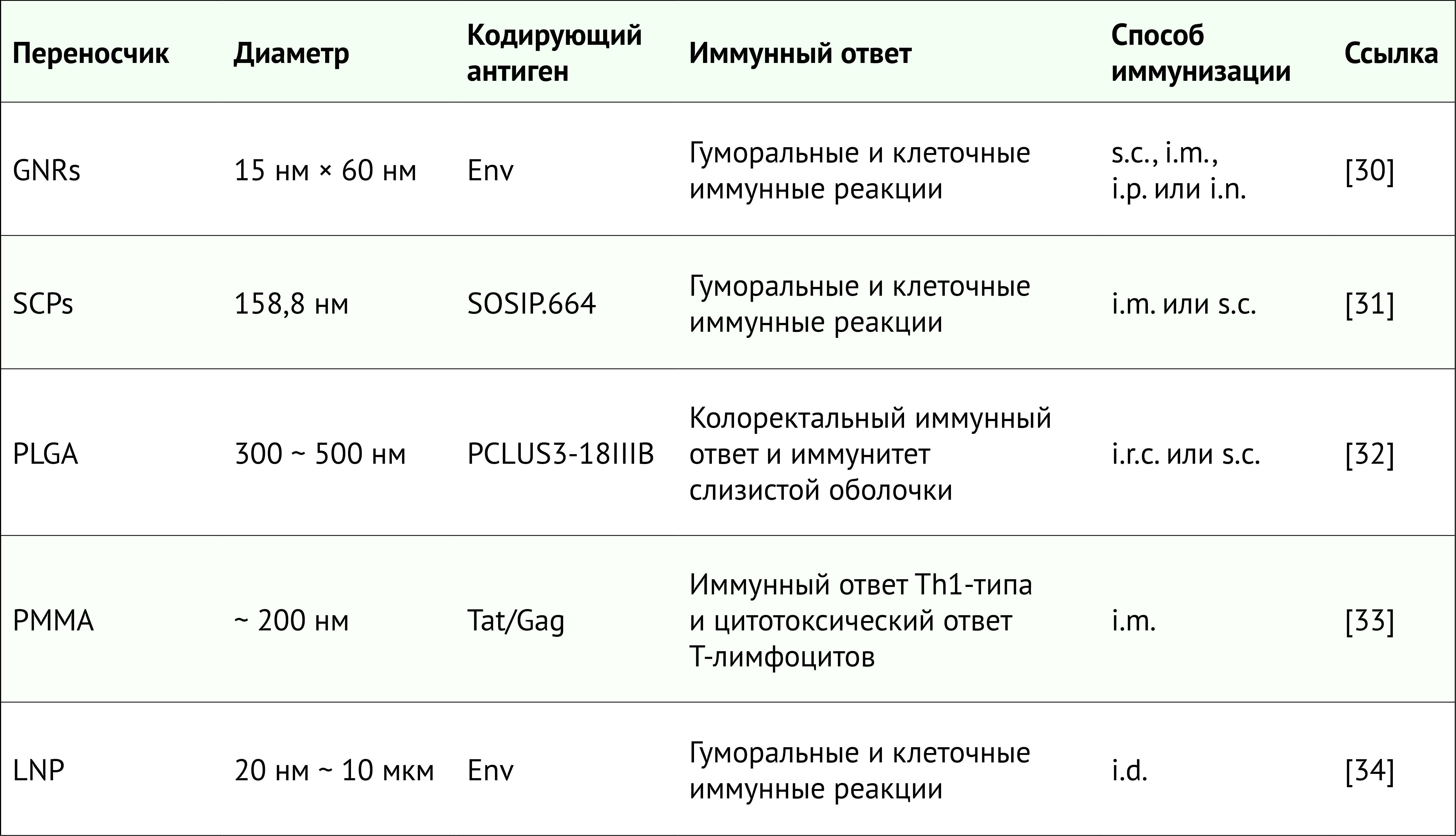
GNRs — золотые наностержни; SCP — покрытые кремнеземом наночастицы фосфата кальция; PLGA — полилактидгликолид; PMMA — полиметилметакрилат; LNP — липидные наночастицы; s.c. — подкожный; i.m. — внутримышечный; i.p. — внутрибрюшинный; i.n. — интраназальный; i.r.c. — интраколоректальный; i.d. — внутрикожно.
Нановакцины с вирусным переносом
Новые вакцины на основе вирусных переносчиков доставляют мультиплексный геном ВИЧ-1 пациенту либо самостоятельно, либо в рамках стратегии первичной стимуляции. Потенциальные преимущества нановакцин на основе вирусных переносчиков ВИЧ-1 следующие:значительная эффективность, долгосрочный иммунитет, эффективная трансдукция, высокая стабильность вакцины, крупномасштабное производство и выработка иммуногена [35]. Вирусная векторная конструкция состоит из промотора, трансгена и регуляторных элементов, которые обеспечивают упаковку в вектор. Рекомбинантный вирусный вектор используется для доставки трансгена к клеткам-мишеням. Считается, что вирусные векторы запускают интернализацию путем эндоцитоза. Вирусные частицы переносятся в ядро через ядерно-поровый комплекс. В ядре вирусная ДНК высвобождается путем снятия покрытия с последующей транскрипцией и экспортом информационной РНК для трансляции. Продукт экспрессии генов вызывает иммунные реакции, специфичные для ВИЧ-1, после высвобождения.
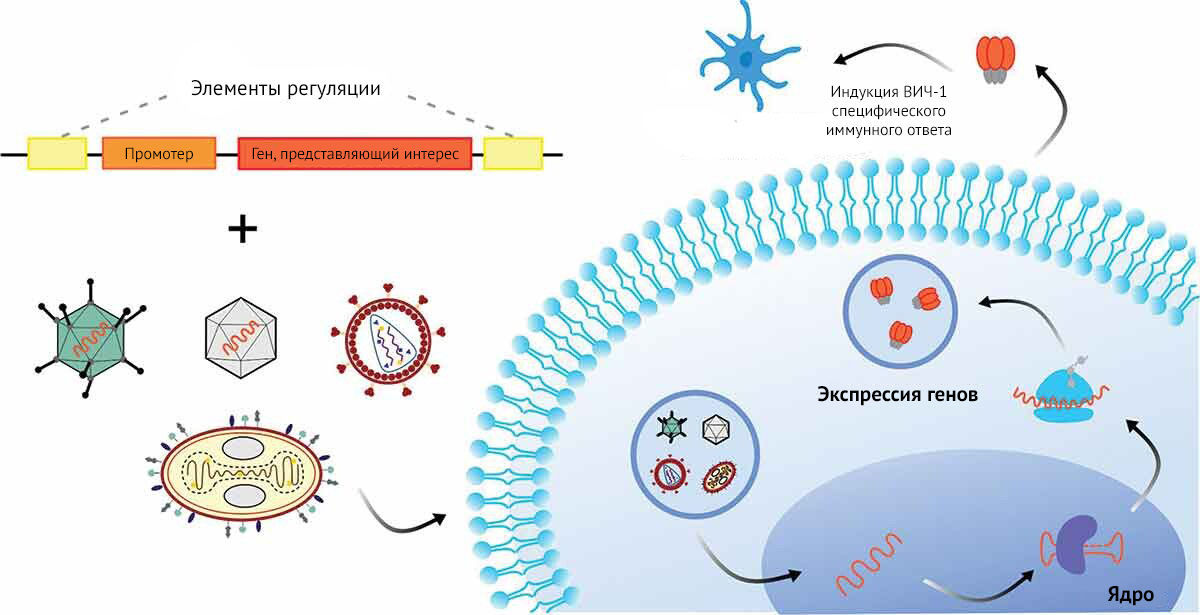
Рисунок 2. Путь трансдукции нановакцин с вирусным переносом для доставки генов против ВИЧ-1. Детали пути распространения не совсем ясны.
В настоящее время разрабатывается ряд вирусных нановакцин с использованием аденовируса, аденоассоциированного вируса, лентивируса. Сообщалось о проведении доклинических испытаний.