Страны постепенно ослабляют карантинные меры, и всё громче звучит вопрос: «А что дальше?». Будет ли новая волна эпидемии? Когда мы сможем вздохнуть спокойно — когда, наконец, появится вакцина против коронавируса? Многочисленные компании и исследовательские группы из разных стран пытаются найти ответ на этот вопрос. Следить за всеми новостями и пресс-релизами сложно, если не невозможно. На помощь приходят обзоры людей, которые пристально следят за происходящим. В данном случае речь идет о Дереке Лоу (Derek Lowe) — медицинском химике и фармакологе, который пишет в своем блоге In the pipeline («В разработке») о новостях фарминдустрии.
Этот материал — адаптированный перевод нескольких постов Дерека [1]. Мы уже переводили один из его предыдущих постов месяц назад [2]. Там Лоу описал типы вакцин, их механизмы, преимущества и недостатки, а также рассмотрел вопросы эффективности, безопасности и логистики кандидатных вакцин против коронавируса.
В этом переводе мы подробнее обсудим кандидатные вакцины, разработанные в разных компаниях и исследовательских группах. Мы узнаем, какие методы они выбирают, с какими проблемами сталкиваются и как планируют их решать. И, главное, на какие сроки испытаний мы можем рассчитывать.
Итак, о чем пишет Дерек Лоу
С публикации прошлого поста о передовых кандидатных вакцинах прошло около месяца [3]. За это время появилось много новостей, и я решил написать новый пост. Из старого можно почерпнуть общую информацию о большинстве описанных ниже проектов. Если вы его ещё не читали, он станет хорошим вступлением.
Кандидатные вакцины, что описаны ниже, я расположил в совершенно произвольном порядке. Нужно быть сумасшедшим, чтобы сейчас пытаться угадать, какие из них сработают, а какие — нет. Впрочем, мы можем быть уверены, что многие из них по той или иной причине провалятся — такова судьба большинства лекарств и вакцин. Мы также можем быть уверены, что придется пойти на сложные компромиссы, касающиеся эффективности, производства, безопасности и других вопросов. Честно говоря, я удивлюсь, если этого НЕ произойдет. Имея это в виду, начнем! (Обратите внимание, что в пункте про вакцину от J&J есть и интересные общие новости о вакцинах.)
Ad5-nCoV от компании CanSino
Несколько дней назад The Lancet опубликовал очень подробный отчет команды CanSino о первой фазе исследований своей вакцины [4]. Как видно из названия, это вирусный вектор, использующий аденовирус-5. Этот выбор, с одной стороны, ускоряет разработку, с другой — вызывает беспокойство насчет эффективности и переносимости. В этом случае аденовирус предназначен для экспрессии коронавирусного гликопротеина Spike — общей мишени для многих кандидатных вакцины. У большого числа людей уже есть антитела к этому виду аденовируса. Однако прошлые усилия по разработке подобной вакцины столкнулись с проблемой иммунной атаки на вектор, которая (как можно догадаться) может нарушить развитие иммунитета к его грузу.
Основной конечной точкой этого открытого исследования с повышением дозы были побочные эффекты на седьмой день после внутримышечной инъекции, с последующим наблюдением в течение 28 дней. Исследователи также определяли выработку нейтрализующих антител и Т-клеточный ответ. Это ценные данные, но необходимо заметить (как это и делается в статье), что, пока мы не перейдем ко второй фазе испытаний, мы не узнаем, какие ответы действительно нужны для защиты от вируса. В испытании было три дозировки, по 36 пациентов в каждой группе, с медианным возрастом 36 лет и с почти равным делением на мужчин и женщин.
75–83% пациентов в каждой группе сообщили, по крайней мере, об одной побочной реакции к седьмому дню. Как правило, это была боль в месте инъекции, иногда лихорадка, мышечные боли и т.д. Побочные реакции были сильнее при самой высокой дозе, что неудивительно. Имейте в виду, что с любым вирусным вектором вы заносите пациенту совершенно новую вирусную инфекцию — пусть и ту, что будет производить нужные антигены, а не новые вирусы. Отсюда и симптомы гриппа. Что важно, в течение 28-дневного периода исследования ни в одной группе не было замечено никаких серьезных реакций. В этом случае «серьезный» означает что-либо, что привело бы к госпитализации или возможности необратимого вреда.
Что насчет иммунного ответа? Все пациенты выработали нейтрализующие антитела и развили T-клеточный ответ (как CD4+, так и CD8+) [5]. Это хорошо: хоть мы и не знаем, какой ответ нужен, этот выглядит значительным и дозозависимым. На данном этапе этого достаточно. Когда мы получим более точные данные от других компаний, работающих над вакциной, мы сможем сравнить.
Но в данных CanSino есть и слабые места. У 44–56% участников исследования (в зависимости от группы пациентов) уже был высокий уровень нейтрализующих антител к вирусу Ad5. И, как обнаружили исследователи, это определенно помешало иммунному ответу на груз — белок Spike. Кроме того, был отмечен более низкий уровень антител у пожилых пациентов (45–60 лет, на что я скажу: «не такие уж и пожилые»). На этот факт исследователи собираются обратить особенное внимание при переходе ко второй фазе испытаний, учитывая то, насколько тяжесть заболевания увеличивается с возрастом.
Честно говоря, это ровно то, чего и следовало ожидать: реальный иммунный ответ на белок Spike, которому мешают антитела к Ad5. Много с чем предстоит разобраться, так что будем ждать вторую фазу.
ChAdOx1 nCov19 от AstraZeneka и Оксфорда
Здесь я отправлю вас к моему недавнему посту про данные, полученные на макаках резус [6]. Если кратко, вакцина не вызвала «стерилизующий иммунитет» (то есть полную защиту от инфекции). И, к сожалению, эти цифры невозможно напрямую сравнить с результатами исследований компании SinoVac.
Статья Билла Хазелтина, опубликованная в Forbes, вызвала шквал комментариев. В ней он сравнивает кандидатную вакцину группы из Оксфорда с вакциной SinoVac. Если вы помните, эти две команды независимо сообщили, что их вакцины, по-видимому, защищают макак резус от заражения коронавирусом [3]. Хазелтин критикует данные, полученные в Оксфорде, а его мнение заслуживает серьезного отношения. Итак, что происходит?
Посмотрев на препринт результатов группы из Оксфорда [7], Хазелтин поставил под сомнение утверждение, что вакцина ChAdOx1 nCoV-19 защитила обезьян от вируса (рис. 1). Исследователи проверяли наличие вирусной РНК несколькими способами. В одном из них использовали бронхоальвеолярный лаваж — метод отбора проб, при котором бронхоскоп вводят в лёгкие и промывают альвеолярные пространства. Это чертовски инвазивный анализ, поэтому вы слышите о нем нечасто по сравнению с мазком из носоглотки. В альвеолярной жидкости зараженных вирусом невакцинированных животных обнаруживали:
- геномную РНК коронавируса — в течение всего исследования;
- вирусную субгеномную РНК (лучше свидетельствует об активной репликации) — на 3 и 5 дни после воздействия.
Из вакцинированных животных геномная РНК нашлась только у двух обезьян, а субгеномная отсутствовала полностью.
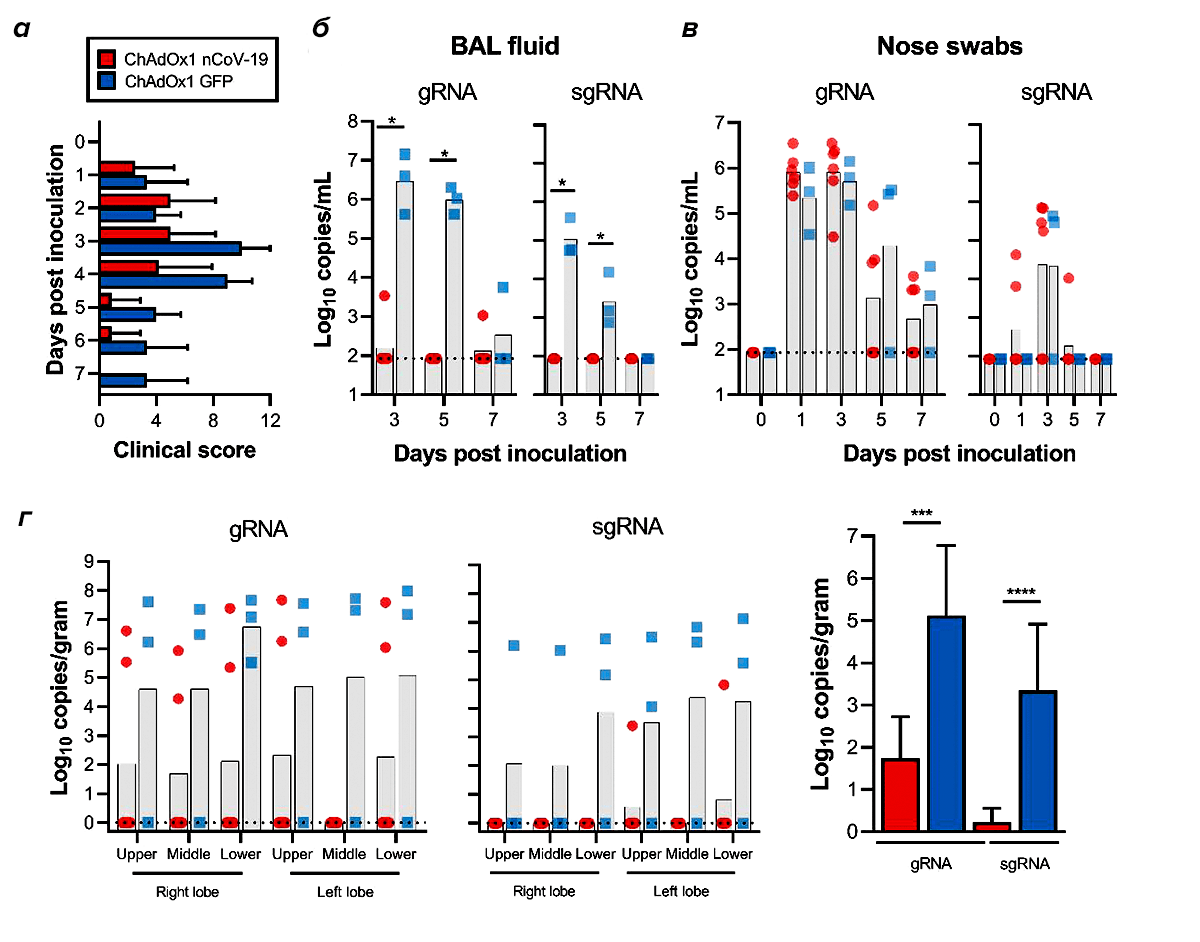
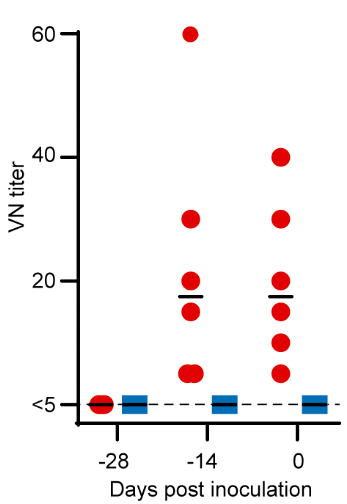
Вроде бы всё хорошо. Но и у привитых, и у непривитых обезьян при взятии образцов мазком из носоглотки нашлось одинаковое количество вирусной геномной РНК (рис. 1в). Именно этот тест используется для тестирования у людей, а, значит, вакцинированные животные должны считаться коронавирус-положительными. К тому же, как отмечает Хазелтин, количество (титр) нейтрализующих антител в крови вакцинированных животных было не так высоко. Желательно, чтобы при разбавлении образцов антител крови в сотни или даже в тысячу раз, при анализе in vitro всё равно была видна антивирусная активность. Но в исследовании Оксфорда активность начала исчезать уже примерно при 40-кратном разведении (рис. 2).
Из положительных сторон: при вскрытии у 2/3 невакцинированных животных были явные признаки вирусной пневмонии, а у вакцинированных — ни у одного. Можно сделать вывод, что вакцинированные животные были инфицированы — вакцина от этого не защищала, — но болезнь протекала гораздо менее серьезно. Это означает, что вирус вполне сможет передаваться от людей, которые привиты такой вакциной, хотя само течение болезни будет не таким смертельным. Хотелось бы иметь что-то получше. Как пишет Хазелтин: «Время покажет, является ли этот подход лучшим. Я бы на это не ставил».
Хазелтин сравнивает это с результатами испытания вакцины на основе инактивированного вируса SinoVac [8]. Та выглядит лучше: даже при самой высокой дозе вакцины вирусную РНК нельзя было найти в тканях вакцинированных животных. Такой «стерилизующий иммунитет» — как раз то, к чему мы должны стремиться. Так, если вакцинировать достаточное количество людей, вирусу просто некуда будет деться. Но стоит отметить, что результаты SinoVac получены после трех доз их вакцины (по сравнению с одной дозой вакцины из Оксфорда). К тому же у последней была примерно вдвое больше вирусная нагрузка (общее количество вирусных частиц). Оксфордская группа также прививала своих обезьян сразу и в верхние, и в нижние дыхательные пути, а команда SinoVac использовала только одну прививку — в трахее. Так что я согласен с этим твитом AndyBiotech: «Я не думаю, что такое сравнение двух вакцин справедливо. Но Хазелтин прав в том, что, судя по результатам, вакцина ChAdOx1 nCoV-19 на самом деле не защитила обезьян от инфекции».
А, может, и защитит, если вводить ее несколько раз , .
Обновление 1: конечно же, это не сработает. После введения аденовирусного вектора у вас будут нейтрализующие антитела не только к желаемому антигену, но и к аденовирусу. Есть только одна попытка.
Обновление 2: возможно, и сработает! В этом испытании исследователи собираются попробовать сделать это и посмотреть, что получится. Но нам, конечно, следует обращать внимание на график дозирования. В конце концов, мы имеем дело с вакцинацией людей по всему миру. Если нам придется вакцинировать всех дважды (скажем, с двухмесячным интервалом), это усложнит ситуацию. А если трижды, то, я думаю, мы будем серьезно рассматривать этот вариант только в случае крайней необходимости. Идеальная вакцина — это одна доза, стерилизующий иммунитет и низкий уровень побочных эффектов. Сейчас мы понятия не имеем, сможем ли мы получить такую, и единственный способ узнать — получить много-много данных на людях. Пусть победит лучшая вакцина, и пусть она действительно будет очень хорошей.
Другой новостью стало заявление Эдриана Хилла, исследователя из Оксфорда, в интервью Sunday Telegraph. Он высказал мнение, что вакцина сработает с вероятностью 50%. Это попало во все заголовки — и не сделало бы этого, живи мы в более информированном мире. Вакцины в принципе проваливают испытания приблизительно в 90% случаев. Конечно, сравнение не совсем корректно, поскольку эта цифра относится к вакцинам против всевозможных патогенных микроорганизмов, а сейчас мы рассматриваем только один из них. С другой стороны, если существует какая-то системная проблема с развитием защитного иммунитета к коронавирусу, она будет общей для всех попыток создания вакцины. (Я не думаю, что это так, но мы не можем исключить эту версию, пока не доберемся до результатов второй фазы.)
Другое замечание Хилла тоже должно быть очевидным: чтобы лучше понять, защищает ли ваша терапия людей, желательно провести испытания второй фазы в популяции, где вирус активно распространяется. Это всё труднее представить в странах, где меры общественного здравоохранения (карантины, маски, социальное дистанцирование и пр.) ограничивают передачу вируса. Возможно, нам придется бегать за вирусом из региона в регион, из страны в страну, чтобы провести лучшие испытания вакцин. А если мы, как многие боятся, снимем меры слишком рано, у нас будет полно мест для тестирования — нам просто нужно будет ждать и наблюдать. Проблема в том, что подготовка этих испытаний требует времени и организации, и трудно угадать заранее, где будут лучшие места для их проведения.
mRNA-1273 от Moderna
Здесь я также отправлю ваc к недавнему посту для более подробной информации [9].
Утром 18 мая появились новости о самых первых испытаниях на людях кандидатной мРНК-вакцины Moderna (mRNA-1273). Вот материалы Stat и Endpts — результаты обобщили довольно быстро, поскольку все они пока на уровне пресс-релиза.
В испытании добровольцам давали три дозы: 25, 100 и 250 мкг мРНК. Для начала поговорим об иммуногенности (вызывали ли эти дозы выработку антител). Хорошая новость: к 15 дню после вакцинации у каждого участника (с любой дозой) начинали вырабатываться антитела. Количество вырабатываемых антител увеличивалось по мере роста дозы, а у людей, получавших дозы в 25 и 100 мкг оно возросло после второго «бустерного» укола мРНК. (То есть уровень антител достиг максимума у добровольцев с дозой в 250 мкг уже после первой вакцинации.)
Звучит многообещающе: у всех участников был дозозависимый иммунный ответ, причем как по количеству мРНК, так и по числу прививок. В качестве сравнения компания заявила, что у 15 добровольцев из группы, получавшей самую низкую дозу (25 мкг), через две недели после второй дозы были такие же уровни связывающих антител, как в крови людей, которые выздоровели от коронавируса самостоятельно. А в группе из десяти человек, получавших среднюю дозу, уровни антител «значительно превышали» уровни, наблюдаемые у выздоровевших пациентов. Результатов остальных участников пока нет, но, видимо, скоро мы их увидим.
Всё это хорошо, но здесь измерялись только связывающие антитела. То, что мы хотим, — нейтрализующие антитела, которые не только связывают, но и полностью отключают вирус (подробнее здесь). Moderna говорит, что пока у них есть такие данные только для первых четырех участников из групп с 25 мкг и 100 мкг. Хорошая новость заключается в том, что эти результаты согласуются с данными об общем количестве связывающих антител: у всех этих людей выработались истинные нейтрализующие антитела. Компания говорит, что они были «на том же уровне или выше», чем обычно наблюдается в крови выздоровевших пациентов с коронавирусом.
А что насчет безопасности и переносимости? В группе с самой низкой дозой побочных реакций не было. В средней группе с дозой 100 мкг наблюдалась эритема третьей степени (покраснение) в месте инъекции. В группе с высокими дозами у трех участников появилась системная реакция. Компания не вдается в подробности, но, как правило, это лихорадка, симптомы гриппа и, возможно, сыпь на теле. Как сообщается в пресс-релизе, все симптомы прошли сами, и серьезных (serious) реакций не было. Это важно — язык здесь довольно точный. Serious — это термин, который означает госпитализацию, возможные долговременные последствия и т.д., в отличие от severe, который является более широким (и который «Модерна» вообще не использует в своем пресс-релизе).
Таким образом, эти результаты прояснили кое-что перед испытаниями второй фазы. Доза в 250 мкг использоваться не будет: кажется, это больше, чем необходимо, и дает больше нежелательных реакций. Компания планирует оставить дозы в 50 и 100 мкг, и первая будет испытана по протоколам первой фазы испытаний прямо сейчас. Испытания второй фазы должны скоро начаться. Их данные планируется использовать для выбора одной дозировки перед переходом к третьей фазе, которая должна начаться в июле. Она будет где-то ниже 100 мкг — посмотрим, как закончится вторая фаза.
Наверное, вы задумались, как вакцина Moderna выглядит по сравнению с вакцинами из Оксфорда и от SinoVac [6]. Мы не знаем: компания не проводила тестов с заражением макак резус. Да и, как вы можете видеть, даже если две разные организации сделали одно и то же, все равно остается много спорных моментов. Moderna проводила исследования с заражением мышей, об этом также впервые упоминается в пресс-релизе. Все, что мы знаем, — «вакцинация mRNA-1273 предотвращает репликацию вируса в легких у животных, зараженных SARS-CoV-2». Никаких дополнительных данных о дозировке, способе заражения, количестве вируса и т.д. нет. Но сообщается, что количество нейтрализующих антител, наблюдаемых у мышей, согласуется с данными, полученными на людях.
Все эти результаты я бы охарактеризовал как «ограниченные, но многообещающие». Это то, что вы ожидаете увидеть от действующей вакцины. Но у нас всё еще недостаточно информации, чтобы сказать, работает ли она и насколько хорошо. Именно для этого нужны испытания второй и третьей фаз, и ожидание их результатов и от Moderna, и от остальных компаний сделает последние дни лета и начало осени довольно интересными, не правда ли?
Moderna критикуют за то, как они выпустили свои данные, и в особенности за то, что они сделали это перед запланированной продажей своих акций. Как и люди в этой статье, я сам задаюсь вопросом, кто же покупает эти акции, учитывая неопределенность в разработке вакцин, во всей эпидемии COVID-19 и, в частности, в механизме работы мРНК-вакцин. Хотелось бы посмотреть на результаты Moderna так же обстоятельно, как в случае CanSino.
И все же я рад, что Moderna в деле. Нам нужны разные стратегии, чтобы распределить значительные риски. Конечно, мы не знаем, насколько хорошо мРНК-вакцины будут действовать на людях, но мы узнаем об этом немного раньше благодаря коронавирусу. Я бы не стал ставить на акции Moderna, но я рад, что они ставят на вирус .
Обновление от 11.06: компания подтвердила, что начнет третью фазу в июле с дозой 100 мкг, как и можно было ожидать на основе предыдущих исследований. Кроме того, компания опубликовала данные исследований на мышах.
BioNTech и Pfizer
Здесь — никаких последних новостей. Испытания продолжаются, но о результатах не слышно. Впрочем, вот хорошая обзорная статья Forbes об этом. Имейте в виду, что Pfizer и BioNTech разрабатывают сразу четыре вакцины, а не одну: они берут на себя огромные риски. Рано или поздно они получат много данных, и ожидается, что хотя бы одна из этих четырех вакцин сможет пройти дальше.
PiCoVacc от Sinovac
Насколько я вижу, здесь тоже ничего нового. Компания одной из первых предоставила данные об использовании своей кандидатной вакцины на основе инактивированного вируса на животных моделях. Но нам придется подождать данных на людях (я напишу обновление в этот пост, когда они их опубликуют). Несколько дней назад появились странные новости — пресс-релиз о том, как Sinovac получила больше финансирования для разработки вакцины. Но это всего $15 млн — смехотворная сумма по сравнению с тем, что будет потрачено любой компанией на испытания на людях. Пометьте звездочкой тех, кто передавал эту новость как полезную, — скорее всего, они в этой теме не разбираются.
Sinofarm и Уханьский институт биопрепаратов
Еще один кандидат с инактивированным вирусом. Последние новости говорят о том, что 96 пациентов в трех возрастных группах прошли первую фазу, и вакцина перешла во вторую. Однако новости уже около месяца — пожалуй, это самая тихая из всех разработок вакцины. Интересно, изменится ли это?
INO-4800 от Inovio
Компания недавно опубликовала статью о результатах применения своей кандидатной ДНК-вакцины на мышах и морских свинках [10]. Результаты выглядят неплохо, но они говорят только об иммуногенности. Наблюдается активная выработка антител, но у нас пока нет данных о процессе вирусного заражения на животных моделях и об иммуногенности или переносимости вакцины у людей. Компания заявила, что ожидает получить данные в июне, а руководитель ее отдела R&D довольно неофициально рассказал Reuters, что пока они не видят никаких сигналов, что вакцина небезопасна для людей.
Johnson&Johnson (Jannsen Pharmaceutica)
За последние пару недель не появилось никаких новостей о кандидатной вакцине на основе аденовируса Ad26 от J&J. В этой вакцине, как и в кандидате из Оксфорда, используется тип аденовируса, с которым люди в основном не сталкиваются. Так исследователи хотят избежать проблем вакцины CanSino Ad5 (см. выше). Конечно, всё это должно быть доказано в клинических испытаниях.
Тем временем лаборатория Barouch в Гарварде (разработчики платформы Ad26) опубликовала статью с длинным списком соавторов, в том числе сотрудников J&J [11]. В ней рассматриваются несколько ДНК-вакцин против коронавируса, использованных на макаках резус. Насколько мне известно, это первый подробный обзор их использования в такой модели. Исследователи провели большую работу. Они испробовали шесть вариантов ДНК:
- Кодирующую полноразмерный белок Spike.
- Без цитоплазматической «хвостовой» области.
- Без хвостовой части и трансмембранного домена (то есть только наружняя часть Spike).
- Только с S1-доменом Spike и меткой тримеризации.
- Только с областью RBD (рецептор-связывающего домена) и меткой тримеризации.
- Довольно сложно сконструированный вариант с делецией сайта расщепления фурином и двумя введенными пролиновыми мутациями (вместе с меткой тримеризации) — для того, чтобы сделать полученный белок более стабильным.
Каждый из вариантов дал разный ответ по титру и типу выработанных антител. Варианты 3 и 6 были похожи больше всего, а 5 сильнее всех отличался от других (рис. 3).
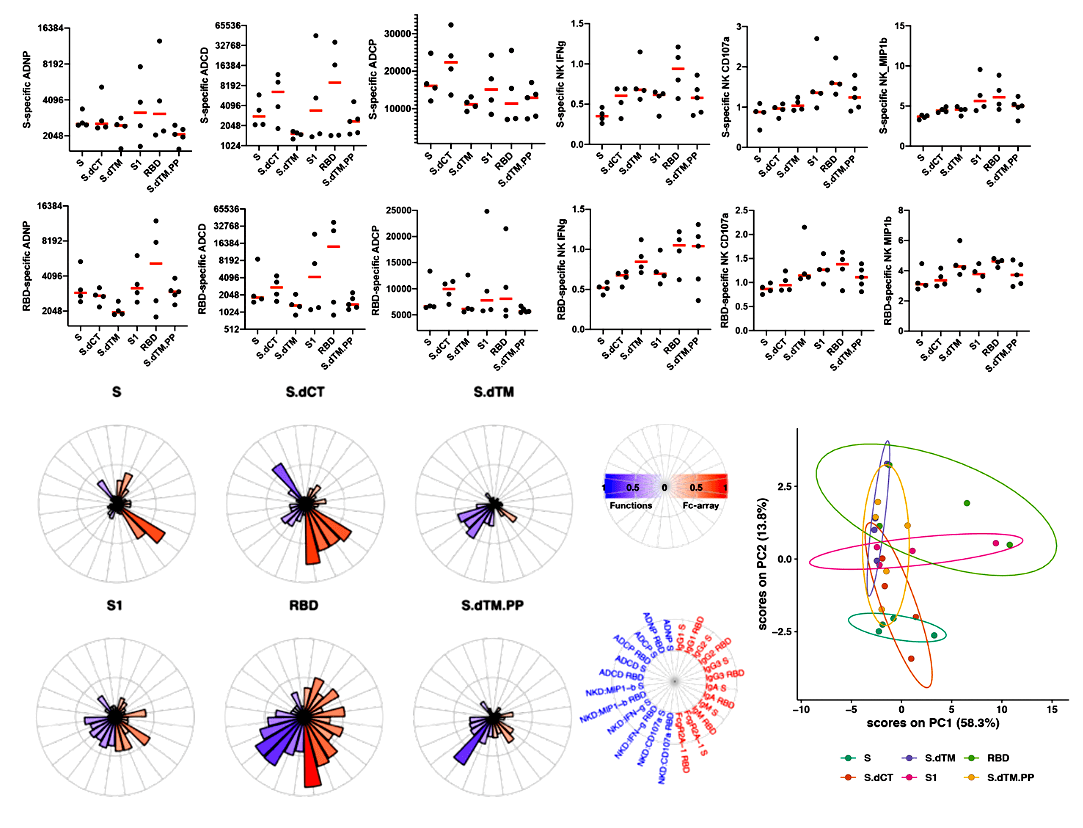
Исследователи также изучили Т-клеточный ответ: более короткие конструкции демонстрировали более слабую активность. Через три недели животным давали бустерную дозу, а еще через три заражали живым коронавирусом. На рисунке 4 показаны результаты (наличие вирусной мРНК проверяли в мазке из носоглотки и в альвеолярной жидкости). Все шесть вариантов были эффективными, между ними не было больших различий. Но всё же обычный белок Spike (1) и RBD (5) были самыми сильными, а дестабилизированный более короткий вариант (3) — самым слабым. Скорее всего, это хорошо, поскольку основные кандидатные вакцины в клинических испытаниях — как раз с использованием Spike и RBD.
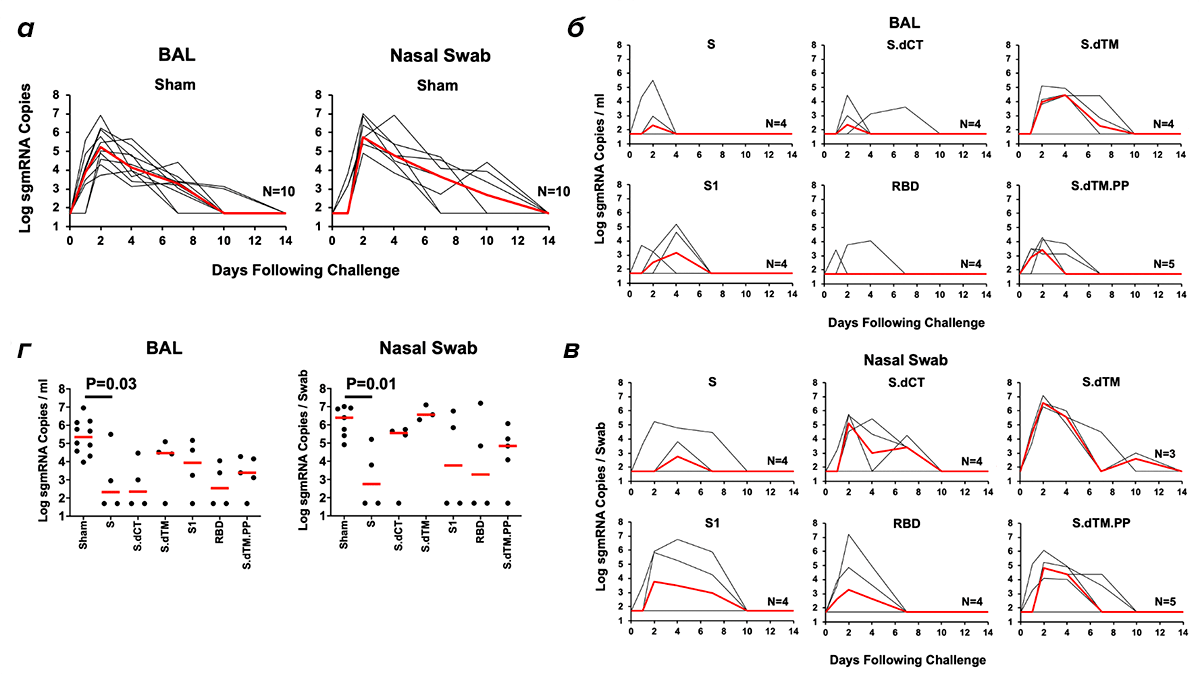
Еще группа смотрела, какие маркеры и тесты лучше всего соотносятся с фактической защитой от заражения вирусом. Интересно, что уровни CD4+ или CD8+ не были надежными показателями. Данные, полученные из альвеолярной жидкости, были лучше, чем из мазка из носоглотки — вероятно, из-за большей вариабельности последнего. В целом, лучшим показателем был титр нейтрализующих антител. Большинство животных в этом исследовании (как и в случае с оксфордской вакциной, см. выше) не приобрели стерилизующий иммунитет: они всё же заразились, но болезнь протекала легче, чем у непривитых животных. У тех, кто был защищен полностью, были и значительно более высокие титры нейтрализующих антител. Кажется, этот показатель — то, что нам нужно, и нам надо будет помнить об этом, когда накопятся данные на людях.
Sanofi / GSK
Из того, что я вижу, никаких последних новостей и об этом сотрудничестве. Но это изменится!
Novavax
Я писал об этих ребятах в недавнем посте — они работают над рекомбинантной белковой вакциной [12].
На прошлой неделе компания Novavax попала в заголовки новостей, когда Международная коалиция за инновации в области обеспечения готовности к эпидемиям (CEPI) дала ей грант в размере $384 млн на разработку кандидатной вакцины NVX-CoV2373. У компании уже есть некоторая история: грант от Фонда Гейтса позволил им довести кандидатную вакцину против респираторно-синцитиального вируса (RSV) (ResVax) до испытаний на людях. Но вакцина не показала эффективности в третьей фазе испытаний в конце 2016 года. Такое происходит удручающе часто, и надо быть готовыми к тому, что это будет происходить и в испытаниях вакцин против коронавируса (поэтому я рад, что сейчас разрабатывается так много кандидатов). Но в марте этого года Novavax сообщила об успешном завершении третьей фазы испытаний вакцины против сезонного гриппа. Поэтому сейчас они (и их технологии, включая собственный запатентованный адъювант) находятся в лучшей форме.
NVX-CoV2373 — это рекомбинантная вирусная белковая вакцина: они используют обычный метод производства белка с использованием клеток насекомых (Sf9), которые генетически модифицированы бакуловирусной инфекцией. Это довольно надежная платформа. Она используется в исследовательских организациях по всему миру, и есть несколько коммерческих вариантов, доработанных для повышения эффективности и выхода. Давно ожидалось, что подобные вещи захватят область вакцин на основе фрагментов вирусных белков. Так что посмотрим, ускорит ли кризис этот процесс.
Сейчас известно, что компания Novavax набрала первых пациентов в исследования первой/второй фаз. Что ж, удачи им!
Обновление от 11.06: компания сообщила, что в исследовании на приматах обнаруживается очень высокий титр антител, и они считают это следствием использования собственного адъюванта. Как сказано в статье, прямое сравнение с другими исследованиями на приматах невозможно, но результаты интересные. Также компания расширяет производственные мощности.
Конечно, это привело к росту стоимости акций компании, как и всех остальных в этой сфере. Просто подчеркну еще раз, что, на мой взгляд, играть с вакциной против коронавируса в вашем портфеле акций — очень плохая идея. Всё будет очень быстро и сильно меняться, и большинство кандидатов проиграет. Нам нужно гораздо больше данных на людях, чтобы получить хоть какое-то представление о том, какие из них могут сработать. Каждая новая волна новостей летом и осенью будет хаотично бросать оценки в ту или иную сторону. Если это соответствует вашему стилю инвестирования — отлично! Но я предупреждал.
Merck
Наконец, Merck вышел из тени со своими новостями о вакцине. Они покупают Themis, компанию из Вены, которая работает над ослабленной формой вируса кори человека в качестве вектора для доставки вакцины (она используется и в качестве собственно вакцины против кори). Планируется, что испытания на людях кандидатной вакцины с этой технологией начнутся «через несколько недель», вероятно, во Франции.
В том же посте, где я упомянул Novavax, я говорил о векторе VSV, который был успешен в вакцине против вируса Эбола [12].
Пример относительно новой технологии, которую используют на людях, — платформа вируса везикулярного стоматита (VSV). Она использовалась для создания вакцины против лихорадки Эбола — той, что производит компания Merck. У Stat есть отличная статья, написанная в начале этого года, которая рассказывает, как эта вакцина была сделана. Ее стоит почитать как ради самой истории, так и для обзора взлетов и падений создания вакцин в целом. Команда из Йеля, которая работала над созданием той вакцины, до этого уже разработала многообещающую кандидатную вакцину против коронавируса SARS. И сейчас они используют полученные уроки в своей текущей работе. Некоторые из кандидатных вакцин против SARS-CoV-2 используют аденовирусные векторы. По сути, эта вакцина — то же самое, только с использованием VSV — вируса, который поражает домашний скот, — вместо аденовирусов человека или приматов. Я не знаю, сотрудничает ли с кем-то команда из Йеля, но я должен упомянуть их дочернюю компанию — CaroGen. У нее есть еще одна разработанная вирусная платформа, которая также используется против SARS-CoV-2. Эти проекты ждут одобрения FDA, чтобы начать проводить первую фазу клинических испытаний, но пока об этом ничего не слышно.
Merck объявил, что они также работают с IAVI — некоммерческой организацией, которая использует VSV в вакцине против ВИЧ, и планируют попробовать его в вакцине против коронавируса. Похоже, в Merck приняли решение сосредоточиться на вирусных векторах, а не на мРНК, рекомбинантных белках и т.д., полагая, что это лучшее решение в плане потенциального иммунного ответа. Увидим в клинических испытаниях!
British American Tobacco
Есть несколько способов получения белковых антигенов для вакцин. Один из них существует уже много лет и заключается в использовании растений, в частности, табака. Вирус табачной мозаики (TMV) много лет изучается как модельная система и используется, чтобы модифицировать растение для получения желаемого белка. Как и в случае с клетками насекомых, здесь есть преимущество — система, в которой нет никаких человеческих патогенов. Табак также хорош тем, что с ним можно добиться хорошего выхода белка в листьях растений и облегчить очистку. Да и выращивать растения проще, чем клеточные культуры. Изучением этого занимается биотехнологическое подразделение «Бритиш американ тобакко» (BAT) в Кентукки. Недавно они объявили, что их кандидатная вакцина готова к началу первой фазы испытаний на людях. BAT надеются начать в конце июня, и они — не единственная табачная компания, которая посматривает на эту идею. Некоторые читатели могут вспомнить, что идея производства белка в табаке использовалась во время эпидемии лихорадки Эбола для производства коктейля моноклональных антител (ZMapp). Эта идея не сработала, но вовсе не из-за метода производства.
Таково текущее положение дел. Я буду и дальше следить за новостями. А новости будут — в этом-то я уверен…
P.S. «Биомолекула» о ситуации с вакцинами в России
По информации с сайта ВОЗ от 22 июня 2020 года, в России две вакцины, разработанные Национальным исследовательским центром эпидемиологии и микробиологии им. Н. Гамалеи, находятся в клинических исследованиях фазы 1/2. Обе вакцины представляют собой аденовирусный вектор, несущий ген S-белка SARS-CoV-2 и различаются тем, что одна выпускается в лиофилизованной (высушенной) форме, а вторая — нет.
Ранее сообщалось о введении этой вакцины сотрудникам института до проведения доклинических исследований и выдачи разрешения на клинические исследования. Этот инцидент был резко раскритикован независимыми экспертами, в частности, Ассоциация организаций по клиническим исследованиям (АОКИ) заявила, что «речь идет о грубом нарушении самых основ проведения клинических исследований, российского законодательства и общепризнанных международных норм».
2 июня разработчики заявили, что собираются получить регистрацию в РФ в августе 2020 г. Как видно из переведенной нами статьи, за это время невозможно ни доказать безопасность и эффективность вакцины, ни обеспечить качественное надежное производство в масштабах, необходимых для регистрации. Как мы видели, мировые лидеры вакцинной гонки не обещают вакцину раньше первого квартала 2021 года, и то эти сроки многим кажутся сверхоптимистичными.
Разработчики из института им. Н. Гамалеи апеллируют к своему предыдущему опыту создания вакцин, однако у мировых лидеров — AstraZeneca, GSK, Sanofi, J&J — он, мягко говоря, не меньше. А новый коронавирус достаточно сильно отличается от MERS и вируса Эбола, чтобы нельзя было переносить данные экспериментов с одного вируса на другой и давать прогнозы относительно защиты на два года.
Всего на сайте ВОЗ приводится 13 кандидатов в клинической стадии и 129 кандидатов в доклинической. Из этих 129 в России разрабатывают вакцины:
- НПО «Вектор» (субъединичную и пептидную вакцины и вакцины на основе вирусов кори, везикулярного стоматита и гриппа, а также РНК-вакцину); планирует начать клинические исследования одного из кандидатов в конце июня;
- Санкт-Петербургский институт вакцин и сывороток (наночастицы с рекомбинантными белками вируса);
- МГУ (на основе вируса табачной мозаики);
- «Биокад» (одну на основе вируса гриппа и другую на основе инкапсулированных в липосомы РНК); планирует начать клинические исследования в августе.
Из российских организаций, не попавших в список ВОЗ:
- о начале разработке ДНК-вакцины сообщает Казанский университет;
- над созданием цельновирионной инактивированной (с искусственно ослабленными вирусами) вакцины работает Федеральный научный центр исследований и разработки иммунобиологических препаратов им. М.П. Чумакова; планируют завершить клинические исследования в январе 2021 года;
- НИИ гриппа им. А.А. Смородинцева в Санкт-Петербурге разрабатывает три разновидности вакцины.
Источник:Биомолекула