Acinetobacter baumannii — опасный противник. Известный своей устойчивостью к высыханию, истощению запаса питательных веществ и дезинфектантам, A. baumannii тяжело поддается уничтожению, когда бактерия приживается на медицинских объектах [1]. Способный избегать воздействия многих антибиотиков, A. baumannii представляет серьезную проблему для врачей и медперсонала, которые лечат зараженных пациентов и ухаживают за ними [2]. Всемирной организацией здравоохранения эта угроза признана, а A. baumannii получил статус важнейшего приоритета для исследований и разработки новых противомикробных препаратов [3]. В статье «Устойчивые к бактериофагам Acinetobacter baumannii получили повторную чувствительность к противомикробным препаратам» авторами продемонстрировано, что фаги могут дать второе дыхание для применения антибиотиков, которые уже есть в распоряжении врачей.
Идея, лежащая в основе этого проекта, возникла после того, как первый автор, Джереми Барр, ныне заведующий лабораторией в Школе биологических наук университета Монаша в Австралии, принял участие в первом клинически успешном применении фаговой терапии против системного A. baumannii, зарегистрированного в США [4, 5]. После последовательного приема смесей фагов командой ученых были осуществлены три, казалось бы, не связанных между собой наблюдения. Во-первых, изолят A. baumannii, полученный от пациента, приобрел устойчивость к смеси фагов. Во-вторых, он потерял устойчивость к антибиотику миноциклину. В-третьих, было выявлено, что бактерии потеряли полисахаридную капсулу. Могут ли быть связаны эти обнаруженные явления? И если да, то как? Это и стало отправной точкой в исследовании ученых.
Чтобы собрать вместе детали головоломки, ученые использовали два филогенетически отдаленных клинических штамма A. baumannii
и два разных бактериофага, выделенных из неочищенных сточных вод. Как
сказал один из авторов, Фернандо Гордиллио Альтамирано, эта работа
является свидетельством того, как часто его любовь к микробиологии
подвергалась проверке на прочность при работе с образцами неочищенных
сточных вод (их помещали в инкубатор на ночь, добавляя в пробирки
богатую питательными веществами среду). Фернандо Альтамирано приносит
коллегам свои извинения за то, что запах смесей из сточных вод часто
вынуждал их покидать лабораторию. Выделение фагов может оказаться
сложной задачей, и, похоже, Фернандо Альтамирано положил начало
тенденции в качестве награды в их исследовательской лаборатории давать
фагам имена людей, которые их выделяют. В статье присутствуют
изображения фагов øFG02 (Фернандо Альтамирано) и øCO01 (Коди Оливьера).
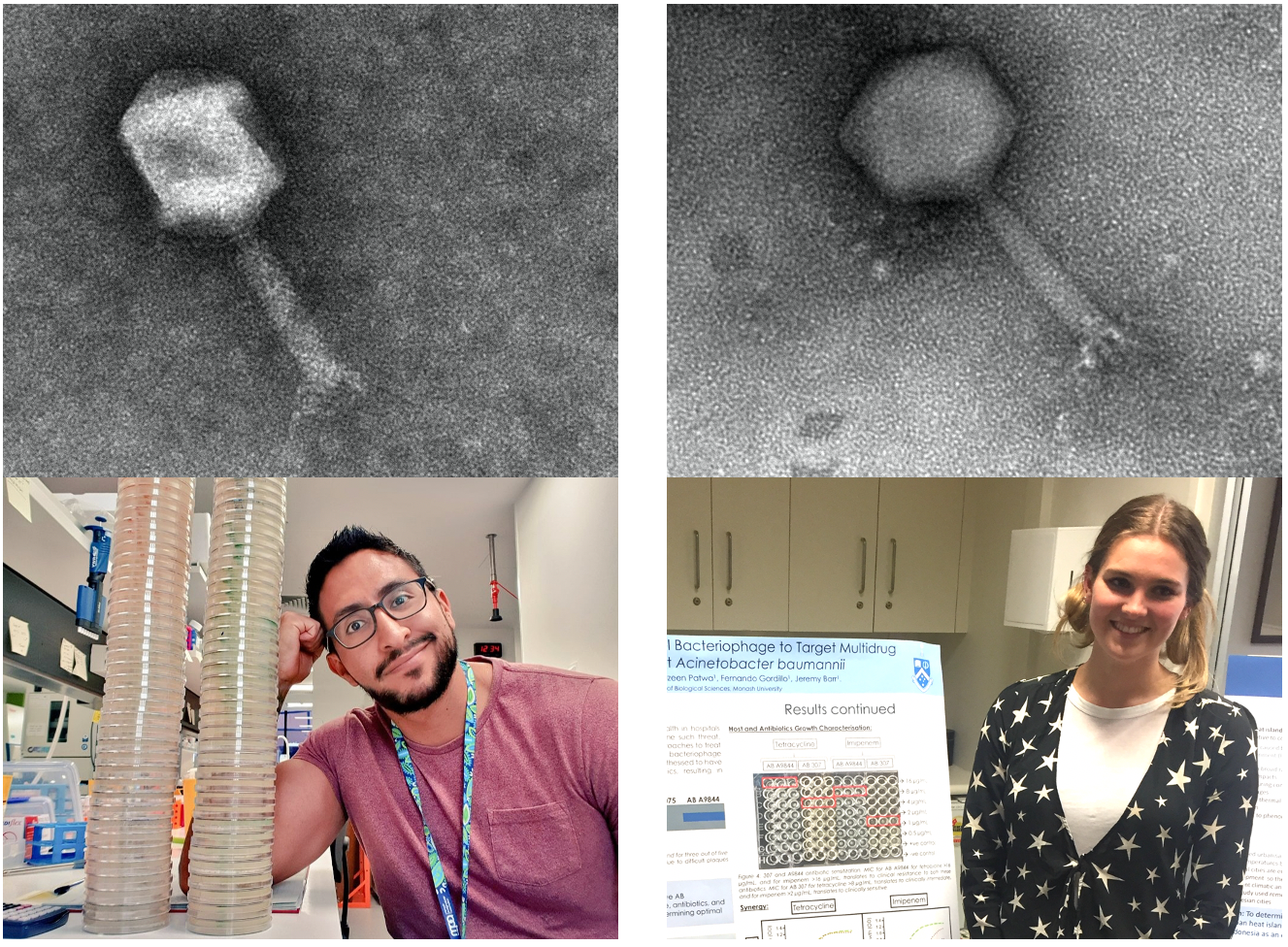
Рисунок 1 | Бактериофаги в исследовании ученых и их гордые первооткрыватели Фаг øFG02 и Фернандо Гордилло Альтамирано (слева), фаг øCO01 и Коди Оливьера (справа). Трансмиссионная электронная микрофотография Дениса Корнеева.
Исследователи обнаружили, что открытые ими фаги используют полисахаридные молекулы капсулы A. baumannii в качестве своего основного рецептора. Ученые пришли к такому выводу после наблюдения следующего:
- в попытке избежать киллинга выделенными фагами штаммы A. baumannii эволюционировали в неинкапсулированную форму;
- у этих устойчивых к фагам мутантов были мутации потери функции в генах, ответственных за образование капсулы;
- этот фенотип бактерии был воспроизведен, когда ученые провели нокаут генов из штаммов дикого типа;
- выделенные фаги не могли прикрепиться к этим мутантам.
То, что казалось простым процессом, на самом деле оказалось самым сложным шагом в исследовании. Ученые выявили, что с бактерией A. baumannii
сложно проводить генетические манипуляции, а многочисленные попытки
трансформации (естественной, химической и электропорацией) оказались
безуспешными. Успешные же попытки экспериментов ученые связывают с
фактором везения и настойчивостью соавторов Джона Форсайта и Рузин
Патва.
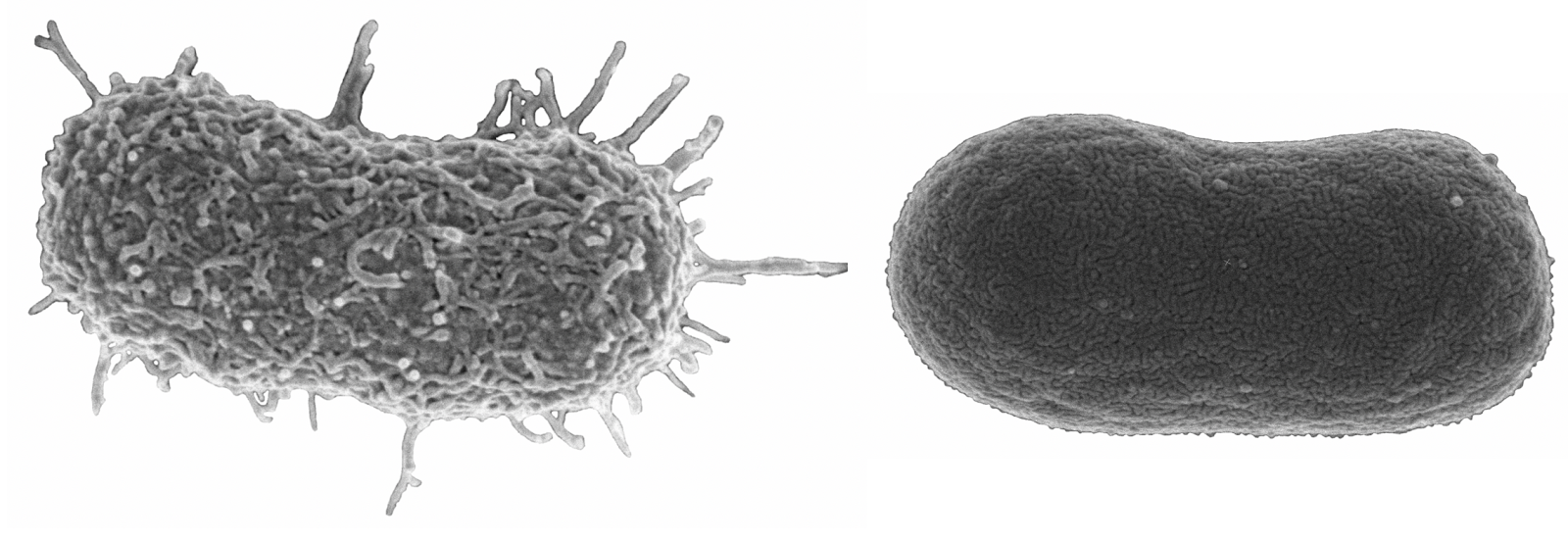
Рисунок 2 | Снимки сканирующей электронной микроскопии (СЭМ) дикого типа (слева) и устойчивого к фагам (справа) Acinetobacter baumannii Обращает на себя внимание сложная полисахаридная капсула дикого типа, которая отсутствует у устойчивой к фагу бактериальной клетки. Ученые продемонстрировали, что фаги øFG02 и øCO01 используют эту капсулу в качестве рецептора. Не покрытый капсулой, устойчивый к фагам A. baumannii вновь чувствителен к противомикробным препаратам. Фото: Денис Корнеев.
Бактериальная капсула — основной фактор вирулентности A. baumannii, защищающий ее от иммунной системы, снижая проницаемость для антибиотиков [6]. Опираясь на фактические сведения, ученые полагают, что толстая капсула исследуемых штаммов дикого типа также играет роль в их очень низкой степени трансформации. В любом случае, исследователи были взволнованы, узнав, что капсуло-дефицитный, устойчивый к фагам A. baumannii стал повторно чувствительным к системе комплемента человека и пострадал от снижения до минимальных ингибирующих концентраций семи антибиотиков, в первую очередь β-лактамов, но также и миноциклина. Выделенные учеными фаги поставили A. baumannii перед дилеммой: умереть от фага или от антибиотика. Результаты исследования подчеркивают важность для терапии идентификации бактериальных рецепторов, которые используются любым фагами; они также вдохновили ученых на статью о перспективах, в которой они размышляют на эту тему [7].
Только в течение последнего десятилетия среди патогенных штаммов микробов, таких как Pseudomonas aeruginosa [8], Enterococcus faecalis [9], Staphylococcus aureus [10] и Klebsiella pneumoniae [11], было выявлено подобное взаимодействие между механизмами устойчивости к фагам и бактериальной адаптацией. Авторы данной работы добавляют в этот список бактерий A. baumannii, что еще раз подчеркивает многогранный потенциал фаговой терапии в борьбе с антибиотикорезистентностью.