В дополнение к многим известным органеллам (компонентам или «органам» клетки) ученым только что удалось открыть еще одну. Это так называемые BAG2 — лишенные мембран гранулы, образующиеся в цитоплазме в ответ на определенный стресс. Вероятно, BAG2 может стать основой для новой терапии нейродегенеративных заболеваний.
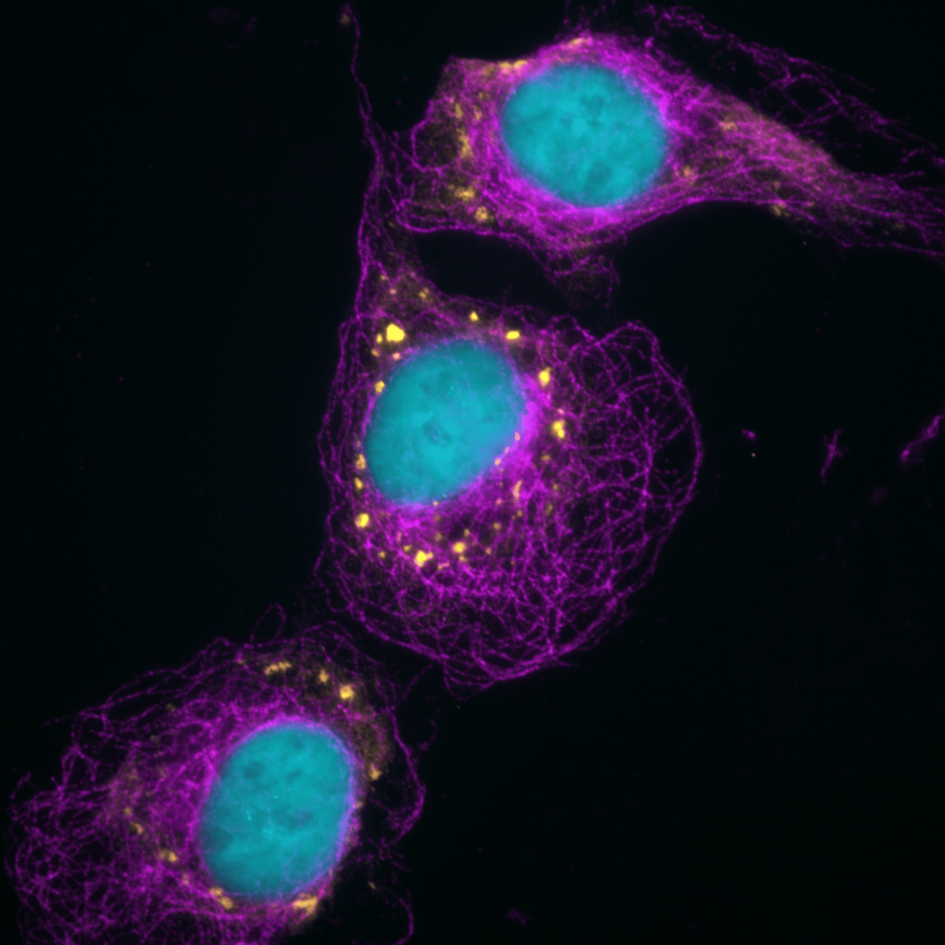
Помимо открытых десятки или даже сотни лет назад ядра, митохондрий, ретикулума и так далее, в клетке существует множество других органелл. Как правило, они поменьше и выполняют конкретную специфическую работу. В свежей статье в журнале Nature Communications ученые из США и Бразилии описали BAG2 (Bcl2-associated athanogene 2) — новый тип органелл, не имеющих мембраны, но хорошо отделенных от цитоплазмы включений.
В этом отношении BAG2 напоминает так называемые стресс-гранулы и тельца процессинга (P-тельца), однако новые органеллы не содержат ни РНК, ни специализированную «метку смерти» — убиквитин. Остаток убиквитина обычно присоединяется к тем белкам, которые клетка затем целенаправленно разрушает с помощью протеасом — молекулярных машин, выполняющих работу «мусороуничтожителя».
«Люди довольно давно в курсе, что в клетке туда-сюда плавают несколько типов объектов без мембраны. Однако до недавнего времени не было известно, как они поддерживают свою целостность, что представляют собой и зачем нужны», — сказал Кеннет С. Косик (Kenneth S. Kosik) из Университета Калифорнии в Санта-Барбаре (США). Теперь, благодаря продвинутым методам молекулярной визуализации, ученые наконец смогли как следует рассмотреть эти динамичные органеллы.
От привычных крупных органелл эти немембранные структуры отличает отсутствие упаковки из липидного бислоя, который также отделяет содержимое клетки от ее окружения. Вместо нее включения вроде BAG2 или P-телец существуют за счет разделения двух жидкостей (их содержимого и основной среды клетки) на фазы — примерно как в случае капли масла на поверхности воды.
Ученые выяснили, что вновь открытые компоненты клетки активизируются (то есть переходят в конденсированную форму) в условиях определенного стресса, в том числе при повышении осмотического давления.
Примерно так же работают стресс-гранулы, которые при активации останавливают синтез белка и сохраняют в себе РНК. Однако BAG2 берет на себя заботу о тех белках, которые уже синтезированы. Дело в том, что в неблагоприятных условиях они могут приобрести неправильную трехмерную структуру и повреждать клетки. Практически то же происходит при нейродегенеративных расстройствах. BAG2 не только уничтожает сомнительные белки, но и способствует работе шаперонов — других молекул, помогающим белкам сохранять правильную структуру. Несмотря на отсутствие убиквитина, BAG2 все же обеспечивает целенаправленное уничтожение белков в тех самых протеасомах. Очевидно, для этого органелла использует какой-то другой путь, в котором участвует и один из белков теплового шока (HSP 70).
Особенно важно, что одной из мишеней BAG2 оказался тау-белок (MAPT), который тоже легко приобретает патологическую форму и «слипается» с себе подобными. Тау-белок считают одним из главных виновников болезни Альцгеймера — более того, именно он, скорее всего, запускает весь ее патогенез. В этом случае тау-белок перестает выполнять свою работу — удерживать микротрубочки (важный компонент клеточного скелета) вместе, отсоединяется от них и образует патологические включения внутри нейронов. Микротрубочки тем временем начинают разрушаться, а нейроны — гибнуть.
Поэтому ученые считают вновь открытую органеллу перспективной мишенью для таргетной терапии. Модифицируя состояние BAG2, а именно — управляя ее переходом в конденсированное состояние, исследователи надеются разработать новые методы лечения заболеваний, связанных с нарушением трехмерной структуры белков: болезней Альцгеймера, Паркинсона и других нейродегенераций.