Этиопатогенез геморрагического инфаркта миокарда
Наиболее частая причина геморрагического инфаркта миокарда (ГИМ) — реперфузия миокарда. Однако только реперфузия не приведет к геморрагической трансформации очага: для этого продолжительность ишемии перед восстановлением кровотока должна быть не менее 60 мин. Возникновение ГИМ возможно как и в редких случаях самопроизвольного лизиса тромба или разрешения сосудистого спазма, так и после успешной консервативной терапии (применение неселективного тромболитика — стрептокиназы, фибринспецифичного рекомбинантного тканевого активатора плазминогена — алтеплазы и его производных — ретеплазы, тенектеплазы, рекомбинатной проурокиназы — пуролазы) или состоявшихся инвазивных вмешательств (селективный внутриартериальный тромболизис, чрескожное коронарное вмешательство).
Длительная ишемия приводит к значительной эндотелиальной дисфункции с развитием стойкой дилатации и повышением проницаемости сосудистой стенки.
В условиях гипоксии кардиомиоциты переходят на анаэробный гликолиз, в результате чего в клетках накапливается продукт неполного окисления глюкозы — лактат. Параллельно в клетке на фоне анаэробного обмена происходит накопление избыточного количества ионов Na+ и Н+. Все это приводит к ацидозу в очаге некроза. Далее Na+, Н+ обмениваются на другие катионы (преимущественно на Са2+), вследствие чего происходит перегрузка кардиомиоцитов Са2+, что в свою очередь приводит к абсорбции его митохондриальными мембранами и последующим блокированием дыхательной цепи электронов. Таким образом замыкается порочный круг.
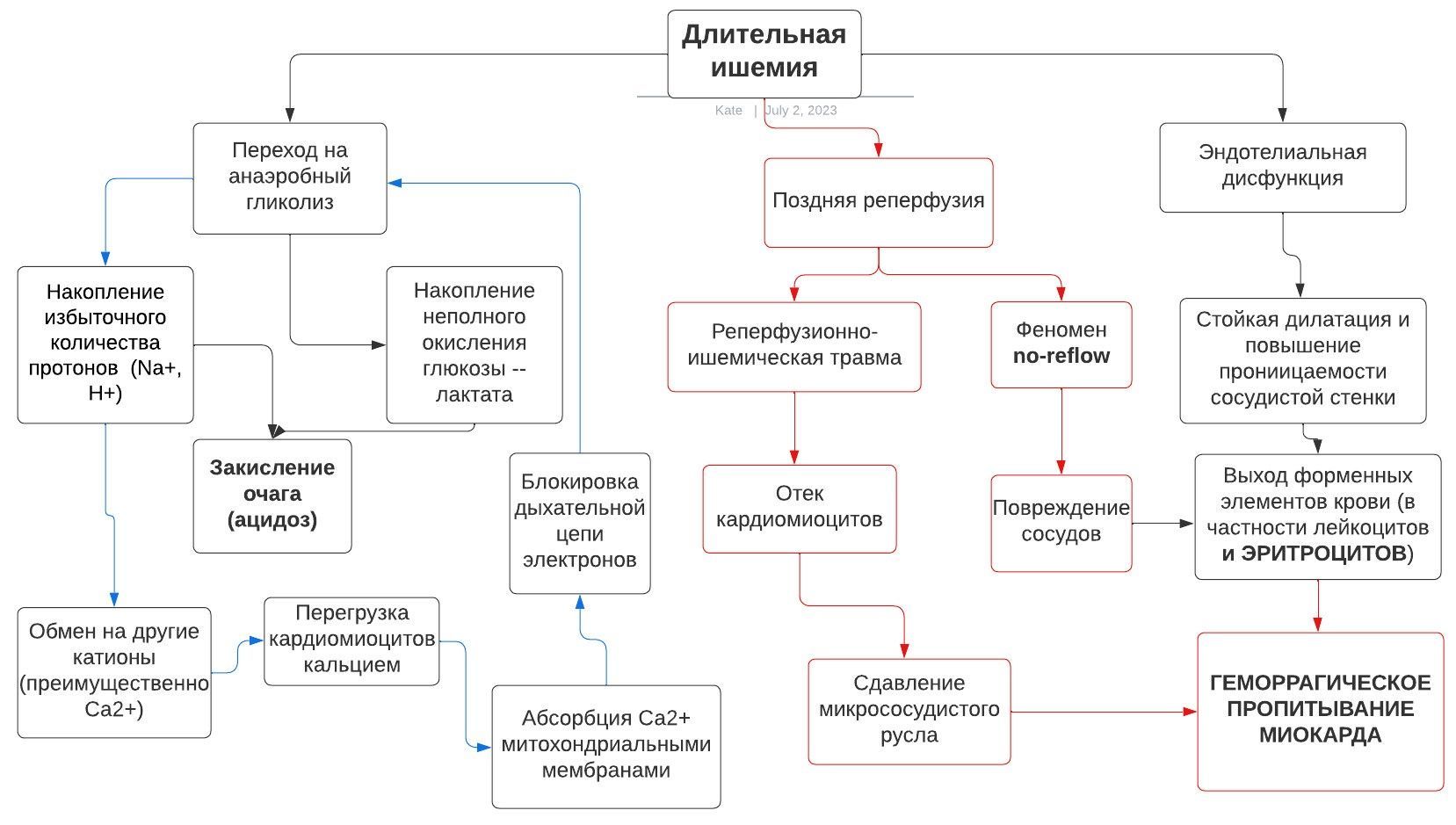
Схема 1 | Патогенез геморрагического пропитывания миокарда
Реперфузия в инфаркт-связанной коронарной артерии усугубляет повреждение эндотелия, вызывая экстравазацию эритроцитов в межклеточное пространство миокарда — геморрагическое пропитывание миокарда (ГПМ). Его появление связано с феноменом no-reflow*, существует две теории возникновения данного феномена. Согласно первой теории, наиболее распространенной, микрососудистая обструкция (МСО) приводит к повреждению эндотелия и, реализуя механизмы, описанные выше, вызывает геморрагическое пропитывание. Вторая концепция утверждает, что ГПМ, являясь частью реперфузионно-ишемической травмы, вызывает отек кардиомиоцитов и сдавление микрососудистого русла, приводя к развитию МСО [3].
*Феномен no-reflow был впервые описан G. Majno в 1967 году, который исследовал особенности восстановления кровоснабжения головного мозга после церебральной ишемии. В 1974 г. R. A. Kloner опубликовал первые данные по моделированию феномена no-reflow в коронарных сосудах у собак: наблюдалось отсутствие адекватной перфузии миокарда на микрососудистом уровне после успешно выполненной реваскуляризации коронарной артерии.
Зависимость между развитием ГПМ и реперфузией подтверждается тем, что при сохранении окклюзии коронарной артерии данного феномена не наблюдалось.
Другими этиологическими факторами геморрагической трансформации очага могут выступать тяжелые сопутствующие патологии у пациента, такие как гемобластозы и авитаминоз.
ГПМ не только является маркером выраженности повреждения миокарда, но и усугубляет микрососудистую травму.
Патоморфологическая картина
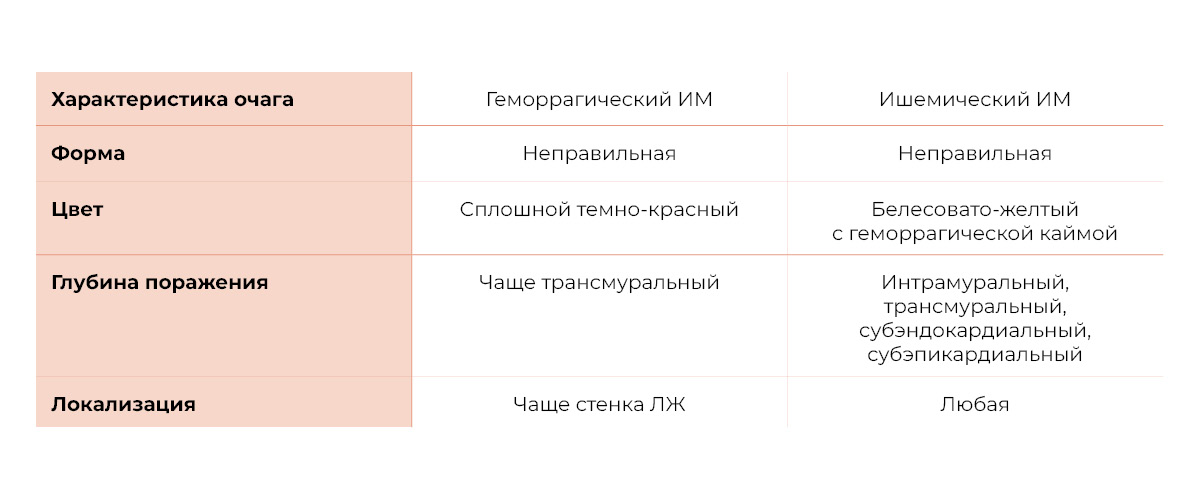
Макроскопически инфаркт миокарда представлен коагуляционным некрозом в сердечной мышце и имеет вид бесструктурного очага неправильной формы. Так как при вскрытии перед нами находится материал, который уже не сможет трансформироваться, в патологической анатомии выделяют две отдельные формы ИМ — ишемическую и геморрагическую.
При сравнительной характеристике этих форм выявляется целый ряд различий в микро- и макроскопической картине (табл. 1).
Таблица 1 | Сравнительная характеристика микроскопической картины ишемической и геморрагической форм ИМ
Разница между ишемическим и геморрагическим ИМ лучше всего заметна при изучении макропрепаратов миокарда с геморрагическим и ишемическим поражениями:
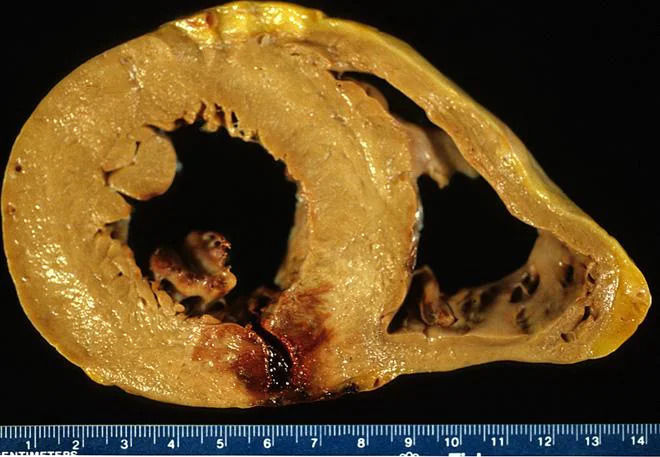
Рисунок 1 | Острый инфаркт миокарда задней стенки левого желудочка реперфузионного типа в поперечном сечении.В этом случае инфаркт носит диффузно-геморрагический характер. Сквозь центр трансмурального очага проходит линия разрыва. Причиной смерти стал гемоперикард [5].
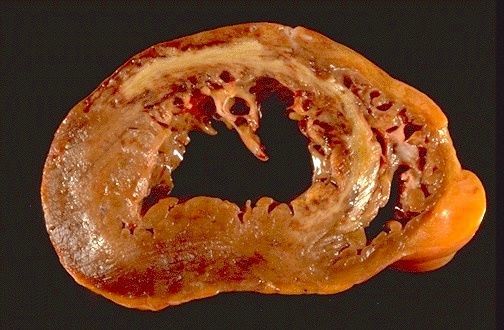
Рисунок 2 | Острый инфаркт миокарда передней стенки левого желудочка и межжелудочковой перегородки в поперечном сечении.Обратите внимание на то, что очаг желтоватого цвета окружен геморрагической каймой и затрагивает практически всю стенку [6].
При гистологическом исследовании ГИМ мы будем наблюдать зону некроза с экстравазальным скоплением эритроцитов в интерстициальном пространстве. В очаге сосуды расширены и полнокровны. Отличительной особенностью данной формы ИМ является отложения соединений трехвалентного железа (например гемосидерина), которые выявляются реакцией Перлса** (рис. 3–4) [2].
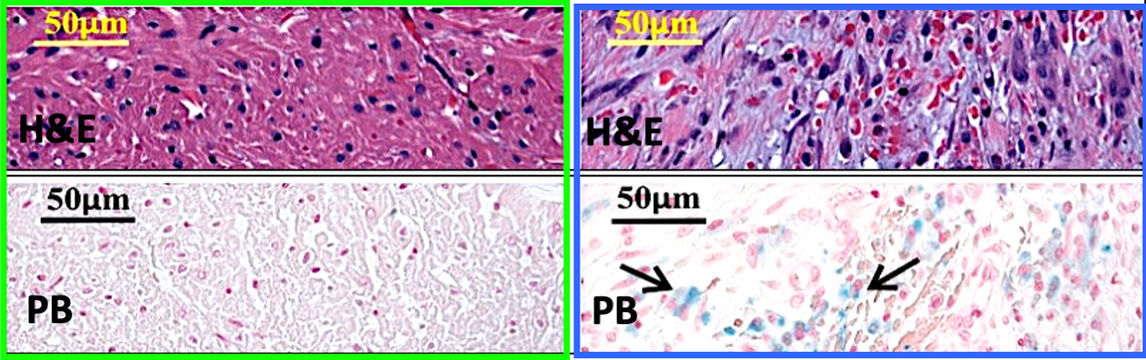
Рисунок 3 | Микроскопический препарат миокарда крысы с ГИМ.Отчетливо прослеживается инфильтрация очага эритроцитами, а также соединения железа лазурного цвета (указаны стрелками).
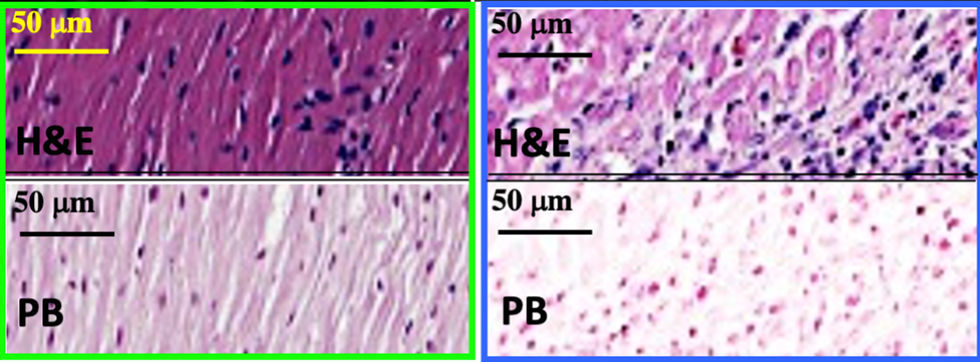
Рисунок 4 | Микроскопический препарат миокарда крысы с ИИМ.Отсутствует экстравазация эритроцитов в интерстициальное пространство. Реакция Перлса отрицательная, поскольку отсутствуют соединения железа.
**реакция Перлса, или реакция образования берлинской лазури — выявление соединений трехвалентного железа [4].
Помимо этого в очаге с геморрагическим пропитыванием наблюдается обильная инфильтрация тканей фагоцитами, что показано на рис. 5.
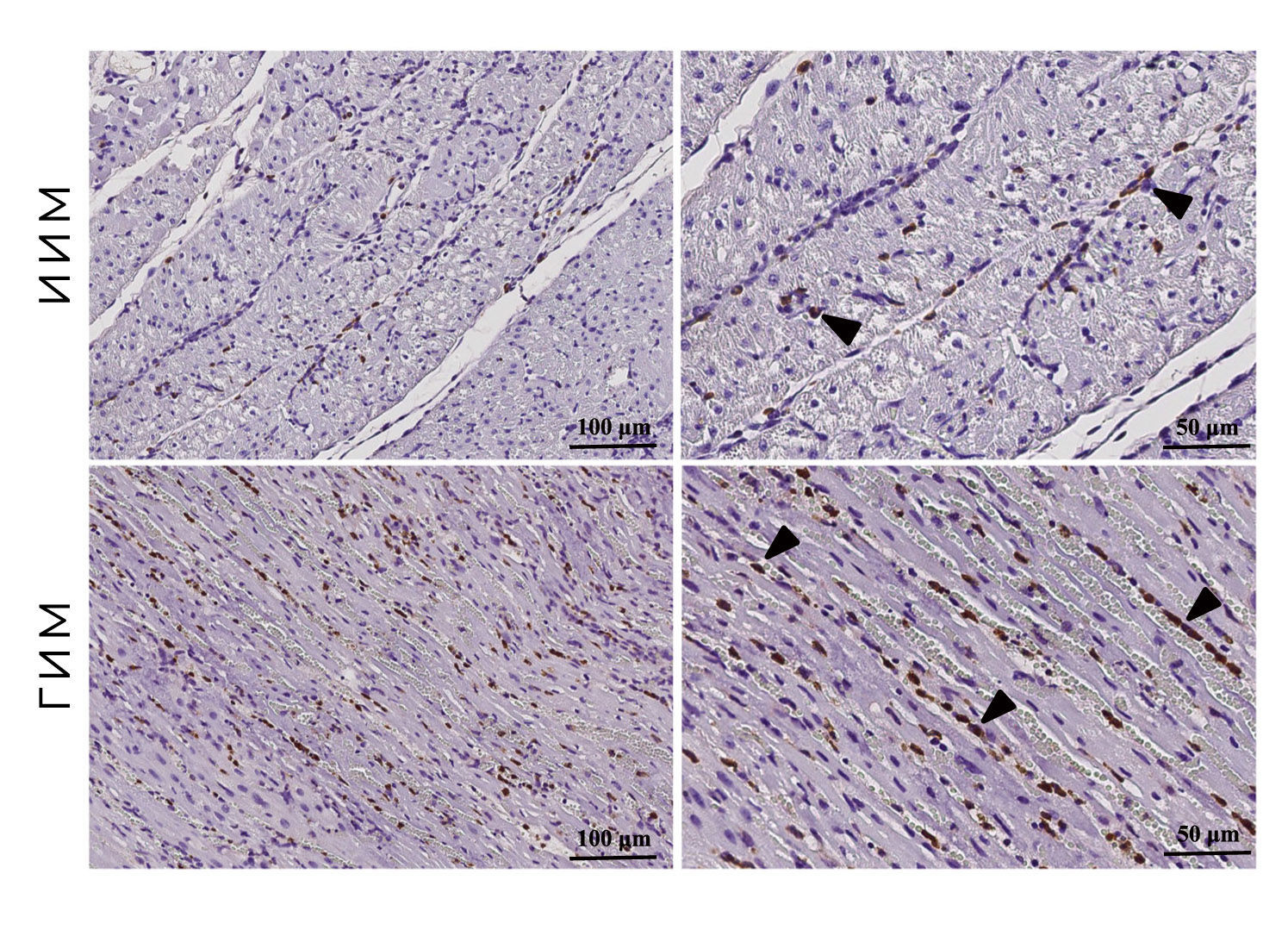
Рисунок 5 | Микроскопический препарат миокарда свиней с ИИМ и ГИМ.Макрофагальная инфильтрация. Фагоциты преимущественно сконцентрированы вблизи эритроцитарной инфильтрации.
NB! Клиническая картина двух форм ИМ не имеет отличий, но патофизиологические механизмы определяют сроки и особенности восстановления, поэтому в данной статье клиника ОИМ не рассматривается.
Диагностика и исходы
Геморрагическая трансформация очага некроза в миокарде тесно связана с основными неблагоприятными сердечно-сосудистыми осложнениями. Предполагается, что между кровоизлиянием, ишемией и воспалением есть тесная взаимосвязь, и каждый компонент усугубляет патологическое действие другого.
Диагностировать ГПМ in vivo возможно лишь с помощью МРТ миокарда в режиме Т2-взвешенных изображений (Т2 ВИ). При этом обнаружение ГИМ затруднено в силу отсутствия прямых показаний к применению МРТ сердца при ИМ.
Однако существует достаточное количество исследований на крупных (свиньях) и мелких (крысы) моделях животных, которые не только демонстрируют кровоизлияние по данным МРТ, но также указывают на прогрессирующее течение сердечной недостаточности.
Далее представлено экспериментальное воспроизведение геморрагической формы миокарда на свиных сердцах. Геморрагическое пропитывание миокарда на снимках выглядит как гипоинтенсивный очаг, что показано на рис. 7. Снимки были получены через 24 часа после восстановления кровотока у животных (свиней), подвергшихся реперфузии через 45 минут после начала ишемии с физиологическим раствором (ИИМ) и коллагеназой (ГИМ).
Следует обратить внимание на более обширный инфаркт и наличие микроваскулярной обструкции (МВО) при ГИМ.
Высокая интенсивность сигналов на Т2 изображениях свидетельствует о наличии отека на территории левой передней нисходящей артерии (место закупорки; синоним — передняя межжелудочковая ветвь) в обеих формах ИМ [1].
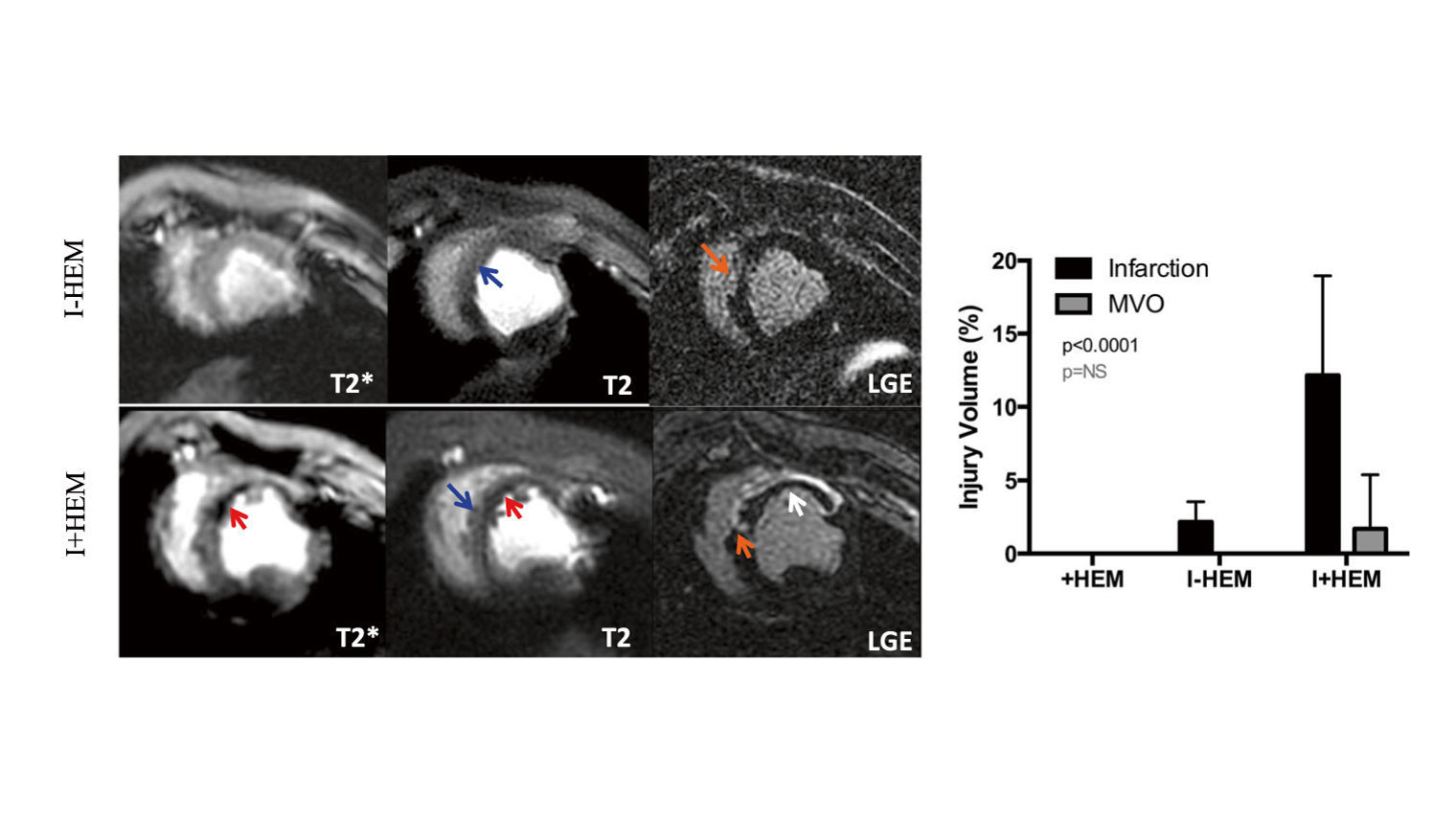
Рисунок 6. Т2* ВИ (ТЕ = 16 мс), Т2 ВИ (ТЕ = 88 мс) и позднее усиление гадолинием (LGE) миокарда свиней при ИИМ и ГИМ.Красные стрелки указывают на кровоизлияние, оранжевые — инфаркт, синие — отек и белая — МВО.
При исследовании крови может быть обнаружена высокая концентрация провоспалительных цитокинов — ИЛ-1β, ФНО-α и MMP-9 (рис. 8), что указывает на более выраженную и длительную воспалительную реакцию в поврежденном миокарде, связанную с экстравазацией ЭР.
Стоит отметить, что MMP-9 — важный фактор ремоделирования. Матриксная металлопротеиназа разрушает белки внеклеточного матрикса (особенно коллаген 4 типа), активирует факторы роста (в частности фактор роста сосудистого эндотелия) и косвенно воздействует на лейкоциты и фибробласты, ответственные за заживление ран миокарда [7]. В результате повышенной экспрессии этого цитокина происходит усугубление ремоделирования миокарда [2].
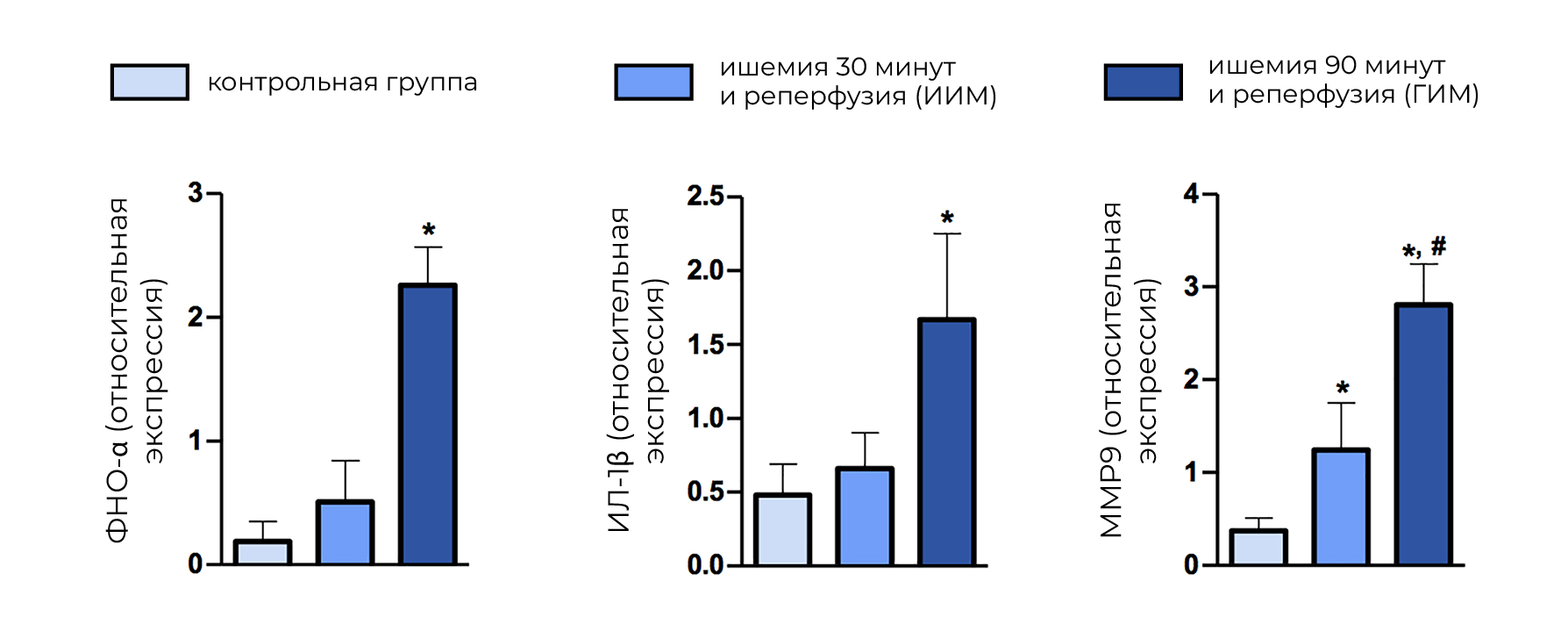
Рисунок 7 | Экспрессия цитокинов в норме и при различных формах ИМ (гИМ и иИМ) у крыс.
Хотя возникновение кровоизлияния в миокард после ОИМ было известно с 1980-х из аутопсийных исследований и исследований образцов тканей, этой особенностью пренебрегали из-за отсутствия чувствительных методов визуализации для обнаружения in vivo.
Сейчас диагностирование ГИМ возможно благодаря МРТ миокарда, результаты которого позволяют нам косвенно связать кровоизлияние с более тяжелым нарушением сердечной функции, серьезными сердечно-сосудистыми осложнениями (разрыв стенки миокарда) и повторными ИМ.
Заключение
Можно сделать вывод, что ишемическое время до реперфузии является ключевым звеном развития геморрагического пропитывания очага ишемии. А кровоизлияние является не просто сопутствующим явлением, но и активным фактором, который способствует клеточному и микрососудистому повреждению и воспалению в сердечной мышце помимо первоначального ишемического повреждения.





