FDA рассматривает возможность получения разрешений на паксловид от
Pfizer и молнупиравир от Merck & Co. — первые два пероральных
противовирусных препарата против COVID-19.
Пандемия, несмотря на все возникшие вместе с ней проблемы, позволила разработчикам продемонстрировать беспрецедентную скорость создания лекарств. Вакцины и антитела на заказ были одним из первых ответов на ситуацию с COVID-19, внедренных чуть менее чем через 11 месяцев после начала пандемии SARS-CoV-2. Теперь и пероральные противовирусные препараты от Pfizer и Merck & Co. готовы оставить свой след.
Паксловид, претендент от Pfizer, прошел путь от соединения в морозильной камере и идей оптимизации на чертежной доске до официального представления всего за 20 месяцев. «Это была быстро проделанная работа», — говорит Микаэль Долстен, главный научный сотрудник Pfizer. «При нормальном развитии программы малых молекул это заняло бы 8–10 лет», — отмечает он.
Молнупиравир компании Merck, находясь на доклиническом этапе к моменту наступления пандемии COVID-19, также получил преимущество в качестве ускорения разработки.
FDA в настоящее время рассматривает оба препарата для получения экстренного разрешения на применение (EUA). Консультативный комитет FDA 30 ноября проголосовал 13 против 10 в пользу EUA для молнупиравира, подготовив базу для принятия решения об одобрении в ближайшие недели. Европейские агенства по лекарственным средствам (EMA) также рассматривают молнупиравир, и заявке от Pfizer тоже непременно придет свое время.
Предварительные данные говорят о том, что оба препарата обладают преимуществами по сравнению с ремдесивиром от Gilead — противовирусным препаратом для внутривенного введения, который получил разрешение для EUA в мае 2020 года и полное одобрение FDA в октябре 2020 года для госпитализированных пациентов. Этот противовирусный препарат уже подвергался критике в ходе клинических испытаний до начала пандемии. Он редко используется за пределами США.
Появление пероральных противовирусных препаратов, которые могут применяться для амбулаторных пациентов, дает инфекционистам надежду.
«Приятно видеть, что противовирусные препараты доказали свою эффективность», — говорит Питер Хорби, соруководитель исследования UK RECOVERY, в ходе которого было изучено множество потенциальных методов лечения COVID-19. Пероральные противовирусные препараты могут служить более дешевым и простым в применении вариантом, нежели антитела, которые уже разрешены для амбулаторных пациентов. Нехватка антител против COVID-19 вызвала политическую напряженность в США, где в прошлом году правительство выделило около 2,4 миллиона доз. Пероральные противовирусные препараты также могут быть менее восприимчивы к мутациям, вызывающим резистентность, добавляет Хорби. Антитела нацелены на устойчивый к мутациям S-белок, который SARS-CoV-2 использует для получения доступа к клеткам человека. «Противовирусные препараты нацелены на компоненты процесса репликации вируса, которые менее устойчивы к изменениям», — объясняет он. Недавно идентифицированный вариант под названием омикрон, например, имеет более 30 мутаций в S-белке, но только по одной в каждом из белков, которые являются мишенью для паксловида и молнупиравира.
Вакцины, вышеупомянутые новые противовирусные препараты и уже существующие методы лечения госпитализированных пациентов будут дополнять друг друга. «Мы всегда думали, что наличие как высокоэффективной вакцины, так и очень доступных, удобных, быстродействующих пероральных лекарственных средств предоставит беспрецедентную возможность предотвратить смерть, связанную с COVID-19», — говорит Долстен.
Заряжен и готов к бою
Как только был опубликован геном SARS-CoV-2, исследователи начали анализировать 29 белков вируса на предмет уязвимостей. Следуя примеру изучения других вирусных заболеваний, многие ученые начали с того, что сосредоточились на механизме репликации вирусов. Паксловид от Pfizer является самым продвинутым из ингибиторов основной протеазы (Mpro).
Во время репликации вирус SARS-CoV-2 синтезирует длинные полипептиды,
которые должны быть расщеплены на составляющие его вирусные белки. Mpro
отвечает за большую часть этого расщепления. Таким образом,
ингибирование Mpro предотвращает образование вирусом белков, необходимых
для репликации.
«Mpro — отличная мишень, так как она выступает в
качестве своего рода Ахиллесовой пяты вируса», — говорит Рольф
Хильгенфельд, исследователь антивирусных программ из Университета
Любека, Германия.
Десятилетия работы над вирусными протеазами позволили сообществу быстро двигаться вперед. «У нас были все реагенты, готовые для клонирования основной протеазы, когда последовательность была опубликована 10 января 2020 года», — вспоминает Хильгенфельд, который ранее определил кристаллические структуры Mpro из различных коронавирусов, включая SARS-CoV-1. В течение месяца после расшифровки генома SARS-CoV-2 его команда разгадала кристаллическую структуру Mpro SARS-CoV-2, в одиночку и в связи с противовирусным препаратом, который они назвали 13b.
Pfizer также задействовала предыдущую работу над SARS-CoV-1 и использовала все преимущества противовирусного средства под названием PF-00835231. Этот препарат основан на рупинтривире — соединении, которое имитирует пептидный субстрат протеазы риновируса человека. Протеазы риновируса и коронавируса не очень похожи, но обе расщепляют свой субстрат после остатков глутаминовой кислоты (Gln). Часть рупинтривира имитирует Gln. Pfizer модифицировал рупинтривир так, чтобы он лучше подходил для Mpro SARS-CoV-1; полученный PF-00835231 ковалентно связывается с активным центром протеазы, инактивируя фермент.
К счастью, Pro SARS-CoV-2 и Mpro SARS-CoV-1 гомологичны и совпадают на 96 %. Таким образом, Pfizer смогла быстро продвигать ингибиторы Mpro SARS-CoV-2 как для перорального, так и для внутривенного введения. PF-07304814, кандидат для внутривенного применения, является фосфатной пролекарственной формой PF-00835231. PF-07321332, кандидат для перорального введения, включил в себя субструктуры ингибитора протеазы HCV боцепревира и дополнительные усовершенствования для повышения биодоступности при пероральном применении. Чтобы получить паксловид, Pfizer объединила PF-07321332 с ритонавиром, лекарством от ВИЧ, которое ингибирует цитохром Р450 и замедляет метаболизм ингибиторов протеазы.
«Эта работа была выполнена «проворной командой спецназа, — говорит Долстен. — 600 соединений, 80 сокристаллов, открытие лекарств на основе структуры и кандидат через восемь месяцев». Pfizer запустила I фазу испытания паксловида в марте 2021 года, а к июлю начались II/III фазы. Промежуточные результаты II/III фазы испытания составляют основу заявки Pfizer для EUA. Испытание завершится в начале 2022 года. Компания также настаивает на использовании препарата для людей с низким риском госпитализации и для профилактического применения.
По итогам промежуточного анализа эффективности паксловида у 1219 пациентов лечение сократило риск госпитализации или смерти на 89 % при введении препарата в течение трех дней с момента появления симптомов. Эти результаты легли в основу заявки Pfizer для EUA.
Другие соединения против SARS-CoV-2, действие которых направлено на Mpro, также находятся в разработке; некоторые из них специально созданы в рамках пандемии (Таблица 1). Подобно соединениям от Pfizer, большинство из них имитируют пептиды, расщепляемые Mpro, ковалентно связываясь с остатками цистеина в активном центре фермента для его ингибирования.
Таблица 1 | Разрабатываемые антивирусные препараты против COVID-19
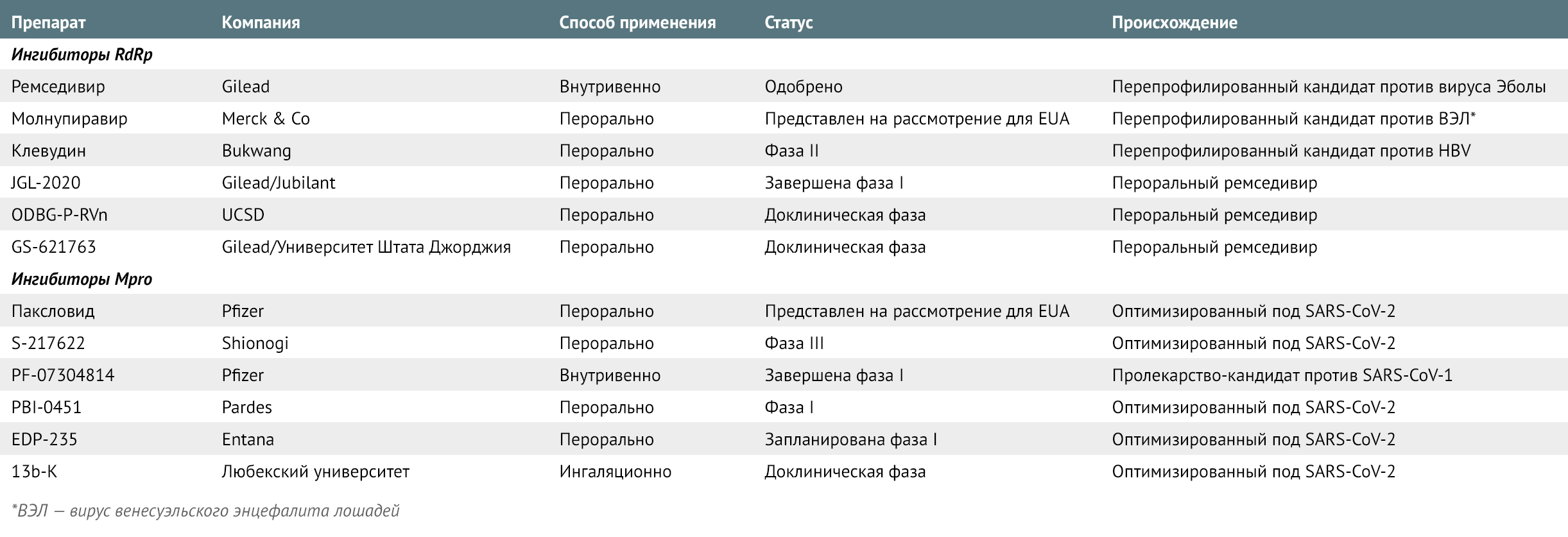
Преимущества препаратов широкого спектра
Merck сосредоточилась на вирусной РНК-зависимой РНК-полимеразе (RdRp) — ферменте, который участвует в синтезе РНК как для трансляции вирусных белков, так и для создания собственных копий. «RdRp предлагает больше возможностей для противовирусных препаратов широкого спектра действия», — говорит Хильгенфельд. Он объясняет, что их структуры сравнительно хорошо сохраняются в разных классах вирусов.
Ремдесивир от Gilead, ингибитор RdRp, обладает широкоим спектром действия. Исследовательская работа по этой программе началась в 2009 году во время поиска препаратов против вируса гепатита С и респираторно-синцитиального вируса. Gilead впервые внедрила его в клинические испытания против вируса Эбола в 2015 году, но препарат не показал эффективность. С появлением COVID-19 он «обрел новую жизнь».
Не все ингибиторы RdPd работают одинаково. В большинстве случаев, включая ремседивир, вирусы включают препарат в синтезирующуюся РНК, и это останавливает процесс элонгации. Механизм действия молнупиравира иной: синтез не прекращается, когда фермент встраивает препарат в вирусную РНК. Вместо этого вирус повторно использует РНК, содержащую молнупиравир, в качестве матричной цепи и включает неправильные основания в новую вирусную РНК, когда он повторно сталкивается с молнупиравиром. Мутации накапливаются в течение циклов, приводя к «катастрофе ошибок» и гибели вируса.
«На самом деле довольно интересно, что мы все еще изучаем новые способы подавления репликации вируса с помощью аналогов нуклеозидов», — говорит Дарья Хацуда, вице-президент по инфекционным заболеваниям и открытию вакцин компании Merck.
Сам молнупиравир был создан в лаборатории Джорджа Пейнтера Университета Эмори. В 2013 году Пейнтер искал препарат для лечения венесуэльского энцефалита лошадей (ВЭЛ) — заболевания, переносимого комарами, которые распространены на юге США. Рассматривая RdRp как мишень, Пейнтер надеялся разработать противовирусный препарат широкого действия для вирусов с генетическим материалом в виде РНК. Он решил исследовать аналоги нуклеозидов, потому что они, как правило, эффективны, имеют высокие барьеры устойчивости и могут быть доступны для перорального введения.
В начале пандемии Пейнтер и его коллеги сообщили, что молнупиравир показал широкую противовирусную активность против SARS-CoV-2, MERS-CoV, SARS-CoV-1 и вируса гриппа в доклинических моделях заболевания. В марте Эмори лицензировал терапию для Ridgeback Biotherapeutics, а Merck получила эксклюзивные права по всему миру на разработку и коммерциализацию препарата всего два месяца спустя.
Вследствие широкого потенциала ингибиторов RdRp молнупиравир не нуждался в каких-либо специфичных для COVID-19 модернизациях до того, как он вступил в фазу I испытаний в апреле 2020 года. Merck начала фазы II/III испытания MOVe-OUT в октябре 2020 года, а в октябре 2021 года представила промежуточные результаты FDA для EUA. Merck также тестирует возможность профилактического применения своего препарата.
Основные результаты применения молнупиравира у 1433 пациентов показывают, что препарат снижает риск госпитализации или смерти на 30 % при его назначении в течение пяти дней с момента появления симптомов. Более значимые промежуточные результаты, демонстрирующие снижение риска вышеперечисленных показателей на 48 %, были получены на меньшей выборке; во второй половине испытания у молнупиравира не было преимущества.
На заседании консультативного комитета FDA по препарату эксперты единогласно проголосовали за разрешение. Но десять участников дискуссии сочли, что преимущества препарата не оправдывают его риски.
Поскольку молнупиравир вызывает ошибки при репликации вирусной РНК, одна из ключевых проблем заключается в том, что теоретически он также может ускорить эволюцию вируса. Этот риск наиболее высок у пациентов с ослабленным иммунитетом, которые могут дольше инкубировать и выделять вирус, а также у пациентов, которые принимают более низкие дозы или более короткие курсы лекарств, чем назначено. Контраргумент Merck в пользу того, что вирус не был обнаружен в конце лечения в клинике и что предположительно возникающие мутантные вирусы быстро устраняются, убедил не всех членов комитета.
Другая проблема заключается в том, что молнупиравир может быть встроен в человеческую ДНК, вызывая мутации в быстро делящихся тканях человека, включая плод. Эта теория мутагенеза не является новой: Pharmasset, как сообщается, отказалась от разработки структурно сходных соединений в 2003 году из-за их мутагенного потенциала.
Молнупиравир показал положительный результат в тесте Эймса, который оценивает мутагенный потенциал на бактериальных клетках. В недавнем контрольном исследовании на мышах были продемонстрированы неоднозначные результаты, а в другом исследовании, как показала Merck, препарат не вызвал мутаций ни у одного из животных. Некоторые члены комитета поставили под сомнение модели и контрольные группы компании.
Молнупиравир также вызывает фетальные мутации у крыс. «FDA не следует одобрять его для беременных женщин, за исключением особых обстоятельств», — резюмировал Дэвид Истмонд, токсиколог из Калифорнийского университета и член консультативного комитета FDA. Другие ингибиторы RdRp — в основном перепрофиллированные препараты— находятся в стадии клинической разработки (таблица 1).
Первые противовирусные препараты
При одобрении препаратов Pfizer и Merck могли бы кардинально изменить ход пандемии. Оба препарата, скорее всего, будут применяться в амбулаторных условиях как у вакцинированных, так и у невакцинированных пациентов вне стационаров. США в ожидании одобрения уже обязались закупить 10 миллионов курсов препарата Pfizer и 1,7 миллиона курсов Merck, заплатив около 530–700 долларов США за курс соответственно.
Однако у более тяжелых и госпитализированных пациентов эти препараты могут быть менее эффективными. Merck остановила клиническое испытание препарата на госпитализированных пациентах после промежуточного анализа. «На ранних этапах лечение будет эффективнее, — говорит Хазуда. — Если состояние заболевшего требует госпитализации, то все доказательства будут свидетельствовать о том, что тяжесть заболевания больше не обусловлена репликацией вируса». В этот момент преобладают воспалительные реакции, подобные тем, которые ослабляются антителом к рецептору IL-6 — например, тоцилизумабом. В исследовании Хорби под названием RECOVERY тоцилизумаб снизил риск смертности и сроки госпитализации.
Но Хорби удивило то, что Merck прекратила свое ключевое испытание по применению молнупиравира у госпитализированных пациентов после лечения всего около 300 человек. «Это слишком маленькое исследование, чтобы отказываться от клинического испытания препарата на госпитализированных пациентах, учитывая, что мы привели доказательство принципа применения противовирусных препаратов в стационаре», — говорит он.
Ремдесивир, разрешенный только для стационарного применения, в то же время может быть более эффективным, если его назначать амбулаторным пациентам. Испытание препарата для внутривенного введения на 562 амбулаторных пациентах показало, что лечение сократило риск госпитализации или смерти на 87 % при назначении препарата в течение четырех дней с момента постановки диагноза COVID-19 и в течение семи дней с момента появления симптомов.
В стационаре же это сокращает время до выздоровления, но не оказывает статистически значимого влияния на выживаемость.
Необходимость своевременного лечения можно также объяснить незначительным воздействием осельтамивира компании Roche для лечения гриппа. «Больные гриппом пару дней чувствуют себя плохо и только потом идут к врачу, где получают рецепт на «Тамифлю» [осельтамивир], – говорит Хильгенфельд, но к тому времени уже слишком поздно».
Своевременное вмешательство — в первые три — семь дней — зависит от доступа к своевременному тестированию. Таким образом, доступность тестирования на COVID-19 является важным рычагом для новейших противовирусных препаратов.
Подспорье для будущего
Подобно тому, как препараты-кандидаты, которые первоначально были разработаны для атипичной пневмонии, стали ключевыми моментами для разработки лекарств против COVID-19, молнупиравир и PF-07231332 могут иметь решающее значение для создания противовирусных препаратов против будущих вспышек.
Хорби вспоминает, что искал готовые к III фазе противовирусные препараты для тестирования в начале пандемии. «У нас был ремдесивир и куча перепрофилированных, очень слабых противовирусных препаратов, в отношении которых у нас не было веры в успех, — говорит он. — Новые препараты определенно необходимы для всего спектра семейства вирусов, которые представляют потенциальную угрозу». Когда появляется что-то новое, сообщество должно быть в состоянии должным образом оценить это в серьезных испытаниях.
Хацуда ожидает, что молнупиравир будет препаратом-кандидатом широкого
спектра действия. «Это может сыграть важную роль в ликвидации этой
пандемии и, возможно, в будущих зоонозных передачах других
коронавирусов», — говорит она. За последние 20 лет распространились три
коронавируса: SARS-CoV-1, MERS-CoV и SARS-CoV-2.
Ингибиторы Mpro, как
правило, имеют более узкий спектр действия, поскольку между протеазами
разных вирусов существует больше структурных различий. Однако в основе
ингибиторов протеаз от Pfizer, Хильгенфельда и других лежат более старые
противовирусные препараты-кандидаты.
Исследовательские программы, изучающие структуры ключевых вирусных белков и свойства молекул, которые их связывают, также должны дать преимущество будущим противовирусным препаратам. Хильгенфельд считает, что этим платформам следует сосредоточиться на сходных мишенях и процессах, включая RdRp и основные протеазы. Различные программы, в том числе проект быстрого реагирования ЕС на коронавирусную терапию стоимостью 2,5 миллиона евро, ускоренные исследования и разработки IMI в Европе на сумму 75 миллионов евро и Противовирусная программа США на три миллиарда долларов для борьбы с пандемиями, делают именно это.
«Мы нуждаемся в инвестициях», — говорит Хильгенфельд. «Ключ к успеху в области противовирусных средств – это поддержание потока поступающих средств, — добавляет Хорби. — Вспышка атипичной пневмонии 2002–2004 годов поддерживала интерес людей в течение года или двух, а затем любопытство быстро исчезло, — вспоминает Хорби. — Остается надеяться, что это больше не повторится».





