Решающим фактором для развития антиген-специфического гуморального ответа является взаимодействие между фолликулярными хелперными Т-клетками (ФТХ) и В-клетками в специализированных микроструктурах, называемых герминативными центрами (ГЦ). ГЦ формируются при встрече с антигеном во вторичных (периферических) лимфоидных тканях, таких как миндалины, и обеспечивают дифференцировку В-клеток и развитие антител с высокой степенью сродства к антигену.
Традиционно иммунологи использовали генетические линии инбредных мышей для изучения динамики взаимодействия ФТХ и B-клеток, особенно в контексте вакцинации или инфекции. Эти исследования часто заканчивались неудачно при переносе результатов на человека. Это подчеркивает необходимость наличия базиса, более ориентированного на физиологию человека, для изучения иммунных реакций, протекающих в его организме. Исследователи под руководством Марка Дэвиса из Стэнфордского университета разработали органоид, состоящий из клеток миндалин человека, который может имитировать взаимодействие ФТХ и B-клеток in vitro.
По словам Дэвиса, он знал об этой старой процедуре, которую Джон Оуэн и Эрик Дженкинсон осуществили в девяностые годы, когда обнаружили, что можно использовать тимусы плода или новорожденного для создания органоидов. Таким образом, команда исследователей попыталась модифицировать версию этого метода с выделенными первичными миндалинами человека, которые затем подвергались действию живой аттенуированной вакцины против гриппа (ЖАВПГ). К седьмому дню ученые наблюдали повторную агрегацию сгруппированных клеток в органоидоподобные структуры, которые поддерживали исходный клеточный состав миндалин. Продольный анализ органоидов показал, что система может поддерживать дифференцировку В-клеток, на что указывает переход нативных В-клеток в В-клетки ГЦ и плазмобласты после стимуляции, а также дифференцировку ФТХ клеток с фенотипами CXCR5+ CD4+ из нативных CD4+ Т-клеток (результаты наблюдений аналогичны тем, которые были сделаны на людях in vivo).
Исследователи изучили пространственную структуру органоидов,
стимулированных ЖАВПГ, и наблюдали наличие ГЦ с отчетливыми светлыми
(СЗ) и темными зонами (ТЗ). При развитии иммунного ответа в ТЗ
герминативного центра происходит дифференцировка антиген-специфических
B-клеток в B-клетки ГЦ (первичная пролиферация активированных
В-лимфоцитов), тогда как в СЗ находятся фолликулярные дендритные клетки
(ДК) и клетки ФТХ. B-клетки ГЦ мигрируют из ТЗ в СЗ и взаимодействуют с
фолликулярными ДК и ФТХ-клетками для регуляции реакции ГЦ на антигенную
угрозу, что приводит к появлению длительно живущих плазматических
клеток, секретирующих антитела, и высокоаффинных B-клеток памяти. При
сравнении транскриптомов B-клеток ГЦ и нативных B-клеток в первых
(находящихся внутри органоидов миндалин) обнаружилась усиленная
экспрессия генов, связанных с ключевыми процессами В-клеток, такими как
выделение антител и дифференцировка B-клеток.
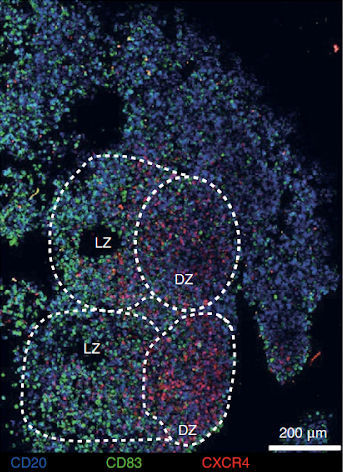
Рисунок 1 | В герминативных центрах внутри органоидов миндалин (после воздействия ЖАВПГ) формируются четко различимые светлая (LZ) и темная (DZ) зоны
Затем исследователи проанализировали уровень экспрессии индуцируемой активацией цитидиндезаминазы (ИАЦД) — важного фермента, необходимого для соматической гипермутации и переключения класса антител. Эти процессы играют ключевую роль при генерации высокоаффинных антител. Ученые выявили усиление экспрессии ИАЦД в B-клетках пре-ГЦ и ГЦ в течение четырех дней после стимуляции ЖАПГВ. Чтобы показать, что органоиды миндалин действительно могут способствовать достижению необходимой степени аффинности, производилось истощение всех ранее существовавших В-клеток с высокой степенью сродства к вирусу гриппа в исходном материале и использовалась истощенная клеточная суспензия для создания органоидов. В результате созревания нативных В-клеток на 10-й день от момента воздействия ЖАВПГ повторно появлялись В-клетки с высоким аффинитетом.
Секвенирование генетической последовательности тяжелых цепей иммуноглобулинов, производимых В-клетками, в нативных и достигших аффинитета В-клетках выявило, что зрелые В-клетки способны продуцировать антиген-специфические антитела. Анализ клонов В-клеток за семь дней эксперимента также показал, что генетическая последовательность антител с течением времени эволюционировала в сторону увеличения сродства к гриппозному пептиду, что позволяет предположить, что органоиды миндалин могут способствовать соматической гипермутации.
Исследователи также использовали эту методику для того, чтобы оценить, как отдельные типы клеток влияют на специфический В-клеточный антигриппозный ответ. Это осуществлялось путем систематического удаления определенных типов клеток и оценки влияния этого на дифференцировку плазмобластов. Например, истощение плазмоцитоидных ДК препятствует развитию плазмобластов. Этот эффект можно обратить вспять с помощью воздействия экзогенного интерферона I типа, что позволяет предположить, что первичная роль плазмоцитоидных ДК в ГЦ заключается в выработке этих интерферонов.
Дэвис считает, что исследования на людях — это будущее иммунологии, следующий уровень. Он утверждает, что до этого у ученых не было системы, которая позволяла бы легко проводить механистические эксперименты на организме человека. Иммунологическая модель in vitro, такая как органоид миндалин, поможет разобраться в тонкостях иммунного ответа на инфекцию или вакцинацию. В будущем команда исследователей сосредоточится на использовании этой модели не только для анализа ответов органоидов разного генетического происхождения на вакцину, но и для решения оставшихся без ответа вопросов в иммунологии человека, таких как роль возраста и пола в аутоиммунитете и реакции на инфекцию.