Как все начиналось
В 1889 году французский физиолог Шарль Броун-Секар поставил над
собой, мягко говоря, немного необычный эксперимент. Ученый внутривенно
вводил себе отфильтрованную вытяжку из яичек собак и морских свинок в
течение трех недель. За это время 72-летний мужчина отметил увеличение
силы сгибателей предплечья, более сильную струю мочи, снижение частоты
запоров и субъективное улучшение когнитивных способностей [1]. В конце
XIX века утверждения Броуна-Секара казались дерзкими и
неправдоподобными, ведь формального, строгого описания его исследования
приведено не было. Однако его опыты вызвали интерес к химическим
веществам, которые секретируются яичками [2].

Сегодня тестостерон, когда-то таинственный компонент «эликсира
жизни», обладает многими хорошо изученными анаболическими,
метаболическими и стимулирующими эффектами, которые оказывают
специфическое влияние на органы-мишени у мужчин и женщин. В начале XX
века среди ученых-биохимиков началась настоящая гонка за выделение
тестикулярного гормона: Адольф Бутенандт и Леопольд Ружичка независимо
друг от друга синтезировали гормон из холестерина [3]. За эти открытия в
1939 году ученые-химики были удостоены Нобелевской премии, после чего
последовал всплеск исследований андрогенов. Некоторые первые работы
описывали симптомы снижения уровня тестостерона, которые тогда
назывались «мужским климаксом»: среди них — бессонница,
раздражительность, депрессия, снижение либидо и импотенция [4,5].
Продолжительность жизни мужчин увеличивается, и поэтому более глубокое понимание физиологических эффектов тестостерона и влияния гормонозаместительной терапии становится критически важным.
Формирование половых признаков. Биосинтез тестостерона
Чтобы оценить многогранную роль тестостерона, важно понимать этапы полового созревания, продукции андрогенов и регуляцию этих процессов. Эмбрион c набором хромосом 46,XY развивается по мужскому типу, так как Y-хромосома несет ген SRY — (англ. sex-determining region Y), или определяющий пол участок Y-хромосомы. Ген SRY кодирует белок TDF (англ. testis-determining factor — тестикулярный детерминирующий фактор), который инициирует трансформацию недифференцированных гонад в яички [7]. У эмбриона мужского пола клетки Сертоли (поддерживающие клетки, или сустентоциты яичек) производят мюллеров ингибирующий фактор (антимюллеров гормон) для разрушения мюллеровой системы. При кариотипе 46,XX — у эмбриона женского пола — мюллерова система формирует парамезонефральные (женские) протоки, развивающиеся в матку, маточные трубы и верхнюю часть влагалища. Интерстициальные клетки яичек, или клетки Лейдига, в свою очередь, синтезируют тестостерон для стимуляции роста и развития вольфовой системы — мезонефрических протоков, которые сформируют сеть и придатки яичек, семявыносящие протоки и семенные пузырьки.
Известно, что в ходе раннего эмбриогенеза яички и кора надпочечников происходят из одной структуры — промежуточной мезодермы, которая формирует метанефрос, или первичную почку, а позже — и интерреналовую систему надпочечника. Данные генетических исследований тканей яичек плода показали, что адренокортикотропный гормон (АКТГ) может стимулировать выработку стероидов клетками Лейдига, что усиливает функциональную связь между тканями надпочечников и яичек [6].
Мочеполовой синус под влиянием тестостерона превращается в предстательную и бульбоуретральные железы. Фермент 5-α-редуктаза, вырабатываемый предстательной железой у плода, преобразует тестостерон в дигидротестостерон (ДГТ). ДГТ — главный андроген, определяющий развитие полового бугорка в наружные гениталии по мужскому типу [8].
Половое созревание наступает с «пробуждением» гипоталамо-гипофизарной оси. Гипоталамус увеличивает секрецию гонадотропин-рилизинг-гормона (ГнРГ), который, в свою очередь, стимулирует высвобождение лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ). Это приводит к значительному увеличению выработки тестикулярного тестостерона и развитию известных вторичных половых признаков, связанных с половым созреванием у мальчиков, таких как скачок роста, повышенное либидо, становление эректильной функции, возникновение акне, рост волос на теле, увеличение мышечной массы, огрубение голоса.
Бóльшая часть тестостерона, основного циркулирующего мужского
андрогена, вырабатывается в яичках из холестерина и ацетата. Сетчатая
зона коры надпочечников вносит минимальный вклад в пул предшественников
тестостерона, секретируя дегидроэпиандростерон (ДГЭА) и ДГЭА-сульфат
(ДГЭА-С). ДГЭА и ДГЭА-С — андрогенные стероиды, вырабатываемые в
наибольшем количестве у людей. В основном они служат субстратами для
образования более мощных андрогенов, таких как тестостерон и ДГТ путем
периферической конверсии — превращения в активные метаболиты в тканях
организма. Однако в недавнем исследовании продемонстрировано, что ДГЭА и
ДГЭА-С напрямую влияют на транскрипционную активность посредством
связывания с рецепторами андрогенов [9]. Часть общего пула тестостерона
преобразуется внутриклеточно с помощью 5-α-редуктазы в ДГТ — более
мощную форму гормона в чувствительных к андрогенам тканях, таких как
предстательная железа, волосяные фолликулы, яичники и яички. Затем
свободный тестостерон и/или ДГТ связываются с внутриклеточным
андрогенным рецептором, оказывая андрогенное действие. Тестостерон также
может преобразовываться в эстроген с помощью цитохром Р-450-ароматазы в
нервной и жировой ткани, печени и костях [10]. У мужчин эстроген играет
важную роль в созревании сперматозоидов и поддержании либидо. У женщин
тестостерон и его предшественник андростендион синтезируются в пучковой
зоне коры надпочечников, а также в стромальных и интерстициальных
клетках яичника (клетки его текальной оболочки). Остальная часть
тестостерона вырабатывается в периферических тканях, таких как кости,
молочная железа, мышечная и жировая ткани [11].
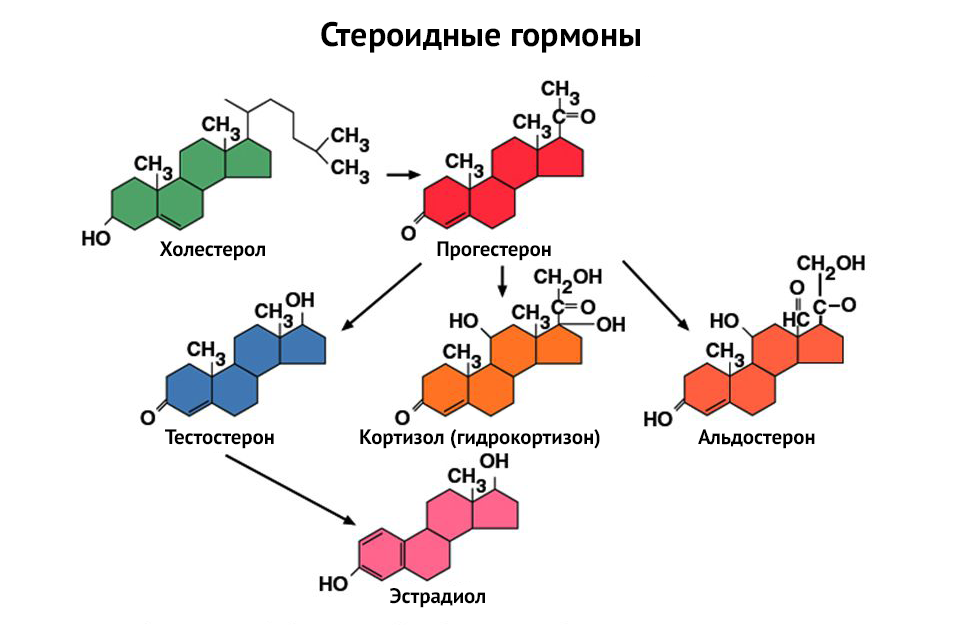
Синтез андрогенов в половых железах мужчин и женщин регулируется
секрецией ГнРГ гипоталамуса, стимулирующего высвобождение ЛГ и ФСГ из
гипофиза. ЛГ стимулирует синтез тестостерона в ткани яичек и яичников
[12].
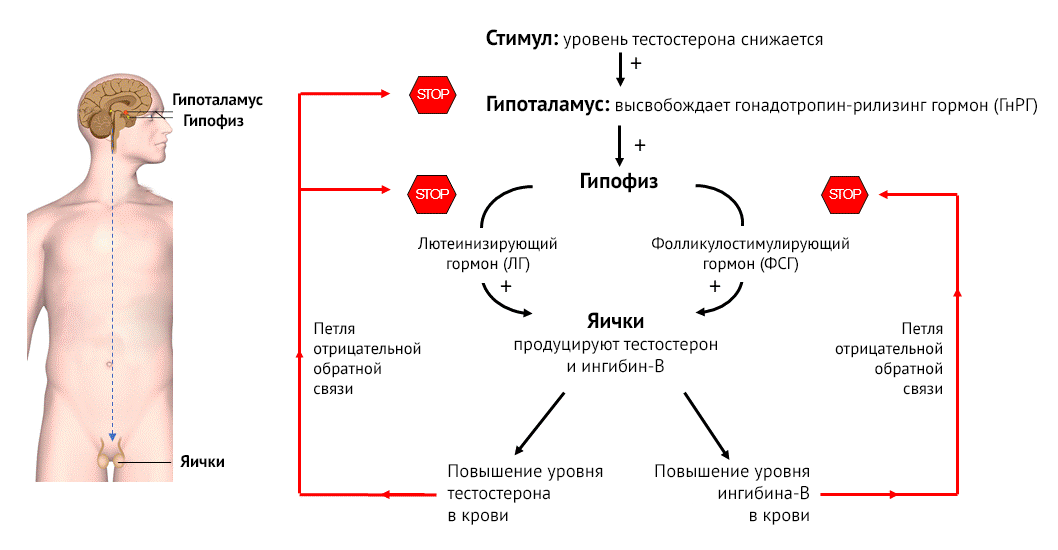
В плазме здоровых мужчин тестостерон распределяется следующим образом: 2 % свободного тестостерона, 38 % тестостерона, связанного с альбумином и 60 % тестостерона, связанного с глобулином, связывающим половые гормоны (ГСПГ). Последние два обычно не могут проникать во внутриклеточную среду и не проявляют свои биохимические эффекты [13]. В течение многих лет ученые находили доказательства того, что несвязанные с белками стероидные гормоны, такие как кортизол, были их единственной биологически активной фракцией в плазме крови человека. Эта концепция распространялась и на тестостерон. Однако позже было показано, что связанный с альбумином тестостерон также является биологически активным, учитывая низкое сродство тестостерона к белку [14]. Кроме того, было обнаружено, что ГСПГ, связанный со стероидами, может генерировать вторичные мессенджеры в клетках-мишенях путем связывания с высокоаффинными мембранными рецепторами. Это взаимодействие позволяло определенным стероидам оказывать свое действие, не проникая в клетки [15].
Как измеряют тестостерон?
Измерение уровня тестостерона в сыворотке обсуждалось в течение многих лет. Грамотный анализ уровня тестостерона играет жизненно важную роль в лечении и диагностике многих эндокринных расстройств: у мужчин — для диагностики клинического гипогонадизма при раке предстательной железы, получающих лечение аналогами ГнРГ, у мальчиков — для мониторинга признаков и симптомов преждевременного и замедленного полового созревания [16].
Секреция тестостерона зависит от циркадных ритмов у мужчин молодого и среднего возраста, причем самые высокие уровни обычно наблюдаются ранним утром [17]. Поэтому кровь для анализа уровней тестостерона следует брать утром, чтобы корректно оценить андрогенный статус пациентов [18]. Еще одним важным моментом, вызывающим сложности, является значительная вариабельность между лабораториями в отношении нормальных значений общего и свободного тестостерона у мужчин.
Врачи также должны понимать, что различия в измерениях в разных
лабораториях могут быть следствием используемого метода, а не отражением
фактических изменений уровней тестостерона [19]. В недавнем
исследовании обсуждались альтернативы измерениям сывороточного
тестостерона и соображения для интерпретации его уровней [20]. Одно из
предлагаемых решений заключается в анализе свободного, а не
сывороточного тестостерона, который можно измерить с помощью
равновесного диализа. При таком методе свободный тестостерон проходит
через мембрану в раствор диализата, а тестостерон, связанный с белком —
нет. Измерения свободного тестостерона позволяют избежать индивидуальных
различий в биодоступном тестостероне и обеспечивают более достоверную
оценку гипогонадизма.
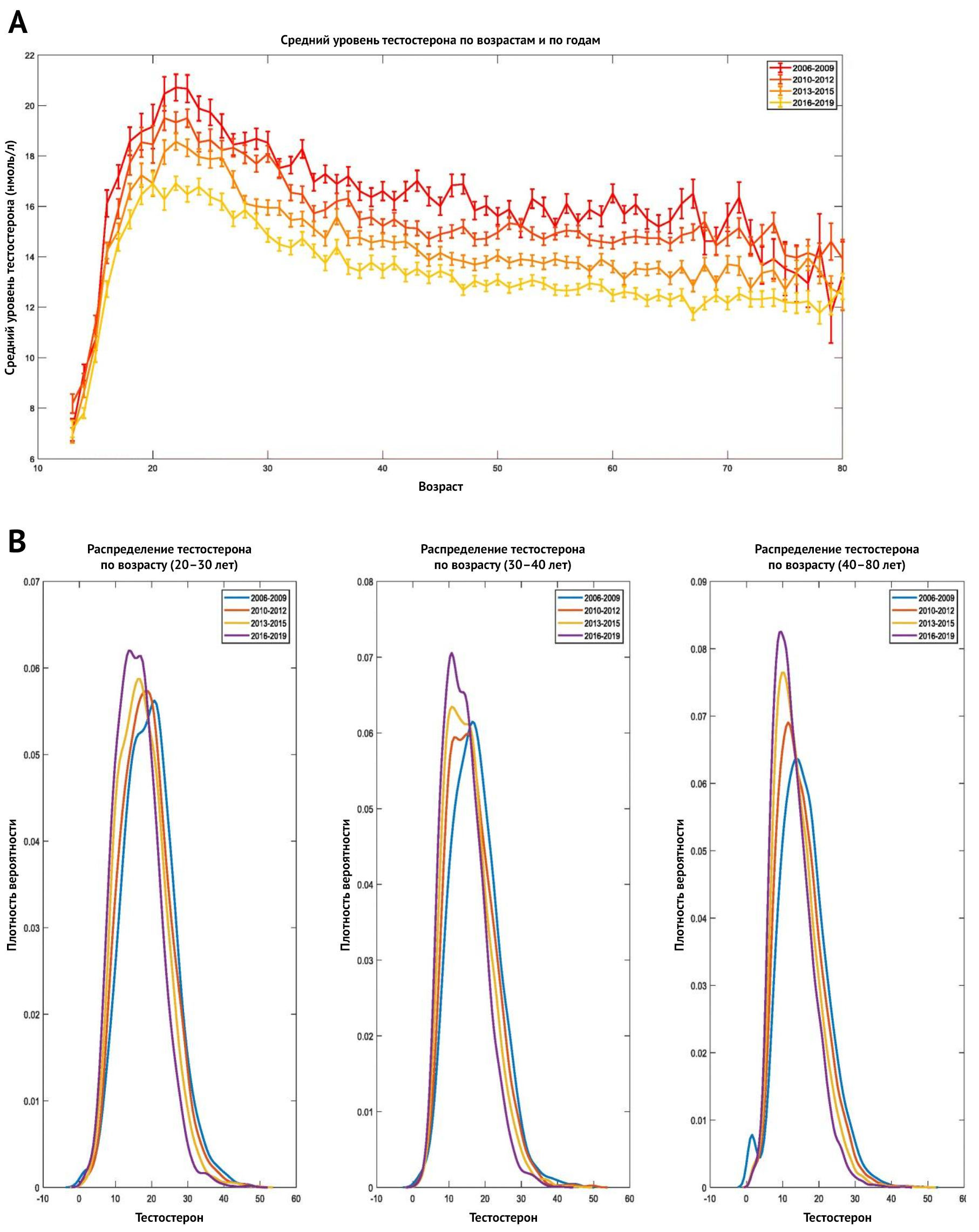
Кстати, уровень тестостерона у мужчин в популяции стремительно снижается, и это вызывает большую настороженность. Согласно исследованию, опубликованному в European Urology Focus в 2021 году [21], дефицит тестостерона встречается у 20 % подростков и взрослых мужчин в США. В рамках национального исследования состояния здоровья и питания авторы измерили уровни тестостерона у 4045 мужчин с 1999 по 2016 год. После исключения искажающих факторов стало ясно, что средние уровни тестостерона со временем снизились и оказались ниже в более поздние периоды (2011–2016 гг.), чем в более ранние периоды (1999–2000 гг.). Повышенный индекс массы тела (ИМТ) также был связан с более низким уровнем тестостерона, но тенденция оставалась значимой даже среди мужчин с нормальным ИМТ.
Популяционное исследование, проводимое в Израиле c 2006 по 2019 год [22] c выборкой в 102 334 мужчин также продемонстрировало резкое снижение уровня тестостерона в сыворотке крови. Таким образом, сегодняшний двадцатилетний парень на пике своего развития имеет уровень тестостерона, какой еще лет пятнадцать назад демонстрировали мужчины вдвое старше него. Поскольку на снижение уровня тестостерона, по-видимому, влияют модифицируемые факторы риска, цели израильского исследования заключались в оценке долгосрочных тенденций за последние десятилетия.
Несколько масштабных популяционных исследований, проведенных в США
[23, 24] и странах Северной Европы [25, 26], показали значительное
снижение уровня тестостерона в сыворотке крови у мужчин с 1970-х до
начала 2000-х годов. Изменения показателей образа жизни и здоровья были
связаны со снижением уровней тестостерона, свободного тестостерона и
ГСПГ, включая увеличение массы тела. Тенденцию сложно назвать новой: еще
в 2007 году исследование из США [27] демонстрировало существенное и
независимое от возраста снижение тестостерона, которое, по-видимому, не
было связано с наблюдаемыми изменениями ряда факторов, включая
характеристики организма мужчины и его образа жизни, такие как курение и
ожирение [28].
Физиологические эффекты тестостерона
Чтобы понять, чем это грозит мировой популяции, далее мы разберем основные биологические функции этого многогранного гормона. Помимо уже рассмотренной нами роли в андрогенезе, тестостерон отвечает за сексуальное поведение, когнитивные функции, ментальное здоровье, стрессовые и иммунные реакции. Появляются данные о влиянии тестостерона на патогенез сердечно-сосудистых и респираторных заболеваний. Подчеркнем, что роль тестостерона в развитие онкологических заболеваний у мужчин будет приведена в следующих обзорных статьях, посвященных онкоандрологии.
Сексуальное поведение
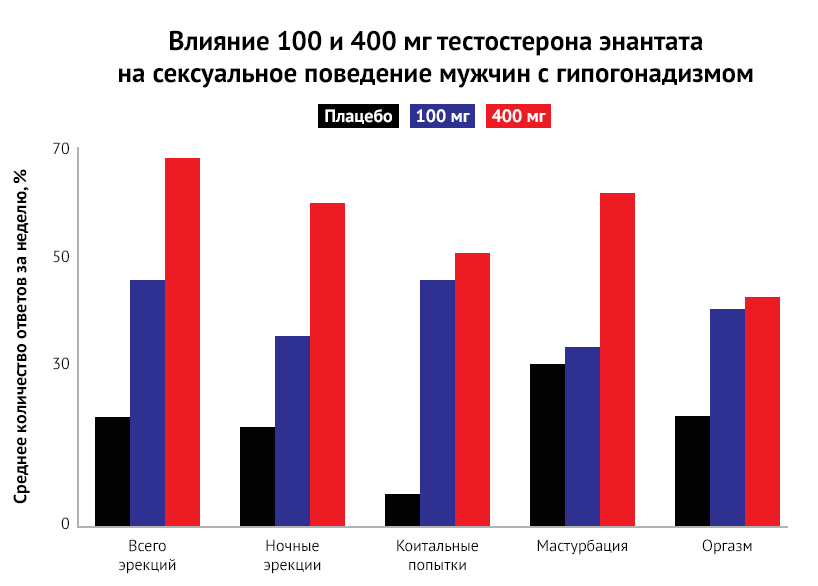
Тестостерон глубоко вовлечен в каждый этап мужского сексуального поведения. Несмотря на это, возникновение сексуальных расстройств нельзя автоматически связывать со снижением уровня тестостерона. Например, известно, что эректильная дисфункция может быть результатом не только низкого уровня тестостерона, но и патологии кровеносных сосудов. Нарушения сексуального влечения может быть результатом широкого спектра органических и психологических факторов, однако в клинической практике такое состояние, как правило, рассматривается в качестве одного из наиболее специфических симптомов гипогонадизма [29]. Соответственно, низкое либидо может быть повышено у мужчин с гипогонадизмом с помощью терапии тестостероном. Связь между низким уровнем тестостерона и задержкой эякуляции недостаточно изучена и нуждается в дальнейшем изучении, как и роль тестостерона в таких случаях. Клиницистам следует помнить, что сексуальные дисфункции имеют многофакторные причины, и гипогонадизм представляет собой лишь одну из них.
В обработке сексуальных стимулов, ответственных за половое влечение, участвуют медиобазальный гипоталамус и лимбическая система, где экспрессируются андрогенные рецепторы [30]. И хотя точные нейрофизиологические механизмы, регулирующие половое влечение, до сих пор в значительной степени неизвестны, данные, полученные на животных моделях, позволяют предположить, что тестостерон играет важную роль. Мыши с тестикулярной феминизацией из-за мутаций в андрогенном рецепторе, а также мыши с нокаутом по андрогенному рецептору демонстрируют аномальное сексуальное поведение [31, 32]. В какой-то степени влияние тестостерона на половое влечение может быть опосредовано эстрадиолом, метаболитом тестостерона, благодаря активности фермента ароматазы [33]. Роль эстрадиола в действии тестостерона на структуры мозга, участвующие в половом влечении, доказана восстановлением полового поведения у мышей с нокаутом ароматазы при введении эстрадиола [34, 35].
Многофакторное происхождение нарушений полового влечения у людей затрудняет изучение взаимосвязи между тестостероном и либидо. Поэтому эпидемиологические исследования нередко дают противоречивые результаты. Исследование округа Олмстед [36], в котором приняли участие 414 мужчин, не выявило связи между уровнем общего тестостерона и половым влечением, в то время как Массачусетское исследование старения у мужчин (Massachusetts Male Aging Study) отметило [37] лишь о слабой корреляции. И напротив, проспективное популяционное исследование Concord Health and Aging in Men Projects (CHAMP) с участием 1226 пожилых австралийцев [38], обнаружило значительную связь между снижением тестостерона в течение двух лет наблюдения и повышением сексуального интереса. В Европейском исследовании старения мужчин (EMAS, European Male Ageing Study) было обнаружено, что снижение частоты мыслей сексуального характера является одним из симптомов, наиболее специфичных для низких уровней тестостерона при перекрестной оценке. Более того, проспективный анализ подтвердил, что развитие вторичного гипогонадизма связано с возникновением или усугублением низкого либидо. Хотя исследование EMAS обнаружило, что низкое половое влечение является специфическим симптомом гипогонадизма, наличие трех симптомов одновременно (эректильная дисфункция, отсутствие утренней эрекции и низкое половое влечение) обладает большей специфичностью для выявления заболевания [39]. В целом эти результаты подтверждают роль тестостерона в регуляции полового влечения, хотя и подчеркивают, что это не единственный участвующий фактор. Другие гормональные (например, влияние того же пролактина), психические, психологические или фармакологические факторы могут вызывать снижение сексуального влечения [40].
Что касается взаимосвязи между тестостероном и эякуляцией, данные
довольно ограничены. В выборке клиники Флорентийского университета из
почти 3000 мужчин (средний возраст 51,3 ± 13,1 года), обратившихся за
медицинской помощью по поводу сексуальной дисфункции, увеличение
латентного периода эякуляции во время полового акта, о котором они
сообщали, было связано со снижением уровня тестостерона в сыворотке
крови [41]. Тем не менее, популяционное исследование 1429 мужчин из
Финляндии (средний возраст 26,9 ± 4,7 года) не выявило корреляции между
уровнями тестостерона в слюне и латентным временем эякуляции, которое
мужчины оценивали самостоятельно [42].
Социальное поведение
Изучение тестостерона и агрессии зародилось в экспериментальных исследованиях на животных, показавших прямую причинно-следственную связь у некоторых видов. Исследования на людях показали в целом слабую корреляцию между тестостероном и агрессией. Гипотеза вызова, или гипотеза провокации (англ. challenge hypothesis), которую мы рассмотрим далее, позволила сформулировать связь между уровнем тестостерона и поведения у людей в рамках теории, которая подчеркивала гормональные реакции на конкуренцию, влияющие на последующее агрессивное поведение [43, 44]. Кратковременное введение тестостерона молодым женщинам и мужчинам продемонстрировало влияние на поведенческие и нервные процессы, связанные с агрессией. Другие результаты исследований указывают на то, что тестостерон влияет на проявление агрессии у мужчин с высоким уровнем доминирования и у мужчин с низким уровнем кортизола, и что тестостерон может влиять как на агрессивное, так и на просоциальное поведение в контексте экспериментальной игры.
Исследования, положившие начало изучению связи между тестостероном и агрессией, берут свое начало в экспериментальных исследованиях на животных, сначала на домашних птицах, а затем на мышах. За этим последовали исследования на людях с использованием различных показателей агрессии и тестостерона. Метаанализ 42 исследований показал коэффициент корреляции r = 0,08 между уровнем тестостерона и показателями агрессии, что соответствует очень слабой корреляции, причем показатель был больше среди молодых мужчин и правонарушителей [45, 46].
Есть три факта, которые не позволяют сделать вывод о наличии прямой причинно-следственной связи между уровнем тестостерона и выраженностью агрессии как у человека, так и у ряда позвоночных [47]. Во-первых, состязательная деятельность, в том числе связанная с агрессией, может привести к повышению уровня тестостерона. Во-вторых, есть доказательства того, что уровень агрессии не увеличивается в период полового созревания у людей, хотя именно в этот этап жизни уровень тестостерона повышается. В-третьих, несколько контролируемых испытаний влияния длительных инъекций тестостерона на настроение и поведение в целом не продемонстрировали какого-либо значительного влияния, хотя исследования краткосрочного перорального применения тестостерона женщинами показывают ряд изменений, в том числе особенности, связанные с агрессией, и с большей активностью в областях мозга, связанных с агрессией [48, 49, 50].
Бóльшая часть существующих исследований, связывающих уровень тестостерона и поведение у людей, может быть понята с точки зрения эволюционно обоснованной гипотезы вызова, первоначально примененной к птицам [51, 52], упомянутой нами ранее. Суть этой гипотезы заключается в том, что, поскольку постоянно высокие уровни тестостерона имеют дезадаптивные последствия, их следует ограничивать периодами высокой репродуктивной конкуренции, особенно у видов, где существует совместная забота о потомстве, как у людей. Гипотеза вызова способствовала формулировке ряда предположений и для людей: у мужчин не будет повышенной агрессии в период полового созревания, несмотря на повышенный уровень тестостерона; мужчины будут реагировать на сексуальные и соревновательные стимулы повышенным уровнем тестостерона; повышенный уровень тестостерона приведет к большей конкурентной агрессии; отцовская забота снизит уровень тестостерона. Доказательства, впервые рассмотренные в середине 2000-х годов и впоследствии обновленные, в целом подтверждают эти тезисы [53].
В других корреляционных и фармакологических исследованиях изучалась
роль тестостерона в моделировании ультимативной игр. Игра «Ультиматум» —
это классическая задача поведенческой экономики, в которой участвуют
два игрока: одному дается денежная сумма (например, 10 долларов), и у
него есть возможность предложить любую сумму второму игроку, у которого
есть выбор: принять или отклонить предложение. Если второй игрок
соглашается c предложенной суммой, оба участника получают свою долю
денег. Если же он отклоняет предложение, оба участника уходят без денег.
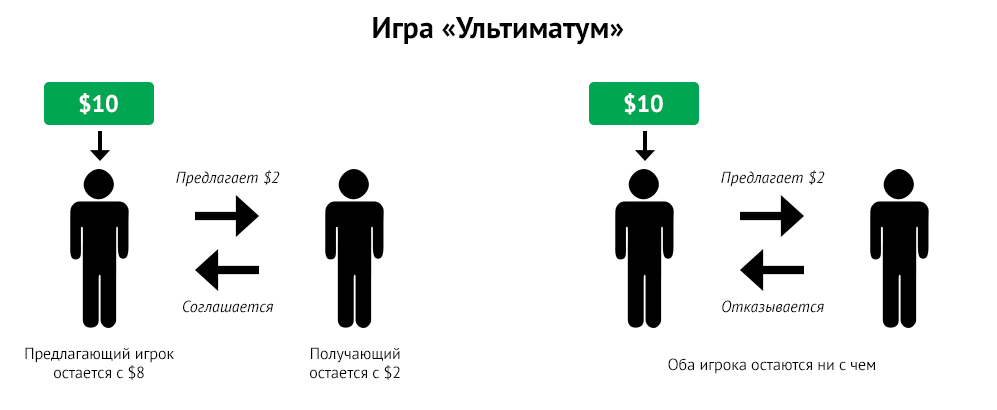
Считается, что какая бы сумма ни была предложена первым игроком второму, он согласится принять свою долю, поскольку в случае отказа оба уйдут ни c чем, однако результаты игры показывают, что люди склонны часто отказывать при несправедливом предложении, чтобы проучить хитрого напарника, прекрасно понимая, что не получат вообще ничего. Этот феномен в экспериментальной экономике получил название «альтруистического наказания».
Два корреляционных исследования показали, что мужчины и женщины с относительно высокими исходными концентрациями тестостерона с большей вероятностью отвергают несправедливые предложения [54, 55]. В недавнем исследовании ученые исследовали влияние экзогенного тестостерона на поведение мужчин в качестве наказания и вознаграждения после несправедливых и справедливых предложений в игре «Ультиматум» [56]. Они не обнаружили влияния тестостерона на количество отказов в игре. Тем не менее, мужчины, получавшие тестостерон, с большей вероятностью отказывались от предложений, чтобы наказать тех, кто предлагал слишком мало, но в то же время они чаще вознаграждали тех, кто делал справедливые предложения [57]. Это исследование показывает, что тестостерон может оказывать как антисоциальное, так и просоциальное воздействие на поведение в зависимости от контекста. Такие данные свидетельствуют о том, что поощрение добросовестных напарников, как и наказание недобросовестных, могут быть способами, с помощью которых человек поддерживает свой социальный статус и репутацию, и что тестостерон играет ключевую роль в изменении социального статуса и решении проблем, связанных с репутацией.
Несмотря на то, что данные о связи между уровнем тестостерона и человеческой агрессией во многом противоречивы, все больше данных свидетельствует о том, что резкие изменения уровня тестостерона в контексте конкуренции и/или социальной провокации могут быть более важны для понимания индивидуальных различий в агрессии человека. Например, в двух исследованиях сообщалось, что резкие изменения концентрации тестостерона во время соревнований положительно коррелировали с агрессивным поведением, измеренным с помощью валидированного теста Point Subtraction Aggression Paradigm (PSAP). Кстати, такая корреляция была характерна для мужчин, но не для женщин [58, 59].
Ментальное здоровье и когнитивные функции
Считается, что тестостерон влияет как на когнитивные способности, так и на психическое здоровье. Исследования показали противоречивые результаты с точки зрения улучшения когнитивных способностей при приеме тестостерона. Исследование 237 пожилых мужчин показало, что у тех, кто получал экзогенный тестостерон, наблюдалось увеличение мышечной массы тела, уменьшение жировой массы и повышение чувствительности к инсулину, но не было отмечено значительного улучшения когнитивных способностей [60]. В рандомизированном двойном слепом исследовании здоровые пожилые мужчины получали 100 мг тестостерона внутримышечно еженедельно (или плацебо) в течение шести недель. Группа, получавшая тестостерон, продемонстрировала значительные кратковременные улучшения пространственной и вербальной памяти. Тем не менее, в этом исследовании не было долгосрочного наблюдения, а также неясно, были ли эффекты вызваны повышенным уровнем тестостерона и/или эстрадиола [61].
Также было показано, что тестостерон влияет на настроение и психическое здоровье. В двухмесячном исследовании с участием 51 мужчины с гипогонадизмом каждые 20 дней испытуемые оценивали параметры настроения по шкале Лайкерта, включая гнев, раздражительность, нервозность и энергичность. Исследование продемонстрировало, что применение гормонозаместительной терапии положительно влияло на настроение, энергию, самочувствие и уменьшало проявления гнева и раздражительности [62].
Симптомы низкого уровня тестостерона часто совпадают с психическими жалобами, включая депрессию и усталость. Было показано, что увеличение уровня тестостерона улучшает настроение у мужчин с низким уровнем тестостерона, хотя этот вывод не был последовательным во всех исследованиях [63]. Несмотря на потенциальное значение низкого уровня тестостерона в психиатрии, распространенность низкого уровня тестостерона среди мужчин, обращающихся в психиатрические клиники с жалобами на психическое здоровье, неизвестна.
Иммунитет и сопротивляемость инфекциям
Хиллгарт и соавт. еще в 1997 выдвинули гипотезу о том, что
иммунодепрессивный эффект тестостерона защищает гаплоидные
сперматозоиды, которые являются антигенными, поскольку клетки
формируются спустя много времени после развития иммунной системы.
Несмотря на частичную защиту сперматоцитов клетками Сертоли и
гематотестикулярным барьером, некоторые лимфоциты все же могут проходить
в семенные канальцы [64]. Хиллгарт и его исследовательская группа тогда
предположили, что тестостерон подавляет выработку антител для защиты
сперматозоидов с антигенными свойствами. Таким образом, тестостерон
может плейотропно снижать выработку антител в целом, когда он находится в
системном кровотоке для регуляции других вторичных половых признаков.
Хотя гипотеза защиты сперматозоидов может объяснить некоторое снижение
уровня гуморального иммунитета у мужчин с высоким уровнем тестостерона,
она все же не объясняет изменения количества циркулирующих лейкоцитов,
связанные с повышенным уровнем тестостерона.
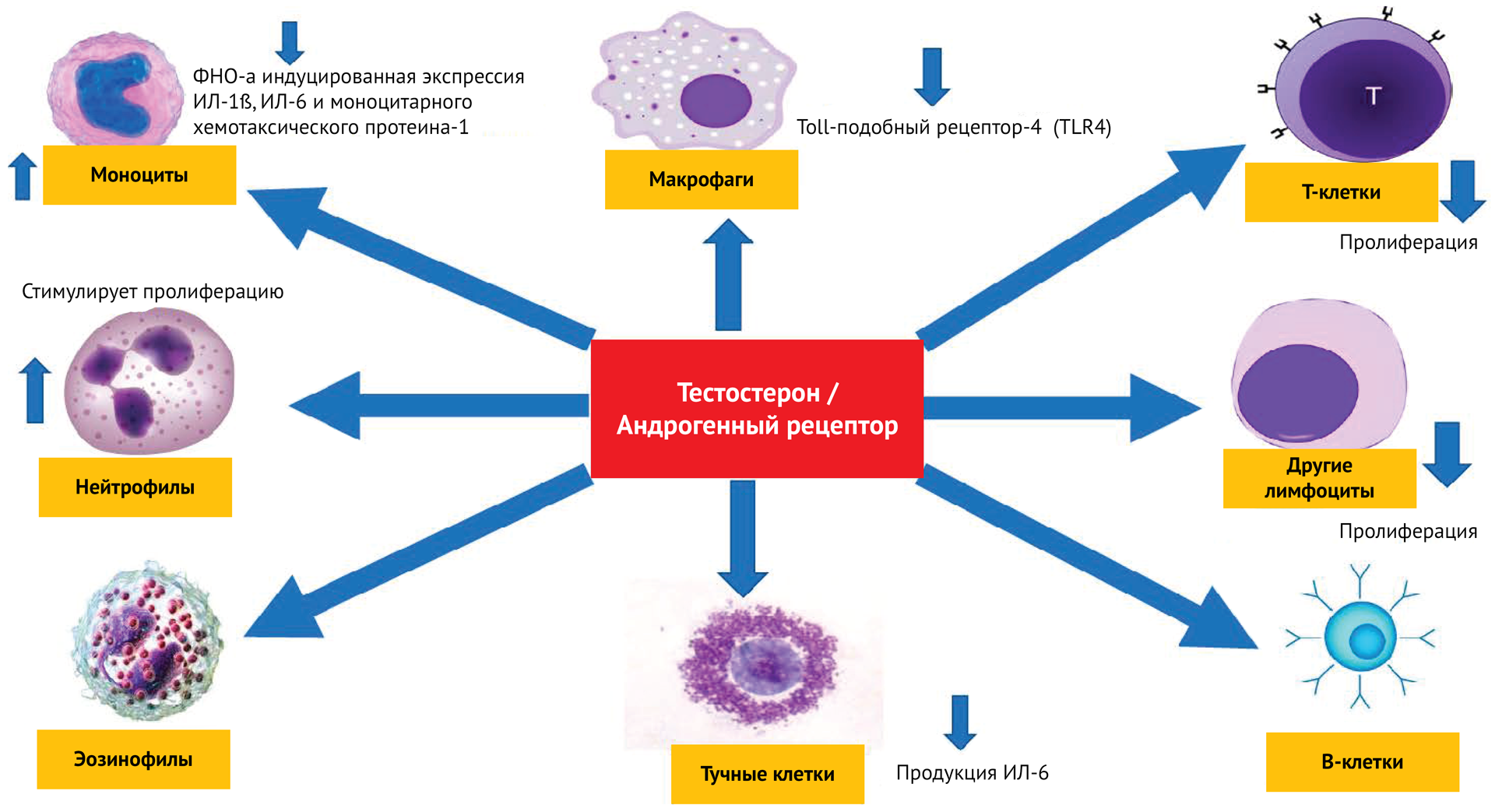
Новое понимание иммунного ответа на стресс предлагает альтернативное объяснение корреляции высокого уровня тестостерона и изменений в иммунной системе. Авторы ряда исследований предполагают, что лейкоциты временно перемещаются в разные отделы иммунной системы в ответ на высвобождение тестостерона, как и в ответ на другие стероиды. Этот процесс, называемый перераспределением иммунных клеток, легко спутать с иммуносупрессией, если иммунитет оценивают по количеству лейкоцитов в периферической крови, или если показатели иммунитета оцениваются только один раз или только в одной ткани.
В отличие от иммуносупрессии, перераспределение — это их временное перемещение иммунных клеток в компартменты, где в данное время они могут быть более полезными, но, возможно, с меньшей вероятностью будут обнаружены. Это хорошо описанная реакция на стресс, как и связанное с ней повышение уровня циркулирующих кортикостероидов.
Иммуносупрессия же подразумевает, что существует единственная иммунная система, которая не может адекватно работать во всем организме, и что более низкое количество иммунных клеток является результатом элиминации или снижения их продукции.
Авторы ряда исследований предполагают три возможных механизма для опосредованного тестостероном перераспределения клеток иммунитета. Во-первых, тестостерон может напрямую активировать миграцию клеток в определенные ткани, связываясь с рецепторами в лейкоцитах или эндотелиоцитах [65]. Такие рецепторы для стероидных гормонов были идентифицированы еще в конце 90-х годов XX века. Во-вторых, тестостерон может повышать уровень кортикостероидов, что, в свою очередь, запускает перераспределение иммунных клеток [66, 67]. Наконец, высокий уровень тестостерона может просто коррелировать с высоким уровнем кортикостероидов из-за стресса [68, 69, 70].
Причина появления гипотезы о том, что тестостерон является иммунодепрессантом, по-видимому, связана с эпидемиологическими данными о том, что мужчины подвержены более высокому уровню инфекций и заболеваний, чем женщины. Однако еще в 1990-м году исследование группы американских паразитологов [71] продемонстрировало, что многие случаи заболеваний и смертности у самцов многих видов связаны с косвенным воздействием тестостерона на поведение. Например, мужчины часто ведут себя более рискованно и поэтому подвержены воздействию других инфекционных агентов, чем женщины [72]. Таким образом, авторы призывали отличать экологические причины от физиологических.
В этой связи интересно рассмотреть влияние тестостерона на то, как во
время пандемии мужчины переносили и переносят новую (сейчас, скорее,
уже привычную) коронавирусную инфекцию 2019 года.
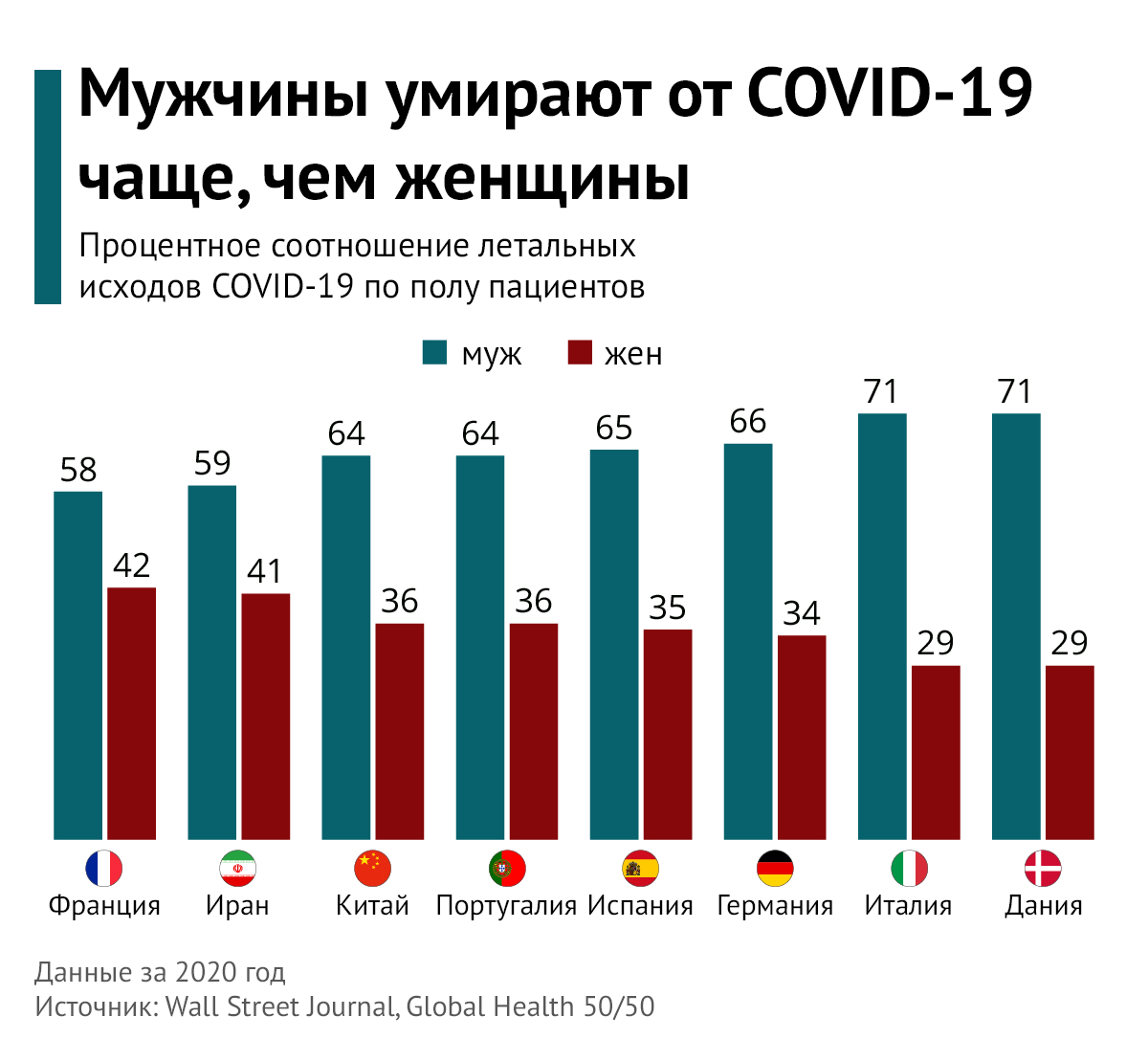
Ряд исследований еще c первой волны пандемии демонстрировали свои данные, согласно которым популяция пациентов с подтвержденным COVID-19 на 58 % состоит из мужчин [73, 74, 75]. Разница по полу в количестве случаев постепенно увеличивается в пользу мужского пола вплоть до возрастной группы 60–69 (66,6 %) и 70–79 лет (66,1 %), за исключением групп 20–29 лет и 30–39 лет, в которой число женщин несколько выше. Кроме того, авторами исследования отмечалась более высокая летальность среди мужчин во всех возрастных группах. Смертность среди возрастной группы 30–39 лет составляет 82,4 % мужчин; среди 40–49 лет — 73,1 % мужчин; среди 50-59 лет — 78,5 % мужчин; среди 60-69 лет — 79,7% мужчин; среди 70–79 лет — 79,6 % мужчин; среди 80-89 лет — 66,9 % мужчин [76].
Было установлено, что летальность от COVID-19 среди мужчин выше, чем у женщин, даже при контроле факторов риска, чаще встречающихся у мужчин, таких как гипертония, курение или ССЗ. Это привело ученых к мыслям о том, что тестостерон играет роль в тяжести заболевания. Для связывания S-белков SARS-CoV-2 с рецепторами ангиотензинпревращающего фермента 2 типа (АПФ2) необходим их прайминг — предварительная активация, которую обеспечивает сериновая протеаза TMPRSS2, трансмембранный клеточный белок. Экспрессия гена данной протеазы (ген TMPRSS2) регулируется тестостероном [77]. Кроме того, S-белки SARS-CoV-2 затем связываются с рецепторами для входа в клетки организма-хозяина, а экспрессия рецепторов АПФ2 также регулируются тестостероном.
Достоверно установлено, что концентрация тестостерона в плазме снижается с возрастом и сопутствующими заболеваниями, такими как ожирение, сахарный диабет и синдром обструктивного апноэ сна.Все эти сопутствующие заболевания широко распространены у пациентов с COVID-19 [78]. SARS-CoV2 поражает клетки альвеолярного эпителия легких, используя в качестве входного рецептора АПФ2 [79]. АПФ2 играет роль в защите легких, и поэтому связывание вируса с этим рецептором может повышать уязвимость легких к самым разным поражающим факторам [80]. Интересно, что исследования показали, что АПФ2 конститутивно синтезируется клетками Лейдига, что предполагает возможное вовлечение яичка в инфекционный процесс у зараженных COVID-19 пациентов. Этот фактор, который,в свою очередь, может влиять на секрецию тестостерона [81].
Провоспалительные цитокины играют центральную роль в прогрессировании COVID-19. Снижение активности цитокинов и/или снижение уровня экспрессии рецепторов к ним (антицитокиновая терапия) тоже может быть полезным в терапии COVID-19. В этом контексте тестостерон может подавлять воспаление. Фактически, несколько исследований, проведенных как на животных, так и на людях, показали, что гипогонадизм связан с повышением провоспалительных цитокинов и что лечение тестостероном снижает уровни IL-1β, IL-6 и TNF-α [82]. Кроме того, связь между повышением провоспалительных цитокинов и снижением уровня тестостерона часто наблюдается у пожилых мужчин [83] и у мужчин c ИБС [84]. Исходя из вышеизложенного, возникает гипотеза, что тестостерон может играть роль в каскаде событий, приводящих к прогрессированию инфекции COVID-19 из-за цитокинового шторма. Подавление экспрессии АПФ2 воспалительными цитокинами, сопровождающееся снижением уровня андрогенов и эстрогенов у пожилых мужчин, может установить отрицательную корреляцию между экспрессией АПФ2 и смертностью от COVID-19 [85].
Вернемся к тестостерон-управляемой теории COVID-19 [86]. Она основана
на активации экспрессии уже упомянутой трансмембранной протеазы серина
2, опосредованной андрогенами (TMPRSS2) [87]. И хотя были описаны и
другие протеазы, активирующие S-белок SARS-CoV-2 in vitro,
только активность TMPRSS2 считается существенной для распространения
вируса и патогенеза COVID-19 [88]. TMPRSS2 также может расщеплять АПФ2,
способствуя вирусной транскрипции. Трансляция рецептора андрогена
(androgen receptor, AR) считалась требованием для транскрипции гена TMPRSS2, поскольку ни один другой известный промотор гена TMPRSS2 не
оказывал такого же действия у людей [89]. Было высказано предположение,
что модуляция экспрессии TMPRSS2 тестостероном способствует
преобладанию мужчин среди больных COVID-19 [90]. Наконец, TMPRSS2 является
как наиболее часто изменяемым геном при первичном раке предстательной
железы, так и критическим фактором, способствующим проникновению
SARS-CoV-2 внутрь клетки [91].
Была предложена роль вариантов TMPRSS2 и
уровней его экспрессии в модуляции тяжести COVID-19, что было вскоре
подтверждено на больших группах пациентов с различными клиническими
проявлениями COVID-19 [92]. Поскольку TMPRSS2 экспрессируется
также в легких, использование ингибиторов протеазы TMPRSS2, применяемых в
настоящее время для лечения рака предстательной железы, представляла
собой привлекательную мишень для профилактики или лечения COVID-19.
Необходимы исследования для подтверждения этой гипотезы и оценки
терапевтического и профилактического потенциала препаратов, нацеленных
на активность андрогенов, таких как ингибиторы рецепторов андрогенов,
ингибиторы стероидогенеза и ингибиторы 5-α-редуктазы.
Респираторные заболевания
Может быть, тестостерон влиял не только на восприимчивость организма к вирусу, но и на тяжесть осложнений со стороны дыхательной системы? Не все так просто.
Как правило, среди большого числа мужчин с тяжелым течением коронавирусной инфекции был описан как раз-таки гипогонадизм. В исследовании итальянских ученых проанализировали, могут ли низкие значения тестостерона влиять на клиническую картину и исход пневмонии, связанной с SARS-CoV-2, на выборке из 221 взрослых мужчин с СOVID-19 [93]. Оценивались соотношение артериального парциального давления кислорода (PaO2) и фракции вдыхаемого кислорода (FiO2), сывороточные параметры тестостерона и маркеры воспаления при включении в исследование, потребность в ИВЛ и госпитальная смертность.
Мужчины с низким уровнем тестостерона (< 8 нмоль / л; 176 случаев) были значительно старше и демонстрировали более высокий уровень сывороточного ИЛ-6, С-реактивного белка, лактатдегидрогеназы, ферритина,более низкое соотношение PaO2/FiO2, среди них чаще встречалась острая дыхательная недостаточность, более частая потребность в ИВЛ и более высокий уровень смертности по сравнению с пациентами с более высокими уровнями тестостерона. Таким образом, низкие значения уровня тестостерона были связаны с неблагоприятным исходом COVID-19.
Что касается других распространенных заболеваний дыхательной системы, таких как хроническая обструктивная болезнь легких (ХОБЛ) и бронхиальная астма (БА), то дефицит тестостерона часто встречается у мужчин с ХОБЛ и может усугубить течение заболевания. Исследования показывают, что заместительная терапия тестостероном может оказывать благотворное влияние на респираторные исходы у мужчин с ХОБЛ. Ученые из США в 2018 году провели два ретроспективных когортных исследования [94]. Они исследовали две группы пациентов: 450 мужчин c ХОБЛ в возрасте 40–63 лет которые начали гормонозаместительную терапию тестостероном (ГЗТТ), и исследованы 253 мужчин c ХОБЛ и получающие ГЗТТ в возрасте старше 66 лет. Результаты показали, что у получавших ГЗТТ ниже частота госпитализаций по поводу респираторных осложнений/обострений ХОБЛ по сравнению с мужчинами, не получавшими ГЗТТ. В частности, пациенты 40–63 лет на ГЗТТ показали снижение госпитализаций по поводу респираторных заболеваний на 4,2 % по сравнению с теми, кто не получал ГЗТТ, причем пожилые пациенты имели частоту госпитализаций на 9,1 % ниже по сравнению с группой, не получавшей ГЗТТ. Эти данные свидетельствуют о том, что ГЗТТ может замедлить прогрессирование заболевания у пациентов с ХОБЛ [95].
Распространенность астмы среди подростков выше у мальчиков в
препубертатном периоде, a по мере взросления частота БА все же
преобладает среди женщин [96]. Многие эпидемиологические исследования
также показывают, что женщины подвергаются повышенному риску развития
астмы во взрослом возрасте, а также страдают более тяжелой формой БА,
чем мужчины [97]. Это свидетельствует о важной роли половых гормонов в
развитии БА. Множество исследований показали, что тестостерон и/или его
метаболиты поддерживают физиологический баланс аутоиммунитета и
защитного иммунитета, сохраняя количество регуляторных клеток.
Тестостерон является иммунодепрессантом и, вероятно, защищает от
иммунологических и воспалительных процессов, которые протекают при БА
[98].
Сердечно-сосудистые заболевания
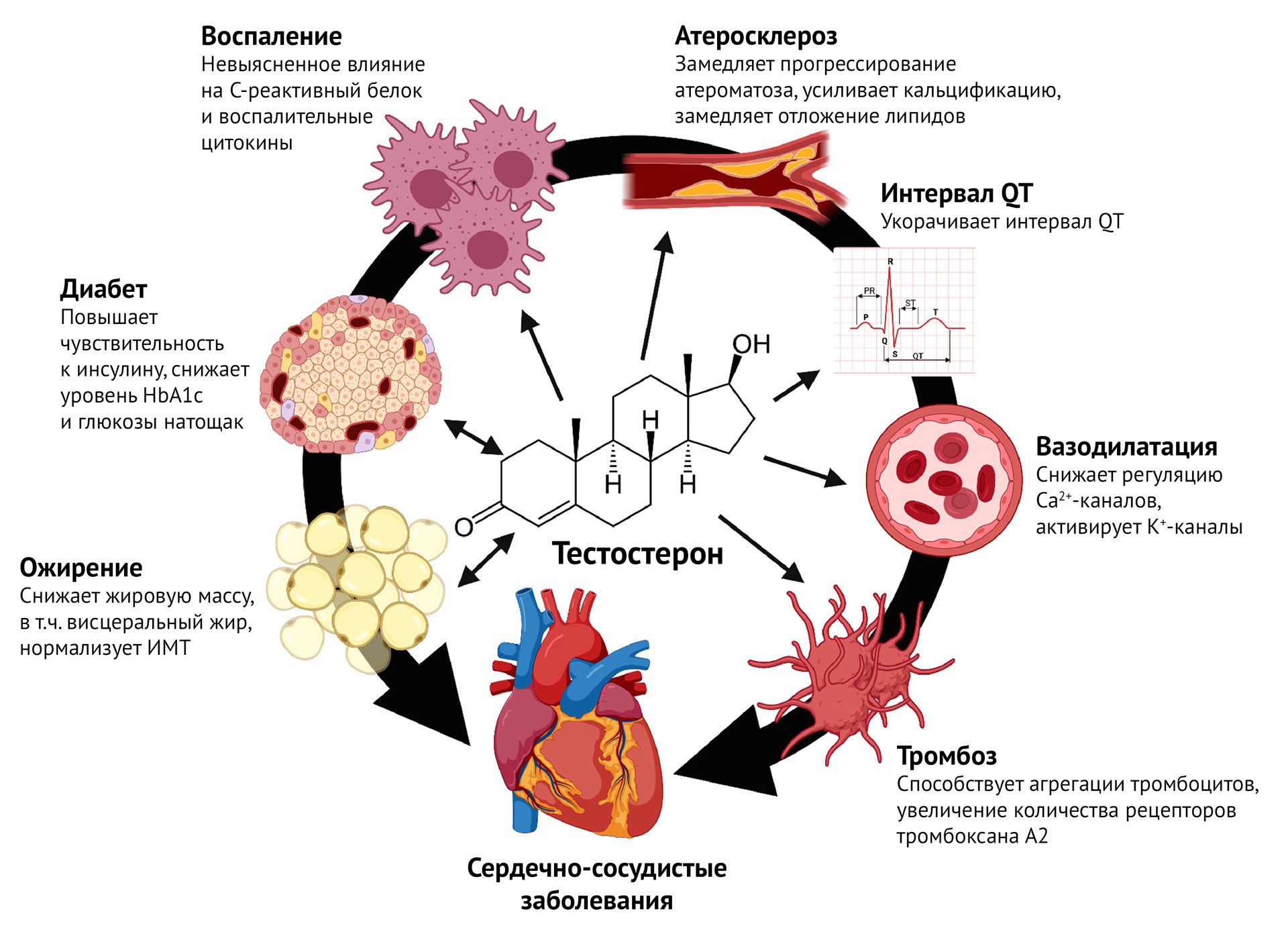
Тестостерон напрямую действует на структуру и функцию миокарда и сосудов, а прием анаболических стероидов увеличивает риск развития сердечно-сосудистых заболеваний (ССЗ). Кроме того, многие исследования показали, что дефицит тестостерона является независимым фактором риска развития ССЗ и летального исхода от других причин [99]. Ранее легкодоступные 17-алкилированные стероиды были популярными суррогатными веществами для изготовления тестостерона. Эти вещества, однако, были способны индуцировать несколько факторов риска ишемической болезни сердца и как следствие, особенно после обширного злоупотребления 17-алкилированным анаболическим стероидом спортсменами, тестостерон стали несправедливо обвинять в развитии ССЗ [100]. Доказательства, однако, позволяют предложить как раз обратное: тестостерон может обладать кардиопротективным действием. Еще в начале нулевых ученые продемонстрировали, что по сравнению с контрольной группой мужчины с ИБС, как правило, имеют: более низкие уровни общего тестостерона и индексы свободных андрогенов, больше абдоминального жира, более высокий уровень сахара в крови и инсулина [102].
Внутрикоронарная инфузия тестостерона вызывает значительное расширение коронарных сосудов, а не их сужение, как было принято считать в конце 90-х XX века [103]. Когда степень коронарного стеноза оценивается с помощью ангиографии, существует прямая связь между степенью сужения коронарных артерий и снижением уровня тестостерона. У мужчин с низким уровнем тестостерона наблюдались: преждевременный атеросклероз, увеличение висцеральной жировой ткани, гиперинсулинемия и другие факторы риска инфаркта миокарда. Было показано, что резистентность к инсулину связана со снижением секреции тестостерона клетками Лейдига [104]. Также предполагается, что низкие уровни эндогенного общего тестостерона и ГСПГ увеличивают риск метаболического синдрома у пожилых мужчин. Доказано, что низкие уровни тестостерона связаны с более низкой чувствительностью к инсулину и более высокими уровнями глюкозы натощак [105]. Таким образом, можно предполагать, что тестостерон играет защитную роль в развитии метаболического синдрома, резистентности к инсулину, сахарного диабета и сердечно-сосудистых заболеваний у пожилых мужчин.
Давно продемонстрировано, что мужчины с повышенным индексом массы тела имели как пониженный тестостерон, так и пониженный уровень липопротеинов высокой плотности (антиатерогенные липопротеины, ЛПВП), a в результате применения препаратов тестостерона уровень ЛПВП увеличился [106]. Чаще, однако, происходило снижение уровня общего холестерина, липопротеинов низкой плотности (атерогенные липопротеины) и уровня триглицеридов [107].
В середине нулевых в США провели проспективное исследование вклада
стресса в ишемическую болезнь сердца [108]. Их исследование, в котором
приняли участие 2512 мужчин в возрасте от 45 до 59 лет, включало анализ
ряда метаболических параметров. Они обнаружили, что повышенное
соотношение кортизола и тестостерона связано с высоким риском
ишемической болезни сердца и что этот риск опосредуется компонентами
синдрома резистентности к инсулину. Сообщалось, что высокий уровень
кортизола и низкий уровень тестостерона связаны с ухудшением
резистентности к инсулину и что есть доказательства в поддержку
возможности улучшения этой ситуации путем терапии экзогенным
тестостероном.
Эндокринная патология
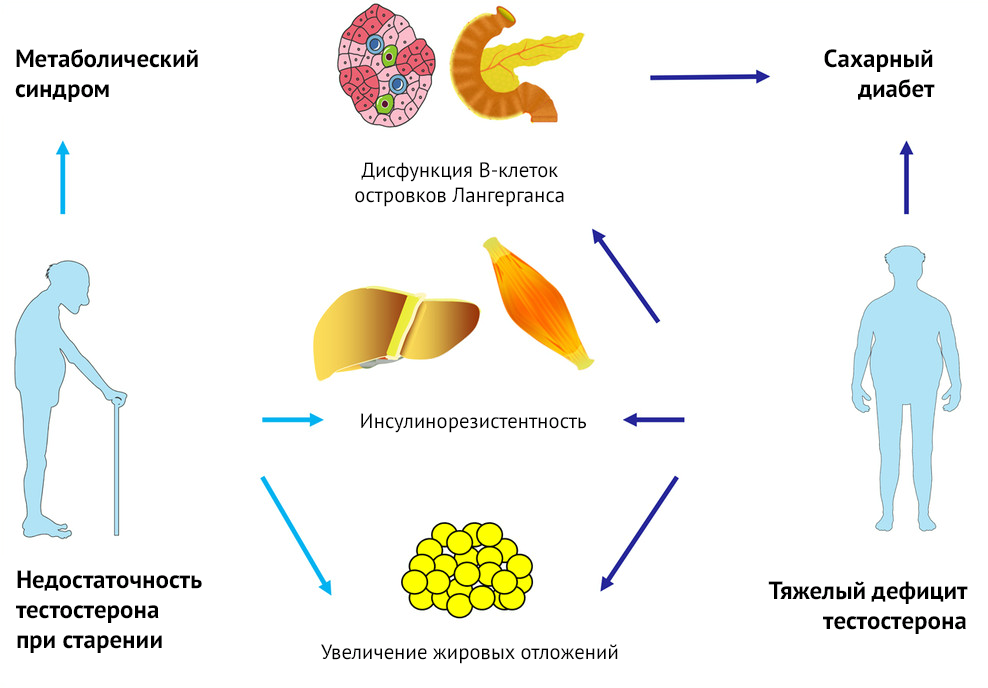
Прослеживается интересная взаимосвязь в исследованиях, посвященных изучению уровня тестостерона при сахарном диабете 2 типа, ожирении и метаболическом синдроме.
Мужчины с метаболическим синдромом подвергаются повышенному риску развития ИБС и сахарного диабета 2 типа. Прогнозирование того, у кого может развиться метаболический синдром, позволит принять профилактические меры в дополнение к контролю веса и другим изменениям образа жизни, таким как прекращение курения и увеличение физической активности. Известно, что при снижении уровня тестостерона у мужчин старшего возраста происходит увеличение жировой и уменьшение мышечной массы тела, возникают нарушения метаболизма инсулина и глюкозы, развивается дислипидемия. Исследования ученых Массачусетского университета показали [109], что у мужчин с низким уровнем тестостерона, ГСПГ или клиническим дефицитом андрогенов, особенно при ИМТ > 25 кг/м2, увеличивается риск развития метаболического синдрома и, следовательно, сахарного диабета 2 типа и ИБС.
Жировая ткань содержит высокие концентрации ароматазы, что ускоряет ход преобразования тестостерона в эстрадиол. Эстрадиол, в свою очередь, подавляет секрецию гонадотропина, что снижает выработку тестостерона. Известно, однако, что мужчины c ожирением и диабетом демонстрируют более низкие уровни ГСПГ и общего тестостерона. Среди 103 пациентов мужского пола c диагностированным сахарным диабетом 2 типа 14 (25 %) имели свободный тестостерон ниже 0,174 нмоль/л. Также обнаружилось, что концентрации ЛГ и ФСГ среди них были значительно ниже [110]. Таким образом, авторы пришли к выводу, что гипогонадотропный гипогонадизм был распространенным явлением при диабете 2 типа независимо от продолжительности заболевания или наличия осложнений.
Исследование у мужчин с диабетом уровня тестостерона может иметь
прикладное клиническое значение. В двойном слепом плацебо-контролируемом
исследовании c целью определения влияния терапии тестостероном на
резистентность к инсулину у гипогонадных мужчин с диабетом 2 типа
обнаружилось, что у мужчин, получавших тестостерон, наблюдалось снижение
резистентности к инсулину, уменьшение уровней гликированного
гемоглобина, глюкозы натощак, общего холестерина и уменьшение окружности
талии [111].
Функция опорно-двигательного аппарата
Тестостерон влияет на костную ткань двумя путями. Первый путь опосредован превращением тестостерона в эстрадиол под действием ароматазы. Эстрадиол блокирует деятельность остеокластов и, следовательно, подавляет резорбцию костной ткани. Второй путь — преобразование в дигидротестостерон при помощи 5-α-редуктазы, стимулирующее деление остеобластов, которые синтезируют матрикс кости [112]. У мужчин с гипогонадизмом выше риск развития остеопении или остеопороза и, как следствие, увеличена частота патологических переломов. Около трети всех переломов бедра происходит у мужчин c остеопорозом, и риск любого перелома у мужчин c остеопорозом старше 50 лет достигает 25 % [113]. Применение ГЗТТ демонстрировало увеличение минеральной плотности костей у мужчин c гипогонадизмом [114].
Тестостерон способствует сохранению азота и является важным компонентом в развитии и поддержании мышечной массы. При снижении уровня тестостерона, мышечная масса и сила уменьшаются, в результате чего пациенты отмечают слабость и усталость. Ряд исследований продемонстрировали способность тестостерона восстанавливать мышечную массу у мужчин c гипогонадизмом, одновременно вызывая потерю жировой массы [115]. Из-за снижения мышечной массы и плотности костей у пожилых людей выше риск получить перелом при падении [116].
Заключение
Тестостерон — это гормон с множеством физиологических функций, играющий огромную роль в репродуктивной функции и обмене веществ у мужчин от внутриутробного развития до глубокой старости. Не стоит воспринимать тестостерон как волшебный эликсир молодости или силы, учитывая его противоречивые эффекты. Никогда не назначайте гормонозаместительную терапию сами себе: в погоне за телом олимпийского бога вы рискуете приобрести лишь аденокарциному простаты.





