В арсенале бактерий есть множество механизмов, чтобы сделать противомикробные препараты неэффективными: эффлюксные насосы, которые способствуют удалению соединений из клетки, ферментативное расщепление противомикробного соединения и модификация микробной мишени. Это лишь некоторые из широко распространенных средств защиты у бактерий. Эти хорошо описанные механизмы устойчивости к противомикробным препаратам (УПП) можно контролировать с помощью тестирования чувствительности in vitro и генетических методов.
Недавно была обнаружена новая форма УПП, которую было невозможно выявить с помощью традиционных методов лабораторных исследований. Механизм, для которого требуется метаболит макроорганизма, позволяет стрептококкам группы A поглощать питательные вещества от человека и формировать устойчивость к сульфаметоксазолу. Уточним, что бактерии получают внеклеточные восстановленные соединения фолиевой кислоты непосредственно от макроорганизма, чтобы обойти ингибируемый сульфаметоксазолом путь биосинтеза фолиевой кислоты.
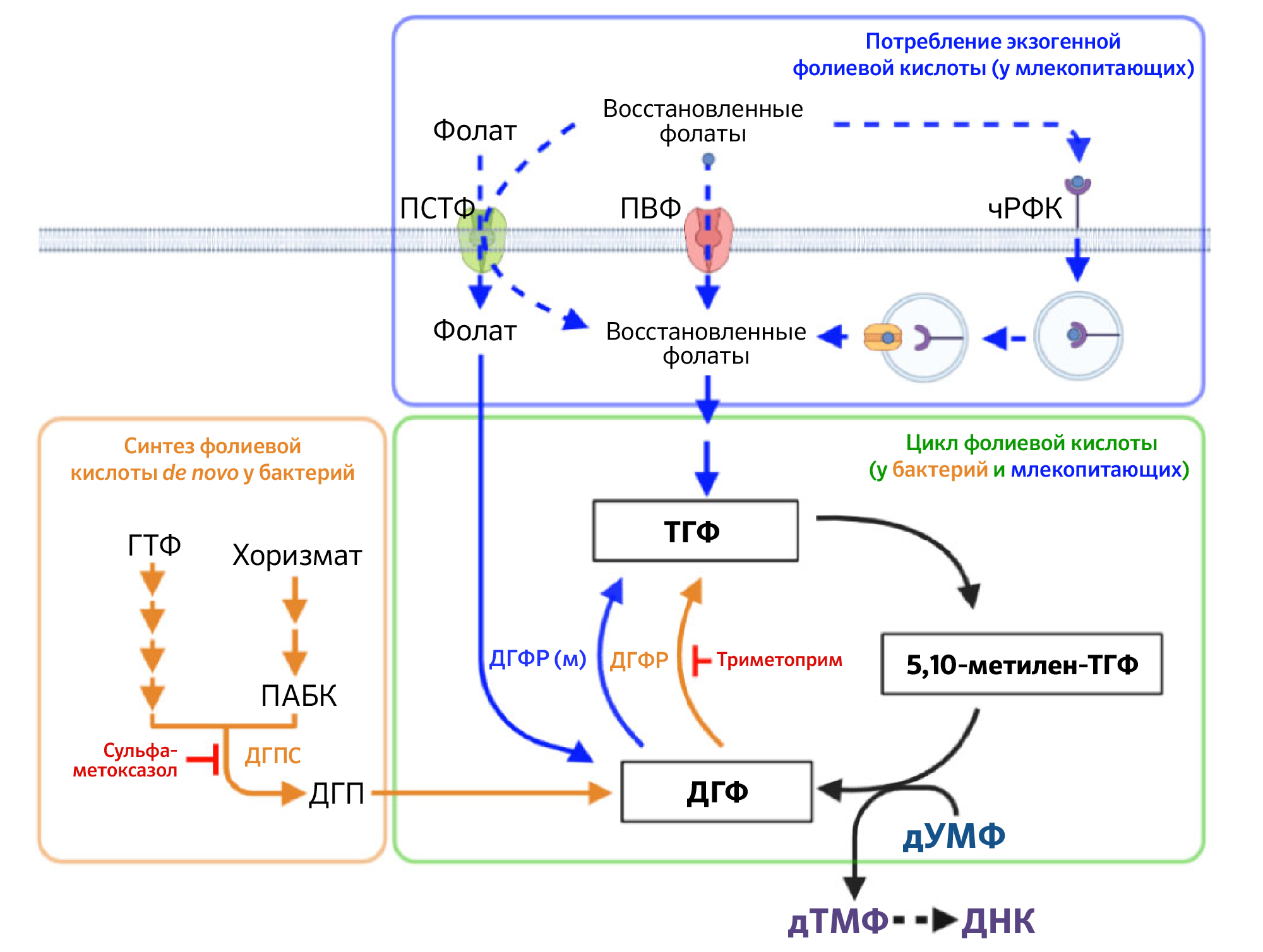
Рисунок 1 | Обзор метаболизма фолиевой кислоты у бактерий и млекопитающих и мишеней сульфаметоксазола (SMX) и триметоприма (TMP)Оранжевые стрелки показывают пути, специфичные для бактерий, а синие — для млекопитающих. Черные стрелки отражают процессы, происходящие как у бактерий, так и у млекопитающих. Дигидрофолатредуктаза млекопитающих (мДГФР) восстанавливает фолиевую кислоту до дигидрофолата (ДГФ), в то время как бактериальные изоферменты дигидрофолатредуктазы не способны катализировать эту реакцию. Пути поглощения экзогенно поступающей фолиевой кислоты млекопитающими могут накапливать несколько восстановленных субстратов фолиевой кислоты (ПВФ, переносчик восстановленных фолатов) и чРФК (человеческий рецептор фолиевой кислоты) или фолиевую кислоту в дополнение к восстановленным фолатам (ПСТФ, протон-сопряженный транспортер фолатов). ПВФ является основным переносчиком фолата по всем тканям, в то время как чРФК и ПСТФ являются тканеспецифичными.
ПВФ — переносчик восстановленных фолатов; чРФК — человеческий рецептор фолиевой кислоты; ПСТФ — протон-сопряженный транспортер фолатов; ГТФ — гуанозинтрифосфат; ДГП — дигидроптероат; ДГФ — дигидрофолат; ТГФК — тетрагидрофолиевая кислота; ПАБК — парааминобензойная кислота; дУМФ — дезоксиуридинмонофосфат; дТМФ — дезокситимидинмонофосфат; TMP — триметоприм, SMX — сульфаметоксазол,
ДГФР — дигидрофолатредуктаза млекопитающих.
Данное исследование опубликовано в Nature Communications в статье «Зависимая от макроорганизма резистентность стрептококка группы А к сульфаметоксазолу, опосредованная транспортером восстановленной фолиевой кислоты, полученного путем горизонтального переноса генов».
Устойчивость к противомикробным препаратам — это тихая пандемия, представляющая гораздо больший риск для общества, чем COVID-19, — отмечает Тимоти Барнетт, PhD, глава отдела патогенеза и диагностики стрептококка А из Wesfarmers Centre of Vaccines and Infectious Diseases, который базируется в Telethon Kids Institute в Перте, Западная Австралия. Барнетт подчеркивает, что по оценкам Всемирной организации здравоохранения, помимо 10 миллионов смертей в год, к 2050 году УПП обойдется мировой экономике в 100 трлн долларов, если не удастся преодолеть неэффективность антибиотиков и антибактериальных химиотерапевтических средств.
Барнетт продолжает, что без антибактериальных препаратов человечество столкнется с миром, в котором не будет способа остановить смертельно опасные инфекции. У онкобольных не будет шанса на химиотерапию, а людям будет невозможно проводить жизненно важные операции. Чтобы сохранить долгосрочную эффективность антибиотиков, необходимо дополнительно выявить и разобраться в новых механизмах устойчивости к антибиотикам, что поможет в открытии новых антибактериальных средств и позволит проводить мониторинг УПП по мере возникновения последней.
Для своего роста бактерии вынуждены производить собственные фолаты. Некоторые противомикробные препараты, такие как сульфаметоксазол и триметоприм, блокируют синтез фолиевой кислоты, что останавливает размножение бактерий.
При изучении антибактериального средства сульфаметоксазола, обычно назначаемого для лечения кожных инфекций, вызванных стрептококком группы А, исследователи воспользовались комбинацией эволюции in vitro и экспериментов по восстановлению метаболизма, чтобы определить механизм резистентности, при котором бактерии впервые стали способны принимать фолаты непосредственно от макроорганизма, когда у бактерий не было возможностей производить собственную фолиевую кислоту.
В частности, удалось обнаружить ген thfT — ген S-компонента переносчика фактора передачи энергии (ECF, energy-coupling factor; transporter S component gene, thfT), который позволяет стрептококкам группы A получать внеклеточные восстановленные соединения фолиевой кислоты. Авторы отмечают, что наличие гена thfT, по всей видимости, расширяет субстратную специфичность эндогенного переносчика ECF, что облегчает получение восстановленных соединений фолиевой кислоты непосредственно от макроорганизма и позволяет обойти путь ингибирования биосинтеза фолиевой кислоты сульфаметоксазолом.
Авторы поясняют, что thfT является функциональным эквивалентом эукариотических путей поглощения фолиевой кислоты, который придает очень высокий уровень устойчивости к сульфаметоксазолу, однако не обнаруживается при выращивании стрептококка группы А в условиях, когда восстановленные фолаты отсутствуют.
Поскольку новая форма устойчивости не поддается обнаружению в условиях, обычно используемых в лабораториях, клиницистам очень трудно назначать антибиотики и противомикробные препараты, которые будут эффективно способствовать лечению инфекции, что может привести к крайне негативным результатам и даже к преждевременному летальному исходу.
Как отмечает Барнетт, к сожалению, есть подозрения, что это лишь верхушка айсберга. Этот механизм определен для стрептококка группы А, но, вероятно, это также распространяется и на другие группы бактерий.
Теперь команда исследователей сосредоточится на разработке методов диагностики для выявления этого механизма устойчивости к антибактериальным препаратам, чтобы разработать эффективное лечение.
Калинду Родриго, аспирант лаборатории Барнетта, отмечает, что очень важно, чтобы удалось хотя бы на шаг вырваться вперед в плане диагностики и лечения УПП. Как исследователи, мы должны продолжать изучать, как развивается устойчивость у патогенов, а также разрабатывать быстрые и точные методы диагностики и терапии. С другой стороны, равные усилия должны быть предприняты на всех уровнях медицинского общества, включая даже и пациентов, медицинских работников всех уровней и представителей общественного здравоохранения, чтобы помочь уменьшить воздействие УПП.





