Наука не стоит на месте, и одно из последних тому свидетельств — признание микробиома (включая «полиморфных микробов») одним из ключевых признаков рака. Микроорганизмы могут сами выступать канцерогенами, влияя на иммунные реакции хозяина и способствуя развитию злокачественных новообразований, или же могут быть ключевыми эффекторами, определяющими эффективность противоопухолевой терапии. Воздействие на микробиом открывает новые способы влияния на исход онкологических заболеваний.
Введение
В 2000 году Дуглас Ханахан и Роберт Вайнберг опубликовали основополагающую статью «Признаки рака», в которой изложили шесть основных механизмов, по которым происходит многоступенчатая трансформация нормальных клеток в злокачественные [1]. Более 20 лет спустя в третьем обновлении работы «Признаки рака: новые измерения» шесть первоначальных признаков расширились до четырнадцати (рис. 1). Последними были добавлены 4 пункта, которые включали разблокировку фенотипической пластичности, немутагенное эпигенетическое репрограммирование, старение клеток и наличие полиморфных микроорганизмов.
Присутствие полиморфных микроорганизмов в этом списке отражает растущее понимание того, что сложные микробные экосистемы (т.е. «микробиом») — включая бактерии, грибы и вирусы, которые симбиотически связаны с человеческим организмом, — играют значимую роль в патогенезе рака [2]. Сегодня доказано, что микробиом сильно вовлечен в процессы онкогенеза, дифференцировку раковых клеток и злокачественную прогрессию [1,3]. Кроме того, микробиом напрямую взаимодействует как положительно, так и отрицательно, с другими установленными признаками рака: воспалением в опухолевой ткани, избеганием иммунного ответа, нестабильностью генома и устойчивостью к противоопухолевой терапии [1]. Наиболее важные доказательства такой комплексной роли получены в результате подробного изучения микробов желудочно-кишечного тракта. Однако в последнее время все большее внимание уделяется роли полиморфных микробов в других тканях/органах, в том числе на других слизистых поверхностях и/или в контакте с внешней средой (например, на коже, в мочеполовых путях и легких), а также роли микробов, обитающих внутри опухолей (внутриопухолевый микробиом).
Микробиом кишечника
По оценкам, в теле человека содержится порядка 4 × 1013 микроорганизмов, а совокупный микробный геном — или «метагеном» — превышает геном человека более чем в 100 раз [4]. Более 97 % микробиома составляют бактерии толстой кишки, и считается, что их высокая плотность обуславливает большинство известных микробных иммуномодулирующих эффектов. В настоящее время появляется все больше доказательств того, что полиморфные микробы в кишечнике играют ключевую роль в патогенезе рака — от участия в возникновении опухоли до влияния на эффективность противоопухолевой терапии [3].
Функциональные исследования по трансплантации фекальной микробиоты (ФМТ) от пациентов с колоректальным раком мышам-реципиентам, предрасположенным к развитию рака толстой кишки, установили принцип, согласно которому микробы обладают как проонкогенными, так и онкопротективными свойствами [5]. Более того, нарушение микробной популяции кишечника (дисбиоз), вызванное инфекцией или приемом антибиотиков, неизменно связывают с канцерогенезом в толстой кишке и других органах [3,6]. Несмотря на четкое определение этой взаимосвязи, из примерно 1012 различных видов микроорганизмов на Земле только 11 определены как прямые канцерогены человека (онкомикробы); например, некоторые штаммы кишечной палочки продуцируют мощный алкилятор ДНК — колибактин, связанный с колоректальным раком [7]. Необходимо отметить, что кишечные микроорганизмы являются лишь «соучастниками», неспособными самостоятельно вызывать канцерогенез, однако потенцирующими другие механизмы развития рака. Bacteroides fragilis вырабатывает токсины, которые связываются с эпителиальными клетками внутренней поверхности толстой кишки, стимулируя сигнализацию пролиферации (признак рака; рис.1), что способствует развитию новообразований толстой кишки [6]. Кроме того, бактерии могут действовать синергически в модели «водитель-пассажир» для запуска и поддержания канцерогенеза; в этом примере бактерия B. fragilis («водитель») способствует образованию опухоли, вызывая ремоделирование микроокружения толстой кишки, позволяя условно-патогенным бактериям-комменсалам Streptococcus gallolyticus («пассажир») доминировать и далее ослаблять канцерогенную эволюцию [6].
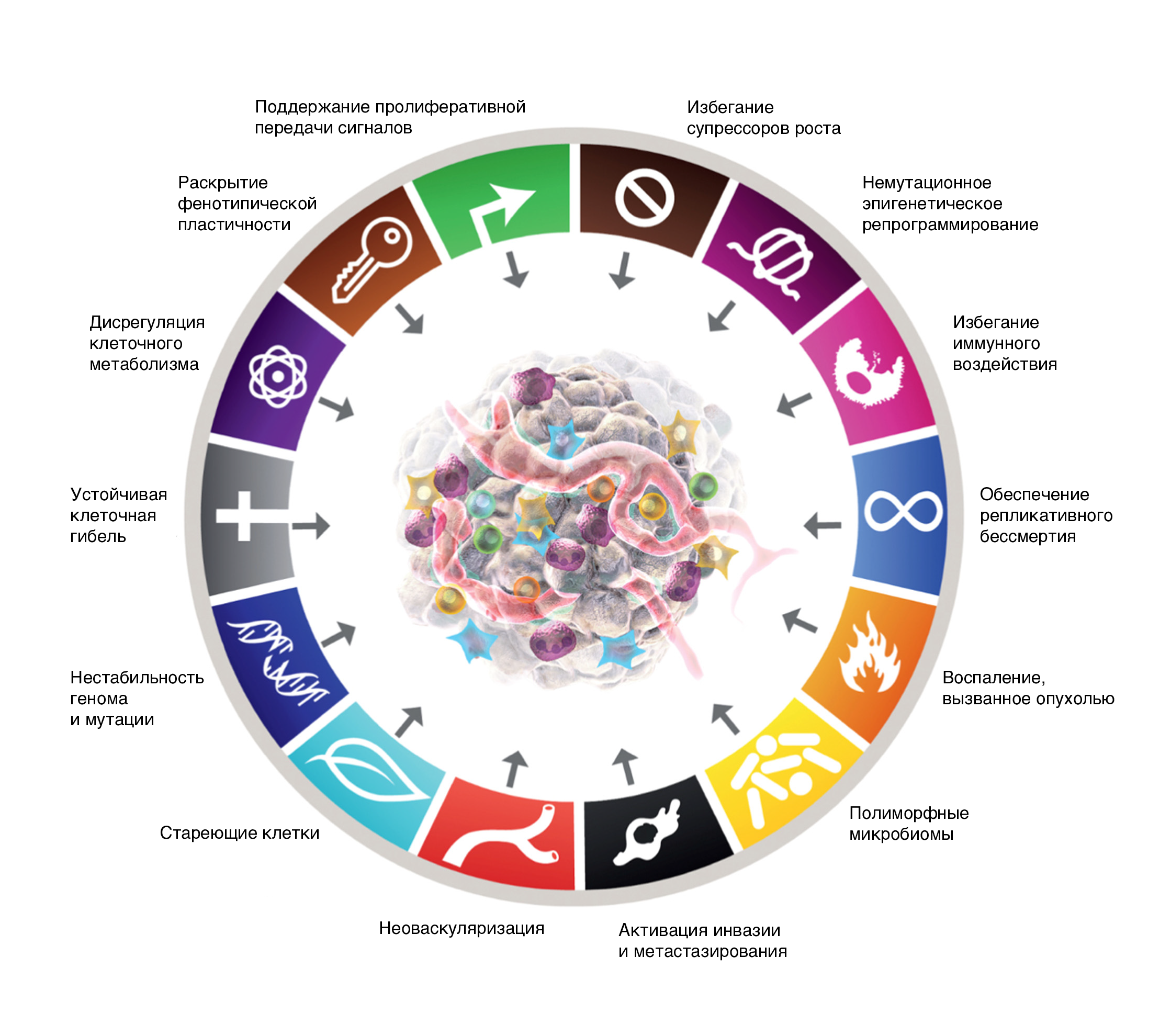
Рис. 1 | Ключевые признаки рака С изменениями — из работы «Ключевые признаки рака: новые измерения» (рисунок печатается с разрешения) [1]. Изображены все 14 ключевых признака рака, включая четыре новых: разблокировку фенотипической пластичности, немутационное эпигенетического перепрограммирование, старение клеток и полиморфизм микроорганизмов.
Доклинические и клинические данные о влиянии микробов кишечника на системный иммунитет весьма обширны. Было показано, что микробиом кишечника оказывает серьезное влияние как на адаптивную, так и на врожденную иммунную систему, приводя к экспрессии разнообразного спектра хемокинов и цитокинов, как проонкогенного, так и антионкогенного иммунного микроокружения [1]. Так, отличительные типы микробиомов отдельных пациентов модулируют другие признаки рака, как например, воспаление в опухолевой ткани, «ускользание» от системы адаптивного иммунитета, реакцию на противоопухолевую терапию [ингибиторами иммунных контрольных точек (ИКТ), к примеру]. Таким образом, модуляция микробиома становится ключом к новым противоопухолевым терапевтическим стратегиям [3].
Модуляция кишечного микробиома
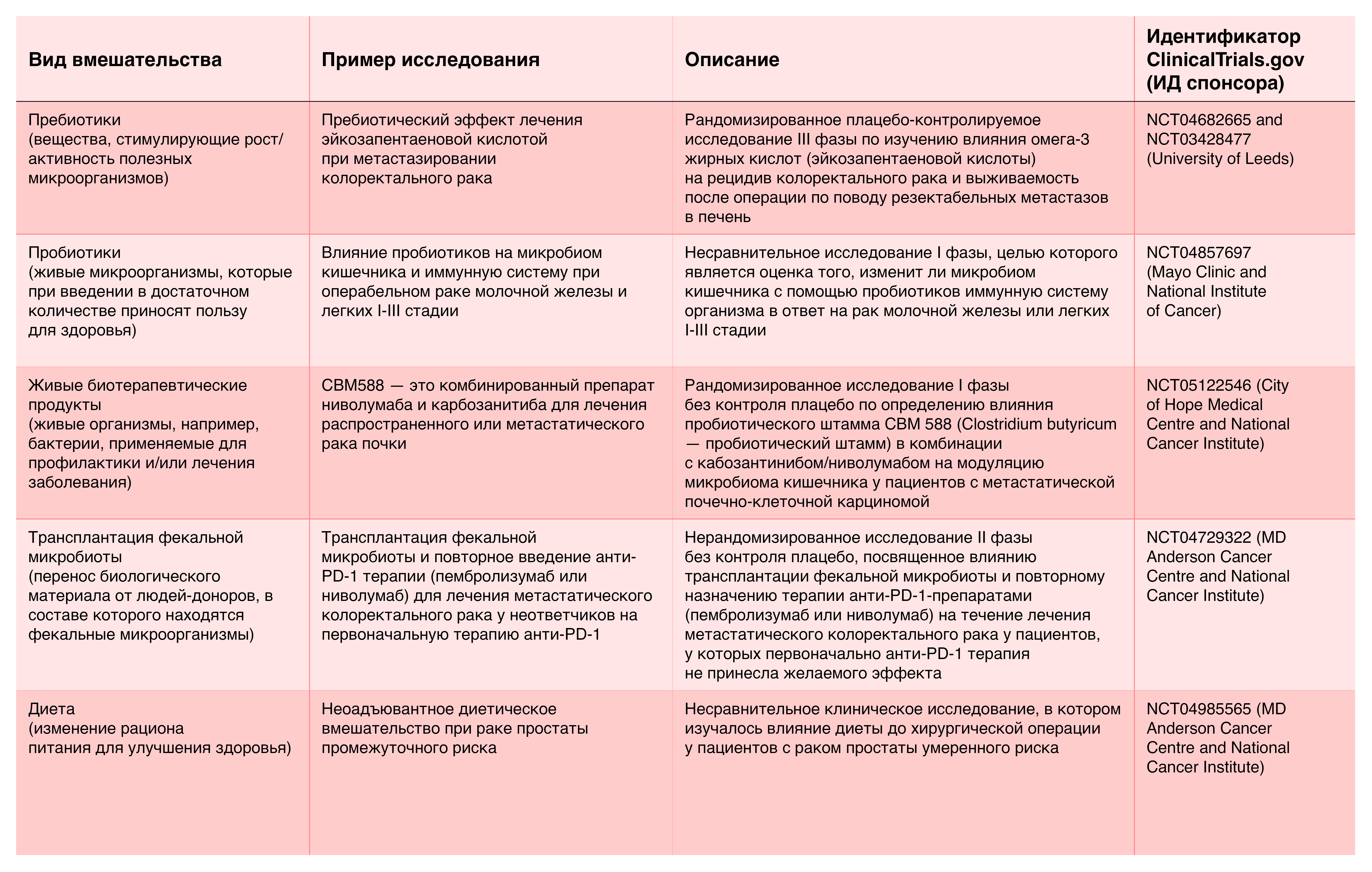
В настоящее время изучается множество различных подходов в модуляции микробиоты при злокачественных опухолях: применение пребиотиков, пробиотиков, живых биотерапевтических продуктов (ЖБП), трансплантация фекальной микробиоты (ТФМ), а также разнообразные диеты (таблица 1). Несмотря на обилие доклинических данных о пользе модуляции микробиоты при раке, в рутинной клинической практике и коммерческих методах лечения эти способы пока не получили распространения. Однако есть обнадеживающие признаки того, что ситуация может измениться. В настоящее время проводится несколько клинических исследований, в ходе которых удалось продемонстрировать потенциал ТФМ, ЖБП и диет для повышения эффективности противоопухолевой терапии, в первую очередь ингибиторами контрольных точек (ИКТ).
Таблица 1 | Примеры различных клинических подходов в модуляции микробиоты при злокачественных заболеваниях
Исследования показали восстановление эффективности ИКТ у пациентов с меланомой после ТФМ от пациентов, у которых наблюдалось улучшение во время предшествующей терапии препаратами ИКТ [8]. Однако наблюдалась значительная вариабельность в уровне ответа (30-40%) среди испытуемых, и необходимо дальнейшее изучение этого процесса.
ЖБП, обычно состоящие из одного очищенного штамма бактерий или консорциумов бактерий-синергистов, также продемонстрировали противоопухолевый потенциал. Например, введение CBM588, состоящего из Clostridium butyricum, спорообразующей бактерии анаэроба, продуцирующей бутират, значительно улучшило клинические исходы у пациентов с метастатическим почечно-клеточным раком, получавших двойную терапию ИКТ [9]. Значительные метаболомные и хемокиновые изменения были отмечены у пациентов, получавших активное лечение, по сравнению с плацебо, что дает ключ к разгадке возможного механизма.
Другой ЖБП, состоящий из Enterococcus gallinarum (MRx0518), проходивший клинические исследования при различных видах рака, также привел к значительным изменениям генов и метагенов у онкологических пациентов, ранее не получавших лечения [10]. Наконец, в ходе доклинических и клинических исследований было показано, что диета, например, увеличение потребления пищи с высоким содержанием клетчатки, улучшает ответ на терапию ИКТ при меланоме [11]. Эти исследования в совокупности составляют многообещающий терапевтический потенциал модуляции микробиоты у онкологических пациентов на ИКТ.
Помимо кишечника
Все ткани и органы, которые взаимодействуют с внешней средой, колонизированы различными микроорганизмами. Микробиота в этих местах значительно варьируется в зависимости от множества факторов, таких как пол, возраст и сама окружающая среда [1]. В отличие от кишечника, где характер симбиотических отношений между микробиотой и человеком более понятен, нормальная и патогенная роли микробиоты в развитии опухолей еще не выяснены. Однако появляется все больше свидетельств того, что в тканеспецифических микробиомах (например, во влагалище) присутствуют микроорганизмы, которые могут либо способствовать развитию злокачественных новообразований, либо защищать от них. [1,3].
При описании микроокружения опухоли (МОО) постоянно обнаруживается присутствие микробов, живущих в строме, иммунных клетках и опухолевых клетках [12]. До недавнего времени низкая биомасса микроорганизмов в этой среде представляла собой серьезную проблему для анализа. Оценки варьируются, но объединенные данные свидетельствуют о наличии ~ одной бактериальной клетки на каждые ~147 раковых клеток в МОО [4]. В настоящее время [в МОО] идентифицировано более 500 различных видов бактерий, и каждый проанализированный тип опухоли демонстрирует уникальный паттерн микробных видов, что потенциально может помочь в диагностике некоторых из наиболее сложных для типизации видов новообразований (например, рака с неизвестной первичной локализацией) [12]. Исследования показали, что внутриопухолевая микробиота может модулировать иммунный фенотип, способствовать метастазированию и определять то, какой будет реакция на противоопухолевую терапию [3,12,13]. Однако для более уверенного подтверждения этих выводов требуется больше исследований.
Влияние на противоопухолевую терапию
С тех пор как плеоморфные микробы признаны одним из ключевых признаков рака, появилась возможность включить профилирование микробиома и воздействие на него в таргетную терапию онкологических заболеваний. Профилирование микробиоты в кишечнике, на слизистых оболочках и в опухоли позволяет глубже изучить сложные отношения между микроорганизмами, человеком и опухолями. Системное описание ракового микробиома позволяет повысить точность определения злокачественных опухолей и увеличить потенциальную эффективность ИКТ [3].
Несколько клинических исследований показали, что модуляция микробиоты с помощью различных механизмов является жизнеспособным и целесообразным методом лечения пациентов с распространенным злокачественным процессом [8, 9, 10]. Однако требуются дальнейшие исследования, чтобы продемонстрировать клиническую пользу в более широком диапазоне подтипов рака и обеспечить более глубокое понимание механизмов действия.
Заключительные замечания
Полиморфные микробы, вероятно, играют важную роль и являются квазинезависимой переменной в развитии и прогрессировании рака и в ответе на терапию злокачественных новообразований. Включение полиморфных микробов в число новых отличительных признаков рака отражает растущее понимание и осознание существенной роли, которую микробы играют в развитии опухолей. Более глубокое изучение этой темы поможет улучшить каждый этап онкологической помощи — от профилактики онкозаболеваний до лечения тяжелого прогрессирующего процесса.