Изрядная доля пациентов в практике амбулаторного хирурга страдает от заболеваний сосудов. Патогенез этих заболеваний разнообразен, и они могут поражать как артерии и вены, так и лимфатические сосуды. На заболевания вен в повседневной деятельности хирурга приходятся некоторые наиболее популярные нозологии, а именно варикозно-расширенные вены, флебит, тромбофлебит – заболевания, которые могут приводить к грозным осложнениям и требовать изменения тактики ведения пациента. Посттромботический синдром (син. — посттромботическая болезнь, посттромбофлебитический синдром, посттромбофлебитическая болезнь) является одним из таких осложнений в циркуляции венозного русла, требующих к себе особого внимания со стороны практикующего хирурга.
Посттромботический синдром (ПТС) — это проявление хронической венозной недостаточности, возникающее после эпизода тромбоза глубоких вен (ТГВ). ТГВ, в свою очередь, является обструктивным заболеванием венозного русла с развитием рефлюкса крови, чаще всего в нижних конечностях.
Этиология
В венах тромб во многих случаях формируется в синусе венозных клапанов, соответствующем пространству между створкой клапана и прилегающей стенкой сосуда – в месте, где имеется сниженная скорость кровотока по физиологическим причинам. В силу ряда причин развитие тромбоза стенки сосуда может следовать по двум путям:
- Тромбофлебитический вариант с началом воспаления венозной стенки и последующим присоединением тромба в локальном участке;
- Флеботромботический вариант, когда первично образуется тромбированная масса в кровотоке, а в последующем присоединяется воспаление сосудистой стенки;
Согласно клиническим рекомендациям Минздрава РФ термины «тромбофлебит» и «флеботромбоз» отражают только варианты начала одного заболевания. Так или иначе, запускаемые гуморальные и клеточные факторы защиты организма работают в целях ликвидации образовавшегося тромба и восстановления функционирования поврежденного сосуда. Заболевание протекает длительно, патологический процесс может растягиваться на месяцы. Спустя несколько месяцев отмечается восстановление кровотока от 50 до 80 % вены от прежней полной обструкции. Однако регресс тромба и стихание воспалительного процесса происходит не всегда.
Длительное устойчивое повышение венозного давления вследствие нарушения функционирования клапанного аппарата вен приводит к патологическому расширению мелких сосудов, повышению проницаемости эндотелия для белков плазмы и эритроцитов в коже и подкожных тканях, что приводит к отеку, пигментации, фиброзу и изъязвлению. Нередко реканализация одного сегмента вены сочетается с закупоркой другого.
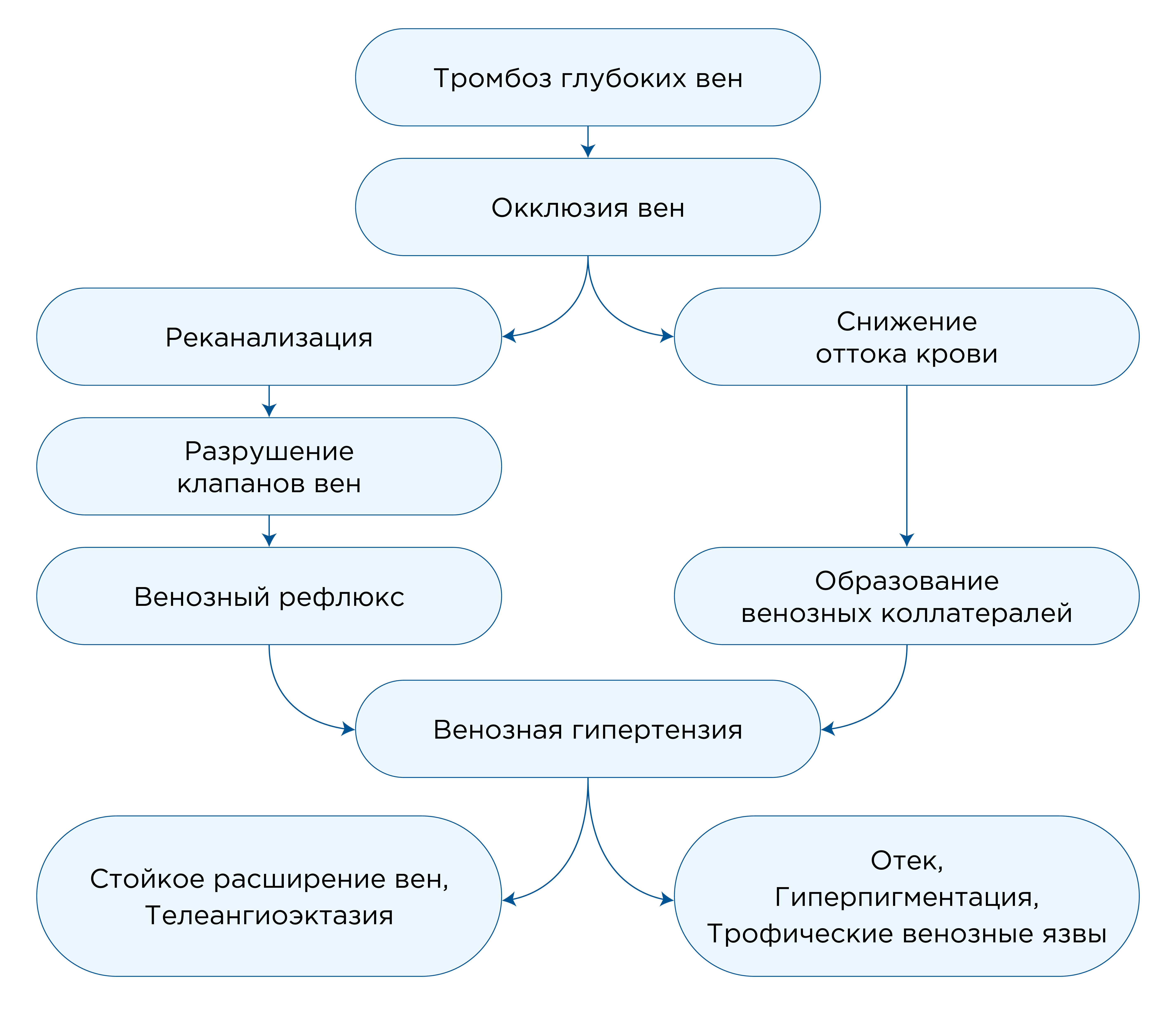
Рис.1. Каскад проявлений осложнений тромбоза глубоких вен
Зачастую обструкция тромботическими массами затрагивает подвздошно-кавальный сегмент и общие бедренные вены, в то время как рефлюкс глубоких вен из-за повреждения клапанного аппарата, затрагивает бедренно-подколенные сегменты. Тромбоз глубоких вен подвздошно-кавального или бедренно-подвздошного венозных отделов имеет значительно более высокий риск ПТС, чем ТГВ подколенных вен и вен голени, поскольку рассасывание тромба происходит медленнее и менее полно в проксимальных венозных сегментах в силу физиологических особенностей кровотока указанных участков венозных магистралей.
Согласно клиническим рекомендациям Минздрава РФ, условной границей для разделения затихшего тромбофлебита и наступивших посттромботических изменений в венозном русле поверхностных вен является срок в 45 суток.
Также условно можно выделить факторы риска ПТС, которые потенциально приводят к этому заболеванию

Эпидемиология и экономический фактор
Ежегодная заболеваемость ТГВ в Великобритании составляет 1-2 на 1000 человек, и, по ряду оценок, более чем у половины (52,6 %) пациентов ПТС развивается в течение нескольких месяцев после перенесенного заболевания. Косвенные затраты на лечение и реабилитацию пациентов с венозным стазом очень высоки, так, по экспертным оценкам на 2009 год, ежегодно в США терялось 2 миллиона рабочих дней из-за трофических язв, как осложнений ПТС. В целом, ПТС является обременительным состоянием, приводящим к значительно худшему качеству жизни пациентов и возможной утрате полноценной трудоспособности.
Клиническая картина
Основные симптомы ПТС:
- Распирающие или тянущие боли различной интенсивности;
- Чувство тяжести в голени при нагрузке и смене положения;
- Отеки стопы и голени постоянные или усиливающиеся к концу дня;
- Видимое варикозное расширение вен конечности;
- Судороги и парестезии в пораженных конечностях.
Пациенты с ПТС часто страдают от болей в конечностях, судорог, отека и кожного зуда. Эти симптомы обычно усиливаются в положении стоя и при ходьбе, что влияет на качество жизни этих пациентов и ограничивает их повседневную активность. При поражении нижних конечностей в стадии декомпенсации появляется пигментация и индурация кожи и подкожной клетчатки чаще в нижней трети голени по медиальной поверхности. Толщина подкожной жировой клетчатки снижается, кожа перестает собираться в складку, наблюдается отсутствие роста волос. При травматизации пораженных участков кожи возможно образование трофических язв с постепенным ухудшением динамики лечения, рецидивированием, увеличением площади пораженных участков.
В клинической практике предложено несколько систем оценки и классификаций для определения тяжести ПТС, включая шкалу Villalta, шкалу Ginsberg и шкалу Brandjes.
В частности, по шкале Villalta оценивается пять симптомов (боль, судороги, чувство тяжести, парестезии, зуд) и шесть клинических признаков (претибиальный отек, уплотнение кожи, гиперпигментация, гиперемия, венозная эктазия, боль при сдавливании голени). Каждая переменная имеет свою балльную шкалу в диапазоне от 0 (отсутствует) до 3-х (тяжелая степень). ПТС диагностируется, тогда, когда сумма баллов по шкале Villalta ≥ 5 или если присутствует венозная трофическая язва. Оценка 5-9 баллов соответствует легкой степени тяжести ПТС, 10-14 баллов — умеренной и ≥ 15 баллов — тяжелой. В 2008 году Международное общество по тромбозу и гемостазу рекомендовало систему оценки Villalta для использования в клинических исследованиях в качестве шкалы для диагностики и классификации ПТС. Считается, что шкала Villalta в сочетании с опросником качества жизни является наиболее подходящим инструментом для диагностики и классификации ПТС.
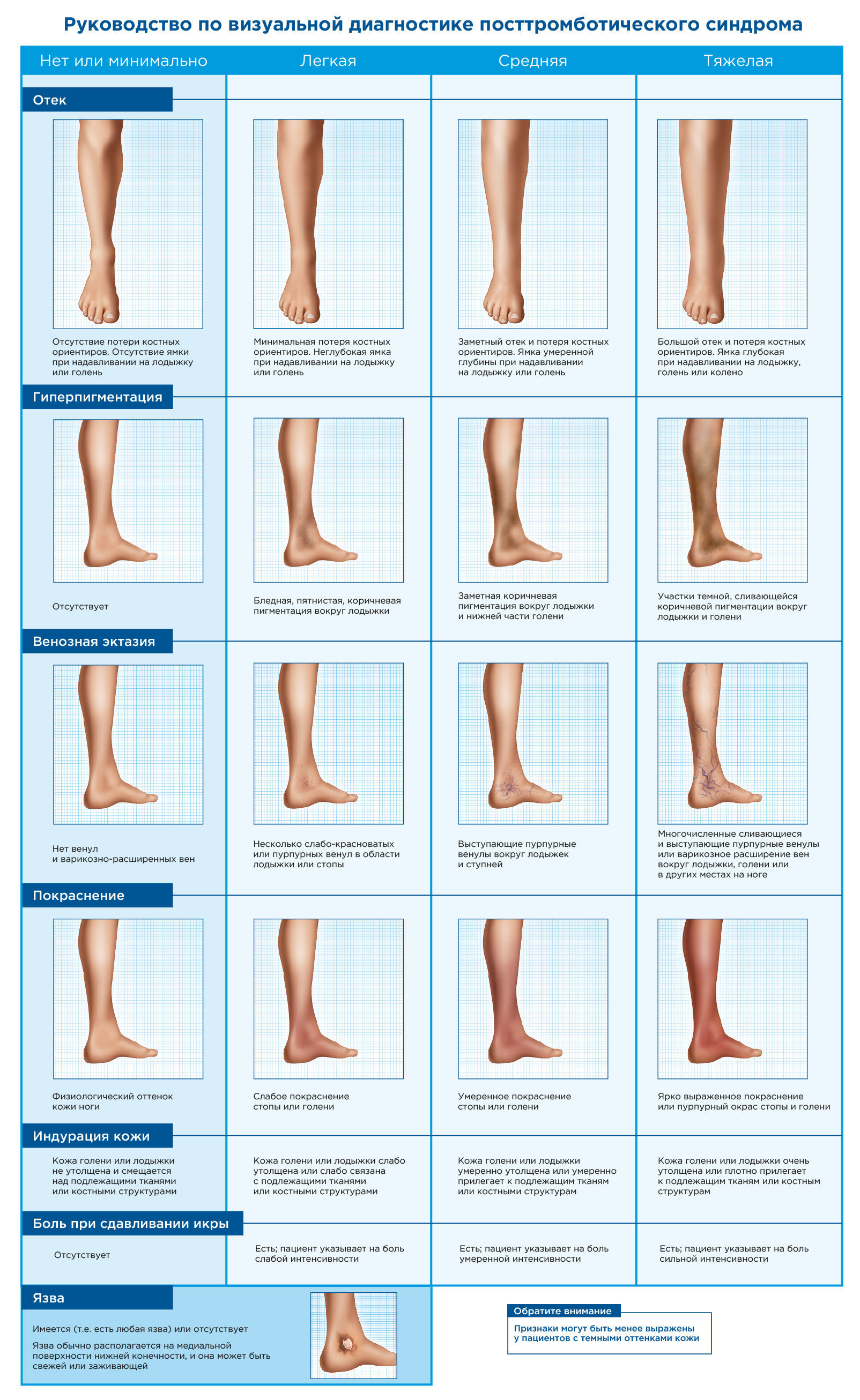
Рис. 2. Признаки ПТС, включенные в шкалу Villalta. Каждый из них имеет свои параметры для оценивания. Наличие венозной язвы автоматически классифицирует степень тяжести ПТС как тяжелую. Стоит отметить, что оценка по шкале Villalta не специфична и не позволяет отличить ранее существовавшую хроническую венозную недостаточность от ПТС.
Диагностика
Диагноз ПТС должен основываться на наличии типичных клинических признаков в сочетании с данными неинвазивных и малоинвазивных функциональных методов. Пальма первенства здесь принадлежит ультразвуковым исследованиям, в частности, ультразвуковому дуплексному сканированию (УЗДС), дающему широкие данные о структурных и функциональных изменениях венозного русла. Исследование производят в нескольких режимах, таких как цветовое и энергетическое картирование. В режиме цветового допплеровского картирования, показывающего направление потока жидкости, можно с высокой достоверностью судить о характере и направлении движения крови. Режим спектральной допплерографии (D-режим) используют для фиксации низкоскоростных потоков, что увеличивает чувствительность метода. Согласно клиническим рекомендациям Минздрава РФ, наиболее высокую диагностическую ценность имеет исследование в B-режиме с компрессией различных венозных сегментов. Также в практике можно использовать и модифицированные варианты УЗДС с применением функциональных проб, например, проб Вальсальвы и компрессионных тестов.
Дополнительные методы, включающие рентгеноконтрастную флебографию, МР-ангиографию и КТ-ангиографию, следует выполнять в случаях затруднения визуализации нарушенного кровотока в конечностях при стандартном УЗДС. Чувствительность и специфичность этих исследований также являются высокими. Например, для МР-венографии чувствительность составляет 100 %, специфичность – 96%.
Лечение
У пациентов с ПТС нехирургические вмешательства направлены на предотвращение прогрессирования заболевания вен и на снижение вероятности осложнений, уменьшение симптоматики и улучшение качества жизни.
Немедикаментозное
Пациентам с ПТС рекомендовано носить компрессионный трикотаж, который уменьшает отек и противодействует венозной гипертензии, вызванной остаточным венозным тромбозом и венозным рефлюксом. При этом чулки ниже колена столь же эффективны, как чулки в полный рост, имея одновременно преимущество в виде повышенной приверженности к регулярному ношению у пациентов. Подбор компрессионного трикотажа остается индивидуальным решением с учетом потребностей пациента. Наиболее часто подбирается белье 2-3 степени компрессии. Возможно применение тугого бинтования в качестве альтернативы компрессионному трикотажу.
ЛФК может снижать симптомы ПТС, но эффект остается не до конца изученным и сомнительным. В систематическом анализе Jasionowska S. с соавт. 2022 года отмечается снижение симптоматики заболевания при использовании разных программ аэробных тренировок, но, возможно, это связано с субъективной оценкой эффектов испытуемыми и недостаточным контролем за экспериментами. Следует использовать упражнения с ходьбой (скандинавская ходьба или простые регулярные прогулки) для усиления сокращений икроножных мышц и нагрузки на подошву, а также упражнения на гибкость суставов для улучшения венозного оттока в околосуставном пространстве тканей.
Медикаментозное
В целях терапии болевого синдрома возможно назначение краткосрочных курсов системных НПВС. Также можно локально использовать гели, мази на основе НПВС и гепарина натрия, что существенно улучшает локальную симптоматику, уменьшает боль.
В качестве антитромботических средств при ПТС может использоваться широкий круг средств, таких как гепарин натрия, низкомолекулярный гепарин, фондапаринукс натрия, антагонисты витамина K, ривароксабан, ацетилсалициловая кислота и др. В то же время применение ацетилсалициловой кислоты в качестве антитромботического средства для лечения ПТС не рекомендуется в связи со слабым протективным эффектом в рамках вторичной профилактики и более низким эффектом в сравнении с ривароксабаном. Препараты антитромботического действия назначаются курсами на длительный период времени (от 45-ти суток) с коррекцией дозировок и подбором индивидуальной терапии. Наиболее многообещающими новыми путями предотвращения патологии крови при ПТС являются ингибирование фактора XI, P/E-селектина и ловушек нейтрофильных клеток (NETs). По данным направлениям ведутся дальнейшие научные работы.
Веноактивные препараты, которые ранее рассматривались для лечения ПТС, включая биофлавоноиды (препараты, снижающие капиллярную фильтрацию и проницаемость микрососудов, например: рутин, кверцетин и другие), в настоящее время имеют ограниченные и низкие или очень некачественные доказательства способности уменьшать симптомы ПТС. При этом назначение таких групп препаратов для терапии ПТС возможно, но с условием ясности для пациента отсутствия прямых доказательств эффективности данных средств.
Хирургическое
Несмотря на оптимальную антикоагулянтную терапию пациентов с ТГВ, по-прежнему существует большое число пациентов, страдающих ПТС из-за хронической венозной обструкции, нарушенной коллатерализации и клапанной дисфункции глубоких вен. ПТС может приводить к тяжелой хронической венозной недостаточности, которая часто является результатом как обструкции глубоких вен, так и рефлюкса.
Следует отметить, что использование хирургических методов лечения ПТС не служит заменой терапевтических, в том числе, антикоагулянтных средств.
На данный момент, наиболее частыми оперативными вмешательствами являются стриппинг или термооблитерация патологически расширенных поверхностных вен и диссекция перфорантных вен. При трофических изменениях мягких тканей голени операцией выбора служит эндоскопическая субфасциальная диссекция перфорантных вен, а также лазерная или радиочастотная облитерация. При развитии трофических язв возможны реконструктивные вмешательства на венозном русле, например, операция перекрестного бедренно-бедренного шунтирования.
При ТГВ подвздошно-кавального отдела возможно рассмотрение операции стентирования, являющейся альтернативой классическим операциям. После такой операции пациенты проходят раннюю амбулаторную терапию, получая антикоагулянты и антитромботическую терапию с индивидуальным подбором препаратов. Дополнительно при наличии в анамнезе острого или хронического ТГВ пациентам в послеоперационный период назначается либо антагонист витамина К, либо прямой пероральный антикоагулянт на подобранный врачом период времени.
Показаниями к плановой госпитализации пациента являются индивидуальные риски прогрессирования ТГВ и развития тромбоэмболии легочных артерий, стадии заболевания, возможностей проведения адекватной терапии в амбулаторных условиях, приверженности пациента назначенной терапией, а также возможности клинического и ультразвукового контроля за течением ПТС в динамике.





