Ожирение: комплексная патология и хроническое заболевание
Ожирение — хроническое и рецидивирующее заболевание, являющее собой значительную проблему при длительном лечении, а также усиливающее прогрессирование таких неинфекционных заболеваний, как сахарный диабет 2 типа, сердечно-сосудистые заболевания и некоторые виды злокачественных новообразований [1]. Хотя модификация образа жизни и уменьшение гиподинамии остаются центральным аспектом управления массой тела, степень эффективности этого подхода в достижении и поддержании в долгосрочной перспективе ограничена. Исторически развитие фармакологических методов лечения ожирения сдерживали многочисленные технические и биологические трудности — в первую очередь неприемлемые побочные эффекты [2]. Прогресс в понимании физиологических и молекулярных механизмов, регулирующих энергетический гомеостаз, позволили разработать таргетированные, рационально спроектированные, безопасные и эффективные методы снижения веса.
Нейробиология приема пищи
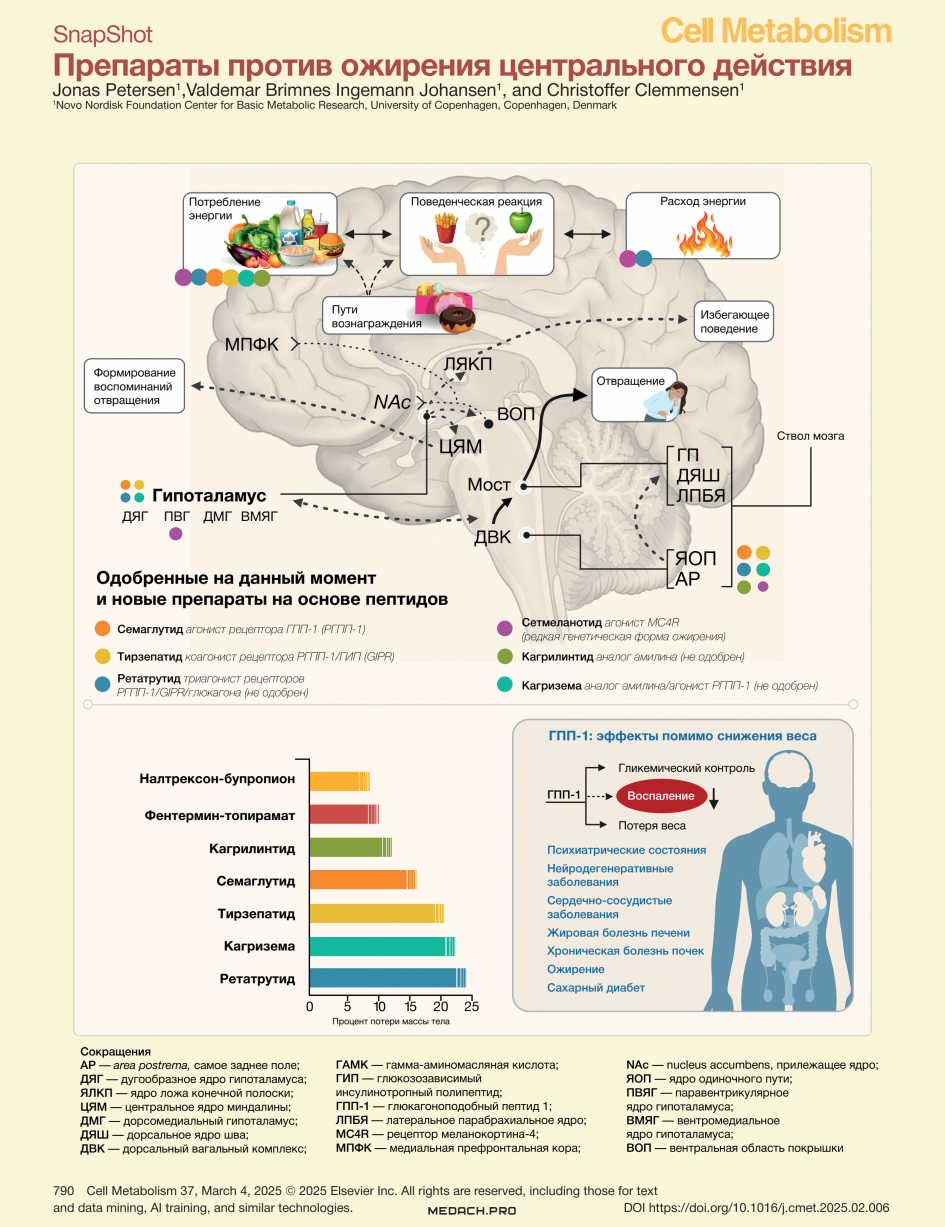
Нейронные контуры, контролирующие энергетический баланс, должны непрерывно интегрировать разнообразный массив сигналов для поддержания долгосрочного, доступного и стабильного энергетического запаса для организма. В число таких сигналов входят: информация о массе жировой ткани, потреблении калорий, расходе энергии и изменениях как во внешней, так и во внутренней среде организма, что так или иначе влияет на потребность в энергии в настоящем и в будущем [3]. Регулирование энергетического гомеостаза центральной нервной системой координируется сложной нейронной схемой, включающей множество областей мозга. Гипоталамус и ствол мозга играют существенную роль в восприятии и интеграции сигналов о циркулирующих питательных веществах, гормональных сигналах и афферентной нейронной активности и совместно с мезокортиколимбическими путями подкрепления участвуют в реализации пищевого поведения [4].
Пептидные гормоны в регуляции аппетита
Выделяемые в кишечнике пептидные гормоны ГПП-1 и ГИП вместе с гормоном поджелудочной железы амилином, воздействуют на родственные рецепторы в гипоталамусе, а также в area postrema (AP; самое заднее поле, расположенное поблизости от треугольника блуждающего нерва) и ядре одиночного пути (ЯОП, оно же — ядро солитарного тракта) в дорсальном вагальном комплексе (ДВК) [3]. Гормональные сигналы в ДВК способствуют насыщению и запускают модуляцию дофаминовой передачи в мезолимбическом пути, влияя на поведение, связанное с подкреплением [3]. Примечательно, что активация рецепторов ГПП-1 в AP также вызывает выраженное отвращение [к пище], по всей видимости, опосредованное проекциями в латеральное парабрахиальное ядро (ЛПБЯ) [5]. У части нейронов ДВК есть проекции в ядрах гипоталамуса, и они способны подавлять голод, не вызывая отвращения [5]. Нейроны рецептора меланокортина-4 (MC4R) в паравентрикулярных ядрах гипоталамуса (ПВЯГ) действуют как ключевые интеграторы гомеостатических сигналов обратной связи, в первую очередь передаваемых нейронами агути-родственного пептида (AgRP) и проопиомеланокортина (POMC), расположенными в дугообразном ядре (ДЯ) гипоталамуса.
Краткая история фармакотерапии против ожирения
Первые препараты центрального действия для снижения веса разрабатывались в период, когда физиологические и нейробиологические механизмы, лежащие в основе регуляции аппетита, были изучены недостаточно. Поэтому неудивительно, что их применение терпело неудачи из-за отсутствия эффективности и невыносимых побочных эффектов по причине плохой специфичности [2]. Сегодня сфера разработки лекарств от ожирения сместилась с фокуса на низкомолекулярных мишенях классических нейротрансмиттерных систем (фентермин, топирамат, налтрексон и бупропион) в сторону влияния на метаболические эффекты эндогенной взаимосвязи между кишечником и мозгом [2]. За относительно короткое время агонисты рецепторов ГПП-1 длительного действия, такие как семаглутид, заняли центральное место в лечении ожирения из-за их способности подавлять аппетит и снижать массу тела путем прямого воздействия на нейроны в гипоталамусе и стволе мозга [6]. Для противодействия мощным гомеостатическим механизмам, которые способствуют сохранению жировой массы тела, было разработано несколько полифармакологических средств на основе ГПП-1 [6]. Тирзепатид, двойной агонист рецепторов ГПП-1 и ГИП, продемонстрировал значительную эффективность в клинических испытаниях, при этом испытуемым удалось снизить массу тела на 22,5 % за 72 недели [7]. Агонисты рецепторов ГИП в первую очередь нацелены на ГАМКергические нейроны для подавления аппетита, а также могут усиливать агонизм к рецепторам ГПП-1, смягчая симптомы тошноты. Кагрилинтид, аналог амилина, также агонист рецептора ГПП-1, усиливая подавление аппетита, преимущественно опосредованное через AP в стволе мозга. В сочетании с семаглутидом его применение позволило пациентам достичь снижения массы тела на 22,7 % в исследовании III фазы [8]. Ретатрутид, тройной агонист (нацелен на рецепторы ГПП-1, ГИП и глюкагона) продемонстрировал многообещающие результаты: пациентам удалось добиться снижения массы тела до 24 % в клиническом исследовании II фазы [9]. Хотя глюкагон способен подавлять аппетит и в одиночку, активация его рецепторов дополняет эффекты ГПП-1 и ГИП, усиливая расход энергии и улучшая липидный обмен [6]. И наоборот, положительное влияние на гликемию инкретиновых гормонов уравновешивает контринсулярное действие глюкагона, подчеркивая возможности рационально подобранной многоцелевой терапии для улучшения результатов лечения ожирения. Важно, что эти препараты способствуют не только снижению веса, но и улучшению параметров широкого спектра сопутствующих кардиометаболических заболеваний. Это обеспечивает более комплексный подход к лечению ожирения.
Преимущества препаратов для снижения веса нового поколения, помимо лечения ожирения
Согласно недавно полученным клиническим данным, лечение семаглутидом или тирзепатидом не только защищает от развития диабета 2 типа, но и приводит к значительному улучшению состояния при жировой дистрофии печени, а также при сердечно-сосудистых заболеваниях и хронической болезни почек [10]. Хотя плейотропные преимущества для здоровья от активации рецептора ГПП-1 могут быть результатом прямой активации клеток (очевидно, экспрессирующих рецептор ГПП-1) в определенных органах-мишенях, они также могут быть вторичными по отношению к потере веса и улучшению гликемического контроля [10]. В частности, в качестве объединяющего механизма было предложено снижение степени интенсивности воспалительных процессов в организме [10]. Противовоспалительные свойства агонистов рецепторов ГПП-1 вызвали интерес к их потенциалу для лечения нейродегенеративных заболеваний, при которых хроническое нейровоспаление ускоряет прогрессирование патологии [10]. Поскольку преимущества агонистов рецепторов ГПП-1 выходят за рамки потери веса, ожидания от препаратов для снижения похудения нового поколения огромны. Препараты в будущем должны не только обеспечивать эффективное и безопасное снижение веса, одновременно улучшая кардиометаболические показатели, но и способствовать сохранению и должному функционированию опорно-двигательного аппарата — в идеале они также должны предотвращать быстрый повторный набор веса, что наблюдается при прекращении лечения.