Артериальная гипертензия является распространенным неинфекционным заболеванием, от которого, по оценкам, страдает более одного миллиарда взрослых людей во всем мире, при этом его распространенность удвоилась за последние 20 лет [1]. С 2012 по 2013 год в США общий экономический ущерб, связанный с гипертензией оценивался в 50 миллиардов долларов ежегодно [2]. Были показаны преимущества оптимального контроля артериального давления (АД): снижение систолического АД на 10 мм рт. ст. приводит к снижению смертности от всех причин на 13% [3]. Тем не менее, АД у значительной части гипертоников остается неконтролируемым, отчасти из-за того, что пациенты не полностью соблюдают рекомендации по лечению. Таким образом, потребность в новых терапевтических вариантах для оптимального контроля АД по-прежнему существует.
В качестве одной из форм иммунотерапии гипертензии были предложены терапевтические вакцины, которые почти 50 лет исследовались на животных [4]. Большинство вакцин против гипертензии нацелены на ренин-ангиотензиновую систему [5–16]. В доклиническом исследовании вакцина против ангиотензина I (PMD3117) снижала артериальное давление у крыс с гипертензией [5], а вакцина против ангиотензина II (AngQb-Cyt006) эффективна в выработке антител к ангиотензину II у грызунов [6]. Кроме того, было показано, что терапевтические вакцины для рецептора ренина и ангиотензина II типа 1 эффективны в лечении гипертензии у крыс [7, 8]. На основании этих доклинических результатов было проведено клиническое испытание вакцин против ангиотензина I и II. Введение вакцины против ангиотензина I (PMD3117) значительно увеличивало титр антител к ангиотензину I в фазе клинического исследования, но не снижало АД [9]. Введение вакцины против ангиотензина II (AngQb-Cyt006) значительно увеличивало титры антител против ангиотензина II [6, 10], но АД значительно снижалось только у тех животных, которые получали высокие дозы. Авторы также начали оценивать эффективность вакцины против ангиотензина II на животных [12, 13]. Введение вакцины против ангиотензина II приводило не только к снижению АД, но и к органопротекторным эффектам, а вызываемый ангиотензином II периваскулярный фиброз в сердце значительно ослаблялся у иммунизированных мышей и крыс [12, 13]. Кроме того, вакцина против ангиотензина II была эффективна в предотвращении сердечной недостаточности у крыс с инфарктом миокарда, вызванным путем постоянной перевязки левой передней нисходящей артерии [14], и в предотвращении инфаркта головного мозга после окклюзии средней мозговой артерии [15]. Авторы провели плацебо-контролируемое исследование с повышением дозы, чтобы изучить безопасность, переносимость и иммунологические реакции этой вакцины против ангиотензина II (AGMG0201). AGMG0201 вводили двенадцати участникам групп с низкими и высокими дозами. Субъекты были случайным образом распределены для получения либо активного исследуемого препарата, либо плацебо. Каждый участник получил одну внутримышечную инъекцию, за которой через 30 дней следовала вторая инъекция; за ним наблюдали в течение 360 дней после второй дозы. Результаты показали, что большинство побочных эффектов вакцинации представляли собой боль и эритему в месте инъекции, которые были классифицированы как легкие или умеренные по степени тяжести, что говорит о хорошей переносимости AGMG0201. Антитела к ангиотензину II наблюдались у пациентов с AGMG0201, особенно в группе высоких доз [16]. В следующем клиническом испытании следует оценить влияние вакцины на снижение АД.
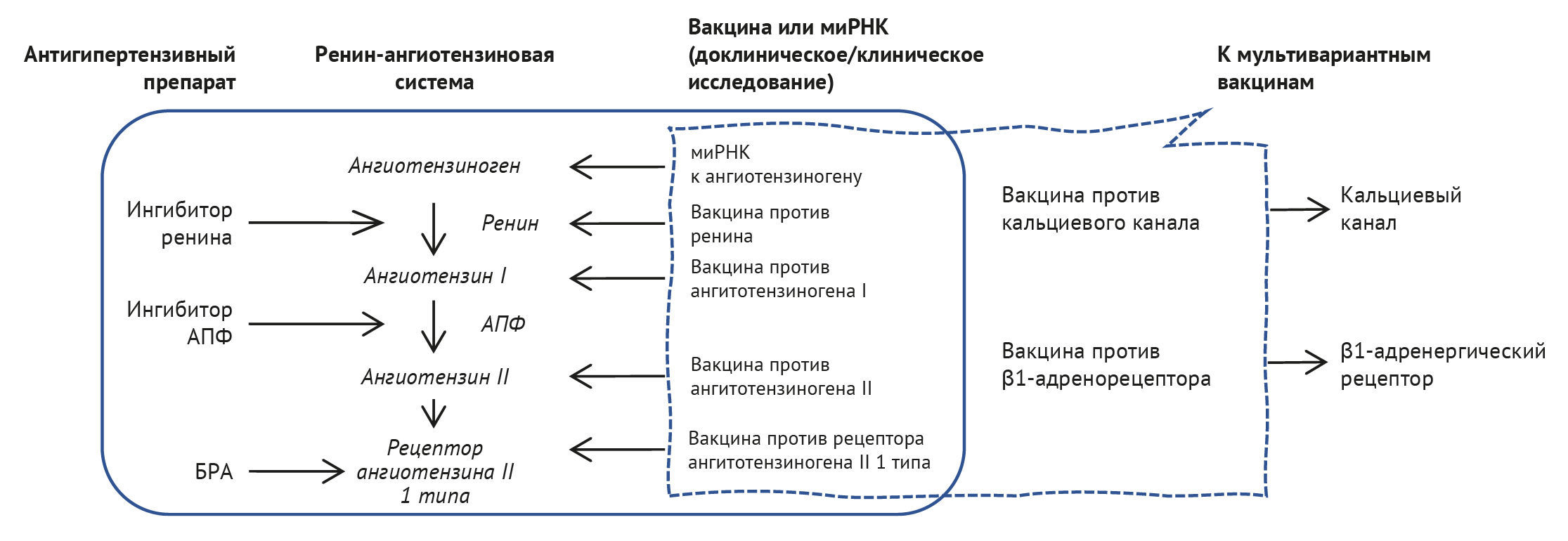
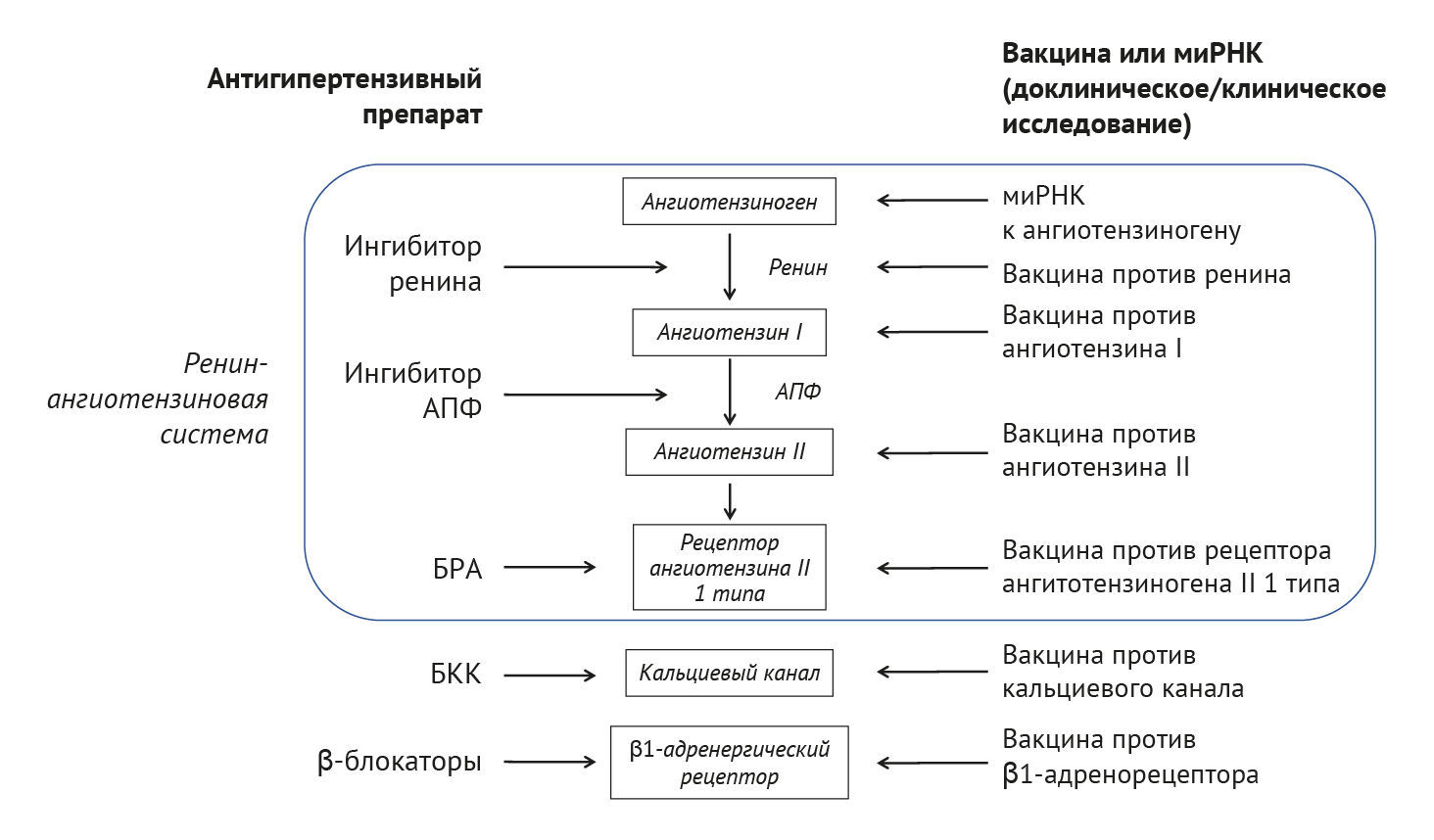
Рис. 1. Разработка вакцины или миРНК для лечения гипертензии.Молекулами-целями для терапии гипертензии служат ренин-ангиотензиновая система (ангиотензиноген, ангиотензин I или II, рецептор ангиотензина II типа 1), кальциевые каналы L-типа и β1-адренорецепторы. Основными антигипертензивными препаратами являются ингибиторы ренина, ингибиторы АПФ (ангиотензинпревращающий фермент), БРА (блокаторы рецепторов ангиотензина), БКК (блокаторы кальциевых каналов) и β-блокаторы. Текущая задача состоит в том, чтобы разработать вакцины или миРНК для одних и тех же молекул-мишеней.
Хотя исследования вакцины для ренин-ангиотензиновой системы все еще исследуются, для лечения гипертензии были предложены вакцины, направленные на решение другой проблемы. Блокада кальциевых каналов является распространенным медикаментозным механизмом лечения гипертензии, и уже сообщалось о введении вакцин для кальциевых каналов L-типа для лечения гипертензии у крыс [17]. При разработке этой пептидной вакцины антиген был выбран из эпитопа третьей внеклеточной области домена IV кальциевого канала L-типа человека [18, 19], и после четырех инъекций вакцины с кальциевыми каналами систолическое АД у крыс с гипертензией значительно снижается. Недавно Ke с соавт. предложили новую терапевтическую вакцину, названную ABRβQ-006, которая нацелена на β1-адренергический рецептор [20]. Введение вакцины ABRβQ-006 способствовало снижению систолического давления крови у крыс с гипертензией (приблизительно на 10 мм рт. ст.) и ослабляла ремоделирование сосудов, гипертрофию миокарда и периваскулярный фиброз. В случае инфаркта миокарда вакцина ABRβQ-006 эффективно подавляла ремоделирование сердца и уменьшала сердечный фиброз и воспалительную инфильтрацию. Вакцина, нацеленная на β1-адренорецептор, показала влияние на гипертензию и контроль частоты сердечных сокращений, что привело к ослаблению ремоделирования миокарда и защите сердечной функции. Что касается клинической практики, то в будущем планируется использовать комбинацию этих вакцин. Поливалентные вакцины обычно применяют для профилактики инфекционных заболеваний. Интересно, что бивалентная вакцина против ренин-ангиотензиновой системы и кальциевых каналов снижает АД у крыс с гипертензией [17]. Хотя для этого типа бивалентной вакцины потребуется эффективный метод равномерной индукции антител к множественным антигенам, эффективное лечение гипертензии с помощью комбинации поливалентных вакцин может быть реализовано в будущем.
Привлекательным вариантом является направленное воздействие на ангиотензиноген терапевтических средств на основе РНК, которые связываются с РНК и изменяют экспрессию любого белка [21, 22]. Антисмысловые олигонуклеотиды состоят из одноцепочечной ДНК, содержащей от 15 до 30 нуклеотидов, и ингибируют трансляцию РНК, связываясь с мРНК-мишенью. Напротив, терапия на основе РНК-интерференции (РНКи) использует двухцепочечную РНК и препятствует экспрессии мРНК. В большинстве методов лечения на основе РНК-интерференции применяются некодирующие малые интерферирующие РНК (миРНК) длиной 21–23 основания. В настоящее время миРНК служат новой терапевтической стратегией; например, инклизиран сначала применялся при лечении редких генетических заболеваний, а затем использовался в терапии семейной гиперхолестеринемии, после чего препарат стали назначать при распространенных заболеваний, таких как первичная дислипидемия [23]. Если говорить о прогрессе в системах доставки лекарств, можно упомянуть, что химически модифицированная миРНК, конъюгированная с N-ацетилгалактозамином (GalNAc), специфически нацелена на мРНК пропротеинконвертазы субтилсин/кексин типа 9 (PCSK9) в печени, поскольку GalNAc связывается с асиалогликопротеиновым рецептором, который в высокой степени экспрессируется на гепатоцитах; это приводит к быстрому эндоцитозу [24]. Действительно, в доклинической модели этот подход был использован для улучшения эффективности доставки миРНК в гепатоциты более чем в десять раз. Сходным образом, миРНК против ангиотензиногена была разработана для лечения гипертензии [25]. Ангиотензиноген служит единственным предшественником ангиотензина I или II и представляет собой перспективную цель для сайленсинга генов. Удаление ангиотензиногена будет подавлять образование ангиотензина I или II без феноменов ускользания ренин-ангиотензиновой системы, которые включают контррегуляторный рост в плазме. Таким образом, устранение ангиотензиногена может привести к более эффективному ингибированию ренин-ангиотензиновой системы и стабильному контролю АД. МиРНК против ангиотензиногена в настоящее время проходит клинические испытания для лечения гипертензии. Однако с данными терапевтическими методами были связаны определенные проблемы, такие как ненаправленные эффекты, иммунная реакция и токсичность.
Разработка агонистов длительного действия с использованием вакцин и препаратов нуклеиновых кислот для лечения гипертензии — интересная стратегия (рис. 1), которая может улучшить контроль гипертензии, который не соответствует клиническим рекомендациям. Практическое применение вакцин или препаратов на основе нуклеиновых кислот требует одновременного продвижения лечения артериального давления в домашних условиях и персонализированной медицины. В качестве преимущества этих новых методов лечения для пациентов, принимающих несколько антигипертензивных препаратов, можно назвать снижение базового артериального давления и его точную настройку в сочетании с антигипертензивными эффектами. В будущем различные методы антигипертензивной терапии обеспечат наилучшую индивидуализированную медицинскую помощь с возможностью выбора.