Благодаря самоинактивирующемуся трассеру вируса бешенства можно проводить долгосрочный мониторинг и транскриптомное профилирование клеток, связанных в синапсы.
Согласно результатам транскриптомного профилирования отдельных клеток, в каждой области мозга находится целый калейдоскоп различных клеточных типов [1-4]. Остается неясным принцип взаимного (как структурное, так и функциональное) размещения этих клеток (цепочек клеток) в синапсах, тем не менее выяснение их значения необходимо для понимания работы головного мозга. Исследователи большинства экспериментов по молекулярному профилированию отдельных клеток затруднились сделать выводы об этих связях, тогда как методики, показывающие работу синапсов, например, трассировка вируса бешенства или электронная микроскопия, не сочетаются с профилированием. Ли с соавт. из института Аллена сообщают о важном шаге к решению данного вопроса путем создания модифицированного вируса бешенства, который обладает меньшей цитотоксичностью, вызывает менее выраженные изменения экспрессии генов и иммунный ответ в клетках макроорганизма по сравнению с существующими вирусами бешенства, применяемыми в экспериментах. Данный молекулярный инструмент на основе вируса позволит исследователям сочетать картирование нервных цепей с методами молекулярного профилирования отдельных клеток. Это поможет выявлять такие типы клеток, которые находятся, в том числе, и в синаптических взаимодействиях (нервных цепях) (рис. 1).
Генетически модифицированный вирус бешенства — очень удобный инструмент для исследования структуры и функции нервных цепей по причине его непосредственного распространения по синапсам. Большинство молекулярных инструментов на основе вируса бешенства получены из вакцинного штамма SAD B19. Их применение ограничивалось краткосрочными экспериментами по причине цитотоксичности, вызываемой вирусом. Изменения экспрессии генов (вследствие воздействия вируса бешенства) в клетках макроорганизма также усложняют молекулярное определение типов инфицированных клеток в трассируемых нервных цепях. При помощи родительского штамма CVS N2c ученым удалось создать самоинактивирующийся вирус бешенства (SiR — от англ. self-inactivating rabies virus): штамм SiR-N2c5. Они сообщают, что с его помощью можно проводить долгосрочное картирование цепей ввиду меньшей цитотоксичности, сниженного иммунного ответа и минимальных изменений экспрессии генов. Это делает возможным осуществление транскриптомного анализа отдельных нейронов.
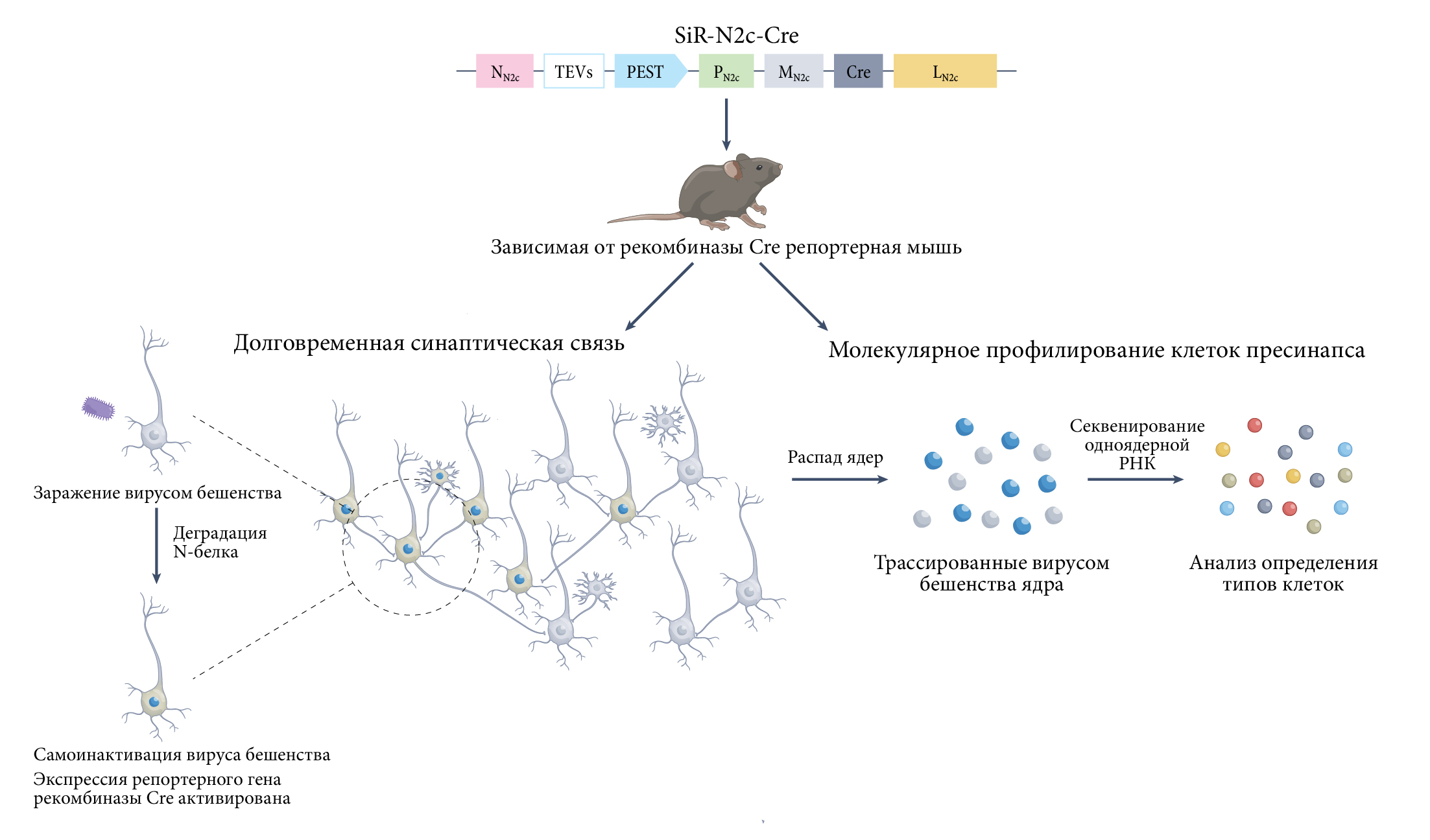
Рис. 1 | Вирус бешенства SiR-N2c как связующее звено исследований коннектома и транскриптома.Создав модифицированную версию вируса SiR-N2c-Cre, ученым удалось добиться минимизации пагубного влияния самого вируса на выживаемость клеток-хозяев и экспрессию генов, нацеливая N-белок для деградации протеасомой. Следовательно, транскрипция генетического материала вируса постепенно снижается или же полностью устраняется после заражения. Экспрессия Cre во время инициального периода заражения вирусом SiR-N2c-Cre достаточна для запуска репортерной экспрессии (на рисунке — голубые ядра), благодаря чему удается трассировка долговременной нервной цепи и молекулярное профилирование меченых нейронов.
TEVS — сайт расщепления вируса гравировки табака;
PEST — нацеленный на протеасомы домен.
Эта работа основана на попытках совершить прорыв в молекулярных инструментах на основе вируса бешенства. Так, новый штамм CVS N2c позволит расширить экспериментальное окно до 17 дней после инфицирования [9]. Нетоксичные штаммы вируса бешенства были созданы путем модификации его генома, где закодирована информация о пяти белках: нуклеопротеин (N), фосфопротеин (P), матричный белок (M), гликопротеин (G) и полимераза (L). Большинство генно-инженерных трассеров бешенства имеют делецию G, вследствие которой нарушается распространение вируса по синапсам, но не его репликация и транскрипция. ΔG-вирус бешенства использовался для транссинаптической трассировки целевой популяции нейронов или ретроградной трассировки проекционных нейронов, посылающих аксоны к определенным участкам. Было показано, что мутантный вирус бешенства с двойной делецией (ΔGL-вирус) приводит к минимально допустимой гибели клеток через 4 месяца после первоначального заражения [10]. Хотя для осуществления транссинаптической трассировки посредством ΔGL-вируса бешенства необходима комплементация обоих удаленных вирусных генов (для его успешного распространения), требуется и своевременное подавление экспрессии этих генов после первичного заражения для снижения токсичности. В качестве альтернативы удалось получить самоинактивирующиеся вирусы бешенства SAD B19 (SiR-B19), экспрессирующие рекомбиназу Cre, путем добавления нацеленного на протеасомы домена к С-концу N-белка бешенства [11]. После первоначального заражения вирусная транскрипция постепенно снижается или же полностью устраняется, поскольку N-белок подвергается деградации протеасомой. При этом одновременно с процессом самоинактивации протекает рекомбинация в геномах мышей посредством рекомбиназы Cre, что приводит к долгосрочному мечению трассируемых нервных цепей. Однако авторы сообщают, что вышеуказанный штамм бешенства SiR-B19 по-прежнему способен вызывать четкий врожденный иммунный ответ с повышенной экспрессией рецептора RIG-I.
Сочетая стратегию самоинактивации со штаммом CVS N2c, Ли с соавт. создали линию вируса SiR-N2c и описали его с точки зрения цитотоксичности, иммуногенности и дисрегуляции экспрессии генов в клетке макроорганизма. По сравнению со своим аналогом — ΔG-вирусом — SiR-N2c продемонстрировал сниженную цитотоксичность и менее выраженный иммунный ответ при сохранении вируса способности распространяться по синапсам. Исследования экспрессии больших массивов генов также показали, что у SiR-N2c наблюдается нарушение регуляции экспрессии на порядок меньшего числа генов по сравнению с его исходным штаммом. Важно отметить, что авторы продемонстрировали возможность комбинации SiR-N2c-опосредованной трассировки нервной цепи с секвенированием одноядерной РНК (snRNA-seq) для транскриптомного анализа нейронов спинного мозга через 10 дней после заражения. Результаты snRNA-seq нейронов, инфицированных SiR-N2c, показали, что они имеют меньшее количество нарушений регуляции эндогенных генов по сравнению с нейронами, инфицированными ΔG-N2c. Как ΔG-N2c, так и SiR-N2c, по всей видимости, приводили к менее выраженным глобальным изменениям транскрипции, которые вызывались, например, ΔG-B19 (ссылка 7). Это звучит довольно многообещающе, и необходимы более обширные исследования snRNA-seq, чтобы полностью описать влияние вирусного вектора SiR-N2c на ландшафт экспрессии генов. Тем не менее комбинирование картирования нервных цепей и транскриптомного анализа с использованием нетоксичных вирусов SiR-N2c повышает возможность отслеживания изменений в составе типов клеток и связей исследуемых цепей в процессе эмбрионального развития и патогенеза заболеваний.
Вирус бешенства SiR-N2c демонстрирует сниженные показатели токсичности, иммуногенности и нарушения регуляции транскриптома клеток макроорганизма по сравнению с подобными себе. Однако, несмотря на преимущества SiR перед соответствующим ΔG-вирусом бешенства, самоинактивация вируса не приводит к полному устранению иммуногенных свойств, доставшихся «в наследство» от исходных штаммов бешенства. Это свидетельствует о том, что даже самоинактивации может быть недостаточно, чтобы избежать неблагоприятного воздействия вирусной транскрипции на клетки. Кроме того, характеризующаяся ошибками амплификация вируса бешенства приводит к реверсии протеасомного нацеливания на N-белок и может вызывать повышенную токсичность и иммуногенность. Процесс создания новых экспериментальных штаммов должен тщательно мониторироваться, чтобы избежать таких нежелательных реверсий. Тем не менее трассер SiR-N2c являет собой многообещающий молекулярный инструмент, который позволит одновременно исследовать коннектомы и транскриптомы в ходе длительного периода времени.