Ротавирусная инфекция — основная причина развития симптомов диареи и рвоты, особенно у детей, что приводит к смерти порядка 128 000 человек в год. Вирус поражает энтероциты тонкой кишки, но обнаружить его можно только в небольшой части восприимчивых клеток. В середине 90-х годов учеными было высказано предположение о том, как именно вирус опосредует развитие тяжелого заболевания. Согласно гипотезе, эта небольшая часть инфицированных клеток посылает определенные сигналы, нарушающие нормальное функционирование соседних незараженных клеток. До сих пор загадочной оставалась природа этих сигналов.
В данном исследовании, результаты которого были опубликованы в «Science», команда ученых под руководством исследователей из Медицинского колледжа Бейлора обнаружила, что инфицированные ротавирусом клетки выделяют сигнальные молекулы, которые удалось идентифицировать как аденозиндифосфат (АДФ), связывающиеся с рецептором P2Y1 на соседних клетках. Активация P2Y1 посредством АДФ приводит к появлению в неинфицированных клетках сигналов, называемых межклеточными волнами кальция. На мышиной модели заболевания было обнаружено, что при нарушении связывания АДФ с этим рецептором тяжесть диареи снижается. На основании этого было выдвинуто предположение, что прицельное воздействие на рецептор P2Y1 может стать эффективной стратегией борьбы с вирусной диареей у инфицированного человека.
Доктор Джозеф Хайсер (доцент вирусологии и микробиологии, член Центра метагеномных и микробиомных исследований Alkek в Бейлоре) говорит, что в предыдущих исследованиях с использованием флуоресцентных кальциевых датчиков и методики покадровой временной визуализации удалось обнаружить отражение аберрантных кальциевых сигналов, испускаемых инфицированными ротавирусом клетками. Эти сигналы удалось визуализировать как яркие импульсы потоков кальция между клетками. Известно, что кальциевая сигнализация связана с различными аспектами развития ротавирусной инфекции, и работа ученых выявила меняющуюся природу клеточных преобразований, вызванных ротавирусом.
В данном исследовании был осуществлен ряд экспериментов с использованием более низкой дозы вируса; в результате специалисты обнаружили динамическую кальциевую сигнализацию не только у инфицированных ротавирусом клеток. Расположенные вокруг них незараженные клетки также испускали потоки волн кальция, согласованные с таковыми от инфицированных клеток. Это наблюдение показало, что инфицированные клетки могут служить пусковой силой для межклеточных волн кальция, испускаемых незараженными клетками.
Исследователи связывают свое наблюдение с теорией, предложенной в середине 90-х годов, предполагающей, что зараженные ротавирусами клетки посылают сигналы соседним незараженным клеткам, что нарушает их функции и впоследствии способствует развитию поноса и рвоты.
Александра Л. Чанг-Грэхэм, первый автор исследования, M.D./Ph.D., обучающаяся по последипломной программе подготовки медицинских исследователей (Medical Scientist Training Program) и окончившая написание диссертации на соискание степени Ph.D. в лаборатории Хайсера, говорит, что видеозаписи живой флуоресцентной микроскопии, демонстрирующие межклеточную кальциевую волновую сигнализацию как в ротавирусных, так и в незараженных клетках, предоставили беспрецедентный способ исследования природы предлагаемого сигнала, который ранее не удавалось идентифицировать.
Обнаружение сигнала
Чанг-Грэхэм, Хайсер с соавт. работали с тремя различными лабораторными моделями, чтобы определить сигнал, который стимулирует испускание межклеточных кальциевых волн незараженными клетками. Они использовали
- клеточные линии почечной ткани обезьяны, которую обычно используют для изучения ротавируса;
- кишечные энтероиды человека (систему культуры клеток, состоящую из эпителиоцитов, бокаловидных клеток, энтероэндокринных клеток и клеток Панета — прим. перев.), служащие моделью, в которой объединяются многие особенности протекания ротавирусной инфекции в кишечнике человека;
- модели ротавирусной инфекции и диареи на новорожденных мышах.
Исследования показали, что вещества, ранее рассматриваемые как триггеры кальциевых волн, например, простагландин Е2 и окись азота, не вызвали выделение кальция. Затем был проведен анализ АТФ и АДФ, известных медиаторов кальциевой сигнализации, о роли которых в патогенезе ротавирусной инфекции ранее не подозревали. Было обнаружено, что зараженные ротавирусом клетки запускают процесс межклеточной кальциевой сигнализации, выделяя АДФ, который связывается со своим рецептором P2Y1 на незараженных соседних клетках. Выключение гена P2Y1, препятствующего сигнализации с помощью АДФ, привело к снижению межклеточного кальциевого тока.
Чанг-Грэхэм заявляет, что с помощью трех модельных систем удалось последовательно обнаружить доказательства того, что зараженные ротавирусом клетки посылают сигналы неинфицированным клеткам с помощью АДФ, что в итоге обусловливает тяжесть заболевания. Молекулы АДФ, являющиеся истинным посредником при сигнализации, до этого даже не удавалось зафиксировать радиочастотными методами. По мнению исследователей, это приведет к смене парадигмы в понимании механизмов патогенеза ротавирусной инфекции.
Развитие симптомов тяжелой ротавирусной инфекции связано с АДФ-опосредованной сигнализацией
Дальнейшие исследования выявили ранее не известную роль АДФ в развитии ротавирусной инфекции и репликации самого вируса, что позволило признать АДФ как важный триггер множества факторов, приводящих к тяжелым поносу и рвоте при этом заболевании. Например, исследователями были обнаружены доказательства того, что сигнализация с помощью АДФ усиливает тяжесть протекания ротавирусной инфекции, экспрессию воспалительного цитокина IL1- и секрецию серотонина (индуктора диареи). Сигнализация АДФ также повышает экспрессию ферментов, вырабатывающих простагландины и окись азота, что потенциально может привести к увеличению концентрации тех соединений, которые наблюдаются при ротавирусной инфекции. Предотвращение сигнализации, опосредованной АДФ, и межклеточных волн кальция снижает выработку вышеупомянутых соединений.
По словам Чанг-Грэхэм, ключевое достижение исследования — определение того, что ингибирование рецептора P2Y1 снижает тяжесть ротавирусной диареи у мышей. С помощью межклеточных кальциевых волн ротавирус вызывает патологические процессы в клетках, непосредственно им не инфицированных. Это первый выявленный вирус, который способен активировать опосредованные AДФ межклеточные кальциевые волны. Потенциально другие вирусы также могут использовать эту стратегию, вызывая заболевание макроорганизма.
По словам Хайсера, эти выводы свидетельствуют о выделении нового и очень мощного сигнального пути развития ротавирусной диареи. С точки зрения лечения, это крайне важно, так как в настоящее время некоторые препараты, прицельно действующие на P2Y1, проходят доклинический этап исследований как антиагреганты. Применение этих препаратов для лечения ротавирусной диареи будет возможно после того, как будет доказана их безопасность для детей.
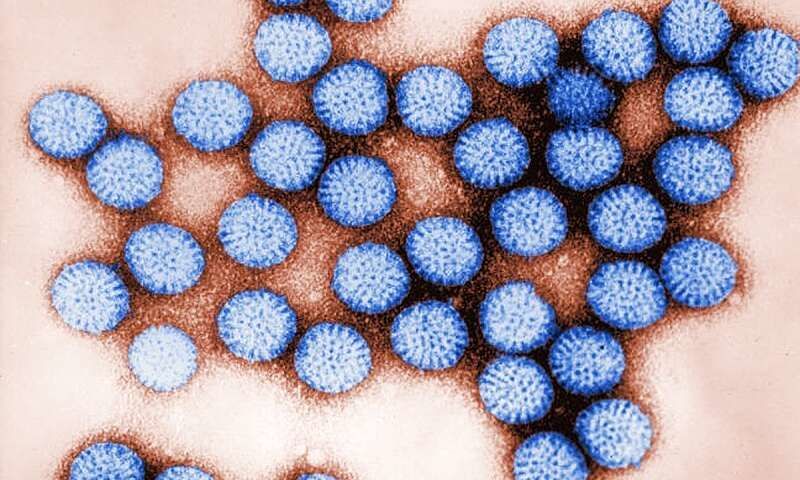
Микрофотография ротавирусных частиц в виде вирионов, полученная путем трансмиссионной электронной микроскопии.