Путем синхронизации приемов пищи с биологическими часами можно добиться усиления теплообразования и затормозить развитие ожирения. Всем известно, что когда потребление энергии превышает энергозатраты, развивается ожирение. Избыток калорий из пищи запасается белыми адипоцитами или же рассеивается в виде тепла бурыми адипоцитами. Молекулярные часы контролируют ритм экспрессии множества генов, что регулирует различные физиологические состояния, такие как потребление и использование энергии в течение дня. Такая регуляция работает в обе стороны, потому что пищевая перегрузка гасит циркадные колебания экспрессии генов и способствует несвоевременному приему пищи, и, что, в свою очередь, вызывает увеличение веса [1]. Алиментарное ожирение можно смоделировать у мышей с помощью высококалорийной диеты с высоким содержанием жиров. Когда временное окно приема пищи с высоким содержанием жиров строго ограничено [кормление, ограниченное по времени (КОПВ)], набор веса у животных тормозится, однако ключевые механизмы этого процесса остаются неразрешенными. Хеплер с соавт. [2] показывают, что КОПВ в активный период циркадных часов (ночью) предотвращает развитие алиментарного ожирения у мышей за счет усиления термогенеза в адипоцитах.
Количество солнечного света является основным фактором, который управляет циркадными ритмами биологических часов, расположенных в супрахиазматическом ядре (СХЯ) гипоталамуса [3]. Генетическое вмешательство в циркадные ритмы способствует переносу потребления пищи на неактивный период (т. е. для мышей — в дневное время) и усиливает развитие алиментарного ожирения [4]. Проекции нейронов СХЯ достигают термогенной бурой жировой ткани. У мышей длительное ежедневное воздействие света нарушает циркадный ритм, снижает термогенез и способствует развитию ожирения [5]; это говорит о том, что точечная активация термогенеза в адипоцитах может компенсировать связь между нарушением циркадных ритмов и чрезмерным потреблением калорий.
КОПВ предполагает преднамеренно ограниченное временное окно, в течение которого потребляется пища; при этом не предпринимается каких-либо попыток уменьшить количество калорий или изменить состав рациона; оставшееся время организм находится в состоянии голодания. КОПВ улучшает работу компонентов циркадных часов и способствует метаболическому здоровью у животных дикого типа, потребляющих рацион с высоким содержанием жиров и у мышей с нарушенным циркадным ритмом без снижения калорийности рациона или усиления физической активности [6]. Из этого следует, что молекулярные механизмы, лежащие в основе таких эффектов, могут оказаться многообещающими точками приложения терапии в условиях избытка пищевых калорий. Хеплер с соавт. исследовали «оптимальное» временное окно КОПВ в контексте переедания без эффектов ограничения калорийности. Они обнаружили, что процесс термогенеза адипоцитов, по крайней мере частично, является основой благоприятного эффекта КОПВ во время активной фазы суточной активности у мышей.
Как удалось определить методами количественной оценки потребления глюкозы, наличие термогенной бурой жировой ткани у людей связано с кардиометаболическим здоровьем [7]. Термогенез может протекать путем стимуляции футильных циклов, в ходе которых происходит либо разобщение окисления макронутриентов и синтеза аденозинтрифосфата (АТФ) (посредством утечки протонов), либо ускорение обмена АТФ. Согласно общепринятой точке зрения, термогенез работает исключительно за счет разобщающего белка 1 (UCP1 — от англ. uncoupling protein 1), что способствует утечке протонов через внутреннюю мембрану митохондрий, минуя синтез АТФ. Еще один путь термогенеза сосредоточен вокруг такого метаболита, как креатин. В большинстве клеток фермент креатинкиназа катализирует обратимый перенос фосфатной группы с АТФ на молекулу креатина для уравновешивания поступления энергии и ее расходования. Однако независимый от UCP1 путь рассеяния энергии в виде тепла, называемый футильным циклом креатина, ускоряет оборот АТФ в цикле фосфорилирования креатина ферментом креатинкиназой B (КKB) и гидролиз фосфокреатина тканенеспецифической щелочной фосфатазой (ТНСЩФ) [8, 9] (см. рисунок).
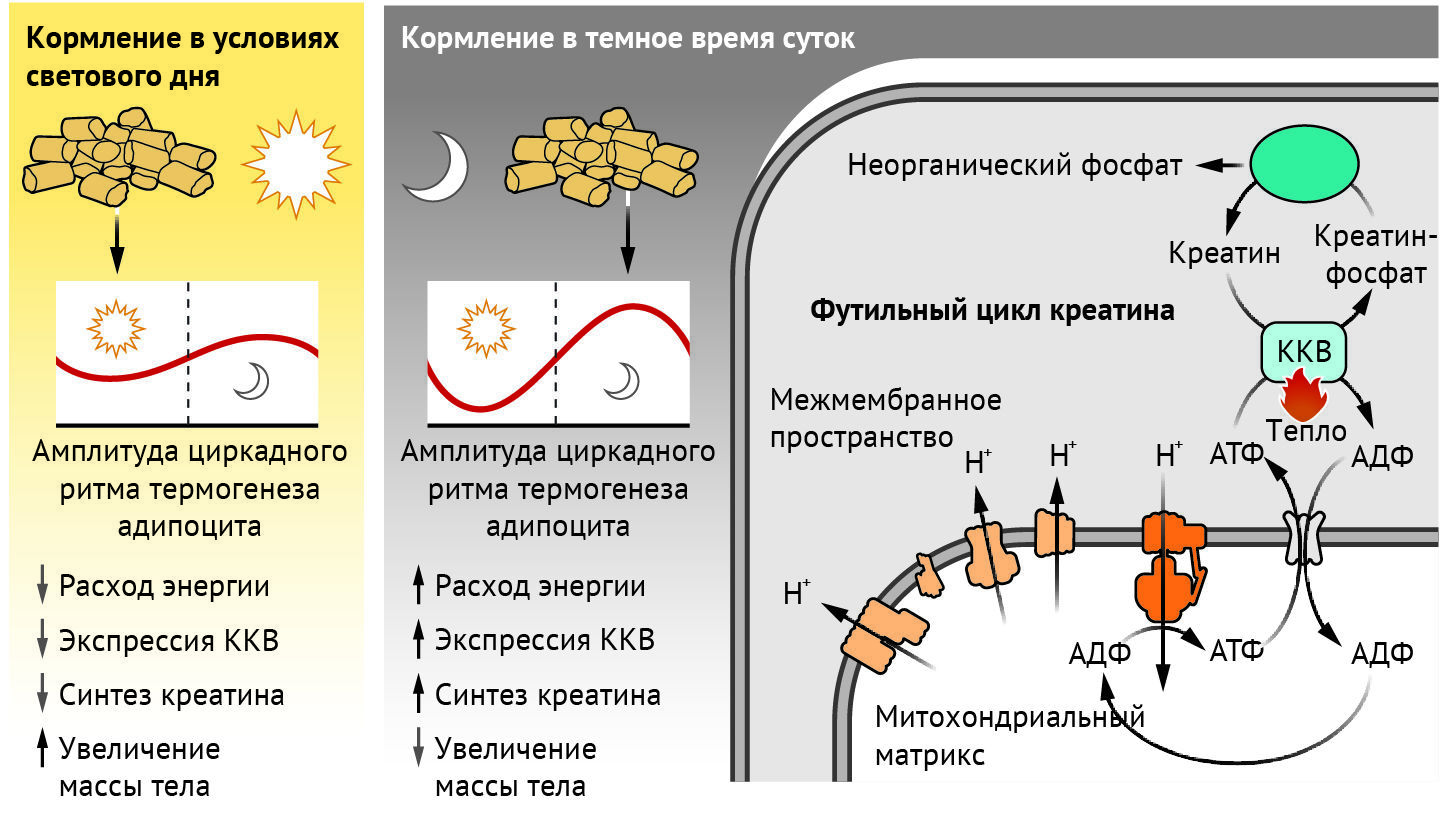
В термогенных адипоцитах креатинкиназа В (КKB) и тканенеспецифическая щелочная фосфатаза (ТНСЩФ) работают в тандеме для ускорения превращения аденозинтрифосфата (АТФ) в аденозиндифосфат (АДФ) в ходе футильного цикла креатина. Этот путь термогенеза стимулирует окисление питательных веществ и потребление кислорода. Экспрессия CKB и количество креатина регулируются циркадными ритмами, достигая пика, когда расход энергии максимален (у мышей — ночью). Если мышей кормят ночью, когда они наиболее активны, а компоненты путей термогенеза экспрессируются в наибольшей степени, такие мыши более устойчивы к ожирению, чем мыши, которых кормили только в светлое время суток.
Хеплер с соавт. обнаружили, что экспрессия ККВ и синтез креатина регулируется циркадными ритмами при кормлении животных, и эти процессы также синхронизированы с ночным временем. А пиковая концентрация как ККВ, так и креатина оказалась соизмерима с усиленным расходом энергии (в т. ч. ночью). Напротив, несвоевременное кормление (т. е. когда в дневное время приемы пищи были ограничены) нарушает ритмичность обилия креатина и экспрессию CKB. В результате вследствие нарушения термогенеза адипоцитами развивается склонность к набору веса. Авторы также обнаружили, что у мышей с адипоцитами, у которых на генетическом уровне отсутствует белок с цинковыми пальцами 423 (ZFP423) — транскрипционный репрессор программы термогенеза [10] — наблюдались усиление выработки тепла адипоцитами и экспрессии КKB; такие мыши также были защищены от ожирения в условиях несвоевременного кормления.
Мыши с дефицитом фермента глицинамидинотрансферазы (GATM), катализирующей лимитирующий этап биосинтеза креатина в адипоцитах, набирали больше веса, чем мыши контрольной группы [11]. На примере двух мышиных моделей со сниженными уровнями креатина в адипоцитах Хеплер с соавт. демонстрируют, что, когда КОПВ синхронизируется с циркадными ритмами, энергозатраты не могут возрастать, вызывая увеличение веса, сходное с таковым при несвоевременном кормлении. В частности, компенсировать такой набор веса может креатин из пищевых добавок, свидетельствуя о том, что добавление креатина полезно, если его содержание в жировой ткани является лимитирующим фактором. Важно изучить, служит ли креатин лимитирующим фактором в условиях избыточного питания, при котором пищевые добавки с креатином могут способствовать рассеиванию тепловой энергии адипоцитами. Если КОПВ регулирует содержание креатина и эффекторов термогенеза с помощью футильного цикла креатина, возможно, эта связь двунаправленная, так что избирательное исчезновение компонентов, опосредующих работу этого цикла, изменяет время приема пищи, если пища находится в свободном доступе. Также следует изучить, осуществляется ли такой двунаправленный контроль жировой ткани эндокринным путем и или посредством чувствительной иннервации [12]. Понимание этих взаимодействий поможет выяснить связь между метаболизмом жировой ткани и потреблением энергии.
Для людей КОПВ представляется многообещающим подходом к снижению массы тела и улучшению состояния обмена веществ лишь с небольшими побочными эффектами [13, 14]. Работа Хеплер с соавт. расширяет наши представления о механизмах, которые лежат в основе КОПВ. Тем не менее, влияние КОПВ на снижение массы тела человека может быть замаскировано — например, в комбинации с диетой с ограничением калорий, — или же эффект КОПВ может быть трудно интерпретировать, если исходный уровень питания не установлен. Сходным образом, преимущества КОПВ могут быть трудноопределимы, если окно времени для приема пищи на исходном уровне схоже с окном при КОПВ [15]. Дополнительные проблемы могут возникнуть из-за отсутствия правильного руководства о том, как придерживаться КОПВ, или же из-за предвзятости самооценки. Кроме того, учитывая, что прием пищи и напитков часто происходит вечером, при разработке диет КОПВ крайне важно критично относиться к социальным аспектам питания.





