езисы
Пищевые волокна представляют собой разнородный класс нутриентов, которые играют важную роль в профилактике различных хронических заболеваний. Большинство из них расщепляется кишечным микробиомом, что способствует регуляции микробиоценоза и метаболизма кишечника, и, следовательно, обусловливает здоровье человека. Пищевые волокна могут регулировать представленность определенных бактериальных таксонов в кишечном микробиоме, однако этот эффект варьирует у разных людей. Кроме того, влияние пищевых волокон на бактериальное разнообразие кишечного микробиома остается предметом обсуждения. В ходе многочисленных интервенционных исследований влияния эффекта пищевых волокон на состояние пациентов с ожирением и связанных с ним метаболическими нарушениями подчеркивается необходимость точного анализа состояния кишечного микробиома для лучшего понимания механизма действия пищевых волокон. Эпидемиологические исследования подтверждают, что увеличение потребления пищевых волокон тесно связано со снижением заболеваемости многими видами рака. Тем не менее существует необходимость определить роль конкретных разновидностей пищевых волокон при развитии онкологии, а также изучить их влияние на эффективность и токсичность терапии и формирование кахексии при онкологии.
Настоящий обзор анализирует механизмы, посредством которых кишечная микробиота реализует защитные эффекты пищевых волокон в контексте ожирения, кардиометаболических нарушений и онкологических заболеваний, патогенез которых ассоциирован с дефицитом пищевых волокон в рационе.
Введение
Пищевые волокна – это соединения, содержащиеся в съедобной части растительных продуктов (например, корневых и листовых овощах, клубнях, фруктах и злаках), которые не поддаются перевариванию ферментами кишечника и поджелудочной железы и играют важную роль в профилактике хронических заболеваний у человека (1,2) (подробнее – Вставка 1). Пищевые волокна представляют собой гетерогенный класс молекул с различной химической структурой и разной степенью полимеризации (1, 2). С химической точки зрения их можно разделить на резистентные углеводы (крахмал) и некрахмальные (поли)сахариды. Их растворимость в воде или этаноле, вязкость и способность ферментироваться (расщепляться) микробиомом кишечника могут служить критериями для их классификации. Тот факт, что пищевые волокна могут быть как растворимыми, так и нерастворимыми, не исключает их биологических свойств. Например, распространенное упрощение, что растворимые пищевые волокна равнозначны ферментируемым, не всегда верно, поскольку некоторые нерастворимые волокна, такие как некоторые резистентные крахмалы, также могут подвергаться ферментации.
Технологические достижения позволили выделить и очистить пищевые волокна из растений, а также синтезировать и модифицировать неперевариваемые олигосахариды и полисахариды. Это расширяет ассортимент пищевых волокон, которые могут быть добавлены в продукты питания для улучшения их питательных или технологических свойств, а также использоваться в качестве пищевых добавок. Существует различие между натуральными волокнами, содержащимися в продуктах растительного происхождения, и пищевыми волокнами, которые специально очищаются или синтезируются для использования в качестве пищевых ингредиентов или добавок (3). В цельных продуктах питания пищевые волокна часто интегрированы в трехмерную матрицу клеточной стенки, содержащую также другие питательные вещества (быстрые углеводы, липиды и микроэлементы) и фитохимические соединения (полифенолы, фитостерины и фитоэстрогены). Такая совместная локализация может оказывать влияние на переваривание и биодоступность биологически активных соединений и питательных веществ, связанных с пищевыми волокнами в растительной матрице. Пищевые волокна влияют на время кишечного транзита, удержание воды и питательных веществ в просвете кишечника, что может приводить к изменению в структуре и функциях кишечного микробиома (4).
Обработка пищевых продуктов, к примеру, измельчение, перемалывание и температурная кулинарная обработка, может значительно повлиять на перевариваемость углеводов в тонком кишечнике, помогая некоторым из них стать доступными для дальнейшей ферментации кишечными микроорганизмами. Например, в исследовании Carmody, R. N. с соавт., 2019 показано, что этот эффект может способствовать вкладу кишечных микроорганизмов кишечника в энергетический статус хозяина (5). Допустим, изменения условий приготовления пищи регулирует количество, структуру и вид резистентных крахмалов. Разные методы приготовления пищи влияют на микробиоту кишечника и, соответственно, на здоровье человека, что подтверждается статистически — от корреляционных связей до причинно-следственных (6). Различия в способах пищевой обработки могут в значительной степени определять влияние резистентного крахмала, содержащегося в рисе, на состав микробиоты кишечника и выработку микробных метаболитов (6).
Рекомендация по включению в рацион пищевых волокон является общепринятой диетической рекомендацией во всем мире (2). Однако в официальных диетических рекомендациях медицинских сообществ существуют некоторые расхождения относительно количества пищевых волокон, необходимого для поддержания здоровья (2, 7, 8). Хотя достаточное потребление волокон зависит от возраста, рекомендуемое количество для взрослых обычно составляет 25–30 г в день. При этом лишь небольшая часть населения планеты соблюдает эти рекомендации (8). В Северной Америке и Европе основными источниками волокон являются продукты на основе зерна, за ними следуют фрукты и овощи, включая картофель, в то время как бобовые, орехи и семена в рационе встречаются в меньшей степени.
Рекомендуемые нормы потребления пищевых волокон были установлены в большей степени для поддержания нормальной перистальтики и здоровья сердечно-сосудистой системы. Однако новые исследовательские данные свидетельствуют о том, что их потенциальная польза гораздо больше, включая оказываемое благотворное влияние на микробиом кишечника (рис. 1). В данном обзоре рассматривается, как пищевые волокна воздействуют на физиологию человека и микробную экосистему кишечника. Понимание того, как пищевые волокна влияют на взаимодействие представителей кишечного микробиома и организма человека, помогает определить их роль в здоровом питании (9). Эпидемиологические исследования показали, что пищевые волокна могут служить защитным фактором при различных хронических заболеваниях, в патогенезе которых фигурирует микробиота кишечника (10). Поэтому в настоящем обзоре исследуется взаимодействие между микробиомом и пищевыми волокнами в контексте ожирения, кардиометаболических и онкологических заболеваний как наиболее тяжелых, экономически обременительных хронических неинфекционных заболеваний с высоким риском смертельного исхода (11).

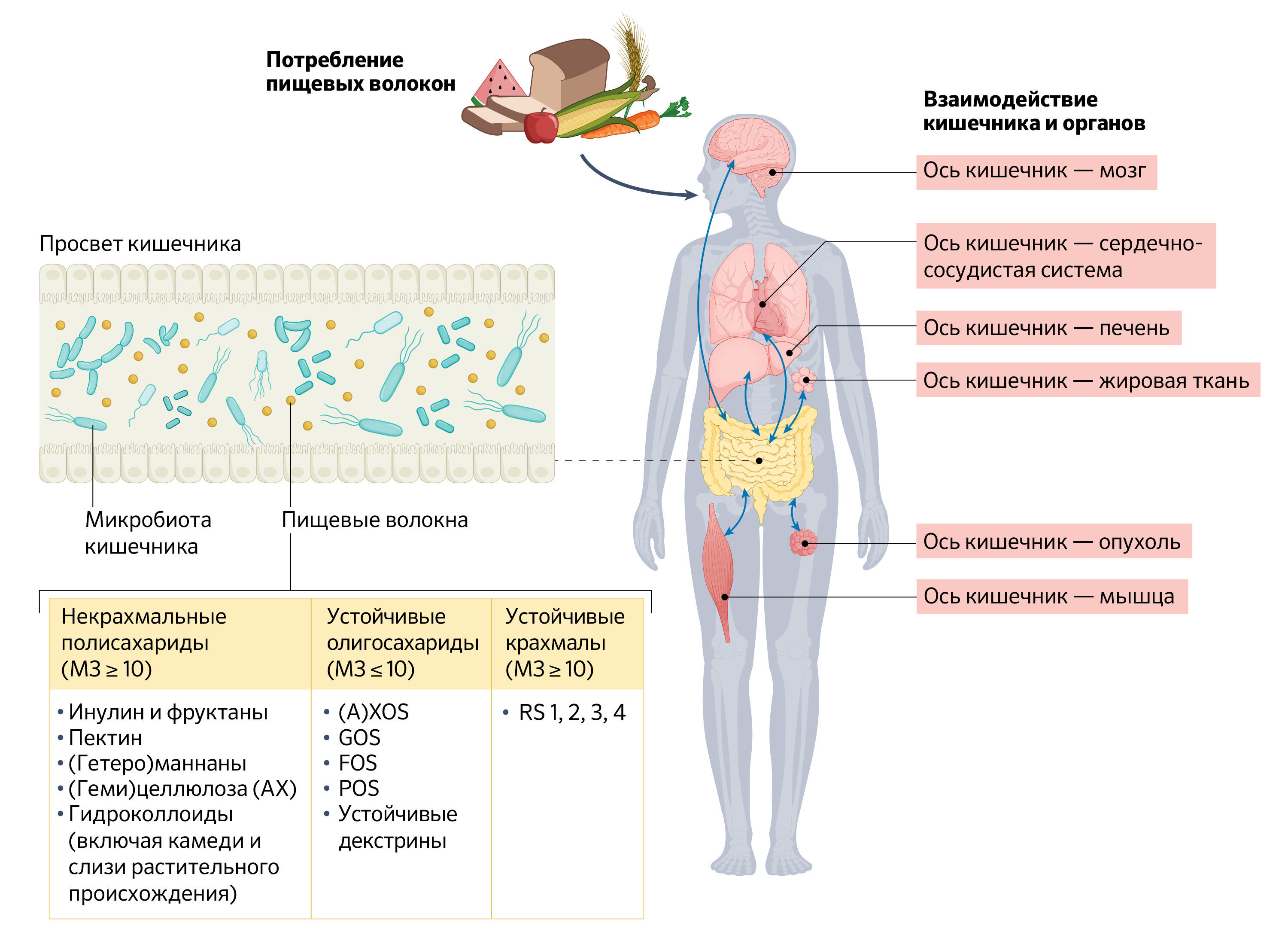
Рис. 1. Пищевые волокна и их взаимодействие с кишечником и другими органами.Пищевые волокна можно классифицировать на некрахмальные полисахариды, резистентные крахмалы и резистентные олигосахариды. Волокна способны влиять на различные физиологические параметры человеческого организма. В Европейском Союзе утверждены следующие факты о пользе потребления пищевых волокон: 1) сокращают время прохождения пищи по кишечнику; 2) снижают уровень холестерина в крови или всасывание холестерина с пищей и желчью; 3) способствуют поддержанию нормального уровня холестерина в крови; 4) способствуют увеличению объема фекалий; 5) способствуют поддержанию нормальной работы кишечника; 6) способствует регулярному опорожнению кишечника; 7) способствуют снижению веса при диете с ограничением калорий; 8) способствуют снижению постпрандиальных показателей гликемии; 9) способствует снижению риска сердечно-сосудистых заболеваний и сахарного диабета 2 типа; 10) способствуют снижению риска развития некоторых видов рака (колоректального рака) (2,155).
AX (arabinoxylans) – арабиноксиланы; (A)XOS ([arabino]xylo-oligosaccharides) – (арабино)ксилан-олигосахариды; FOS (fructo-oligosaccharides) – фруктоолигосахариды; GOS (galacto-oligosaccharides) – галактоолигосахариды; MU (monomeric units) – мономерные звенья; POS (pecto-oligosaccharides) – пектоолигосахариды.
Взаимодействие между микробиомом кишечника и пищевыми волокнами
Ключевую роль в способности пищевых волокон модулировать кишечный микробиом играет их возможность ферментироваться бактериями. Метаболизм неперевариваемых углеводов осуществляется бактериями, экспрессирующими ферменты углеводного обмена (carbohydrate-active enzymes, CAZymes), включая семейства гликозидгидролаз, гликозилтрансфераз, углеводных эстераз и полисахарид-лиаз (12, 13) (рис. 2). Широкий спектр активности этих ферментов позволяет расщеплять сложные смеси пищевых волокон, содержащиеся в продуктах растительного происхождения. Простые пищевые волокна, состоящие в основном из одного мономера, такие как фруктан, требуют активности одного или двух семейств CAZymes, в то время как для расщепления более сложных пищевых волокон, таких как пектин, необходима работа как минимум семи семейств CAZymes. Конечные продукты, образующиеся при деградации пищевых волокон под действием CAZymes, состоящие из пяти- или шестиуглеродных моносахаридов, поглощаются бактериями благодаря транспортным системам для утилизации гликанов, например, локусам утилизации полисахаридов. В бактериальных клетках моносахариды превращаются в пируват по пятиуглеродному пентозофосфатному пути и/или по шестиуглеродному пути Эмбдена-Мейергофа-Парнаса (14). Пируват и фосфоенолпируват по составу представляют собой предшественники КЦЖК. Важно отметить, что профиль КЦЖК зависит от расщепления пищевых волокон бактериями различных родов и видов, а также от бактериального метаболизма аминокислот, получаемых из белков (15).
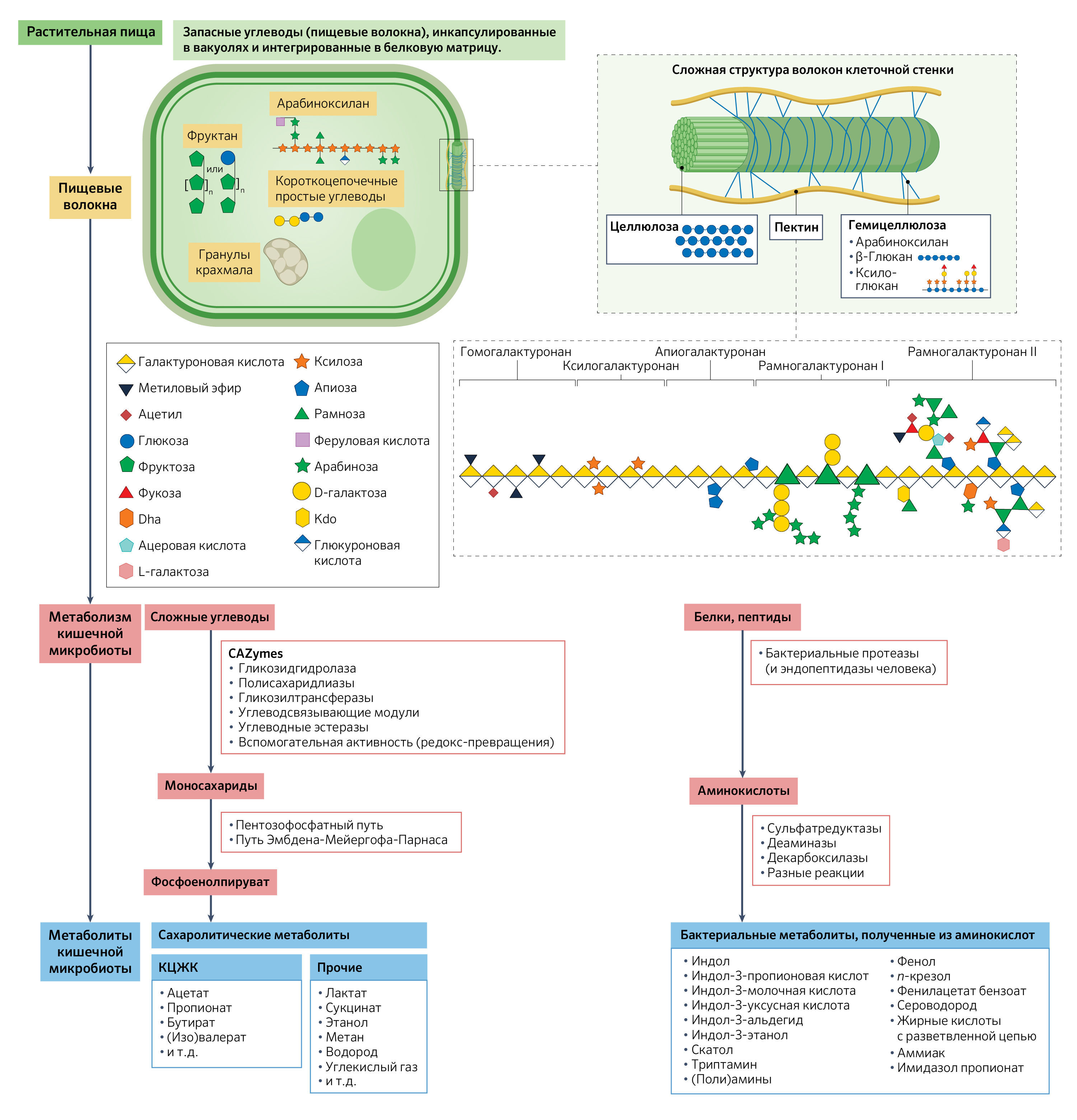
Рис. 2. Структура пищевых волокон и их расщепление кишечной микробиотой.Пищевые волокна могут формировать сложную трехмерную структуру, которая составляет основу растительных клеток, или находиться в вакуолях растений в виде углеводов, хранящихся вместе с другими питательными веществами, такими как липиды, белки и полифенолы (3). Волокна, содержащиеся в клеточной стенке растений, состоят из целлюлозы, которая образует фибриллы, стабилизированные гемицеллюлозой и дополнительно укрепленные пектином (156). Сложные углеводы с запасающей функцией, такие как фруктаны, арабиноксиланы и гранулы крахмала, заключены в белковую матрицу. Клетки некоторых фруктов и овощей содержат также вакуоли, заполненные в основном короткоцепочечными простыми углеводами, водой и другими питательными веществами. Сложные углеводы и белки растительных клеток ферментируются микробными сообществами, находящимися в кишечнике, что приводит к образованию сахаролитических и протеолитических метаболитов. Некоторые из этих метаболитов включают короткоцепочечные жирные кислоты (КЦЖК), такие как ацетат, пропионат и бутират, бактериальные аминокислотные метаболиты, такие как индолы, фенолы и п-крезол, а также другие метаболиты, такие как лактат, этанол и метан. На рисунке выделены основные метаболические пути, важную роль в которых играют: 1) ферменты углеводного обмена (carbohydrate-active enzymes, CAZymes) (13), участвующие в метаболизме сложных углеводов, пентозофосфатном пути и гликолитическом пути Эмбдена-Мейергофа-Парнаса, метаболизме моносахаридов до фосфоенолпирувата, а также 2) бактериальные протеазы и другие ферменты, которые метаболизируют белки и пептиды в бактериальные метаболиты, полученные из аминокислот. На рисунке также показаны промежуточные продукты, участвующие в производстве микробных метаболитов, таких как КЦЖК, жирные кислоты с разветвленной цепью, газы (водород, метан, углекислый газ, сероводород) и индольные соединения (15).
Dha – 3-дезокси-D-ликсо-гептопиран-2-уларовая кислота; Kdo — 3-дезокси-D-манно-окт-2-улозоновая кислота.
Влияние пищевых волокон на микробиоценоз кишечника и его функциональность
Пищевые волокна могут оказывать влияние на микробное разнообразие кишечника и присутствие определенных таксонов, причем этот эффект имеет существенные индивидуальные различия. Кроме того, пищевые волокна могут менять функции микроорганизмов, приводя к изменению профиля специфических метаболитов, участвующих в физиологии человека. Национальный центр биотехнологической информации США (National Centre for Biotechnology Information, NCBI) обновил названия некоторых бактерий в соответствии с включением ранга «филум» в Международный кодекс номенклатуры прокариот (International Code of Nomenclature for Prokaryotes, ICNP). Поэтому, чтобы соответствовать большинству цитируемых ссылок, здесь сохранены названия бактерий в том виде, в каком они опубликованы в оригинале.
Пищевые волокна и α-разнообразие микроорганизмов в кишечнике
Под α-разнообразием микробиоты кишечника понимается богатство (высокая представленность микроорганизмов разных таксономических групп) и выравненность обилий вида (равномерность распределения видов по их обилию в сообществе). В ряде исследований выявлена обратная связь между α-разнообразием и тяжестью течения заболеваний (16). Ферментируемые пищевые волокна могут создавать микробные ниши в кишечнике, однако существуют разногласия относительно того, может ли потребление пищевых волокон увеличить разнообразие кишечной микробиоты и ее богатство, в частности. В одном из исследований показано, что на фоне повышенного потребления пищевых волокон наблюдается увеличение богатства микробиоты, которое взаимосвязано с повышением ее стабильности (17). В большинстве интервенционных исследований, в ходе которого изучили эффект потребления клетчатки, не было зафиксировано увеличения α-разнообразия, а в некоторых случаях даже отмечалось его снижение (18–22). Снижение α-разнообразия может быть вызвано изменением выравненности видов по обилию (к примеру, в результате избыточного бактериального роста) или потерей бактериальных видов (20,23). Нет доказательств того, что снижение α-разнообразия, связанное с потреблением пищевых волокон, исключает потенциально негативные последствия для человеческого организма. В систематическом обзоре и мета-анализе (So, D. и соавт., 2018) установлено, что употребление пищевых волокон не оказывает эффекта на разнообразие кишечной микробиоты, но увеличивает численность определенных бактерий (Bifidobacterium и Lactobacillus) и концентрацию бутирата в фекалиях здоровых добровольцев (16).
Влияние употребления пищевых волокон на рост определенных таксонов бактерий
Введение в рацион пищевых волокон с определенной химической структурой позволяет целенаправленно корректировать состав кишечной микробиоты. Далее в обзоре будет продемонстрировано, что модулирующее влияние пищевых волокон на состав микробиоты кишечника зависит в большей степени от их физико-химических характеристик, чем от вида. Например, микробиота после употребления резистентных крахмалов с кристаллической структурой характеризуется увеличением численности Eubacterium rectale, Ruminococcus bromii и родственных видов Ruminococcus. Такая структура значительно отличается от кишечной микробиоты, которая формируется после приема в пищу поперечно-сшитого резистентного крахмала типа 4 (cross-linked resistant starches type 4, RS4), способствующего увеличению численности Parabacteroides distasonis (24,25). Оба вида резистентных крахмалов стимулируют рост бактерии Bifidobacterium adolescentis, однако же реакция на них со стороны организма человека может быть очень индивидуальной. Арабиноксиланы, в частности, способствуют росту Bifidobacterium longum. В ходе интервенционных исследований, направленных на сравнение эффекта приема очищенных фруктанов инулинового типа с плацебо, также установлено значительное увеличение числа бифидобактерий у большинства участников (18,21,26,27). У добровольцев с ожирением при употреблении фруктана увеличивается число бифидобактерий определенных видов (B. longum, Bifidobacterium pseudocatenulatum и B. adolescentis), тогда как число других видов не меняется (Bifidobacterium animalis и Bifidobacterium breve) (28). Интересно, что кишечный микробиом человека, обогащенный как B. longum, так и B. adolescentis, ассоциируется с таксономическим разнообразием и более высокой представленностью бактерий, продуцирующих бутират; кроме того, эти бактерии более распространены среди здоровых людей (29). Галактоолигосахариды также способствуют росту некоторых видов бифидобактерий кишечной микробиоты (30). Специфичность реакции на пищевые волокна может проявляться на уровне рода, вида и даже подвида бактерий (31–33). Сложные пищевые волокна также могут вызывать специфические реакции. Например, представитель сложных углеводов арабиноксилан кукурузы высокоспецифичен в отношении роста B. longum и Prevotella copri, в то время как употребление арабиноолигосахаридов способствует росту бактерий семи разных видов, принадлежащих родам Bifidobacterium и Prevotella, а также других родов, таких как Eubacterium и Roseburia, что делает арабиноолигосахариды менее специфичным пищевыми волокнами (34). Эти наблюдения позволяют некоторым авторам предположить, что сложность строения пищевых волокон может определять специфичность их воздействия на различные виды кишечных бактерий.
Ответ микробиоценоза кишечника на употребление пищевых волокон
Хотя пищевые волокна могут значительно влиять на определенные популяции бактерий, общий ответ микробиоценоза кишечника на их употребление может быть очень индивидуальным. Это можно оценить, используя индексы индивидуальной вариабельности β-разнообразия, которые отражают индивидуальные особенности кишечной микробиоты (то есть видовое разнообразие среди различных мест обитания, участков и образцов в разные моменты времени). Например, в различных исследованиях доказано, что менее чем в половине случаев наблюдается увеличение числа бифидобактерий в кишечной микробиоте участников при употреблении арабиноксиланов, галактоолигосахаридов или резистентных крахмалов (24,25,30,35). По-прежнему недостаточно понимание факторов, опосредующих индивидуальную реакцию человека на прием пищевых волокон, Первоначальный состав микробиома кишечника, особенности поведения человека (физические упражнения, подверженность стрессу и т. д.) или воздействие ксенобиотиков, включая медикаментозное лечение, могут во многом менять состав микробиома кишечника при употреблении пищевых волокон (36). Если ответ P. copri на арабиноксиланы в основном зависит от его наличия в микробиоте (встречается редко у популяции индустриального общества), то у B. Longum такой связи не наблюдается (35). В микробиоме кишечника выделяют экологические гильдии бактерий, специализирующиеся на ферментации пищевых волокон. Ответ микробиоты на пищевые волокна бывает первичным и вторичным (37,38). Первичный ответ определяется генетической способностью микроорганизмов использовать определенные структуры волокон и часто являются высокоспецифичными. После первичного ответа могут возникать вторичные реакции, затрагивающие другие бактерии, рост которых либо стимулируется, либо подавляется. В просвете кишечника некоторые бактериальные метаболиты, образующиеся при ферментации пищевых волокон, служат субстратами для специфических кишечных бактерий, участвующих в перекрестном питании (симбиотическая утилизация субстратов). Например, лактат может служить энергетическим субстратом для некоторых бактерий, которые метаболизируют лактат в другие КЦЖК, такие как бутират. Это способствует росту бактерий, зависящих от КЦЖК как от субстрата. Некоторые микробные метаболиты, такие как пропионат, обладают бактериостатическим действием, либо способны снижать pH (рис. 3). Снижение pH при воздействии пищевых волокон, таких как галактоолигосахариды (30) и резистентные крахмалы (25), в свою очередь, может привести к уменьшению численности видов Bacteroides , несмотря на способность бактерий утилизировать субстрат. Снижение численности Bacteroides spp. из-за низкого pH наглядно представлено в исследованиях по изучению эффекта пищевых волокон in vitro, отличающихся строгим контролем pH (39). Эффекты вторичных реакций на микробиоту, особенно если они ингибирующие, гораздо менее специфичны, чем селективное обогащение микробиоты, вызванное волокнами, и, вероятно, их значительно сложнее предсказать с помощью метагеномных подходов и методов машинного обучения, поскольку они обусловлены сложными экологическими взаимодействиями (25). Исследование показало, что точные изменения в микробиоме кишечника на уровне видов, связанные с приемом в пищу различных RS4, ассоциированы с четкими сдвигами выработки либо пропионата, либо бутирата. Несмотря на отсутствие доказательств прямой связи этих эффектов с клиническими исходами, они позволяют целенаправленно регулировать метаболическую активность кишечной микробиоты для создания персонализированных терапевтических стратегий, включающих питание.
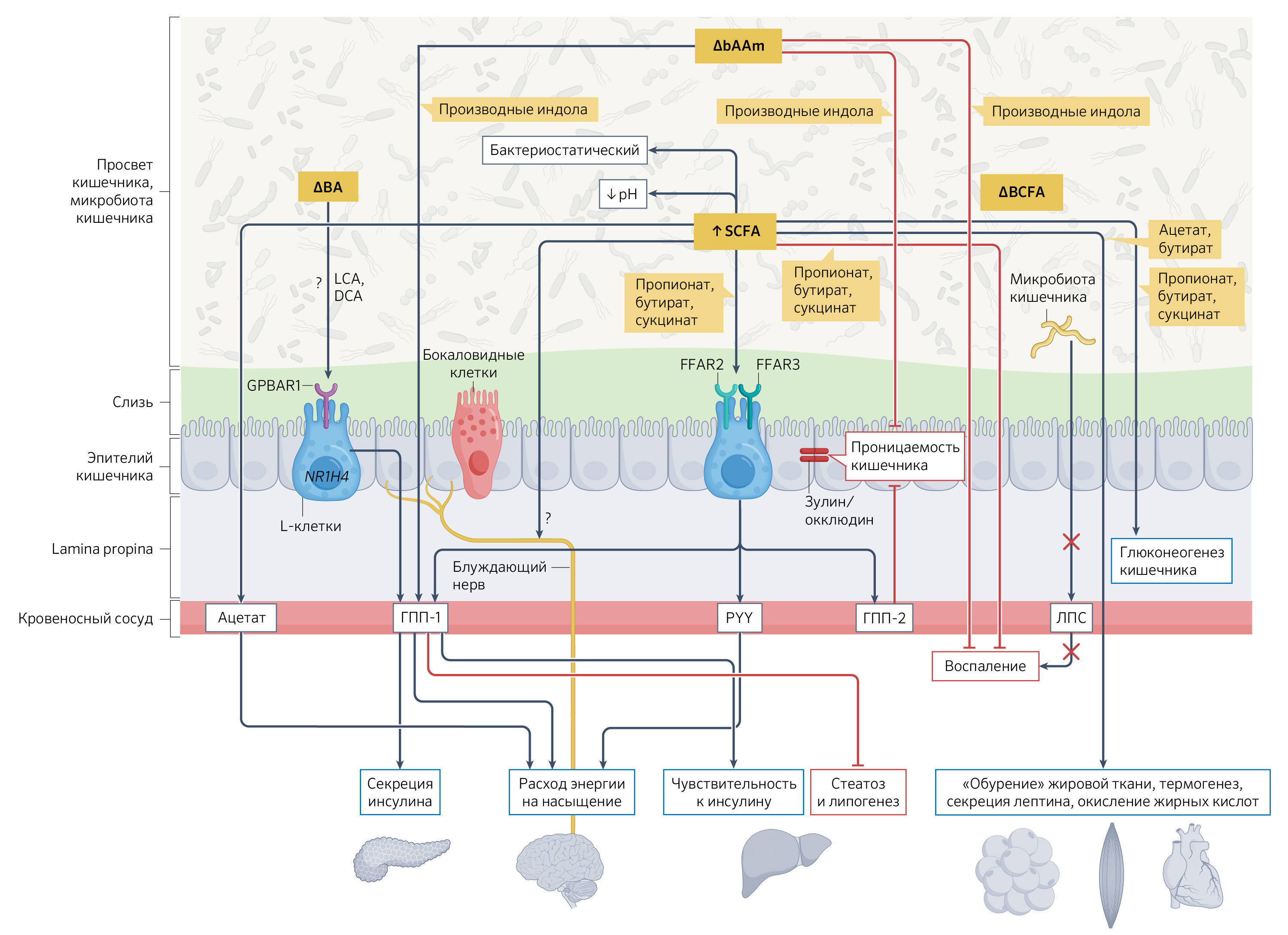
Рис. 3. Механизмы, через которые пищевые волокна участвуют в системных эффектах, зависящих от микроорганизмов кишечника.Ферментация пищевых волокон микроорганизмами кишечника, происходящая в просвете кишечника, может приводить к образованию различных метаболитов, таких как короткоцепочечные жирные кислоты (КЦЖК, short-chain fatty acids, SCFAs) и жирные кислоты с разветвленной цепью (BCFA, branched-chain fatty acids), которые оказывают значительное влияние на физиологию человека на системном уровне. Однако другие вторичные метаболиты, которые не образуются в результате микробно-зависимой ферментации пищевых волокон, такие как вторичные желчные кислоты (bile acids, BAs) или бактериальные метаболиты, полученные из аминокислот (bacterial amino acid-derived metabolites, bAAm), также способствуют этим эффектам. Некоторые из этих метаболитов, к примеру, КЦЖК могут влиять на активность симпатической нервной системы, что сказывается на энергетическом обмене. КЦЖК могут снижать воспаление в печени и кишечнике и способствовать стимуляции афферентных нейронов блуждающего нерва, поддерживая энергетический гомеостаз (15). Некоторые КЦЖК или желчные кислоты активируют рецепторы, сопряженные с G-белком, такие как рецептор свободных жирных кислот 2 (free fatty acid receptor 2, FFAR2) и 3 (FFAR3), а также 1-й рецептор желчных кислот, сопряженный с G-белком (G protein-coupled bile acid receptor 1, GPBAR1), которые экспрессируются эпителиальными клетками кишечника (в частности, L-клетками). Это приводит к выработке гормонов кишечника, таких как глюкагоноподобный пептид 1 (ГПП-1, glucagon-like peptide 1) и 2 (ГПП2), а также пептид YY (peptide YY, PYY). Эти гормоны влияют на кишечный транзит, насыщение и гомеостаз глюкозы, а также на проницаемость кишечника. Улучшение состояния кишечного барьера (в частности, за счет улучшения распределения белков плотного контакта, таких как зонулин и окклюдин) снижает эндотоксемию (транслокация липополисахаридов [ЛПС], показана на рисунке стрелками с красным крестом) и системное воспаление. В свою очередь, bAAm может уменьшать воспаление кишечника и модулировать барьер эпителиальных клеток. Некоторые КЦЖК, такие как пропионат, обладают бактериостатическим эффектом и могут приводить к снижению pH, в то время как другие, такие как ацетат, или бактериальные компоненты, такие как ЛПС, также могут попадать в кровоток и непосредственно влиять на метаболизм и функцию периферических тканей (жировая ткань, печень, мозг и мышцы). Синие и красные прямоугольники на рисунке выделяют, соответственно, положительные и отрицательные метаболические или воспалительные исходы кардиометаболических заболеваний. Механизмы, показанные на этом рисунке, главным образом основаны на экспериментальных исследованиях. Связи, которые не имеют четкой доказанности, обозначены вопросительными знаками.
DCA (deoxycholic acid) – дезоксихолевая кислота; LCA (lithocholic acid) – литохолевая кислота; Lamina propina – собственная пластинка слизистой оболочки; ГПП-1 (glucagon-like peptide 1) – глюкагоноподобный пептид 1; ГПП-2 (glucagon-like peptide 2) – глюкагоноподобный пептид 2; PYY – пептид YY; ЛПС – липополисахарид.
Метаболиты кишечной микробиоты
Существует огромное разнообразие метаболитов, которые могут быть произведены микробиомом кишечника. Такие метаболиты, как КЦЖК, в первую очередь образуются в результате ферментации пищевых волокон. как Представители жирных кислот с разветвленной цепью (BCFA, branched-chain fatty acids) — изобутират, 2-метилбутират и изовалерат —могут образовываться путем ферментации аминокислот с разветвленной цепью: валин, изолейцин и лейцин соответственно. Вторичные желчные кислоты или метаболиты, полученные из аминокислот бактерий, не образуются при ферментации пищевых волокон, но последние могут косвенно влиять на их профиль. В этом разделе рассматриваются метаболические эффекты этих биоактивных соединений микробного происхождения.
Короткоцепочечные жирные кислоты (КЦЖК)
Пищевые волокна служат субстратами для различных микробных сообществ, что приводит к образованию КЦЖК и газа. КЦЖК могут использоваться в качестве энергетических субстратов в клетках кишечника, а также в периферических органах, где они могут играть роль регуляторов метаболизма в клетках хозяина (40,41) (рис. 3). В отличие от неферментируемых пищевых волокон, которые не участвуют в энергетическом метаболизме, поскольку выводятся без биотрансформации, производство КЦЖК при ферментации позволяет восстановить от 1,5 до 2 ккал на грамм пищевых волокон (42). Участвуя в молекулярных процессах регуляции метаболизма, КЦЖК способны менять ацетилирование и метилирование гистонов, связываться с рецепторами, сопряженными с G-белками (G protein-coupled receptors, GPCR), способствовать секреции различных гормонов (например, ГПП-1, ГПП-2 и пептид YY) и нейрохимических веществ (например, серотонина), а также влиять на функцию блуждающего нерва. Все эти механизмы могут способствовать улучшению чувствительности к инсулину через их воздействие на жировую ткань и скелетные мышцы, а также на метаболизм и функцию печени (43). Влияние КЦЖК на гистоновые деацетилазы и GPCR также может откладывать возникновение и прогрессирование онкологических заболеваний (44). Расщепление пищевых волокон с образованием КЦЖК часто приводит к полезным эффектам, включая подавление образования потенциально патогенных метаболитов. Например, снижая pH в кишечнике за счет производства КЦЖК, ферментация пищевых волокон подавляет протеолитическую ферментацию и связанное с ней образование потенциально вредных конечных продуктов, таких как фенолы, аммиак и амины (45). Однако стоит отметить, что некоторые исследования выявили негативное воздействие КЦЖК на здоровье человека. Например, было показано, что они способствуют развитию нейровоспаления и двигательных нарушений в мышиной модели болезни Паркинсона (46).
Метаболиты, полученные из аминокислот
Исследования показали, что бактериальные метаболиты, полученные из аминокислот, такие как имидазол-пропионат, фенилацетат, бензоат, p-крезол и фенол, оказывают негативное влияние на метаболизм человека. У пациентов с ожирением наблюдается повышенное содержание п-крезола и фенола в моче, которое снижается при потере веса (47). Низкий уровень генетического разнообразия микробного сообщества также связан с более высоким производством фенилуксусной кислоты бактериями кишечной микробиоты, что может приводить к гепатостеатозу (48). Напротив, производство индола может способствовать секреции ГПП-1 кишечными энтероэндокринными клетками и оказывать положительное воздействие на барьерные свойства эпителиальных клеток, а также на воспаление печени, обусловленное ожирением (49–51). Ферментация белков и аминокислот приводит к образованию сероводорода, аммиака и п-крезола, которые могут способствовать развитию колоректального рака (52). Данные метаболиты могут влиять на окислительный метаболизм колоноцитов и выработку аденозинтрифосфата (АТФ), а также приводить к увеличению активных форм кислорода, вызывать повреждение ДНК и изменять клеточный цикл, что в конечном итоге снижает пролиферацию колоноцитов. Исследования с участием добровольцев показали, что потребление пищевых волокон может влиять на образование определенных вредных метаболитов. Например, потребление резистентного мальтодекстрина в течение 24 недель снизило уровни некоторых условно-патогенных вирулентных метаболитов, таких как имидазол-пропионат и триметиламин, у лиц с уровнем гликированноого гемоглобина A1c (HbA1c) выше 6 %, ранее имевших повышенное количество этих метаболитов (53). Другое исследование показало, у людей среднего и старшего возраста, придерживающихся средиземноморской диеты, наблюдались более высокие концентрации бензойной и 3-гидроксифенилуксусной кислот в фекалиях, что положительно коррелировало с потреблением основных классов и подклассов полифенолов и волокон, а также с более высокими уровнями полезных бактерий из кластера XVIa Clostridium и Faecalibacterium prausnitzii (54). Эти результаты подчеркивают связь между средиземноморской диетой, биоактивными соединениями в рационе и метаболическим профилем фенольных соединений кала.
КЦЖК являются маркерами бактериальной ферментации белка, однако их потенциальное влияние на здоровье человека остается недостаточно изученным (55,56). Недавний систематический обзор Yehia, N. A. и соавт., 2023 выявил положительную связь между КЦЖК и кардиометаболическими нарушениями у человека: были установлены статистически значимые обратные корреляции между сывороточными КЦЖК и жировой тканью, инсулинорезистентностью, триглицеридами, инсулинорезистентностью скелетных мышц и/или массой тела. Однако в ходе одного рандомизированного исследования влияния питания не было выявлено значительных различий в отношении концентрации КЦЖК в стуле или индексе массы тела (ИМТ) среди участников с ожирением, которым были назначены группы с фруктово-овощной или цельнозерновой диетой, по сравнению с контрольной группой, получавшей очищенное зерно (57). Не так давно в исследовании «Microbiome and Insulin Longitudinal Evaluation Study» (MILES) была выявлена связь между высоким уровнем КЦЖК и улучшением гомеостаза глюкозы в когорте, состоящей из 219 участников европеоидной расы нелатиноамериканского происхождения и 126 афроамериканцев (58). Также была обнаружена отрицательная корреляция между потреблением пищевых нерастворимых волокон и уровнем КЦЖК в кале (59). Кроме того, исследования in vitro показывают, что определенные пищевые волокна могут снижать выработку КЦЖК и патогенного п-крезола, причем этот эффект зависит от характеристик микробиома кишечника и диетического режима исследовавшихся добровольцев (60). В то же время в двойном слепом рандомизированном перекрестном исследовании с участием здоровых добровольцев показано, что добавление фруктана в пищу способно умеренно снижать общую концентрацию КЦЖК в фекалиях (61).
Желчные кислоты
Желчные кислоты представляют собой класс структурно разнообразных молекул, образующихся в результате метаболизма холестерина (62). Первичные желчные кислоты синтезируются путем гидроксилирования холестерина через классический CYP7A1-зависимый путь с участием катализирующего фермента холестерин-7α-гидроксилазы (CYP7A1), либо через альтернативный путь, реализуемый ферментом оксистерол-7α-гидроксилазой (CYP7B1). Затем желчные кислоты конъюгируются в печени, высвобождаются в кишечник, где они модифицируются кишечной микробиотой во вторичные желчные кислоты и повторно конъюгируются в печени. Идентифицировано несколько мембранных и ядерных рецепторов, реагирующих на желчные кислоты, что объясняет механизмы, с помощью которых они координируют передачу сигнала в различных типах клеток и тканях (рис. 3). Эти рецепторы включают ядерный рецептор подсемейства 1 группы H член 4 (nuclear receptor subfamily 1 group H member 4, NR1H4), также известный как фарнезоидный X-рецептор (farnesoid X receptor, FXR) и рецептор GPBAR1, также известный как G-белковый рецептор 5 (Takeda G protein-coupled receptor 5, TGR5). Сигнальные пути GPBAR1 (TGR5) в значительной степени подвержены изменению со стороны кишечного микробиома. Конъюгированные и неконъюгированные первичные желчные кислоты, а также первичные и вторичные желчные кислоты оказывают разнонаправленные эффекты, воздействуя на NR1H4 или GPBAR1 в органах, вовлеченных в энтерогепатическую циркуляцию (62). Мощными активаторами GPBAR1 являются Вторичные желчные кислоты, такие как литохолевая кислота и дезоксихолевая кислота, а также их конъюгированные формы. За последние два десятилетия препараты, являющиеся миметиками желчных кислот и нацеленные на NR1H4 и GPBAR1 или на оба, продемонстрировали свою эффективность в облегчении хронических метаболических и воспалительных состояний, включая ожирение.
Потребление пищевых волокон, особенно обладающих свойствами секвестрантов желчных кислот, ассоциировано со снижением сердечно-сосудистого риска, несмотря на противоречивые результаты клинических исследований (63). Например, после 6-недельного приема целлюлозы наблюдалось избирательное снижение уровня вторичных желчных кислот в кале (таких как дезоксихолевая, изолитхолевая, тауролитхолевая, тауродезоксихолевая и гликолезоксихолевая кислоты), тогда как потребление арабиноксиланов не снижало концентрацию желчных кислот по сравнению с исходным уровнем (23).
Пищевые волокна могут также могут обеспечивать организм биоактивными соединениями после ферментации, влияя на доступность других питательных веществ. Хотя этот эффект по большей части был продемонстрирован на животных моделях, такие пищевые волокна как фруктаны инулинового типа могут снижать всасывание жирных кислот и переваривание сахаров, а также повышать усвояемость глютена, тем самым изменяя источники субстратов для микробиома кишечника в толстом кишечнике (64–66).
Таким образом, многие метаболиты, продуцируемые кишечной микробиотой и зависящие от потребления пищевых волокон, влияют на метаболизм хозяина через взаимодействие с ядерными и мембранными рецепторами или за счет изменения энергетического обмена.
Пищевые волокна, микробиота кишечника и хронические заболевания
Согласно данным Всемирной организации здравоохранения (ВОЗ), ожирение и рак являются наиболее серьезными проблемами общественного здравоохранения в XXI веке. Ожирение представляет собой фактор риска для двух основных причин смерти в мире, включая сердечно-сосудистые заболевания и диабет (Информационный бюллетень ВОЗ по ожирению и избыточной массе тела), а также различные виды рака (Информационный бюллетень ВОЗ по раку). Исследование, проведенное Институтом измерения показателей и оценки состояния здоровья (Institute for Health Metrics and Evaluation) в рамках Исследования глобального бремени болезней, показало, что в 2021 г. сердечно-сосудистые заболевания и рак стали причиной 19,4 миллиона (29 %) и 9,8 миллиона (15 %) смертей, соответственно (учитывая оба пола и все возрастные группы). Около трети случаев рака в западных странах связано с модифицируемыми факторами риска, такими как высокий ИМТ, низкое потребление фруктов и овощей, курение, употребление алкоголя и недостаток физической активности (Информационный бюллетень ВОЗ по раку).
Анализ микробиома кишечника выявил специфические особенности микробиоты у пациентов с ожирением или онкологическими заболеваниями (67,68). ходе метаанализов было подтверждено, что представители определенных родов бактерий (Odoribacter, Oscillospira, Akkermansia, Alistipes и Bacteroides) значительно снижены при ожирении (70), несмотря на противоречия, вызванные расхождениями между небольшими когортными исследованиями (69). Также микробиом кишечника пациентов с ожирением характеризует сокращение КЦЖК-продуцентов (несколько видов Alistipes, Odoribacter splanchnicus и др.) и уменьшение численности бактерий, отвечающих за целостность кишечного барьера (Akkermansia muciniphila и B. longum) (71).
Микробиом кишечника пациентов с раком также отличается от микробиома здоровых людей. Это утверждение доказано в первую очередь для пациентов с колоректальным раком, у которых, как ни странно, отмечается более высокое богатство кишечного микробиома по сравнению со здоровыми пациентами. Это высокое богатство связано с увеличением видов, характерных для микробиома полости рта, таких как Fusobacterium nucleatum, Solobacterium moorei, Parvimonas micra и Peptostreptococcus stomatis (72). Анализ больших когорт пациентов с онкологией представляет большую редкость, и в такой анализ часто включают пациентов, проходящих соответствующее лечение, что затрудняет различие непосредственного влияния онкологического процесса от влияния терапии (68). Yonekura, S. с соавт., 2022 провели метагеномное секвенирование кишечной микробиоты методом shotgun (73). Образцы кала собирали более чем у 1900 проходивших терапию онкологических пациентов с восемью разными типами новообразований различной степени злокачественности. Сравнение проводилось с образцами кала, полученными от более чем 5500 здоровых добровольцев. В ходе исследования выявлено снижение численности 25 таксонов (к примеру, P. copri, Eubacterium hallii, E. rectale, Anaerostipes hadrus, B. adolescentis) и увеличение численности Clostridium bolteae и Butyricimonas virosa среди 5–6 видов рака (из 8 представленных) по сравнению с добровольцами без онкологического процесса.
Диета и образ жизни объясняют около 20 % структурных различий в микробиме человека (74). Это подчеркивает потенциал диетических стратегий в лечении неинфекционных заболеваний путем изменения микробиоты кишечника, особенно в контексте ожирения и рака (74–77). Существуют убедительные доказательства того, что пищевые волокна являются ключевым компонентом питания в этом контексте. В работе Reynolds, A. и соавт., 2019, проанализированы данные большого числа исследований с высоким уровнем доказательности (135 миллионов человеко-лет) и был сделан вывод, что у людей, потребляющих большое количество пищевых волокон, риск развития кардиометаболических заболеваний (ишемическая болезнь сердца, инсульт, сахарный диабет 2 типа), колоректального рака и смертности в целом снижался на 15–30 % по сравнению с теми, кто употребляет мало волокон. Авторы пришли к выводу, что минимальное потребление пищевых волокон у взрослых должно составлять 25–29 г в день, с дополнительными преимуществами, связанными с дальнейшим увеличением потребления пищевых волокон (78). В следующих разделах будет рассмотрено, как пищевые волокна могут влиять на микробиоту кишечника у пациентов с ожирением высоким кардиометаболическим риском, также будет оценено их возможное влияние на риск развития онкологических заболеваний и терапевтический процесс.
Ожирение и кардиометаболические заболевания
Здоровый рацион (диета с высоким содержанием фруктов, овощей и цельного зерна; нежирные и обезжиренные молочные продукты и постный белок; низкое содержание насыщенных жиров, трансжиров, натрия и добавленных сахаров) является важным фактором поддержания нормальной массы тела на протяжении всей жизни человека и помогает снизить риск развития нарушений обмена веществ при ожирении (79). Соблюдение средиземноморской диеты, характеризующейся употреблением продуктов, богатых растительной клетчаткой, связано со снижением риска неинфекционных заболеваний, таких как сердечно-сосудистые заболевания и ожирение (80).
В недавнем систематическом обзоре и метаанализе 22 рандомизированных контролируемых исследований Huwiler, V. V. с соавт., 2022, установлено, что прием пищевых добавок с изолированными растворимыми пищевыми волокнами может способствовать снижению ряда параметров у пациентов с избыточным весом или ожирением: массы тела и ИМТ, окружности талии, уровня инсулина в крови натощак, резистентности к инсулину, определяемой с помощью гомеостатической модели оценки резистентности к инсулину (homeostatic model assessment of insulin resistance, HOMA-IR) (81).
До конца не изучен механизм, позволяющий пищевым волокнам влиять на потерю веса (7,82) (рис. 3). Одно исследование показало, что пищевые волокна могут снижать потребление пищи (83), однако эффект насыщения от их потребления при свободном выборе порций в тестовых приемах пищи остается спорным (84–86). Влияние пищевых волокон на выработку пептидов, таких как ГПП-1, пептид YY или грелин, ответственных за регулирование аппетита и метаболизма глюкозы, в основном демонстрировалось в интервенционных исследованиях с использованием относительно высоких доз очищенных пищевых волокон. Хотя во многих исследованиях эффекта пищевых волокон оценивалось влияние пищевых волокон на ожирение и связанные с ним метаболические нарушения, только в некоторых из них изучалась связь с изменениями в микробиоме кишечника. В Таблице 1 приложения представлено резюме опубликованных данных плацебо-контролируемых исследований, описывающих эффект приема пищевых волокон (сравнение приема пищевых волокон на основе цельных продуктов с добавками изолированных пищевых волокон) у лиц с избыточным весом или ожирением. Эти исследования рассматривали как анализ микробиома, так и исходы, связанные с состоянием здоровья (в частности, ожирение и кардиометаболические нарушения). В Таблице 1 Приложения также перечислены клинические исследования, описаны проводимые вмешательства и использование плацебо, используемые дозы пищевых волокон, сроки исследований и влияние на исходы дополнительных факторов, связанные со здоровьем человека (пол, физические упражнения и энтеротип кишечной микробиоты).
Доказано, на фоне приема пищевых волокон происходят изменения в микробиоме кишечника: почти половина исследований сообщает об увеличении количества бифидобактерий (либо актинобактерий) при употреблении пищевых волокон типа инулина, а также волокон других типов (галактоолигосахариды, арабиноксиланы, бобовые культуры; волокна, которыми обогащена цельнозерновая диета, средиземноморская диета). Несколько исследований показали снижение количества Bacteroides spp. на фоне употребления пищевых волокон. Однако нет единого мнения в отношении изменения уровня КЦЖК, которые могут как увеличиваться, так и уменьшаться. В некоторых исследованиях авторы сообщали об интересных корреляциях (не подразумевающих причинно-следственную связь) между биологическими исходами и характеристиками кишечного микробиома (см. Таблицу 1 Приложения), хотя эффект приема пищевых волокон по сравнению с плацебо не был статистически значимым. В одном из исследований было установлено, что специфические бактерии, стимулируемые приёмом инулиноподобных фруктанов у пациентов с ожирением, а также связанные с ними метаболиты (фосфатидилхолин, лактат, гиппурат), демонстрировали обратную корреляцию с уровнем ЛПС в сыворотке крови, несмотря на отсутствие значимого влияния на массу тела (26). Представленность бактерий видов Anaerostipes, Akkermansia и Butyricicoccus до вмешательства влияла на снижение ИМТ в ответ на потребление инулина (87). Важно отметить, что изменения в представленности бактерий родов Bifidobacterium, Dialister и Catenibacterium из-за инулина были значимыми, только если участники активно занимались спортом (88). Такие факторы, как исходный состав кишечного микробиома, медикаментозная терапия или уровень физической активности, объясняют вариабельность ответных реакций на снижение массы тела на фоне употребления инулина (21, 87, 88). Это интересное взаимодействие между потреблением пищевых волокон, физической активностью и составом микробиоты кишечника требует дальнейшего изучения, поскольку механизмы таких взаимодействий до конца не изучены.
Кроме того, потребление пищевых волокон положительно сказывается на здоровье, улучшая метаболизм и снижая воспалительные процессы в организме, минуя непосредственное влияние на массу тела или жировую массу. В нескольких исследованиях также сообщалось о влиянии пищевых волокон на формирование чувства сытости (23,89). Арабиноксиланы улучшали метаболизм липидов и глюкозы как у здоровых добровольцев, так и у пациентов с метаболическим синдромом и сахарным диабетом 2 типа, что подтверждает заявление Европейского агентства по безопасности продуктов питания (European Food Safety Authority, EFSA) о пользе подобных очищенных пищевых волокон с гелеобразующими свойствами при использовании в качестве пищевых добавок (49,90).
Механизмы, лежащие в основе влияния пищевых волокон на ожирение и связанные с ним метаболические заболевания, часто включают выработку биоактивных метаболитов, таких как КЦЖК. При этом именно циркулирующие КЦЖК, а не КЦЖК, содержащиеся в кале, связаны с чувствительностью к инсулину и концентрацией ГПП-1 у человека (91). Несмотря на большое число данных, полученных в экспериментах на животных, для внедрения научно обоснованных диетических вмешательств с использованием образовавшихся в кишечнике КЦЖК с целью борьбы с ожирением и метаболическими нарушениями, его сопровождающими, необходимы подтверждающие данные, полученные в клинических исследованиях (92). В одном исследовании сравнивали биодоступность двух видов триглицеридов, обогащенных КЦЖК (бутират и гексаноат, которые эстерифицированы длинноцепочечными жирными кислотами, либо исключительно бутират и гексаноат), и изучали, могут ли они поступать в системный кровоток и влиять на постпрандиальный метаболизм у мужчин с избыточным весом и/или ожирением (93). Хотя после приема жидкой высокожировой смеси с триглицеридами, обогащенными КЦЖК, уровни циркулирующих бутирата и гексаноата в постпрандиальный период повысились, исследование не выявило влияния: на уровень водорода в выдыхаемом воздухе, аппетит, жалобы со стороны желудочно-кишечного тракта, концентрации циркулирующего ГПП-1, свободных жирных кислот, глюкозы, триглицеридов, инсулина и цитокинов.
В двух недавних рандомизированных перекрестных исследованиях изучилась эффективность применения смеси пищевых волокон у худых добровольцев мужского пола и мужчин с избыточным весом или ожирением, имеющих предиабет, и описали изменения в выработке КЦЖК (94). В одном из исследований у мужчин с предиабетом, получавших пищевые добавки, включающих инулин и резистентные крахмалы, отмечен повышенный уровень ацетата в плазме по сравнению с мужчинами, получавшими только инулин или мальтодекстрин. Прием смеси пищевых волокон двух типов привел к увеличению расхода энергии и окисления углеводов, снижению постпрандиальной концентрации глюкозы по сравнению с мальтодекстрином, на фоне параллельного увеличения маркеров ферментации пищевых волокон. В другом исследовании пищевые добавки, содержащие β-глюкан и резистентный крахмал, увеличили уровень бутирата в плазме у лиц с предиабетом по сравнению с мальтодекстрином, но не повлияли на другие маркеры ферментации или метаболизма. Изменения в кишечном микробиоме, вызванные пищевыми волокнами, варьировали у разных людей и были более выражены при приеме смеси пищевых волокон, содержащей инулин, по сравнению с β-глюканом.
В целом, полученные результаты подтверждают необходимость детального анализа состояния кишечного микробиома (активности и состава), чтобы оценить индивидуальные реакции на пищевые волокна в контексте ожирения и связанных с ним метаболических нарушений. Изменения в составе микробиома, при отсутствии доказанной причинно-следственной связи с клинической эффективностью, вряд ли могут рассматриваться как достоверные биомаркеры. Хотя КЦЖК часто упоминаются как модуляторы аппетита и метаболизма, новые метаболомные данные, безусловно, выявят другие микробные регуляторы веса тела и пищевого поведения.
Рак
Частое употребление пищевых волокон неоднократно связывалось с более низкой заболеваемостью раком (1,78,95). Эта связь стабильно наблюдалась в отношении колоректального рака (78,96) и рака молочной железы (97), хотя степень доказанности этих данных варьирует от низкой до средней. В ряде метаанализов также сообщалось о связи между потреблением пищевых волокон и низкой заболеваемостью раком поджелудочной железы (98), мочевого пузыря (99), яичников (100) и эндометрия (101). Глиома выделяется, как исключение из этой закономерности: в ходе анализа объединенных данных проспективных исследований, объединяющих 1262104 участников, наблюдавшихся в течение 15,4 миллиона человеко-лет, не обнаружено отрицательной связи между повышенным потреблением пищевых волокон и повышенным риском развития глиомы (102). Эти недавние отчеты еще больше подтверждают научную значимость постулата о здоровье, сделанного Управлением по контролю качества пищевых продуктов и лекарственных средств (Food and Drug Administration, FDA) в 1993 г., в котором утверждается, что «диеты с низким содержанием жиров и высоким содержанием зерновых продуктов, фруктов и овощей, содержащих клетчатку, связаны с пониженным риском некоторых видов рака» (103).
Польза для здоровья, приписываемая частому потреблению пищевых волокон, часто предполагается общей для большинства типов волокон (1). Однако, учитывая гетерогенное влияние пищевых волокон на состав и функции кишечной микробиоты, а также ключевую роль последней в реализации онкопротекторных эффектов через модуляцию физиологии человека, маловероятно, что все типы волокон обладают равным потенциалом в профилактике или торможении канцерогенеза. Типы волокон характеризуются разной способностью связывать желчные кислоты, определенной ферментируемостью, а также соответствующим профилем КЦЖК (23,25). Продолжаются споры о потенциальной роли некоторых пищевых волокон в развитии рака. Хотя многие доклинические исследования сообщали о противоопухолевом эффекте фруктанов инулинового типа (44,104–106). Кроме того, в нескольких работах указывался протуморогенный эффект у восприимчивых мышей (107,108). В большой когорте взрослых добровольцев из исследования «The NutriNet-Santé» обнаружена значимая положительная взаимосвязь между потреблением ферментируемых олигосахаридов, включая резистентные олигосахариды, дисахаридов, моносахаридов и полиолов и риском развития рака (109). Эти аспекты подтверждают мнение о том, что не все пищевые волокна в равной степени связаны с риском развития рака.
Многие проспективные диетические вмешательства, включая те, что рекомендовали повышенное потребление пищевых волокон, проводились у пациентов с высоким риском развития рака, однако ни одно клиническое исследование проспективно не оценивало влияние отдельных типов волокон на возникновение онкологических заболеваний. Например, в рамках исследования по профилактике полипов «The Polyp Prevention Trial», проведенного в США, участников исследования мотивировали следовать диете с высоким содержанием клетчатки, фруктов, овощей и низким содержанием жиров, что соответствовало научным данным, подтверждающим заявление FDA от 1993 г. о пользе такой диеты (110). Первоначальная оценка результатов исследования показала, что проведение подобного мотивационного консультирования не привело к снижению риска рецидива аденомы толстой кишки среди его участников. В дальнейшем было установлено, что степень приверженности к диетическим рекомендациям оказалась ключевым фактором при интерпретации результатов: у тех участников, которые строго придерживались трёх диетических рекомендаций на всех четырёх ежегодных осмотрах, риск рецидива аденомы был ниже на 35 % по сравнению с контрольной группой (111). Интервенционные исследования в этой области в настоящее время ограничиваются оценкой воздействия пищевых волокон на биомаркеры рака толстой кишки преимущественно у здоровых добровольцев, поскольку проведение таких исследований занимает меньше времени, чем наблюдение за развитием рака. К примеру, употребление на протяжении четырех недель высокоамилозного кукурузного крахмала, модифицированного бутиратом, предотвратило повышение концентрации ДНК-аддуктов в тканях прямой кишки, вызванное диетой с обилием жареного красного мяса у здоровых добровольцев (112). Аналогичным образом, четырехнедельный приём глюкоманнана, экстрагированного из растения конжак, привел к снижению цитотоксичности фекальной воды и уменьшению генотоксических эффектов (повреждение ДНК) у взрослых добровольцев (113). Напротив, потребление пшеничных отрубей не привело к улучшению цитотоксичности и генотоксичности жидкой фракции фекалий, несмотря на наличие явного эффекта на ферментацию в толстой кишке и состав кишечной микробиоты (114). Таким же образом, употребление высокоамилозного кукурузного крахмала на протяжении четырех недель не улучшило ни один из биомаркеров колоректального рака (115). Полученные данные подтверждают гипотезу о том, что противоопухолевые свойства пищевых волокон определяются их химической структурой и типом. Влияние частого потребления волокон на онкогенез в эпидемиологических исследованиях можно объяснить с помощью нескольких механизмов. Выделено пять основных механизмов, связанных с микробиотой кишечника, они представлены на рис. 4.
Во-первых, ферментация волокон приводит к образованию КЦЖК, таких как бутират, которые часто признаются обладающими противоопухолевым эффектом, отчасти благодаря ингибированию активности гистоновой деацетилазы и активации GPCR (44). В знаковом исследовании Donohoe, D. R. и соавт., (2016) использовались гнотобиотические модели мышей, колонизированных дикими или мутантными штаммами бактерий, продуцирующих бутират, чтобы продемонстрировать, что пищевые волокна действительно оказывают мощный эффект подавления опухолей, но это зависит от кишечной микробиоты и самого бутирата (116). Во-вторых, желчные кислоты, особенно вторичные, могут способствовать образованию опухолей, как сообщалось в недавнем препринте Wortmann, E. с соавт., (2023) (117). Паттерн желчных кислот может изменяться под воздействием пищевых волокон как через микробиоту кишечника (118), так и независимо от нее (например, изменения в абсорбции растворимых волокон с гелеобразующими свойствами) (23,119,120). В эпидемиологических исследованиях сообщается, что множественные циркулирующие желчные кислоты связаны с более высоким риском колоректального рака. В исследовании по профилактике полипов «The Polyp Prevention Trial» исходный уровень циркулирующих желчных кислот до приема пищевых волокон был положительно связан с рецидивом аденомы, в то время как потребление пищевых волокон было обратно пропорционально общему исходному уровню желчных кислот. Тем не менее ведение рациона с высоким содержанием клетчатки, фруктов, овощей и с низким содержанием жиров не изменило уровни желчных кислот (121). В-третьих, лигнаны, связанные с пищевыми волокнами, могут метаболизироваться бактериями в энтеролигнаны (энтеролактон и энтеродиол). Энтеролигнаны могут влиять на внутриклеточные сигнальные пути в раковых клетках и связаны с уменьшением образования опухолей толстой кишки в животных моделях и снижением риска колоректального рака у человека (122). Интересные результаты получены Lampe, J. W. с соавт., (2019). Через два месяца приема добавки лигнанов льняного семени у лиц с низким уровнем энтеролигнанов в кале наблюдалось ослабление противовоспалительных реакций в биоптатах слизистой оболочки толстой кишки по сравнению с группой участников с высоким уровнем энтеролигнанов (122). Это указывает на то, что продукция энтеролигнанов кишечной микробиотой может влиять на эффективность диетического вмешательства с применением лигнанов. В-четвертых, некоторые пищевые волокна могут снижать активность бактериальной β-глюкуронидазы, тем самым уменьшая образование и реабсорбцию токсинов, что ограничивает риск канцерогенеза (113). Такое воздействие на активность бактериальной β-глюкуронидазы может также смягчить кишечную токсичность таких препаратов, как иринотекан, способствуя поддержанию и эффективности химиотерапии (123). Наконец, потребление пищевых волокон может участвовать в формировании противоопухолевого иммунитета. В мышиной модели меланомы введение инулина снизило рост опухоли, способствуя сдвигу в сторону микросреды опухоли, богатой Т-клетками, что связано с более мощным противоопухолевым ответом (106). Кроме того, были предложены не связанные с микробиотой механизмы, включая снижение концентрации токсинов в фекалиях за счет увеличения гидратации кишечного содержимого, ускорение кишечного транзита, увеличение массы стула, что в совокупности снижает воздействие мутагенов на колоноциты (113,124).
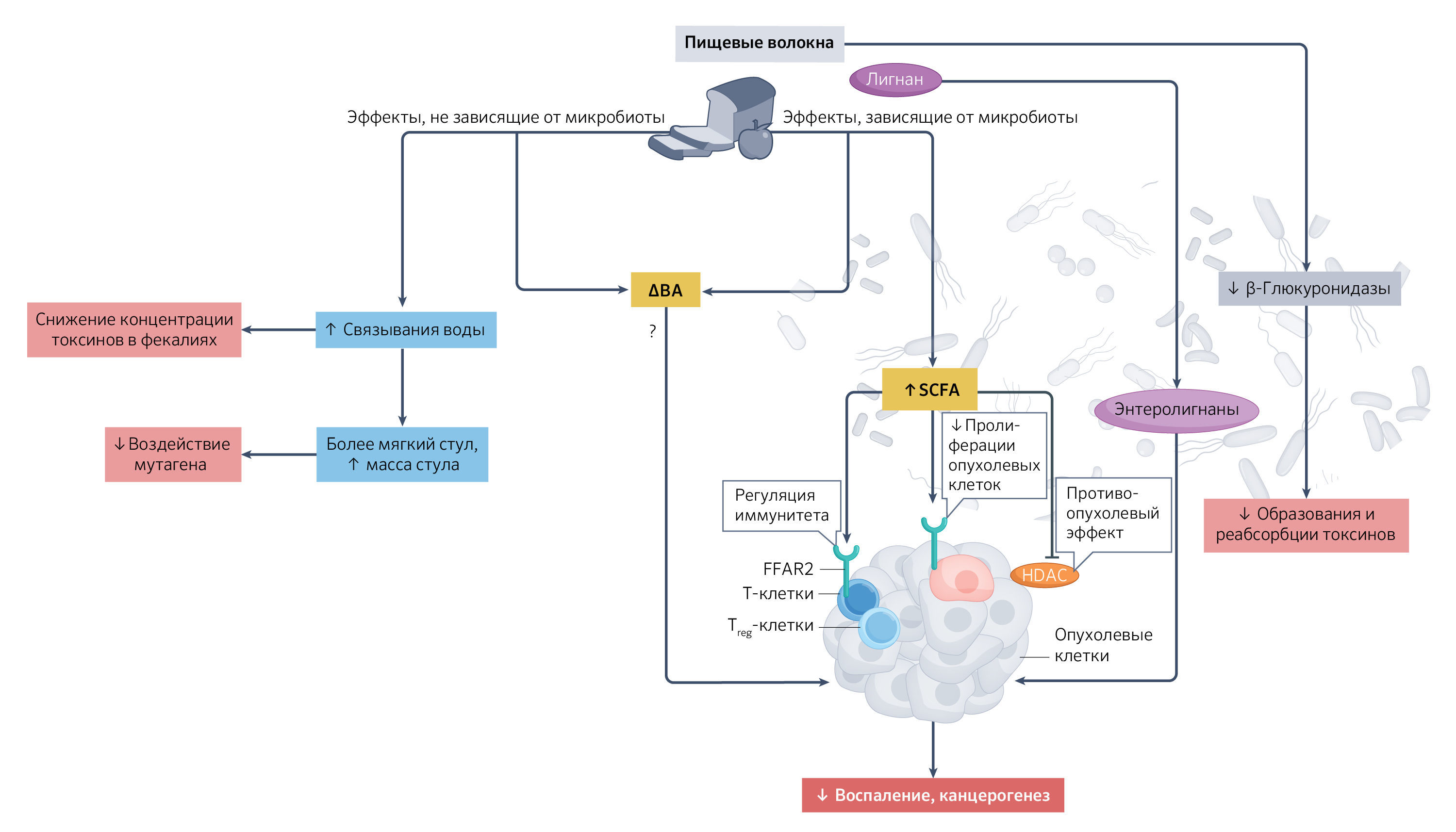
Рис. 4. Предложенные механизмы, объясняющие влияние пищевых волокон и их метаболитов на онкогенез.Пищевые волокна могут снижать воздействие токсинов и мутагенов на организм человека за счет увеличения (↑) связывания воды и фекальной массы, а также могут изменять структуру некоторых метаболитов, таких как желчные кислоты (bile acids, BA) независимым от кишечной микробиоты образом. Короткоцепочечные жирные кислоты (КЦЖК) играют важную роль в иммунной регуляции, способствуя дифференциации наивных Т-клеток в эффекторные клетки и T-регуляторные клетки (Treg). КЦЖК описаны во многом как противоопухолевые вещества благодаря ингибированию активности гистоновой деацетилазы (histone deacetylase, HDAC). Некоторые пищевые волокна, такие как фруктаны инулинового типа, могут снижать пролиферацию опухолевых клеток, уменьшать воспаление и увеличивать концентрацию пропионата в портальной системе печени, что способствует снижению пролиферации раковых клеток человека за счет активации рецептора свободных жирных кислот 2 (free fatty acid receptor 2, FFAR2) (44). Снижая активность бактериальной β-глюкуронидазы, некоторые пищевые волокна, такие как глюкоманнан, получаемый из корня конжака, могут уменьшать образование и реабсорбцию токсинов (113). Лигнаны пищевых волокон могут метаболизироваться бактериями в энтеролигнаны, которые могут влиять на клеточные пути в раковых клетках. Желчные кислоты, особенно вторичные, такие как дезоксихолевая кислота, могут способствовать образованию опухолей. Паттерн желчных кислот может меняться как в зависимости от микробиоты кишечника, так и независимо от нее (например, изменения в абсорбции желчных кислот из-за растворимых пищевых волокон с гелеобразующими свойствами). Некоторые из этих желчных кислот могут вызывать апоптоз в раковых клетках (62). Механизмы, показанные на этом рисунке, по большей своей части доказаны в экспериментальных исследованиях. Связь, которая не была четко продемонстрирована, обозначена вопросительным знаком.
Вопрос о том, связано ли более частое потребление пищевых волокон после постановки диагноза рака с лучшей выживаемостью, остается недостаточно изученным в клинических исследованиях. Улучшение выживаемости пациентов с раком может быть результатом воздействия волокон на прогрессирование онкологического процесса, эффективность лечения, токсичность противоопухолевой терапии и/или нарушение метаболизма при раке. Например, потребление пищевых волокон может принести пользу во время лечения рака в виде повышения эффективности терапии и улучшения переносимости, учитывая влияние волокон на состав и функцию кишечной микробиоты. Кроме этого, кишечная микробиота способна повышать эффективность химиотерапии и иммунотерапии, а также смягчать токсичность лекарственных препаратов (77,125,126).
С точки зрения терапевтической эффективности пищевых волокон, большинство исследований сосредоточено на изучении их влияния на химиотерапию. Инулин и фруктоолигосахариды, потребляемые вместе с назначенным 5-фторурацилом, снижали развитие опухолей и метастазирование, а также увеличивали общую выживаемость на моделях крыс. Аналогичные эффекты наблюдались при терапии различными химиотерапевтическими препаратами, включая доксорубицин, винкристин, циклофосфамид, метотрексат и цитарабин (127). Эти эффекты могут быть опосредованы бутиратом, который усиливает цитотоксичность противоопухолевых препаратов, таких как 5-фторурацил и иринотекан (128). Эффективность лучевой терапии также может повышаться на фоне приема пищевых волокон: кормление мышей инулином привело к задержке роста опухоли после облучения в модели ксенотрансплантата (129). В контексте иммунотерапии потребление пищевых волокон в объёме свыше 20 г/день ассоциировалось с повышением выживаемости и улучшением частоты ответа у пациентов с меланомой, получавших терапию ингибиторами контрольных точек (130,131). Эти данные согласуются с экспериментальными работами, где показано, что иммунотерапия антителами к белку запрограммированной клеточной смерти 1 (programmed cell death protein 1, PD1) замедляла рост опухоли у мышей, получавших пищу с высоким содержанием клетчатки, (цельнозерновые продукты) по сравнению с мышами, находящимися на диете с низким содержанием волокон (131). Кроме того, они согласуются с отчетами, показывающими связь между уровнями КЦЖК в фекалиях и эффективностью ингибиторов PD1 (132,133). И напротив, КЦЖК, по-видимому, ограничивают эффективность ингибиторов иммунных контрольных точек анти-CTLA4 (134).
При исследовании влияния пищевых волокон на переносимость лечения, сочетанное введение крысам фруктоолигосахаридов и 5-фторурацила способствует поддержанию целостности кишечника, снижению потери веса и уменьшению воспаления, что предполагает адъювантное защитное действие этих пищевых волокон (135,136). Снижение побочных эффектов доксорубицина на фоне использования пектина может объясняться прямым, независимым от микробиоты ингибированием Toll-подобного рецептора 2 (Toll-like receptor 2, TLR2) (137,138).
Связанные с раком кахексия или саркопения способствуют снижению вероятности выживания пациентов при многих видах рака (139). Кахексия определена как «многофакторный синдром, характеризующийся продолжающейся потерей массы скелетных мышц (с потерей или без потери жировой массы), которая может быть частично, но не полностью обращена вспять с помощью обычной нутритивной поддержки» (140). Кахексия является результатом сочетания более низкого потребления пищи, метаболических изменений и воспаления (139,141), и, по данным доклинических и клинических исследований, связана с дисбиозом кишечной микробиоты, нарушением кишечного барьера и измененным метаболизмом кишечных бактерий (142–148). Ранее в исследованиях было показано, что введение пектоолигосахаридов снижало симптомы анорексии и потерю жировой массы у мышей с кахексией (149). В ходе исследований с участием человека будет установлено, полезно ли для пациентов с раковыми заболеваниями употребление пищевых волокон, которые меняют их кишечную микробиоту, регулируют барьерную функцию кишечника и воспалительные процессы, а также связанное с ними нарушение метаболизма.
Частое потребление пищевых волокон рекомендовано Всемирным фондом исследований рака (World Cancer Research Fund, WCRF) и Американским институтом исследований рака (American Institute for Cancer Research, AICR) может быть полезным для здоровья пациентов, находящихся в ремиссии после рака (124). В проспективной когорте из 456 человек, прошедших лечение колоректального рака, увеличение потребления пищевых волокон, фруктов и овощей было связано с улучшением физических функций и способностью выполнять повседневные действия, а также с меньшей утомляемостью в первые два года после завершения лечения (150). Однако, как было продемонстрировано в одном из метаанализов, приверженность пациентов рекомендации о частом приеме пищевых волокон в данной когорте была низкой (151). Последующие исследования должны определить, являются ли барьеры, мешающие частому потреблению пищевых волокон в этой группе населения универсальными, и можно ли их экстраполировать на всю популяцию в целом.
Хотя эпидемиологические данные убедительно демонстрируют, что высокое потребление пищевых волокон ассоциировано со снижением частоты различных видов рака, необходимы дополнительные исследования для оценки влияния конкретных волокон на риск развития онкологических заболеваний, эффективность терапии, токсичность и кахексию. Чтобы устранить имеющийся пробел в знаниях, будущие эпидемиологические и интервенционные исследования должны учитывать тип пищевых волокон (информацию, которая пока труднодоступна), а также индивидуальные характеристики человека, включая микробиом кишечника.
Выводы и перспективы
Пищевые волокна представляют собой компоненты пищи различного происхождения. Их взаимодействие с кишечным микробиомом трудно переоценить, поскольку пищевые волокна обладают протективным эффектом от развития ожирения и связанных с ним заболеваний, а также онкологии. Сложность и специфичность взаимодействий между различными типами пищевых волокон и микробиомом кишечника могут объяснить наблюдающуюся вариативность ответа на диетотерапию как между отдельными людьми, так и между различными интервенционными исследованиями. Индивидуализированный подход, основанный на анализе микробиома кишечника, может быть разработан для пересмотра диетических рекомендаций по потреблению пищевых волокон.
Состояние микробиома кишечника, определяемое потребляемыми ферментируемыми пищевыми волокнами, во многом формирует здоровье человека, механизмы чего, так или иначе, остаются предметом обсуждения. При оценке компонентов микробиоты, которые меняются на фоне употребления пищевых волокон (таксоны, метаболиты и т. д.), первым, но не единственно важным шагом, является исключение из анализа интервенционных клинических исследований тех результатов, что демонстрируют сильные корреляции между таксономическими и функциональными характеристиками кишечного микробиома и биологическими исходами (152). Для оценки причинно-следственных связей необходимо использовать современные статистические методы, такие как анализ медиации. Дополнительные исследования микробиома на гнотобиотических животных, способных воспроизводить ключевые виды бактерий, взаимодействующих с пищевыми волокнами, а также экспериментальные работы, в которых сравниваются эффекты бактериальных метаболитов с плацебо, могут предоставить необходимые доказательства того, как именно определенные компоненты микробиома кишечника, модулируемые пищевыми волокнами, могут оказывать влияние на физиологию человека.
Высокая стоимость и сложность интерпретации данных микробиома могут стать препятствием для проведения масштабных исследований в этой области. Однако политика открытой науки, предполагающая свободный доступ к биоинформационным базам данных, может помочь преодолеть эти обстоятельства. Также важным аспектом, подчеркнутым в данном обзоре, является необходимость изучения роли натуральных источников пищевых волокон из растительных продуктов, по сравнению с изолированными пищевыми волокнами, на что следует ориентироваться при создании микробиом-ассоциированных стратегий питания. Вопрос о значимости потребления пищевых волокон разных видов для увеличения бактериального разнообразия кишечного микробиома остается дискуссионным, поскольку определенные виды пищевых волокон могут способствовать росту одних бактериальных родов в ущерб другим, что, в свою очередь, может снижать α-разнообразие.
Важной задачей глобального здравоохранения является поддержание здоровья человека и населения в целом, чему способствует достаточное потребление пищевых волокон, играющих ключевую роль в поддержании здоровья микробиома кишечника. Основным источником пищевых волокон является растительная пища, которая также считается важнейшим компонентом экологически устойчивого питания. Использование очищенных пищевых волокон открывает новые возможности в питании, особенно с учетом современных технологий, позволяющих извлекать питательные вещества из пищевых отходов. Например, пектоолигосахариды успешно получают из кожуры авокадо, цедры лимона или апельсина, а также мякоти сахарной свеклы. Другой пример — арабиноксиланы, которые выделяют из сельскохозяйственных и пищевых отходов (153, 154).
Для снижения заболеваемости хроническими заболеваниями населения во всем мире необходимо проведение исследований и создание прикладных разработок, которые будут направлены на продвижение доступных пищевых продуктов с высоким содержанием клетчатки. Основываясь на способности пищевых волокон взаимодействовать с микробиомом кишечника и стимулировать выработку полезных биоактивных веществ в организме, важно разработать согласованные экспертами руководства по потреблению пищевых волокон с указанием требований, предъявляемых к их качеству, и уровню суточного потребления.