Широкий термин «воспаление» включает в себя разнообразный набор тканевых реакций, в классическом случае вызываемых распознаванием микробов и повреждением тканей [1, 2]. Недавно недавно стало понятно, что состояния, связанные с нарушением метаболизма, — начиная от диабета и заканчивая ожирением, — вызывают явные или субклинические воспалительные реакции. Общая роль воспалительных реакций заключается в усилении врожденной резистентности тканей и их регенерации, что приводит к восстановлению гомеостаза (рисунок 1A).
Системные проявления воспаления включают лихорадку, изменение количества лейкоцитов, сердечно-сосудистые реакции, эндокринные реакции и переориентацию метаболизма в связи с повышенной выработкой разнообразного набора молекул, называемых белками острой фазы [4, 5]. Классический белок острой фазы — С-реактивный белок — первоначально был описан как молекула, присутствующая в кровотоке пациентов с инфекциями и способная распознавать полисахариды С-типа Streptococcus pneumoniae [6, 7]. Повышение уровня белков острой фазы в крови и других жидкостях организма (рисунок 1B) является частью более сложной реакции на местное или системное воспаление (например, сепсис), которую называют реакцией острой фазы [5] и которая характеризуется снижением продукции альбумина гепатоцитами, переориентацией обмена железа и гормональными изменениями [4, 5]. Такие изменения также наблюдаются в контексте хронических воспалительных состояний и субклинического воспаления.
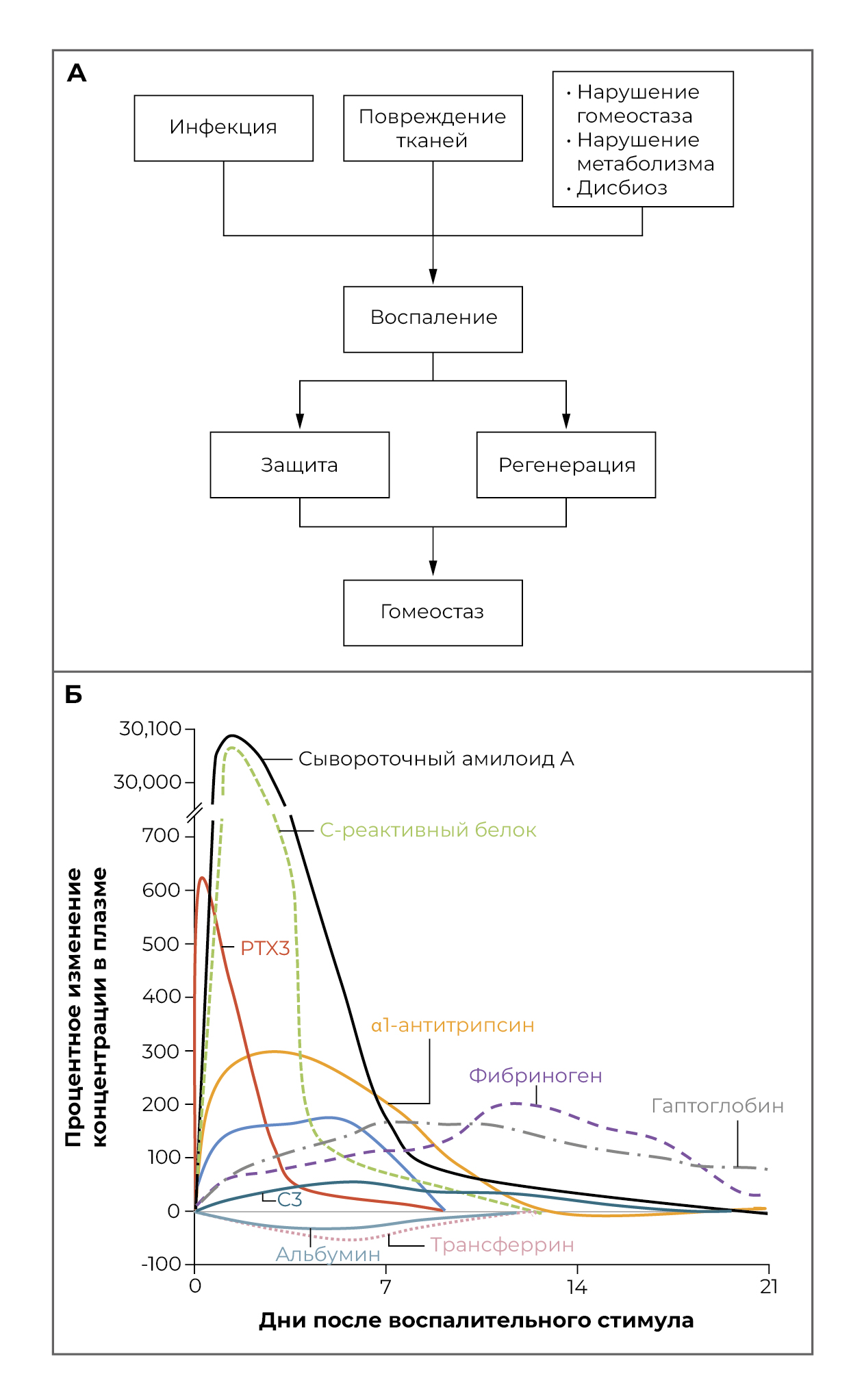
Рисунок 1. Роль воспаления и изменений в циркуляции белков острой фазы.
Спустя почти столетие после открытия С-реактивного белка белки острой фазы продолжают служить фундаментальными инструментами диагностики, которые могут применяться для пациентов с рядом состояний, включая инфекции, сердечно-сосудистые заболевания, злокачественные новообразования, нейродегенерацию и нарушение обмена веществ [8–10]. Во время пандемии коронавируса (COVID-19) белки острой фазы, такие как С-реактивный белок, фибриноген и продукт его деградации D-димер и ферритин, послужили бесценными инструментами в повседневном лечении заболеваний и в качестве прогностических показателей (таблица 1). Достигнут прогресс в изучении синтеза, структуры и функции многих из этих молекул, и результаты показали, что фундаментальная функция реакции острой фазы заключается в усилении устойчивости к микроорганизмам и восстановлении тканей, при этом многие из белков острой фазы представляют собой ключевые компоненты гуморального врожденного иммунитета («пред-антитела») [25]. С этой общей точки зрения авторы рассматривают ключевые аспекты выработки, структуры и функции ряда белков острой фазы, по-прежнему представляющие собой важные диагностические инструменты, которые можно более систематически интегрировать в молекулярные сигнатуры, недавно полученные из транскриптомных и протеомных профилей.
Таблица 1. Главные белки острой фазы и их роль при COVID-19
Контекст: клеточный и гуморальный врожденный иммунитет
Врожденный иммунитет представляет собой первую линию устойчивости против микробных патогенов, который участвует в активации адаптивных иммунных реакций, а также в регенерации тканей. Врожденный иммунитет состоит из клеточного и гуморального звеньев. Молекулярные стратегии, используемые клеточным иммунитетом для обнаружения микробных фрагментов и повреждения тканей, включают связанные с клеткой молекулы распознавания образов, расположенные в разных клеточных компартментах (плазматическая мембрана, эндосомы и цитоплазма) и принадлежащие к разным молекулярным семействам, включая toll-подобные рецепторы (TLR), NOD (nucleotide-binding oligomerization domain)-подобные и RIG-I (retinoic acid–inducible gene I)-подобные рецепторы, инфламмасомы, стимулятор генов интерферона (STING), лектины C-типа и фагоцитарные рецепторы (рисунок 2). Активация этих рецепторов приводит к экспрессии цитокинов (включая интерфероны и хемокины), молекул адгезии и противомикробных эффекторов или к устранению микробов посредством фагоцитоза [1, 2, 25].
Гуморальное звено врожденной иммунной системы состоит из различных классов молекул, таких как пентраксины, коллектины и фиколины, которые функционально действуют как предшественники антител (пред-антитела), инициируя активацию комплемента, опсонизируя микробы и поврежденные клетки, агглютинируя или нейтрализуя микробы и регулируя воспаление [25]. Как обсуждается ниже, некоторые из этих молекул являются ключевыми компонентами реакций острой фазы (таблица 1), которые быстро индуцируются в клетках печени или других типах клеток первичными воспалительными цитокинами или микробными фрагментами.
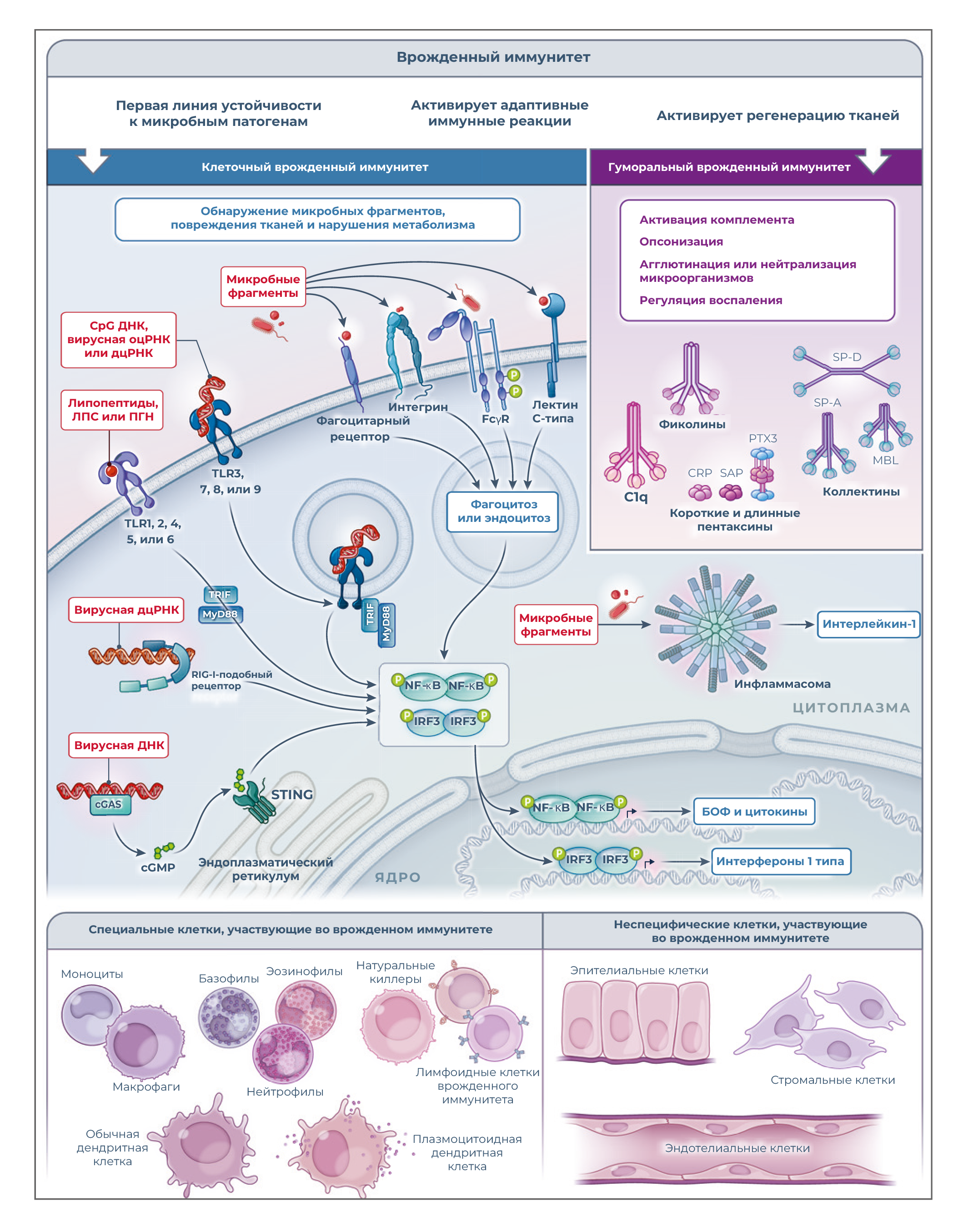
Рисунок 2. Врожденный иммунитет — клеточное и гуморальное звено.Клеточные сенсоры повреждения тканей, инфекции и нарушения обмена веществ стратегически локализованы на клеточной поверхности, в эндосомном компартменте и в цитоплазме, как в профессиональных (т. е. клетках, у которых участие во врожденном иммунитете является основной функцией), так и в непрофессиональных клетках врожденного иммунитета (то есть тех, у которых основные функции другие). К последним относятся гепатоциты — основной источник белков острой фазы. В условиях гомеостаза и в ответ на воспаление вырабатываются компоненты гуморального звена врожденного иммунитета. Эти молекулы выполняют комплексные функции, в том числе обеспечивают иммунную устойчивость, активируя комплемент и обладая опсонической активностью («пред-антитела»). БОФ — белок острой фазы, cGAS — синтаза циклических ГМФ–AMФ, цГМФ — циклический гуанозинмонофосфат, CРБ — C-реактивный белок, дцРНК — двухцепочечная РНК, IRF — регуляторный фактор интерферона, ЛПС — липополисахарид, MBL — маннозо-связывающий лектин, MyD88 — белок первичного ответа миелоидной дифференцировки 88, NF-κB — ядерный фактор каппа B, ПГН — пептидогликан, RIG-I — белок гена I, индуцируемого ретиноидной кислотой, SAP — сывороточный амилоид P, SP-A — сурфактантный белок A, SP-D — сурфактантный белок D, оцРНК — одноцепочечная РНК, STING — стимулятор интерфероновых генов, TLR — toll-подобный рецептор, TRIF — адаптер, содержащий домен рецептора toll/интерлейкина-1 и индуцирующий интерферон-β.
До ответа острой фазы: цитокиновый каскад
Обнаружение с помощью клеточных молекул распознавания паттернов микробных фрагментов, повреждение тканей или нарушение метаболизма запускают каскад цитокинов, который вызывает усиление и регуляцию врожденного иммунитета и продукцию белков острой фазы, как показано на рисунке 3A. Первичные воспалительные цитокины, обычно интерлейкин-1, интерлейкин-6 и фактор некроза опухоли (TNF), индуцируют продукцию вторичных медиаторов в тканях (например, самого интерлейкина-6, хемокинов, колониестимулирующих факторов, молекул эндотелиальной адгезии, простагландинов и оксида азота); эти медиаторы усиливают рекрутирование лейкоцитов, эффекторные функции и местный врожденный иммунитет. Усиление местного врожденного иммунитета создает условия для активации и направленности адаптивных (антиген-специфических) иммунных реакций.
Помимо стимуляции выработки хемокинов и содействия переходу острого воспаления в хроническое, интерлейкин-6 является мощным индуктором продукции белков острой фазы в печени посредством перепрограммирования и переориентации метаболических функций (например, снижения выработки альбумина и усиления синтеза белков острой фазы). Воспалительные цитокины также действуют на центральную нервную систему за счет активации оси гипоталамус–гипофиз–надпочечники, что приводит к выработке адренокортикотропного гормона и глюкокортикоидных гормонов. Глюкокортикоидные гормоны, помимо их многочисленных функций, действуют как негативные регуляторы воспаления, например, подавляя интерлейкин-1 и индуцируя рецептор-приманку интерлейкина-1 интерлейкин-1R2 [26]. Противовоспалительные цитокины (интерлейкин-10, трансформирующий фактор роста β и интерлейкин -1Ra) также являются частью путей негативной регуляции (рисунок 3A). Интерлейкин-1Ra, который действует как антагонист интерлейкина-1R, традиционно считается синтезируемым в печени белком острой фазы [27] и вырабатывается макрофагами и другими типами клеток в тканях. Интерлейкин-1 и интерлейкин-6 — ключевые регуляторы синтеза белков острой фазы в печени за счет активации ими сети факторов транскрипции (преобразователя сигнала и активатора транскрипции 3 [STAT3], ядерного фактора κB [NF-κB] и CCAAT/энхансер-связывающих белков) и метилирования мотивов CpG в сайтах связывания этих факторов транскрипции [28].
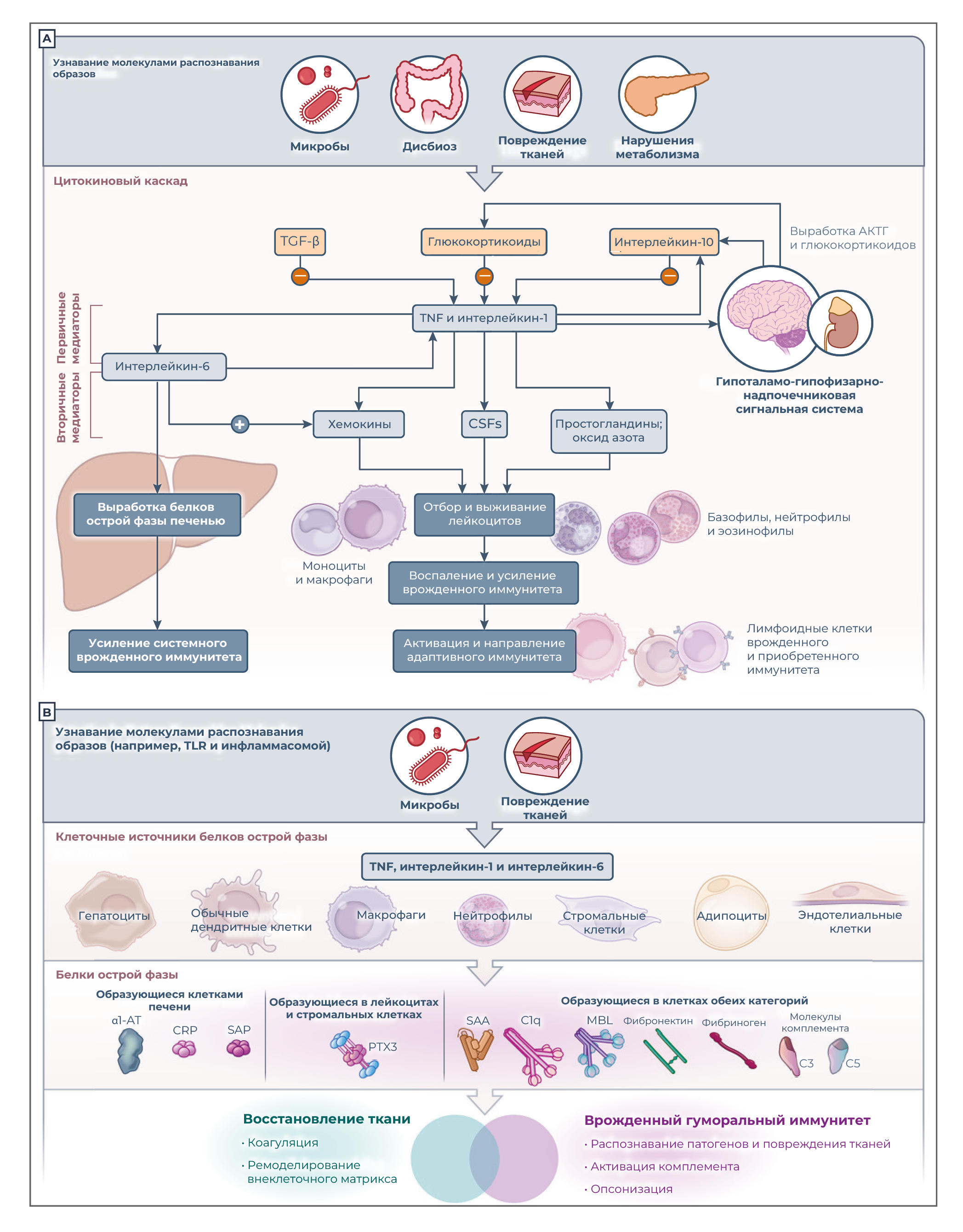
Рисунок 3. Цитокиновый каскад и клеточные источники и функции белков острой фазы.На панели А показан каскад цитокинов, запускаемый молекулами распознавания образов; этот процесс включает продукцию первичных и вторичных медиаторов, активацию ответа острой фазы и стимуляцию рекрутирования лейкоцитов; он приводит к усилению местного и системного врожденного иммунитета, а также к активации и направлению адаптивных иммунных ответов. Воспалительные цитокины также способствуют экспрессии негативных регуляторов воспаления (интерлейкина-10, трансформирующего фактора роста бета [TGF-β] и интерлейкина-1Ra) и активации оси гипоталамус–гипофиз–надпочечники, что приводит к выработке адренокортикотропного гормона (АКТГ) и глюкокортикоидных гормонов. Как показано на панели B, помимо гепатоцитов, в синтезе белков острой фазы участвуют другие типы клеток, которые способствуют гуморальному врожденному иммунитету и восстановлению тканей. α1-AT — α1-антитрипсин, КСФ — колониестимулирующий фактор, SAA — сывороточный амилоид A, TNF — фактор некроза опухоли.
Печеночные и внепеченочные источники белков острой фазы
Печень традиционно считалась источником повышенных уровней белков острой фазы в крови [4] (рисунок 3A), в ней вырабатывается около 200 белков острой фазы: в основном гепатоцитами, но и также и другими типами клеток. Эти клетки включают моноциты, инфильтрирующие органы, и резидентные в тканях макрофаги, такие как клетки Купфера (звездчатые клетки печени) и эндотелиальные клетки, все из которых являются источниками провоспалительных цитокинов, активирующих синтез белков острой фазы гепатоцитами [28].
Имеющиеся данные говорят о том, что помимо гепатоцитов некоторые белки острой фазы могут продуцировать клетки периферических тканей (рисунок 3B). Например, макрофаги и эндотелиальные клетки могут вырабатывать компоненты комплемента [29], сывороточный амилоид А (SAA) [30], переносчики железа, α1-антитрипсин [31] и интерлейкин-1Ra [29]. Пентраксин, родственный С-реактивному белку — пентраксин 3 (РТХ3) — при индукции микробными группировками или воспалительными цитокинами выделяется в основном в периферических тканях различными типами клеток, в первую очередь фагоцитами и эндотелиальными клетками. На локальном тканевом уровне местная продукция дополняет функцию циркулирующих белков острой фазы, вырабатываемых гепатоцитами (рисунок 3B). Например, жировая ткань вносит важный вклад в общую системную концентрацию белков острой фазы в ответ на провоспалительные стимулы (интерлейкин-1 и интерлейкин-6). Адипоциты экспрессируют большое количество факторов комплемента (C3, D и B), α1-кислый гликопротеин и липокалин-2, а также ингибитор активатора плазминогена 1 (PAI-1) и сывороточный амилоид A3 (SAA3) [32]. При миопатии индукции белков острой фазы в мышечных клетках способствуют истощение скелетных мышц и атрофия, связанная с критическим заболеванием, локально продуцируемые интерлейкин-6 и TNF. В этом состоянии мышечной атрофии способствуют первичные воспалительные цитокины и сывороточный амилоид A1 (SAA1) [33].
Молекулы и функции
Пентраксины
Пентраксины представляют собой семейство эволюционно консервативных белков, характеризующихся циклической мультимерной структурой и наличием консервативного пентраксинового домена из 200 аминокислот. С-реактивный белок (также называемый PTX1) и компонент Р сывороточного амилоида (SAP или PTX2) — пентамерные короткие пентраксины [34]. PTX3 представляет собой октамерную молекулу, и каждый протомер имеет пентраксиноподобный домен, связанный с длинным N-концевым доменом, не родственный доменам других известных белков [35].
С-реактивный белок — прототипный белок острой фазы из печени человека, тогда как SAP является основным белком острой фазы у мышей. У людей в ответ на стимул острой фазы — в частности на интерлейкин-6 — уровень С-реактивного белка в плазме увеличивается в 1000 раз, тогда как SAP постоянно присутствует в плазме. Напротив, PTX3 быстро индуцируется в ответ на интерлейкин-1 и TNF или микробные компоненты в различных типах клеток, в частности, в миеломоноцитарных клетках (моноцитах, макрофагах, дендритных клетках), сосудистых и лимфатических эндотелиальных клетках и стромальных клетках [35]. Нейтрофилы синтезируют PTX3 во время миелопоэза, сохраняют его в лактоферрин-положительных гранулах и быстро выделяют после распознавания микробов [36]. Таким образом, PTX3 отличается от коротких пентраксинов с точки зрения структуры, клеточного источника и регуляции.
С-реактивный белок, SAP и PTX3 связывают различные бактерии, грибки и вирусы, стимулируя врожденный иммунный ответ на эти патогены [25, 34, 37, 38]. Пентраксины также связываются с фосфолипидами и малыми ядерными рибонуклеопротеинами в апоптотических клетках, способствуя избавлению от этих клеток невоспалительным путем [39].
С-реактивный белок, SAP и PTX3 взаимодействуют с различными молекулами комплемента (например, C1q, фиколинами и маннозо-связывающим лектином [MBL]), что приводит к усилению распознавания и расширению его потенциала. В дополнение к комплемент-зависимой опсонизации короткие пентраксины и PTX3 способствуют фагоцитозу микробов и апоптозных клеток путем взаимодействия с FcγR, особенно с FcγRIII (также называемым CD16) и FcγRII (CD32) [40] (рисунок 2). Они также взаимодействуют с регуляторами комплемента, такими как фактор H и C4BP, тем самым способствуя регуляции зависимого от комплемента воспаления.
Повышение уровня С-реактивного белка связано с генетическими полиморфизмами, а уровень С-реактивного белка в крови ассоциирован с риском развития ишемической болезни сердца [8, 9]. Эта связь предполагает патогенетическую роль С-реактивного белка при атеросклерозе. Менделевский рандомизационный анализ в большой когорте пациентов с ишемической болезнью сердца показал, что генетическое повышение концентрации С-реактивного белка не связано с обычными факторами риска и риском сердечно-сосудистых событий [41].
SAP связывает и стабилизирует все формы амилоидных фибрилл, способствуя развитию амилоидоза [34, 42], а также связывается с компонентами внеклеточного матрикса, такими как ламинин, коллаген IV типа, фибронектин и протеогликаны, тем самым регулируя отложение внеклеточного матрикса и ингибируя фиброз. При идиопатическом легочном фиброзе у человека SAP (PRM-151) улучшает функцию легких [43] путем ингибирования альтернативной активации макрофагов и дифференцировки фиброцитов. Кроме того, PTX3 взаимодействует с белками внеклеточного матрикса (TNF-α-индуцированный белок 6 и ингибитор интер-α-трипсина), фибриногеном или фибрином и плазминогеном, что объясняет его участие в ремоделировании матрикса при повреждении и регенерации тканей [44].
Концентрация PTX3 в плазме быстро увеличивается при ряде инфекций и положительно связана с тяжестью заболевания и риском смерти [45–48], как обсуждается ниже для COVID-19. Уровень PTX3 в плазме также отражает тяжесть воспалительных сосудистых заболеваний от атеросклероза до васкулита [49]. При воспалительных состояниях уровень PTX3 повышается раньше, чем уровень C-реактивного белка, как показано на рисунке 1B. Различная кинетика появления РТХ3 и С-реактивного белка вполне может отражать их разные клеточные источники. PTX3 хранится в гранулах нейтрофилов, готовых к высвобождению, а ген PTX3 служит в качестве раннего гена немедленной реакции в тканях, при этом его транскрипция индуцируется агонистами TLR и воспалительными цитокинами. Напротив, продукция С-реактивного белка в печени является нижестоящей по отношению к каскаду цитокинов, что приводит к более позднему появлению.
Генетические полиморфизмы PTX3 и SAP были связаны с восприимчивостью к грибковым и бактериальным инфекциям [38, 48, 50, 51] и к образованию гранулем легких при саркоидозе посредством регуляции комплемента [52]. Таким образом, результаты механистического анализа; данные, полученные от мышей с направленным воздействием на гены, и результаты анализа генетических полиморфизмов человека согласуются с мнением о том, что пентраксиновое трио С-реактивный белок–SAP–PTX3 играет роль в усилении врожденной резистентности к определенным патогенам и в регуляции ремоделирования тканей.
Сывороточный амилоид А
Члены семейства SAA — важные белки острой фазы у человека. У людей различные представители семейства кодируются четырьмя генами; SAA1 и SAA2 представляют собой типичные печеночные белки острой фазы, которые в совокупности называются A-SAA. Внепеченочный синтез A-SAA в суставах обусловливает высокий уровень SAA в синовиальной жидкости, помимо высокой системной концентрации в плазме [53]. В тонком кишечнике SAA индуцируется интерлейкином-22 в эпителиальных клетках и способствует местной дифференцировке Т-хелперов 17 и эффекторной функции, участвуя в поддержании целостности кишечного барьера [54].
Сообщалось о цитокиноподобной функциональной активности членов семейства SAA, включая хемотаксис, вызванный прямым взаимодействием с формилпептидными рецепторами, связанными с G-белком. Кроме того, фагоцитарный рецептор B-I (CD36) действует как рецептор эндоцитоза SAA и участвует в SAA-опосредованных иммунных и воспалительных функциях. Также известно, что A-SAA индуцирует смещение популяции макрофагов в М2-подобное (противовоспалительное) состояние и опсонизирует грамотрицательные патогенные бактерии, способствуя их клиренсу и врожденной устойчивости к инфекциям [55].
Из-за значительного увеличения концентрации в плазме во время воспаления A-SAA использовали в качестве маркера при ряде воспалительных состояний, таких как ревматоидный артрит, сердечно-сосудистые заболевания, злокачественные новообразования и инфекции, включая коронавирусную инфекцию тяжелого острого респираторного синдрома 2 (SARS-CoV-2) [30, 53, 56]. Долгосрочные или периодически возникающие высокие концентрации SAA в плазме (например, вследствие туберкулеза или ревматоидного артрита) в сочетании с аллельными вариантами SAA1 или другими неизвестными факторами могут привести к амилоидозу A (AA) — состоянию, вызванному накоплением фибрилл AA в ряде органов, включая почки, селезенку и печень, что нарушает их функцию. Фибриллы AA образуются в результате сворачивания образующегося из SAA укороченного с С-конца белка AA в чрезвычайно гидрофобные β-листы, которые агрегируют в олигомеры, формируя нерастворимые, устойчивые к протеолизу фибриллы [57].
Система комплемента
Система комплемента — эволюционно консервативный центральный компонент гуморального врожденного иммунитета. Она состоит из примерно 50 растворимых молекул, в основном вырабатываемых печенью и обычно присутствующих в кровотоке, и рецепторов, которые экспрессируются несколькими типами клеток [29, 58].
Печень служит основным местом синтеза большинства молекул комплемента. Среди них присутствуют как активирующие молекулы (C3, C4, C9 и фактор B), так и негативные регуляторы (ингибитор C1 и C4BP), которые активируются во время реакции острой фазы, что подчеркивает актуальность активации сбалансированных ответов, опосредованных комплементом. Однако их синтез увеличивается умеренно по сравнению с синтезом основных молекул острой фазы реакции и достигает пика в поздние моменты времени [4] (рисунок 1B). Локальными источниками белков комплемента, таких как C1q, C3 и C529, помимо гепатоцитов, могут быть и другие типы клеток, включая моноциты, макрофаги, эндотелиальные клетки, фибробласты и адипоциты [29] (рисунок 3B).
Маннозосвязывающий лектин
MBL представляет собой образующийся в печени и присутствующий в плазме лектин C-типа — это класс молекул распознавания образов, состоящий из домена лектина Ca2+-типа (также называемого доменом распознавания углеводов) и коллагеноподобного домена [59], действующего как молекула — гуморальный распознаватель образов высоким сродством к маннозе и N-ацетилглюкозамину, присутствующим на поверхности микробов. MBL взаимодействует с этими углеводными фрагментами через лектиновый домен, опсонизируя патогены для фагоцитоза и приводя к активации MBL-ассоциированных сериновых протеаз, тем самым инициируя каскад комплемента через лектиновый путь. В MBL2 — гене, кодирующем MBL человека, — обнаружены три точечные мутации в экзоне 1, который кодирует коллагеновую область MBL; кроме того, в промоторной области найдено несколько полиморфизмов. Эти мутации и полиморфизмы влияют на функцию и концентрацию молекулы в плазме. Сочетание промоторных гаплотипов и структурных мутаций приводит к дефициту MBL, который встречается примерно у 25% людей и связан с повышенной восприимчивостью к отдельным инфекциям — особенно у детей с первичным или вторичным иммунодефицитом [60]. Первоначально MBL был определен как белок острой фазы на основе усиления экспрессии MBL2 в образцах биопсии печени пациентов с воспалительными состояниями. Однако последующие исследования показали, что у большинства людей с кодирующими мутациями MBL не активируется в острой фазе инфекционных состояний. Например, в исследованиях с участием пациентов с сепсисом или пневмонией MBL вел себя как позитивный или негативный белок острой фазы или не менялся во время госпитализации, при этом его поведение зависело в основном от генотипа экзона 1 и промотора [62, 62] и, возможно, от других однонуклеотидных полиморфизмов в регуляторных регионах [22].
Белки острой фазы и гомеостаз железа
Ряд белков острой фазы участвует в метаболизме железа — нутриента, необходимого для ряда функций клетки-хозяина, а также для роста микробных патогенов. К общим функциям белков острой фазы в метаболизме железа относятся связывание с ним, что предотвращает использование циркулирующего свободного железа патогенами и его удержание внутри клеток. Таким образом, сложная регуляция метаболизма железа приводит к метаболической резистентности к отдельным патогенам. Белки острой фазы, участвующие в контроле свободного железа, включают циркулирующий пептидный гормон гепсидин, ферритин, гаптоглобин и гемопексин, которые активируются в острой фазе реакции, тогда как трансферрин представляет собой негативный белок, который подавляется в течение острой фазы (таблица 1). Гепсидин связывается с трансмембранным белком ферропортином, регулирующим выход железа из клеток в плазму. Содержание ферритина обычно напрямую отражает уровень железа в крови; однако, в отличие от железодефицитной анемии, анемия, связанная с хроническими воспалительными заболеваниями, характеризуется более высоким уровнем ферритина, чем в норме, из-за его индукции при реакции острой фазы. Действительно, высокая концентрация ферритина в плазме наблюдается у пациентов с тяжелыми патологическими воспалительными состояниями, включая синдром активации макрофагов, септический шок и COVID-19, при которых ферритин используется в качестве маркера тяжести и прогноза (см. ниже).
Гаптоглобин и гемопексин представляют собой белки острой фазы, которые действуют как растворимые поглотители свободного гемоглобина и гема, соответственно. Свободный гем очень токсичен, поскольку он является источником редокс-активного железа и обладает способностью встраиваться в липидные мембраны, способствуя перекисному окислению липидов. Повышение содержания гаптоглобина и гемопексина в реакциях острой фазы способствует защите от окислительного стресса, опосредует гемом, потери железа при воспалительных состояниях, связанных с гемолизом, и инфекций, предотвращая использование железа патогенами.
Белки острой фазы, свертывание крови и регенерация тканей
Ряд белков острой фазы связан с каскадом свертывания крови. Фибриноген и продукты его последующего распада (d-димер и другие продукты распада фибрина) широко используются в качестве диагностических маркеров при воспалительных состояниях, включая COVID-19. Cвертывание крови и регенерация тканей — тесно связанные процессы. Фибриновая сеть, образующаяся после активации каскада коагуляции, служит временной матрицей, необходимой для восстановления тканей. Его своевременное удаление посредством фибринолиза является необходимым условием последующих этапов созревания матрикса. Реакция острой фазы задействует и активирует компоненты, участвующие в свертывании крови (например, фибриноген) и формировании внеклеточного матрикса (фибронектин) (таблица 1). PTX3, в отличие от родственного ему С-реактивного белка, участвует в тройном взаимодействии с фибриногеном и плазминогеном, способствуя своевременной деградации временной фибриновой сети и последующему восстановлению тканей [44]. Помимо компонентов внеклеточного матрикса, во время реакции острой фазы вырабатываются ингибиторы протеолитических ферментов (например, α1-антитрипсин, α2-макроглобулин и α1-кислый гликопротеин), которые могут ограничивать повреждение тканей. Например, α1-антитрипсин защищает хозяина при аутоиммунитете и инфекциях [31, 63].
Белки внеклеточного матрикса, в том числе фибриноген и фибронектин, связывают микробы и облегчают их клиренс фагоцитами. Изначальной функцией молекул, содержащих домен фибриногена, была защита [25]. Таким образом, продукция некоторых белков внеклеточного матрикса во время системного воспаления находится на пересечении процессов тканевой регенерации и врожденного иммунитета.
COVID-19
Распознавание SARS-CoV-2 врожденным иммунитетом действует как фундаментальная первая линия сопротивления, запускает адаптивный иммунитет и стимулирует иммунопатологические эффекты инфекции [64]. Клеточные сенсоры, участвующие во врожденном ответе на SARS-CoV-2, включают мембранные лектины С-типа, которые распознают шиповидный белок [65]; эндосомные TLR3, TLR7 и TLR8, распознающие вирусные нуклеиновые кислоты; путь цитоплазматической синтазы цГМФ–АМФ (cGAS)-STING; и инфламмасому (рисунок 4). Недавно было показано, что кодируемый SARS-CoV-2 белок открытой рамки считывания 8 (ORF8) ингибирует выработку интерферона с помощью эпигенетических механизмов [66]. Компоненты SARS-CoV-2 распознаются отдельными белками острой фазы. MBL связывает шиповидный белок всех протестированных вариантов и обладает противовирусной активностью [22]. Кроме того, он активирует лектиновый путь комплемента, что, возможно, способствует иммунопатологическим эффектам на поздних стадиях заболевания. PTX3, в отличие от С-реактивного белка и SAP, связывает вирусный нуклеопротеин [22], но фактическая функция этого взаимодействия in vivo не определена.
Хотя клиническое значение распознавания вируса отдельными белками острой фазы еще предстоит полностью выяснить, эти молекулы служили неоценимыми диагностическими инструментами на протяжении всей пандемии в самых разных контекстах, от амбулаторных клиник до отделений реанимации и интенсивной терапии (ОРИТ) (таблица 1). Широко использовались С-реактивный белок, прокальцитонин и ферритин, и в большинстве исследований высокие концентрации в плазме при поступлении в больницу были связаны с тяжелым заболеванием и плохой выживаемостью [11–14]. Концентрация d-димера после фибриногена положительно коррелировала с площадью гипоперфузии у пациентов с острым респираторным дистресс-синдромом, что указывает на тромбоэмболическое заболевание и связано с более высокой смертностью [67]. Было обнаружено, что нарушение регуляции гомеостаза железа, которое часто встречается у госпитализированных пациентов с COVID-19 и проявляется в виде анемии и повышенного соотношения ферритин : трансферрин, служит предиктором поступления в ОРИТ и необходимости искусственной вентиляции легких [24]. У пациентов с COVID-19 повышена концентрация компонентов комплемента, что подтверждает роль этого пути в иммунопатологических эффектах [20]. При COVID-19 путь комплемента стал терапевтической мишенью, с обнадеживающими предварительными результатами небольших когортных исследований, показывающих снижение острой фазы реакции, активности тромбина и образования нейтрофильных внеклеточных ловушек в связи с ингибированием комплемента [21]. В серии независимых исследований, основанных на традиционном иммуноанализе [16, 17, 68–70] или протеомном подходе [71], PTX3 оказался сильным прогностическим маркером и независимым предиктором летального исхода в течение нескольких дней у госпитализированных пациентов. Было обнаружено, что PTX3 экспрессируется миелоидными клетками периферической крови и легких, а также эндотелиальными клетками легких у пациентов с COVID-19 [16]. Сильная независимая прогностическая значимость PTX3, превосходящая таковую для C-реактивного белка, интерлейкина-6, ферритина или d-димера, может отражать интеграцию активации миелоидных и эндотелиальных клеток микроциркуляторного русла.
Отбор пациентов для различных видов терапии на разных стадиях заболевания и их последующее наблюдение остается огромной проблемой. Повышение уровня С-реактивного белка в сочетании с определением потребности в дополнительном кислороде использовалось для отбора пациентов, которым может помочь терапия, направленная против интерлейкина-6 [72]. В небольшом исследовании (с участием 30 пациентов) ответ на лечение с помощью моноклонального антитела к интерлейкину-6 (силтуксимаб) измеряли с использованием ряда биомаркеров. Уровень С-реактивного белка снижался независимо от клинической пользы, отражая ингибирование продукции этого белка острой фазы печенью вне связи с воспалением тканей. Напротив, PTX3 и интерлейкин-8, которые продуцируются в тканях, лучше коррелируют с клиническим ответом [68].
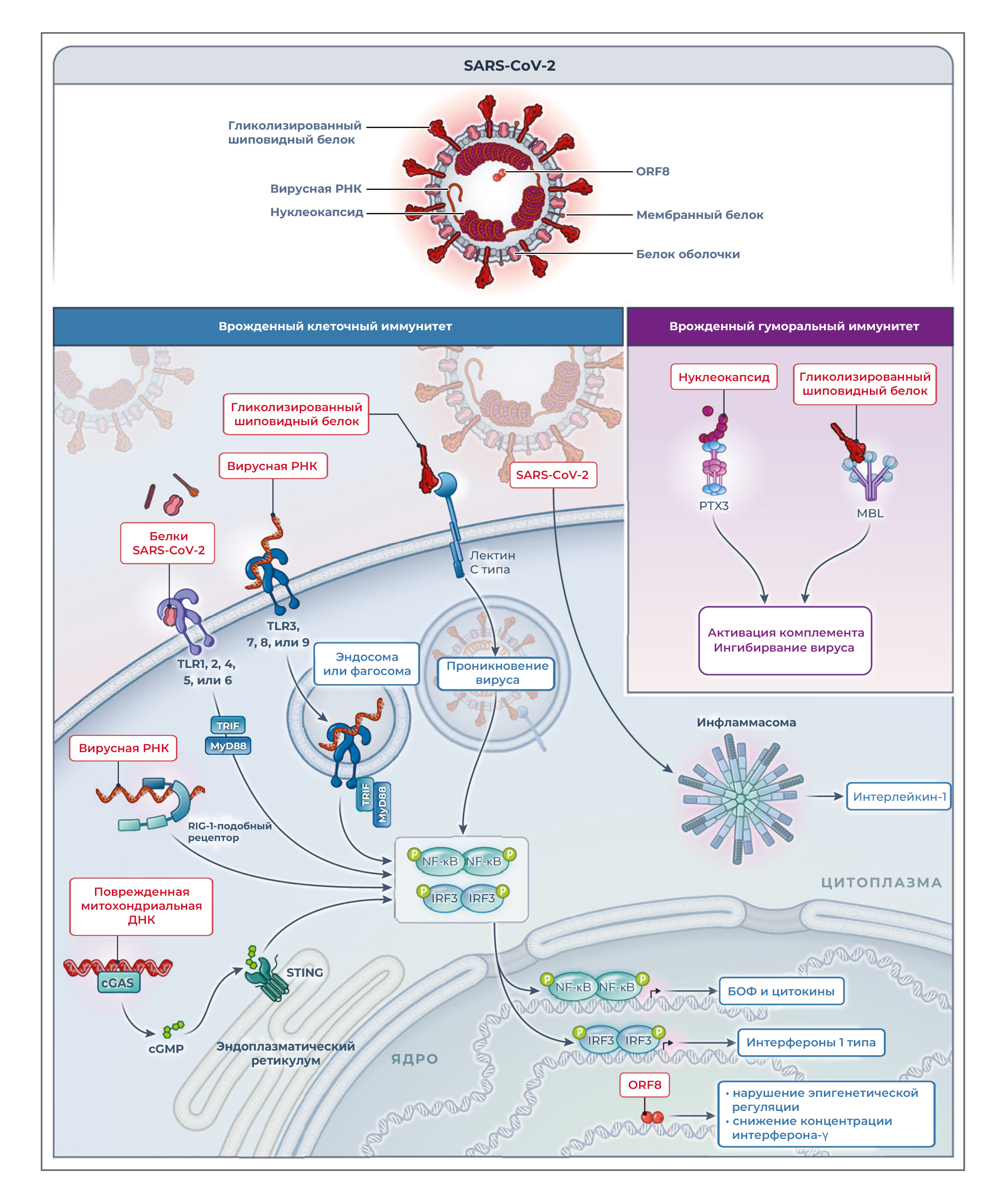
Рисунок 4. Узнавание SARS-CoV-2 клеточными и гуморальными молекулами распознавания образов, включая белки острой фазы.Белки и нуклеиновые кислоты коронавируса 2 тяжелого острого респираторного синдрома (SARS-CoV-2) распознаются клеточными рецепторами, участвующими во врожденном иммунитете, включая лектины С-типа, TLR, cGAS-STING и инфламмасому. Белок открытой рамки считывания 8 (ORF8) ингибирует продукцию интерферона с помощью эпигенетических механизмов. Молекулы распознавания гуморального паттерна MBL и PTX3 связывают гликозилированный шиповидный белок и вирусный нуклеокапсид, соответственно.
Прогнозирование прогрессирования заболевания представляет собой святой Грааль для своевременного вмешательства. Было обнаружено, что недорогая панель, включающая С-реактивный белок как показатель системного воспаления, РТХ3 как коррелят тканевой реакции и лактатдегидрогеназу как индикатор повреждения клеток и тканей, показывает корреляцию с тяжестью поражений на компьютерной томографии и последующим прогрессированием заболевания у пациентов с малосимптомным COVID-19 [18]. Интеграция низкотехнологичных и недорогих измерений выбранных белков острой фазы с молекулярными сигнатурами может проложить путь к разработке инструментов, позволяющих применять ранние подходы, более адаптированные к потребностям пациентов.
Наступающие после острой фазы последствия COVID-19, также известные как «посковидный синдром» (ПКС), создают трудности для пациентов и системы здравоохранения. Патогенез ПКС сложен и зависит от нескольких движущих факторов, включая персистенцию SARS-CoV-2 в различных органах, реактивацию и ответ на неродственные вирусы, такие как вирус Эпштейна–Барр, аутоиммунитет, стойкое воспаление и тромбоз сосудов микроциркуляторного русла [73–75]. Усталость, мышечная слабость и непереносимость физических нагрузок являются одними из наиболее частых симптомов постковидного синдрома. Эта клиническая картина напоминает состояние, известное как синдром хронической усталости или миалгический энцефаломиелит, возникающее после вирусных инфекций, при котором белки острой фазы оказываются коррелятами активности болезни [73, 76]. В недавнем протеомном исследовании, направленном на определение биомаркера, связанного с последующим развитием ПКС, набор белков острой фазы, включая С-реактивный белок и молекулы, участвующие в метаболизме железа, оказался в числе признаков воспаления и реакции на стресс, предсказывающих развитие ПКС [77]. Через восемь месяцев после COVID-19 легкой и средней степени тяжести наблюдались глубокие нарушения функции миелоидных клеток. С ПКС был связан набор биомаркеров (интерферон-β, интерферон-γ, интерферон-λ, интерлейкин-6 и PTX3) [19]. Границы проявлений ПКС и разнообразие затрагиваемых органов все еще плохо определены. Изменения уровней белка в острой фазе вместе с выявляющимися сигнатурами [74, 78] могут помочь определить эти границы, разнообразие проявлений ПКС и прогноз поражения органов.
Заключение
С момента открытия С-реактивного белка белки острой фазы стали бесценными инструментами в клинической практике при широком спектре заболеваний, включая COVID-19 и постковидный синдром [11–14, 16], что указывает на воспаление как на метанарратив медицины в настоящее время и в обозримом будущем [10, 26]. Белки острой фазы оказались активными участниками острого и хронического воспаления. Многие из этих молекул распознают микробные фрагменты и поврежденные клетки или ткани. Эти «пред-антитела» способствуют избавлению от микробов и мертвых клеток, активируя и регулируя каскад комплемента и опосредуя активность опсонизации. Увеличение производства молекул матрикса (фибриногена и фибронектина) и ингибиторов протеаз во время ответа острой фазы можно рассматривать как общий механизм, способствующий регенерации тканей. Более того, широкое значение на системном (метаболическая резистентность) и клеточном уровнях имеют изменения в метаболизме железа [79]. Таким образом, белки острой фазы и реакция острой фазы в целом являются важным компонентом гуморального врожденного иммунитета, способствующим устойчивости к противомикробным препаратам и восстановлению тканей.
Признание того, что некоторые белки острой фазы представляют собой нечто большее, чем биомаркеры, повышает вероятность того, что они могут представлять собой терапевтические инструменты или мишени. SAP связывается со всеми формами амилоидных фибрилл и служит терапевтической мишенью при амилоидозе и нейродегенерации [34, 42, 80]. Тем не менее, на основании его ингибирующего действия на дифференцировку фиброцитов SAP прошел клиническую оценку для лечения идиопатического легочного фиброза [43] и в настоящее время проходит фазу III рандомизированных испытаний (номера в ClinicalTrials.gov NCT0459470 и NCT04552899). Генетический полиморфизм локусов SAP и PTX3 и данные доклинических исследований указывают на терапевтический потенциал этих молекул при аспергиллезных инфекциях, представляющих серьезную клиническую проблему [38, 48]. MBL вводили пациентам с генетическими дефектами [81], и недавно было показано, что он распознает спайковый белок известных вариантов SARS-CoV-2 и опосредует устойчивость к этому вирусу [22]. Таким образом, генетика человека, безопасность и доклинические данные создают необходимость изучить потенциал белков острой фазы для будущего применения в терапии.
Комплексные подходы, использующие преимущества передовых технологий, выявили сигнатуры-кандидаты, связанные с риском и клиническим течением COVID-19 [19, 74, 77, 78], и некоторые из обсуждаемых здесь молекул входят в состав этих сигнатур. Интеграция классических проверенных биомаркеров в новые сигнатуры и их тщательная оценка в крупных популяционных исследованиях с использованием устойчивых технологий отправляют белки острой фазы «назад в будущее» через 100 лет после их первоначального открытия [6, 7].





