Работа эндокринной системы — четко отлаженный механизм. При нарушении одного из его звеньев происходят кардинальные изменения в работе всего организма. Они приводят к развитию заболеваний, которые влияют на все системы органов. К одному из таких заболеваний относится тиреоидит Хашимото.
Что такое аутоиммунный тиреоидит (АИТ)?
Аутоиммунный тиреоидит (тиреоидит Хашимото) — хроническое воспалительное заболевание щитовидной железы аутоиммунного генеза, при котором в результате хронически прогрессирующей лимфоидной инфильтрации происходит постепенная деструкция ткани железы, приводящая к развитию гипотиреоза.
Тиреоидит Хашимото — распространенное аутоиммунное заболевание, которое по статистике поражает женщин в 7–10 раз чаще, чем мужчин. И развивается из-за генетической предрасположенности, паттернов инактивации Х-хромосомы, модулируемых факторами окружающей среды, а также составом микробиома, и приводит к дисбалансу собственного организма [7].
При АИТ наблюдается 3 типа антител:
- антитела к тиреопероксидазе;
- антитела к тиреоглобулину;
- антитела (стимулирующие или ингибиторные) к рецептору ТТГ
С 2020 года отмечается повышенный уровень выявляемости АИТ, что по некоторым исследованиям соотносят с таким состоянием как “Long Covid”. Другие специалисты связывают этот факт с гипердиагностикой и бОльшим охватом диспанцеризацией населения в ковидный период.
Почему организм решает «открыть охоту» на щитовидную железу?
Аутоиммунные проявления АИТ основаны на взаимодействии факторов окружающей среды и генетического фона.
К аспектам генетической предрасположенности можно отнести следующие моменты:
- антигены системы HLA (человеческий лейкоцитарный антиген), чаще HLA DR3, DR4, DR5. (HLA),
- Т-лимфоцит — связанные 4 (CTLA-4),
- протеинтирозинфосфатаза,
- нерецепторный тип 22 (PTPN22) генов,
- паттерны инактивации Х-хромосомы.
Нарушения в данных структурах приводит к дисбалансу между механизмами самотолерантности, поддерживаемыми регуляторными Т- и В-лимфоцитами [1-4].
Кроме того, факторами генетической предрасположенности могут выступать:
- генетические полиморфизмы аутоантигенов, цитокинов и их рецепторов,
- рецепторы эстрогенов,
- молекулы адгезии (CD14,CD40),
- промоторная область селенопротеина S,
- генные продукты, связанные с апоптозом
Эти генетические предрасположенности могут быть эпигенетически модифицированы посредством метилирования, модификаций гистонов и РНК-интерференции некодирующих РНК [5, 6].
Некоторыми медицинскими сообществами высказывается мнение о том, что предрасположенность к АИТ кодируется редкими вариантами генов. Одним из недавних примеров вероятно такого гена, является описание ранее неизвестного варианта сайта сплайсинга в гене тиреоглобулина (TG c. 1076 — 1G>C), связанный с пропуском экзонов и приводящий к вариантному транскрипту ТГ. Этот вариант был обнаружен у пораженных членов семьи с явно аутосомно-доминантной ГТ [8]. Следует отметить, что у пораженных членов были аутоантитела как к тиреоглобулину, так и к тиреопероксидазе (ТПО).
Сообщалось о другой семье с аутосомно-доминантным наследованием HT с мутацией, приводящей к гаплонедостаточности гена, кодирующего белок 3, индуцированный фактором некроза опухоли-α, также известный как A20 [9]. Уже известно, что гаплонедостаточность А20 может приводить к воспалительным и аутоиммунным заболеваниям, предположительно из-за роли А20 в регуляции Т-хелперных клеток 17 (Th17).
Как известно, внешние факторы могут спровоцировать аутоиммунные заболевания у генетически предрасположенных пациентов.
Эти триггеры включают, помимо прочего, бактериальные и вирусные инфекции, курение сигарет, материнско-плодовый микрохимеризм и воздействие химических соединений, таких как антипирены и фталаты [10, 11].
С другой стороны, ограниченное воздействие факторов окружающей среды, например проживание в почти стерильных условиях, также было связано с высокой частотой аллергических и аутоиммунных заболеваний, включая АИТ [12] .
Так же было установлено, что изменения состава микробиома были связаны с развитием аутоиммунного заболевания щитовидной железы: бифидобактерии и лактобактерии значительно уменьшилась, а вредная микробиота повышалась при АИТ по сравнению с контрольными лицами без аутоиммунитета.
Пищевые привычки также могут влиять на естественное течение АИТ, так как избыток йода связан с с увеличением заболеваемости АИТ до 4 раз [13]. Механизм этого явления может быть связан с повышенной иммуногенностью тиреоглобулина по йоду у генетически предрасположенных лиц. Имеются данные о том, что снижение потребления селена может активировать АИТ, однако введение селена не показало улучшения течения заболевания, хотя наблюдалось снижение титров аутоантител к тиреопероксидазе (ТПО).
Патогенетические механизмы
На основании клинических и гистологических признаков выделяют следующие основные формы АИТ:
- Зобная (гипертрофическая, фиброзная)
- Атрофическая
- Тиреоидит Риделя
- Тиреоидит IG4
Давно обсуждается вопрос взаимосвязи между зобной и атрофической формами аутоиммунного тиреоидита. Существует предположение, что это не два отдельных варианта развития заболевания, и АИТ протекает с постоянной сменой этих форм.
Следовательно пациенты с тиреоидитом Хашимото могут испытывать симптомы как гипертиреоза, так и гипотиреоза. При этом лабораторные показатели Т3, Т4 и ТТГ могут быть как критично высокими, так и критично низкими.
Заболевание, связанное с IgG4 (IgG4-RD), является недавно признанным заболеванием, поражающим ряд тканей и характеризующимся инфильтрацией IgG4-позитивных плазматических клеток, стромальным фиброзом и повышенными концентрациями IgG4 в сыворотке.
В настоящее время хорошо известно, что регуляторные Т-клетки (Treg) играют решающую роль в предотвращении аутоиммунитета. Было идентифицировано несколько типов Treg (CD4+CD25+Foxp3+), которые, как ранее было показано, являются аномальными при АИТ и дифференцируются на периферии в ответ на специфический антиген. Отмечалось увеличение CD4+CD69+Foxp−Treg, но со сниженной функцией при АИТ [14], а также снижение как количества, так и функции CD4+CD49+LAG-3+ IL-10+Treg типа 1 [15].
С точки зрения повреждения клеток щитовидной железы, цитокины, полученные из лимфоцитарного инфильтрата, играют ключевую роль. Они способны стимулировать сами клетки щитовидной железы к высвобождению провоспалительных медиаторов, таким образом, усиливая и сохраняя аутоиммунный ответ [16]. Th17-клетки крови и щитовидной железы, которые секретируют цитокин IL-17, увеличиваются при АИТ. В недавнем исследовании сообщалось об обнаружении дополнительного источника IL-17 в самих фолликулярных клетках щитовидной железы. ХТ [17].
Экспрессия коррелирует с появлением CD68+макрофагов внутри фолликула, хотя не было доказательств, подтверждающих прямую роль IL-17 в дисфункции плотных контактов. В дополнение к IL-17 клетки Th17 секретируют IL-22, который нацелен на эпителиальные клетки и который также секретируется клетками Th22. В настоящее время сообщалось о высоких уровнях клеток Th22 в крови и щитовидной железе пациентов с АИТ.
Дальнейший провоспалительный каскад был идентифицирован при АИТ с обнаружением повышенной экспрессии множественных компонентов воспаления (NLRP1, NLRP3, NLRC4, AIM2, ASC и каспазы-1) и связанных с ними цитокинов (IL-18 и IL-1β) в щитовидной железы пациентов, а также выявление высвобождения воспалительного компонента клетками щитовидной железы, стимулированными in vitro IFN-γ и фактором некроза опухоли-α, что, в свою очередь, может способствовать дальнейшему высвобождению цитокинов и гибели клеток посредством пироптоза[18].
Также была исследована ось PD-1/PD лиганд-1 (рецептор запрограммированной клеточной смерти), которая играет важную роль в подавлении адаптивного иммунитета в различных условиях, включая иммунный ответ опухолевых клеток. Такая блокада может привести к аутоиммунному заболеванию.
PD лиганд-1 экспрессируется фолликулярными клетками щитовидной железы как при АИТ, так и при болезни Грейвса в областях щитовидной железы, ассоциированных с присутствием PD-1.Т-клетки и IFN-γ способны индуцировать экспрессию лиганда-1 PD в первичных культурах и линиях клеток щитовидной железы. Это повышает вероятность того, что такая экспрессия может помочь поддерживать периферическую толерантность при продолжающемся воспалении, аналогично тому, как экспрессия HLA II клетками щитовидной железы работает в отсутствие подходящего костимулирующего сигнала [19, 20], а также может объяснить появление деструктивного тиреоидита после лечения в отделении интенсивной терапии.
Механически АИТ характеризуется прямой атакой Т-клеток на щитовидную железу, что подтверждается гистологически наличием лимфоплазмоцитарной инфильтрации, фиброза, образования лимфатических фолликулов и паренхиматозной атрофии.
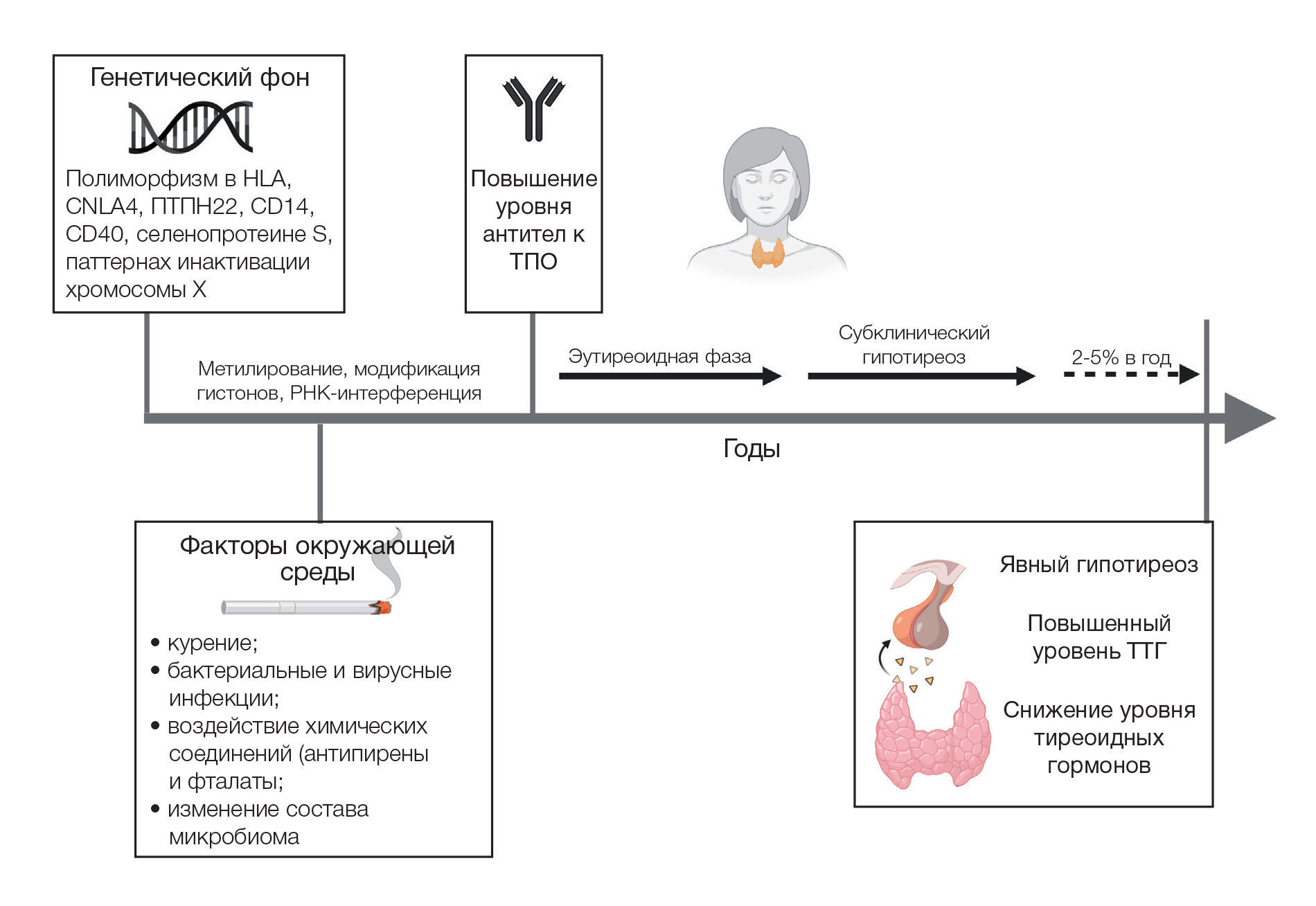
Рис. 1. Этиология и патогенез тиреоидита Хашимото.
В начальной стадии атака провоцирует выброс в кровоток больших доз преформированных тиреоидных гормонов, что может приводить к развитию тиреотоксикоза (Хашитоксикоза). Запасы циркулирующего гормона истощаются быстрее, чем успевает восстановиться функция щитовидной железы. Возникает стадия эутиреоза. На этих стадиях тиреоидит Хашимото может не проявляться клинически. [21]
Последующий гипотиреоз возникает из-за усиливающегося разрушения фолликулярных клеток щитовидной железы за счет инфильтрации иммунных клеток, что приводит к воздействию тиреоидных антигенов (ТПО и тиреоглобулин [Tg]), дальнейшему увеличению выработки антител (TgAb, TPOAb) и усугублению разрушения фолликулов щитовидной железы.
Важно понимать, что данный процесс циклический. Исследования показывают, что после прекращения аутоиммунной атаки, поврежденная железа может регенерировать.
При АИТ наблюдается нарушение структуры и функции щитовидной железы. Основным патологическим признаком является наличие выпуклых белесоватых участков на поверхности щитовидной железы. Так называемые «очаги Хашимото» образуются в результате инфильтрации клетками иммунной системы, атрофии, склероза и гиалинизации нормальных тканей щитовидной железы.
Клиническое течение или как распознать симптомы тиреоидита Хашимото?
Примечательно, что у некоторых пациентов при ярко выраженной деструкции щитовидной железы в начальной стадии могут проявляться симптомы гипертиреоза (хашитоксикоза):
- эмоциональная неустойчивость, раздражительность, беспричинная плаксивость;
- снижение концентрации и внимания;
- ежедневные нарушением сна;
- слабость во время ходьбы;
- повышенная потливость, ощущение «жара»;
- периодическое сердцебиение;
- дрожь в теле;
- нарастающая потеря веса и другие.
Если деструкция паренхимы железы протекает не активно, начальная стадия характеризуется состоянием эутиреоза. Зачастую симптоматически АИТ начинает проявляются при эволюции состояния в гипотиреоз.
Первичный гипотиреоз обычно считается «явным», когда уровень тиреотропного гормона (ТТГ) повышен, а СТ4 снижен.
Субклинический гипотиреоз характеризуется повышенным ТТГ при нормальных концентрациях СТ3 и СТ4.
Симптомы гипотиреоза развиваются при нарастающем дефиците тиреоидных гормонов в тканях-мишенях и характеризуются:
- увеличением массы тела;
- вялостью, апатией, развитием депрессии;
- бледной, желтоватой, сухой кожи;
- отеками;
- ломкостью ногтей и выпадением волос;
- повышенной чувствительности к холоду;
- снижением перистальтики и запорами;
- брадикардией;
- гиперлипидемией;
- охриплостью голоса;
- болезненными судорогами;
- нормоцитарной или микроцитарной анемией;
- ановуляцией менструальных циклов;
В некоторых случаях отмечается чрезвычайно редкое состояние — энцефалопатия Хашимото, характеризующееся повышенным содержанием белка в спинномозговой жидкости и неспецифическими корковыми изменения на МРТ.
Данные симптомы не являются специфическими и могут свидетельствовать как и о прочих заболеваниях щитовидной железы, так и о заболеваниях других систем органов. Поэтому важно помнить о том, что основным диагностическим моментом тиреоидита Хашимото является постоянно высокий уровень антител к тиреопероксидазе, к тиреоглобулину, к рецептору ТТГ.
Диагностические критерии
Диагноз тиреоидит Хашимото ставится на совокупном анализе клинической картины, УЗИ-картины и наличии антител. При этом Ат-ТПО встречаются в 80-95% случаев, Ат-ТГ в 60-80% случаев, Ат-ТТГ в 20% случаев. Серонегативная форма АИТ встречается всего в 5-10% клинических случаев [23]. Большинство людей с повышенным уровнем антител к ТПО биохимически находятся в эутиреоидном состоянии.
Ультразвуковые признаки ГТ включают увеличение объемов железы, снижение эхогенности, гетерогенность, гиперваскуляризацию и наличие мелких кист [22].
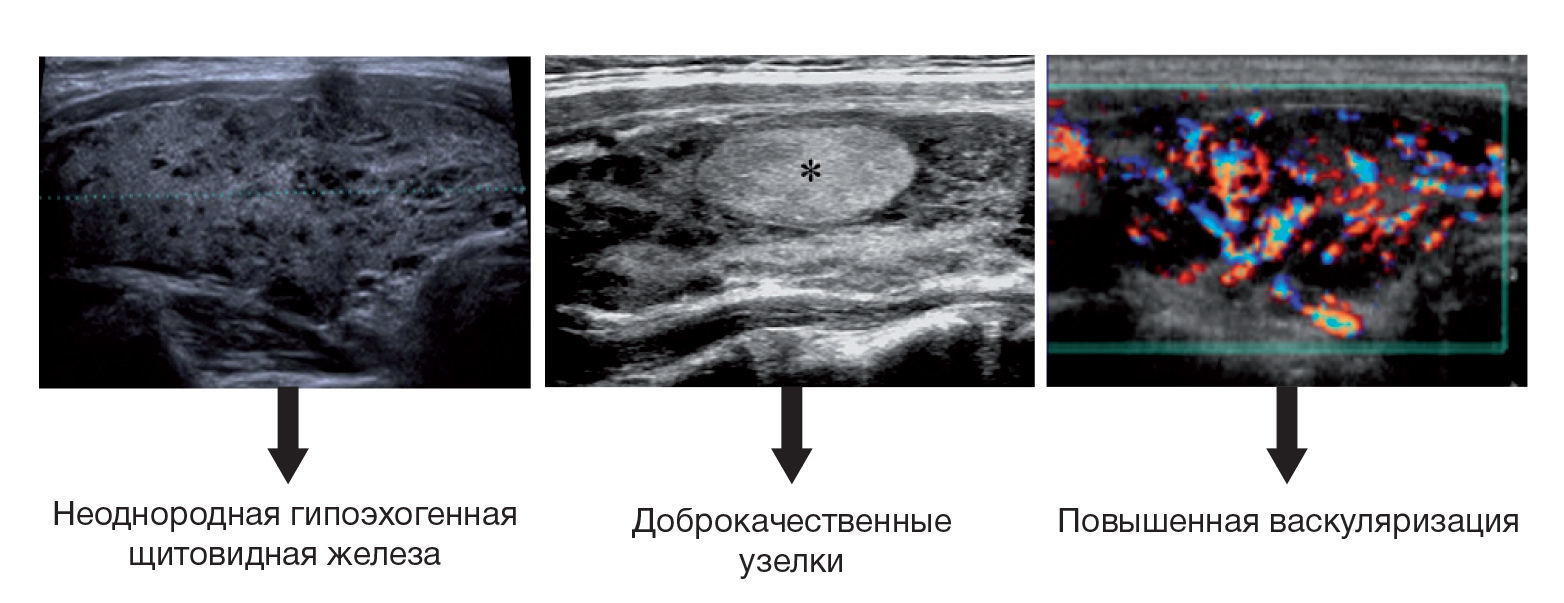
Рис 2. Демонстрация УЗИ щитовидной железы при прогрессирующем АИТ.
При физикальном обследовании обычно выявляется бугристый безболезненный зоб, который обычно симметричен и часто имеет пальпируемую пирамидальную долю. Возможно увеличение регионарных лимфатических узлов. В то время как узловое заболевание щитовидной железы может и часто возникает при тиреоидите Хашимото, подозрительные узлы следует оценивать с помощью пункционной аспирационной биопсии, чтобы исключить сопутствующее злокачественное новообразование. Офтальмопатии присутствуют у небольшой группы пациентов с тиреоидитом Хашимото. Несмотря на это они обычно протекают в тяжелой форме [24, 25].
Принципы лечения
Основное лечение тиреоидита Хашимото заключается в заместительной терапии гормонами щитовидной железы при наличии гипотиреоза.
L-тироксин
L-тироксин является гормоном выбора для заместительной терапии гормонами щитовидной железы из-за его постоянной активности и продолжительного действия. Из-за длительного периода полувыведения тироксина (7 дней) новые равновесные концентрации гормона не достигаются до 4-6 недель после изменения дозы. Таким образом, нет необходимости проводить повторное обследование с определением концентрации ТТГ в сыворотке крови с интервалом менее 4–6 нед.
Целью заместительной терапии тироксином является достижение уровня ТТГ в
пределах нормы, поскольку чрезмерная замена тироксина, подавляющего значения ТТГ до субнормального диапазона может вызвать остеопороз и вызвать сердечную дисфункцию [26].
Пациенты, получающие супрессивную терапию L-тироксином, должны периодически проходить повторное обследование с целью корректировки дозировки L-тироксина. При этом доза супрессивного гормона должна быть снижена или прекращена, если не достигнуто значительного уменьшения зоба. Хирургия иногда показана только при компрессионном зобе с местными обструктивными симптомами.
ТРГ-тест
При терапии заместительными гормонами необходима постоянная (4-6 недель) оценка её эффективности. Для этого рекомендуется использовать тест с ТРГ (тиреолиберин, тиреотропин-релизинг-гормон).
В 1990 году были проведены исследования [28], в ходе которых были изучены 92 пациента с гипотиреозом на фоне тиреоидита Хашимото и 70 здоровых пациентов контрольной группы. При проведении теста у всех контрольных была нормальная реакция щитовидной железы на тиреотропный гормон (ТТГ), концентрация которого в крови повышалась при введении 500 мкг тиреотропин-рилизинг-гормона (ТРГ). При этом практически все пациенты с АИТ подобной реакции не давали. Во время лечения тироксином у 22 пациентов восстановилась чувствительность щитовидной железы к ТТГ, и когда лечение было прекращено, у этих пациентов эутиреоидная железа сохранялась в течение 1-8 лет. Тогда как у оставшихся 70, у которых не восстановилась чувствительность щитовидной железы к ТТГ, в течение 3 месяцев развился гипотиреоз. Более 20% пациентов с гипотиреозом после тиреоидита Хашимото могут восстановить удовлетворительную функцию щитовидной железы, и их можно определить во время лечения тироксином по реакции щитовидной железы на ТТГ в тесте ТРГ.
Качество жизни
Для большинства больных тиреоидитом Хашимото заместительная гормональная терапия левотироксином является незаменимой. Тем не менее, правильный режим питания, улучшение сна и бодрствования и экологический образ жизни могут дополнить стандартное лечение и способствовать ремиссии АИТ за счет улучшения функции щитовидной железы, а также за счет регулирования уровней ТТГ, Т3, Т4, АТ-ТРО и АТ-ТГ.
Соблюдение рекомендаций по питанию с упором на преобладающую противовоспалительную диету и контролируемое дозирование витамина D может помочь отдельным пациентам с ТН снизить потребность в лекарствах, замедлить течение заболевания и избежать рецидивов.
Диетотерапия при тиреоидите Хашимото направлена на оптимальное питание и модуляцию иммунной системы с помощью противовоспалительной диеты. Поскольку у пациентов с АИТ распространен дефицит питания, поэтому управление питанием считается необходимым для лечения пациентов с АИТ. В литературе имеются данные о дефиците селена, калия, йода, меди, магния, цинка, железа и витаминов A, C, D и B. Кроме того, было высказано предположение, что адекватное потребление белка, пищевых волокон и ненасыщенных жирных кислот, особенно из семейства омега-3, играет полезную роль.
Основным принципом диетотерапии при АИТ считается употребление продуктов, богатых антиоксидантами. Они способствуют противовоспалительному эффекту.
Так же важно исключить из рациона продукты, вызывающие дисбактериоз. Считается, что повышенная кишечная проницаемость и дисбактериоз положительно влияют на прогрессирование АИТ. Появляется все больше сведений о существовании связи между щитовидной железой и кишечником. Доказано снижение содержания лактобактерий и бифидобактерий при гипо или гипертиреозе. В свою очередь нарушенный баланс микрофлоры может приводить к дебюту или прогрессированию АИТ.
Отмечается, что регулярный прием пищевых добавок, содержащих пробиотики и пребиотики, значительно снижает ТТГ при одновременном повышении Т3 [29]. Это может быть связано с положительной корреляцией лактобактерий и бифидобактерий с пищевым селеном и цинком.
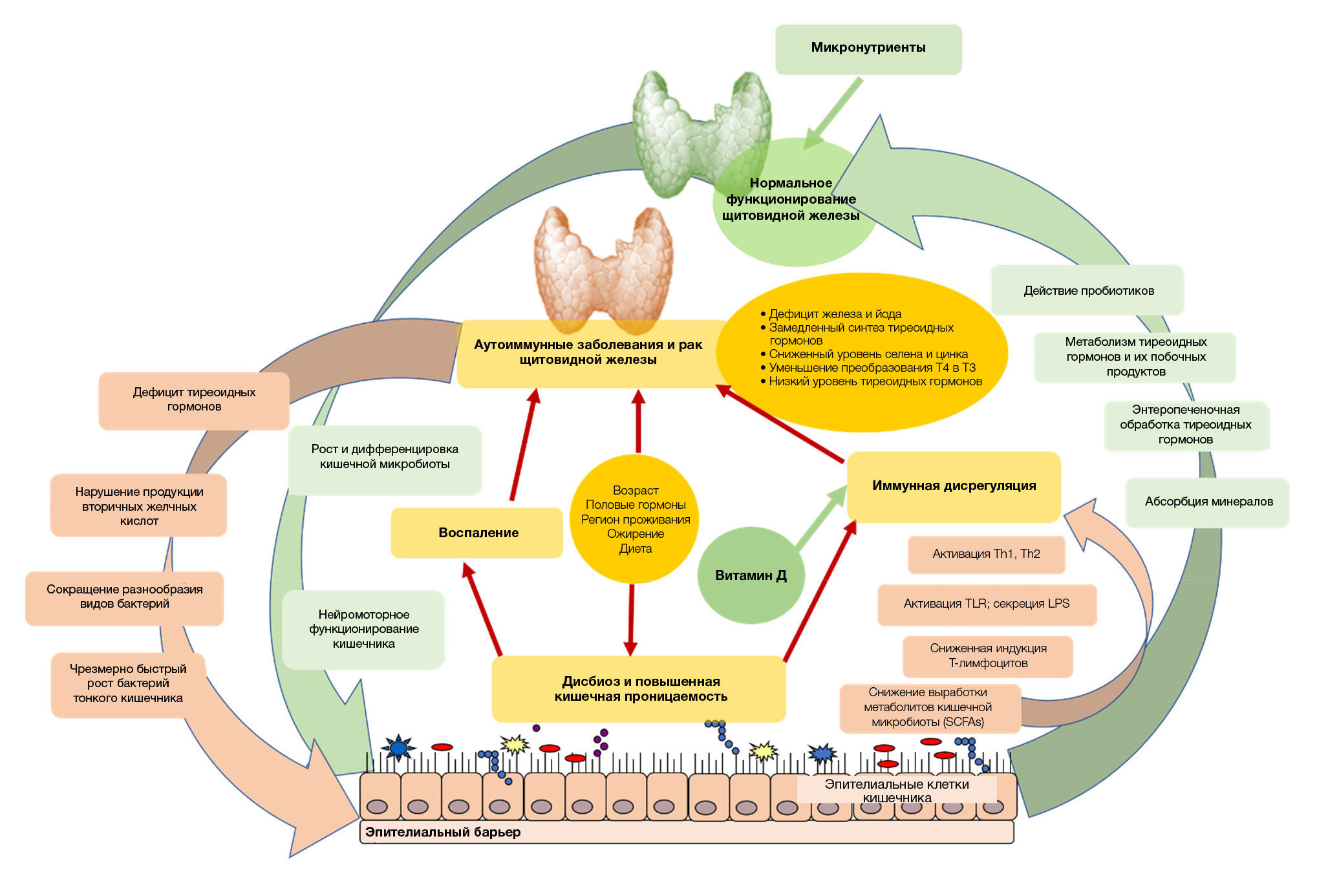
Рис 3. Взаимодействие кишечника и щитовидной железы в норме и при патологии (АИТ и рак).
У пациентов с АИТ продемонстрирован дефицит витамина D [30]. Это может быть связано с недостаточностью его естественных эффектов на множественную дифференцировку и созревание иммунных клеток, презентацию антигена, а также на регуляцию продукции цитокинов и хемокинов. Было показано, что в моноцитах/макрофагах витамин D ингибирует экспрессию Toll-подобного рецептора (TLR) 2/4 и выработку воспалительных цитокинов, таких как IL-1, IL-6 и TNF-α. Таким образом, дефицит витамина D играет решающую роль в патогенезе большинства аутоиммунных заболеваний.
Диетологическое лечение АИТ включает детоксикацию печени и очищение от тяжелых металлов. Когда органы и системы поражены, токсины и другие примеси не выводятся должным образом, и на организм неблагоприятно влияет воспаление и аутоиммунный ответ. Накопление тяжелых металлов в организме человека приводит к тяжелым поражениям различных органов, в частности нервной, дыхательной, эндокринной, желудочно-кишечной и репродуктивной систем. Некоторые зарубежные исследования сообщают о дезинтоксикационном эффекте диет, которые в сочетании с планом упражнений, могут приводить к улучшению здоровья и снижению веса [31].
Учитывая многочисленные исследования, можно составить диетологическую карту запрещенных, допустимых и разрешенных продуктов [32].

Несмотря на все вышесказанное тиреоидит Хашимото все еще остается недостаточно изучен в настоящее время. Многие аспекты этиологии, патогенеза, диагностики и лечения до сих пор не до конца раскрыты. Мы надеемся, что с дальнейшим развитием генетики, иммунологии и эндокринологии будут углубляться наши знания про это заболевание, а также будут разработаны новые, более эффективные методы стабилизации аутоиммунного тиреоидита.





