«Словами не передать то ужасное страдание, которое мне довелось перенести… Однако я никогда не забуду чистый вихрь эмоций, ужас необъятной тьмы и ощущение брошенности Господом и людьми, что пронеслось сквозь мой рассудок и переполнило мое сердце» [1].
Такими были ощущения от хирургических операций у пациентов до октября 1846 г., когда Уильям Мортон в стенах Клинической больницы штата Массачусетс успешно продемонстрировал действие эфирного наркоза. Последнее привело к широкому распространению этой методики среди хирургов. В наши дни в арсенале анестезиологов имеется целый спектр различных препаратов, часть которых используется для общего наркоза [2,3]. Данный обзор сосредоточен на применении ингаляционных анестетиков (рис.1): оксиде азота, галотане, энфлуране, изофлуране, севофлуране и дезфлуране. Наше понимание того, каким образом благодаря этим веществам удается достигать обратимого изменения функции центральной нервной системы в корне изменилось за последние два десятка лет.
Авторы обобщили все данные о том, как ингаляционные анестетики пресекают двигательную реакцию тела в ответ на болезненные стимулы (т.е. иммобилизация) путем угнетения функций спинного мозга, а также — как амнестические эффекты опосредуются корой головного мозга. Некоторые соединения, так называемые «неиммобилизаторы», характеризуются множеством общих черт с ингаляционными анестетиками, а также обладают амнестическим эффектом, однако не подавляют активность скелетной мускулатуры (у животных в эксперименте). Из-за этих различий принято утверждать, что анестетики вызывают амнезию и неподвижность, воздействуя на определенные молекулярные мишени. В своем обзоре авторы описывают новые методы динамической оценки активности областей мозга, что в сочетании с электрофизиологическим мониторингом предоставляют важную информацию о том, как анестетики влияют на работу нервных сетей. Основываясь на чувствительных к анестетикам белков ионных каналов, контролирующих возбудимость нейронов, был сделан вывод, что рецепторы гамма-аминомасляной кислоты типа А (ГАМК-А), по всей видимости, участвуют в механизме действия многих общих анестетиков. Тем не менее некоторые ингаляционные анестетики действуют за счет ингибирования таких возбуждающих ионных каналов, как каналы никотиновых и глутаматных рецепторов нейронов. Вероятно, слегка отличающиеся клинические эффекты ингаляционных анестетиков обусловлены разным специфическим действием на небольшое количество значимых молекулярных мишеней.
Определение специфических сайтов связывания ингаляционных анестетиков с некоторыми белками — это резкое отступление от классического взгляда на то, что все общие анестетики характеризуются неспецифическим механизмом действия. Различная чувствительность к различным механизмам анестезии может быть генетически обусловленной. Кроме того, согласно новым исследованиям, эффекты общих анестетиков зависят от особенностей молекулярной структуры, и, возможно, стоит заострить на ней внимание для повышения их клинической эффективности [4,5].
ПЕРЕМЕНЫ В ПРИМЕНЕНИИ И РОЛИ ОБЩЕЙ АНЕСТЕЗИИ
За исключением лечения эпилептического статуса, общая анестезия всегда служит дополнением к другой процедуре. Анестезиология развивалась в ответ на новые манипуляции, и, в свою очередь, обезболивание и наркоз ускоряли их разработку. Количество амбулаторных хирургических вмешательств в Соединенных Штатах быстро растет; почти 75 % всех хирургических вмешательств в настоящее время выполняются амбулаторно [6]. Общая анестезия также все чаще используется для неинвазивных и минимально инвазивных диагностических и терапевтических методик, требующих иммобилизации и глубокой седации пациента, например, в детской радиологии и эндоскопии, инвазивной радиологии, электросудорожной терапии, лучевой терапии, различных кардиологических процедур, трансбронхиальной биопсии и урологических процедур. В подобных условиях, которые нацелены на экономическую эффективность, быструю выписку и удовлетворенность пациентов оказанием медицинской помощи, особую роль играют быстрый выход организма из наркоза и минимизация побочных эффектов.
Несмотря на то, что летучие анестетики могут вызывать угнетение функции сердечно-сосудистой и дыхательной систем и даже смерть при близких к глубокому наркозу концентрациях, новые шаги в анестезиологической практике привели к снижению смертности от общей анестезии (примерно 1 на 250 000 здоровых пациентов) [7]. Более распространенными нежелательными и потенциально вредными эффектами, возникающими во время и после общей анестезии, являются расстройства вегетативной нервной системы, гипотермия, сердечные аритмии, тошнота, рвота и делирий; эти явления не только вызывают дискомфорт у пациента, но также задерживают момент его выписки и увеличивают финансовые затраты на лечение [8]. В некоторых случаях использование общей анестезии вне операционной может представлять больший риск для пациента, чем сама манипуляция, ради которой и производится обезболивание (например, в случае магнитно-резонансной томографии у детей). По этим причинам крайне желательно применение ингаляционных анестетиков, которые обеспечивают быстрое наступление анестезии и характеризуются малым количеством побочных эффектов.
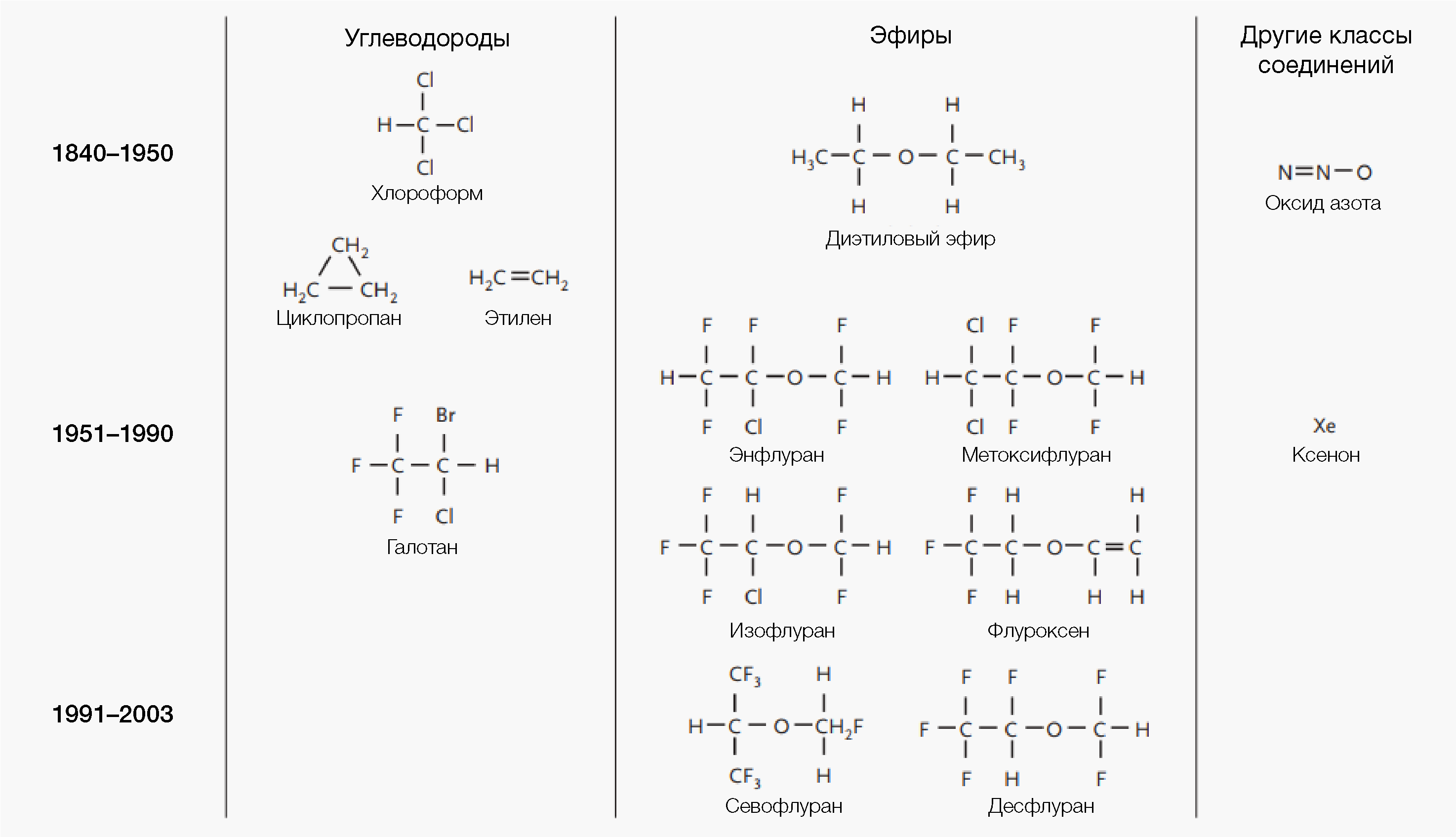
Рис.1 | Классы и поколения ингаляционных анестетиковВ течение нескольких лет после внедрения в широкое клиническое применение ингаляционных анестетиков, использовались три основных класса: углеводороды, эфиры и другие (неуглеродсодержащие) газы. В начале 19 века впервые было признано, что оксид азота обладает анальгезирующим эффектом, однако низкий потенциал не позволяет использовать это соединение в качестве единственного анестетика в случае большинства манипуляций. Углеводороды и диэтиловый эфир характеризуются либо высокой токсичностью (хлороформ), либо взрывоопасностью (циклопропан, этилен и эфир). Галогенирование алканов и эфиров снижает их воспламеняемость, однако флуроксен (первое такое соединение), дебют которого в клинической практике состоялся в 1954 г., позже был отозван по причине остаточной горючести. Галотан, первый негорючий летучий галогенированный алкан, в клинической практике начал применяться в 1956 году. Энфлуран и изофлуран, галогенированные эфиры, впервые использовались в клинической практике в 1972 и 1981 годах, соответственно. По сравнению с диэтиловым эфиром и галотаном их растворимость в крови меньше, что обеспечивает более быстрое поглощение и выведение из легких. Поглощение и выведение севофлурана и десфлюрана, внедренных в 1990-е годы, происходит еще быстрее. Ксенон, который впервые был признан анестезирующим средством в 1951 году, обладает желательными клиническими характеристиками, такими как отсутствие вкуса или запаха, быстрое поглощение и выведение из легких. Кроме того, ксенон не метаболизируется в печени или почках, минимально угнетает сердечно-сосудистую деятельность и не характерен в плане аритмогенности. По всей видимости, ограниченные объемы запасов ксенона и затраты на его получение из атмосферного воздуха, препятствуют его широкому использованию в ближайшем будущем.
ЧТО ТАКОЕ ОБЩАЯ АНЕСТЕЗИЯ?
Оливер Уэнделл Холмс ввел термин «анестезия» для обозначения нечувствительности к боли во время хирургического вмешательства.Но до сих пор нет единого, более объективного определения общей анестезии. Ингаляционные анестетики в различных концентрациях вызывают ряд обратимых, клинически значимых эффектов (табл. 1 и рис. 2). В низких концентрациях они могут давать разные эффекты: амнезию, эйфорию, анальгезию, гипноз, возбуждение и гиперрефлексию. При более высоких концентрациях наступает глубокая седация, мышечная релаксация и снижение двигательных и вегетативных реакций на болевые раздражители: эти эффекты способны развиться до «хирургической» анестезии. Также некоторые летучие анестетики способны защитить миокард от последствий ишемии, что имеет большое значение для многих пациентов [10].
Были определены строгие рамки исследований основных механизмов действия анестетиков на животных и среди добровольцев для клинической оценки глубины анестезии (табл. 1) [11]. Эти эффекты должны быть обратимыми и развиваться без необходимости использования дополнительных миорелаксантов, бензодиазепинов, наркотических средств или модуляторов активности вегетативной нервной системы. Утрата соответствующих реакций на определенные голосовые команды используется для выявления гипноза (нарушение восприятия) у субъектов под наркозом. Кроме того, у пациентов может наблюдаться перцептивное сознание без припоминания, потому как механизмы памяти более чувствительны к анестетикам по сравнению с сознанием [12-14]. У лабораторных животных проводится оценка утраты установочных рефлексов (неспособности вернуться в вертикальное положение в ответ на безболезненные раздражители), тогда как другие тесты, как например, определение поведенческой обусловленности (прим. ред. — привычек), проводятся для оценки влияния анестезии на процессы обучения и памяти.
Шкалы, оценивающие активность ингаляционных анестетиков, основаны на альвеолярных концентрациях анестетиков ( обычно определяются в конце выдоха). Эти концентрации связаны с определенными безусловно рефлекторными («поведенческими») конечными точками (таблица 1). Наиболее широко используемой шкалой является минимальная альвеолярная концентрация анестетика (МАК или МАК-иммобилизация), которая направлена на определение такой концентрации вещества, которая подавляет целенаправленные движения, в ответ на стандартный болевой раздражитель. Всё же чаще аббревиатура МАК используется для обозначения средней альвеолярной концентрации, указывающей на среднее значение для популяции в контролируемых условиях [9]. МАК-иммобилизация усиливается по мере увеличения интенсивности стимула. В аналогичных шкалах активности определяется MAК, которая предотвращает произвольные ответы на голосовые команды (MAК-пробуждение) [12,15], и MAК, необходимая для притупления вегетативных реакций на болевые стимулы (MAК-ПВР) [16].
Таблица 1. Терминология

НЕСПЕЦИФИЧЕСКАЯ ФАРМАКОДИНАМИКА И ЛИПИДНЫЕ ТЕОРИИ ДЕЙСТВИЯ АНЕСТЕТИКОВ
Более века две концепции — унитарная гипотеза и правило Мейера-Овертона — преобладали среди теорий о механизмах, лежащих в основе действия анестетиков. К 1870-м гг. стало известно, что широкий спектр структурно неродственных соединений обладает анестезирующей активностью, и это привело Клода Бернара к предположению об общем механизме действия [17]. Примерно 30 лет спустя Мейер и Овертон выявили выраженную корреляцию между активностью анестетиков и их растворимостью в оливковом масле (рис. 2) [18,19]. Эти две идеи привели к формированию теории о том, что летучие анестетики неспецифически действуют на гидрофобные липидные компоненты клеток.
Большинство исследователей отказались от этой теории, несмотря на ее научную складность, потому что анестетики вызывают лишь незначительные перестройки липидных клеточных структур, которые экспериментально можно воспроизвести небольшими изменениями температуры. Последнее не влияло на поведение животных [20]. Более того, существует большое число исключений из корреляция Мейера-Овертона. Это можно объяснить различиями в размере и ригидности молекулы анестетика и ее полярности [21,22], а также расположением в липидном бислое, что отличается от такового у родственных соединений, не обладающих анестезирующей активностью [23,24]. Интерес к возможной роли липидов и липидно-белковым взаимодействиям в анестезии не иссякает [22], однако для проверки существующих гипотез отсутствуют модели. Кроме того, единый механизм действия у различных структурных классов ингаляционных анестетиков (рис. 1) представляется маловероятным в настоящее время.
ФАРМАКОЛОГИЯ И ЭФФЕКТЫ ИНГАЛЯЦИОННЫХ АНЕСТЕТИКОВ
В ходе исследований был выявлен ряд критически важных исключений из правила Мейера-Овертона и гипотезы единого механизма действия. Например, у гомологичных рядов анестетиков, таких как n-спирты и n-алканы, обнаруживается устойчивое повышение активности по мере включения в их структуру метиленовых (СН2) групп вплоть до пороговой точки, при которой добавление еще одной устраняет анестезирующую активность (т.н. «предел длинноцепочечных спиртов») [25,26]. Кроме того, согласно правилу Мейера-Овертона, вещества-«неиммобилизаторы» — летучие галогенированные алканы, сходные по структуре с летучими анестетиками — оказываются сильнодействующими анестетиками. Однако их иммобилизирующая активность недостаточна, а в некоторых случаях они вызывают судороги [27]. В отличие от традиционного акцента на гидрофобность, анализ молекулярной структуры и активности указал также важную роль электростатических сил и размера самой молекулы на иммобилизирующую активность ингаляционных анестетиков [28- 30].
Путем сравнения фармакологии нескольких анестетиков удалось выявить четкие соотношения между структурой и активностью. Например, соотношение МАК-пробуждения к МАК-иммобилизации для закиси азота и диэтилового эфира значительно выше, чем для некоторых галогенированных летучих анестетиков [12,15]. И поскольку последние вызывают амнезию у животных [31], вероятно, амнестический и иммобилизационный эффекты этих препаратов опосредованы разными механизмами [32]. У людей амнезию и гипноз можно легко отличить клинически, электрофизиологически и фармакологически [33].
ОБЕЗБОЛИВАЮЩЕЕ ДЕЙСТВИЕ НА РАЗЛИЧНЫЕ ОТДЕЛЫ НЕРВНОЙ СИСТЕМЫ
Спинной мозг
Примечательно, что индуцированное анестезией прекращение движений в ответ на боль опосредуется, в первую очередь, спинным мозгом [34]. Благодаря экспериментам на животных удалось выяснить, что для подавления моторных реакций на боль не требуется воздействия анестетиков на головной мозг. У крыс, подвергнутых анестезии, перерезка шейного отдела спинного мозга не приводила к изменению МАК данного анестетика для стимуляции конечностей. Аналогично у коз селективное введение изофлюрана в организм, но не выше продолговатого мозга, также мало влияет на концентрацию, которая препятствует прекращению боли в задних конечностях. Напротив, гипноз и амнезия действуют супраспинально [32].
Общие анестетики уменьшают передачу болевых импульсов от спинного к головному мозгу, тем самым уменьшая супраспинальное возбуждение [35,36]. У коз селективное введение общих анестетиков в туловище (не в головной мозг) замедляет передачу корковых электроэнцефалографических сигналов [37]. Только при введении летучих анестетиков в головной мозг в концентрациях в три раза выше контрольной МАК у коз стимулируется иммобилизация [38]. Таким образом, вполне вероятно, что восходящие сигналы от спинного мозга влияют на гипнотическое действие анестетиков в головном мозге, тогда как нисходящие сигналы модифицируют иммобилизирующее действие анестетиков в спинном мозге.
Головной мозг
Вдыхаемые соединения глобально угнетают кровоток и метаболизм глюкозы в структурах, расположенных выше спинного мозга, а также избирательно угнетают несколько супраспинальных областей [39]. Например, умеренные гипнотические концентрации изофлурана снижают активность мозга, стимулированную каким-либо заданием, в нескольких отдельных областях коры, однако зрительная, моторная кора и подкорковые области остаются неизменными [40]. Региональное поглощение глюкозы у глубоко наркотизированных добровольцев, что видно по томографии, указывает на подавление активности таламуса и ретикулярной формации среднего мозга в большей степени по сравнению с другими областями [41]. Ход вызванных потенциалов с периферии к сенсорной коре свидетельствует о снижении амплитуды у пациентов в глубоком наркозе, вызванном летучими анестетиками. Такое затухание сигнала характеризуется прерывистостью и наблюдается в релейных ядрах таламуса, а также в глубоких слоях коры [35].
Хотя отсутствуют четкие доказательства того, что определенные области мозга оказываются мишенями для ингаляционных анестетиков, внимание ученых обычно сосредоточено на структурах, играющих роль в функциях, восприимчивых к действию анестетиков. Ретикулярная активирующая система, таламус, мост, миндалевидное тело и гиппокамп задействуются в процессах познания, памяти, обучения, сна и внимательности [35,42-45]. Интересно, что состояния сна и наркоза характеризуются общими электроэнцефалографическими и поведенческими особенностями. В обоих случаях наблюдается подавление сенсорных сигналов, торможение моторных реакций и анальгетический эффект [46]. Хотя состояния сна и наркоза по своей сути различны, подкорковые нервные сети, участвующие в генерации первого, могут также опосредовать некоторые анестезирующие эффекты [43, 47]. В недавних исследованиях фокус внимания смещен к туберомаммилярному ядру — ГАМК-модулируемой области гипоталамуса, которая связана с состоянием сна, а также с седативными эффектами некоторых внутривенно вводимых общих анестетиков и, возможно, даже ингаляционных агентов [48].
Большинство ингаляционных анестетиков приводят к общему замедлению, увеличению амплитуды и «доминированию» электроэнцефалографической активности фронтальной коры. Однако хирургическая анестезия не характеризуется электроэнцефалографическими признаками. В результате некоторые измеряемые величины на основе данных ЭЭГ хорошо коррелируют с конечными точками гипноза и иммобилизации (применительно к отдельным агентам). Однако невозможно предсказать глубину анестезии, вызванной любыми ингаляционными анестетиками или комбинациями этих веществ, основываясь на каких-либо измерениях [49]. Тем не менее разобщение когерентной антеропостериорной (движимой спереди-назад) и межполушарной электрической активности устойчиво связано с утратой сознания, индуцированной анестезией (в данном случае это определялось по прекращению счета пациентами во время анестезии) [50].
МОЛЕКУЛЯРНЫЕ ЭФФЕКТЫ ИНГАЛЯЦИОННЫХ АНЕСТЕТИКОВ
Белковые сайты
Давно известно, что общие анестетики взаимодействуют с небольшими полостями большинства глобулярных белков, однако можно выявить значительную избирательность [30, 51, 52]. В серии фундаментальных экспериментов Фрэнкс и Либ обнаружили, что широкий спектр анестетиков ингибирует фермент люциферазу светлячков (у этого фермента отсутствуют липидные кофакторы) в соответствии с правилом Мейера-Овертона [53,54]. Ингибирование люциферазы приводит даже к обрыву длинноцепочечных спиртов, что связано с размером кармана, где происходит связывание анестетика [55]. Важность этих наблюдений заключается в демонстрации того, что белковые сайты также могут влиять на действие общих анестетиков [25,56]. Хотя анестетики изменяют функции различных цитоплазматических сигнальных белков, например, протеинкиназы С [57,58], именно ионные каналы считаются наиболее вероятными молекулярными мишенями анестетиков.
Влияние анестетиков на ионные каналы
Ионные каналы — это белки, которые регулируют поток ионов через цитоплазматическую мембрану. Различные ионные каналы, модулирующие электрическую активность клеток, связаны с поведенческими или же физиологическими эффектами анестетиков (табл. 2). Некоторые из этих каналов чувствительны к различным ингаляционным анестетикам (табл. 3). В их число в клинически эффективных концентрациях входит надсемейство нейротрансмиттерных рецепторов «цистеиновой петли» (никотиновые ацетилхолиновые, серотониновые 3-го типа, ГАМКА и глициновые рецепторы, глутаматные рецепторы, которые активируются N-метил-d-аспартатом (NMDA) или амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислотой (AMPA)) [81-84]. В структуре синапсов ионные каналы могут влиять на пресинаптическое выделение нейротрансмиттеров и изменять постсинаптическую возбудимость в ответ на это. Также потенциал-зависимые ионные каналы для натрия, калия и кальция чувствительны к некоторым ингаляционным анестетикам, но в более высоких концентрациях по сравнению с теми, которые используются в клинических условиях [82]. Рабочей гипотезой является усиление ингаляционными анестетиками ингибиторный потенциал постсинаптических каналов (ГАМКА и глициновые рецепторы) и подавление ими возбуждающей активности синаптических каналов (н-холиновые, серотониновые и глутаматные рецепторы) (рис. 3). Наибольшее внимание привлекли анестезирующие эффекты на рецепторы ГАМКА.
ГАМКА-рецепторы
Рецепторы ГАМКА являются наиболее распространенными рецепторами тормозных нейротрансмиттеров в головном мозге. Каждый рецептор — это гетеромерный трансмембранный белковый комплекс, открывающий проницаемую для хлоридов пору в ответ на связывание ГАМК (рис. 3). В геноме человека содержится, по крайней мере, 18 различных генов субъединиц ГАМКА-рецепторов. И хотя считается, что большинство рецепторных комплексов содержат комбинации субъединиц a, b и g, их разные сочетания могут образовывать функциональные каналы, а само распределение различных типов (молекулярная нейроанатомия) субъединиц не является однородным [85]. В клинически эффективных концентрациях после импульса высвобождения ГАМК общие анестетики повышают чувствительность рецепторов к этому медиатору и продлевают опосредованный рецептором ингибирующий ток (рис. 3). Это еще больше усиливает опосредованное ГАМКА-рецептором ингибирование постсинаптической возбудимости нейронов [86].
Эффективность, с которой летучие анестетики усиливают функцию ГАМКА-рецепторов in vitro, аналогична МАК-иммобилизации [87]. Многие другие классы общих анестетиков также усиливают реакции ГАМКА [59,88], однако «неиммобилизаторы» не способны на это [89]. Результаты позитронно-эмиссионной томографии у людей свидетельствуют о зависимой от концентрации анестетика модуляции ГАМКА-рецепторов в головном мозге параллельно усиленным ответам ГАМК-рецепторов in vitro [90]. Эти наблюдения подтверждают центральную роль ГАМКА-рецепторов в развитии анестезирующего эффекта и, как казалось до недавнего времени, предполагали общий механизм для всех ингаляционных анестетиков.
Другие ионные каналы
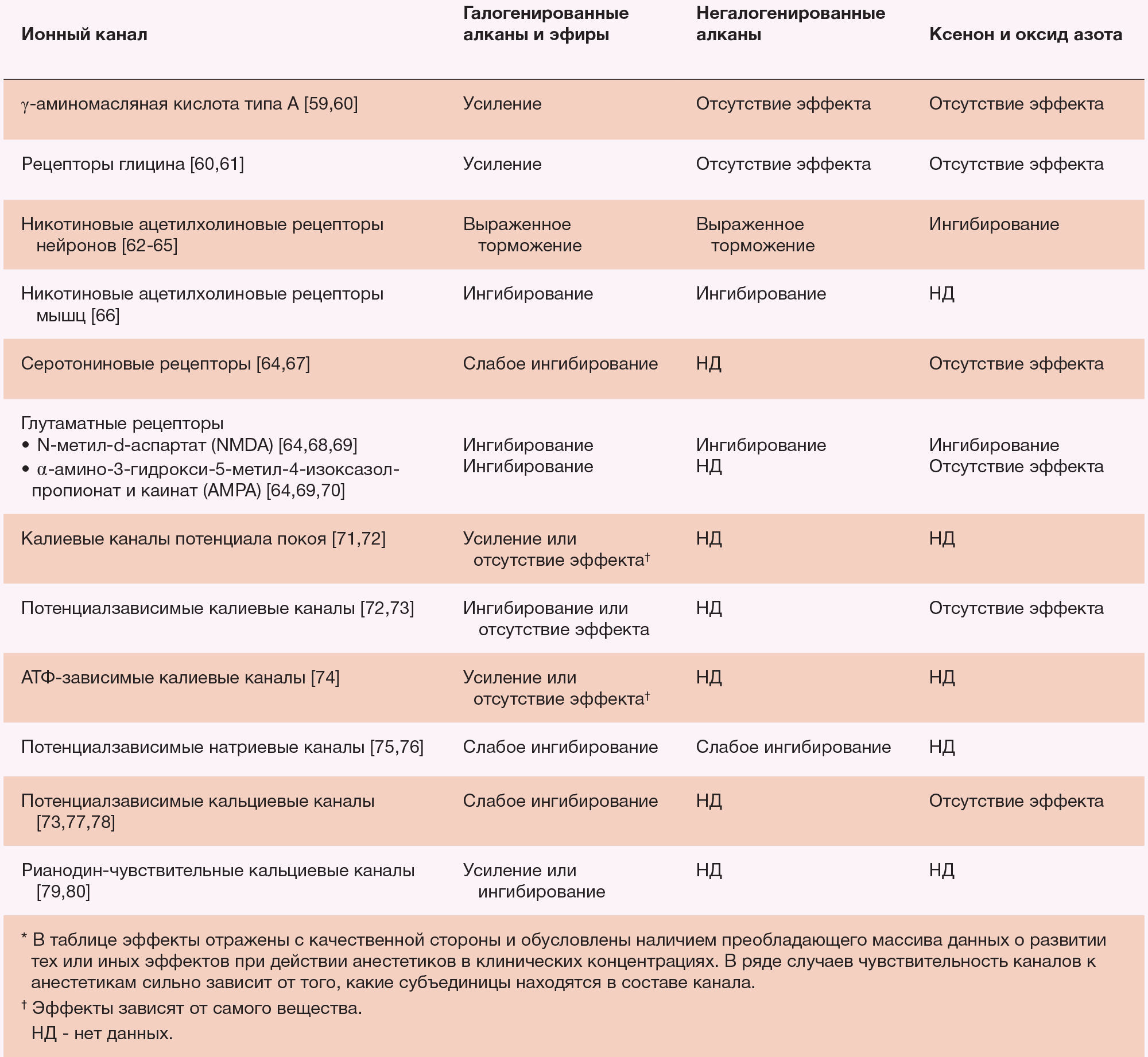
Модуляция ГАМКА-рецепторов, однако, не является ни необходимой, ни достаточной для объяснения каждого эффекта всех общих анестетиков (таблица 3). Газообразные анестетики ксенон и оксид азота лишь минимально усиливают ГАМК-опосредованные токи in vitro [64,83,91], и даже высокие концентрации циклопропана и бутана не изменяют функцию ГАМКА-рецепторов [65]. Очевидно, что эти ингаляционные анестетики не действуют непосредственно через ГАМК-опосредованные механизмы. Напротив, в клинических концентрациях эти газы ингибируют NMDA-чувствительные глутаматные каналы и нейрональные н-холинорецепторы. Это позволяет предположить, что возбуждающие лиганд-зависимые ионные каналы опосредуют альтернативный путь анестезии.
Помимо рецепторов ГАМКА, другие ионные каналы, по всей видимости, играют роль в иммобилизации, вызванной анестезией. В двигательных нейронах спинного мозга летучие анестетики усиливают активность тормозных глициновых рецепторов [69,92] и ингибируют постсинаптические АМРА- и NMDA-рецепторы [93]. Ингибирование рецепторов глутамата является прямым и не связано с усилением тормозных потоков ГАМК [93].
Отдельные ионные каналы могут опосредовать различные поведенческие и физиологические эффекты ингаляционных анестетиков. Ингаляционные анестетики в низких концентрациях замедляют никотиновые ацетилхолиновые рецепторы нейронов, вызывая амнезию, но не иммобилизацию. Также обстоят дела с летучими «неиммобилизаторами» [63,94,95]. Ингибирование этих рецепторов анестетиками, по всей видимости, ухудшает память и обучение [96], однако не ведет к иммобилизации. Считается, что ингибирование анестетиками калиевых и кальциевых каналов в сердце лежит в основе отрицательного хроно- и инотропного действия, а также их проаритмогенных эффектов [97-99]. Относительная стабильность сердечно-сосудистой функции у пациентов под ксеноновой анестезией по сравнению галогенирующими соединениями, коррелирует с более слабым ингибированием ксенона как тока кальция по каналам L-типа, так и потенциал-зависимого калиевого тока в сердечных миоцитах [73]. Эффективность, с которой анестетики вызывают ишемическое прекондиционирование (прим. ред. — повышение устойчивости к ишемии) миокарда также коррелирует с их действием на АТФ-чувствительные калиевые каналы [74].
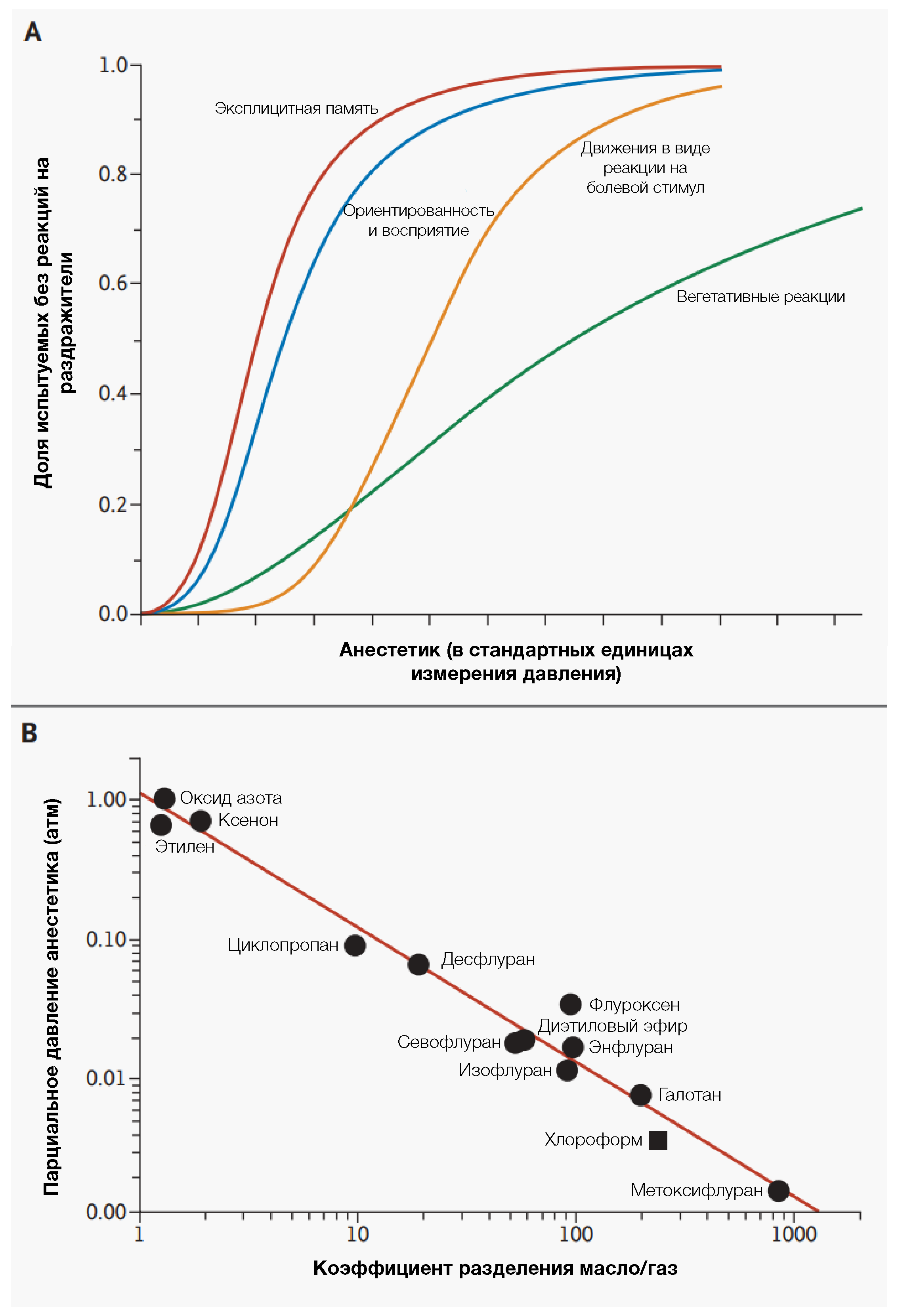
Рисунок 2 | Эффективность ингаляционных анестетиковВажные эффекты ингаляционных анестетиков достигаются при различных концентрациях. График А иллюстрирует общую связь между концентрацией анестетика в конце выдоха и четырьмя его эффектами. «Отключение» эксплицитной памяти и реакции на произносимые команды (т.е гипноз) происходит при более низких концентрациях анестетика, чем при тех, что предотвращают моторные реакции в ответ на болевые стимулы (хирургический разрез), а блокада вегетативных реакций на боль требует очень глубокой анестезии. Чувствительность к ингаляционным анестетикам у людей варьируется, а характер кривых зависимости реакции от концентрации отражает индивидуальные реакции. График B иллюстрирует сильную корреляцию между эффективностью анестетика (относительно единственной конечной точки) и гидрофобностью анестетиков, показанных на рисунке 1, что полностью согласуется с правилом Мейера-Овертона. Парциальное давление вдыхаемых анестетиков, необходимое для предотвращения моторных реакций на разрез у людей, то есть средняя альвеолярная концентрация или MAК-иммобилизация, изображено на графике, в зависимости от коэффициента разделения «оливковое масло-газ». Сведения по хлороформу основаны на исследованиях на животных. Сильная (r = 0,99) корреляция между МАК-иммобилизацией и разделением анестетика между масляной и газовой фазами (т.е. мерой гидрофобности) может быть расширена (в размахе в 100 000 раз) за счет введения других веществ, которые, однако, не подходят для клинического использования (например, азот и тиометоксифлуран). Согласно этой корреляции можно заключить, что большинство анестетиков действуют на один или несколько гидрофобных участков. Хотя такая закономерность характерна для большинства анестетиков, правило Мейера-Овертона не может объяснить отсутствие анестезирующей активности у некоторых родственных гидрофобных соединений.
Таблица 2. Значение некоторых ионных каналов, чувствительных к анестетикам, для процессов клеточной возбудимости и физиологических и поведенческих реакций; аспекты фармакологии этих веществ.
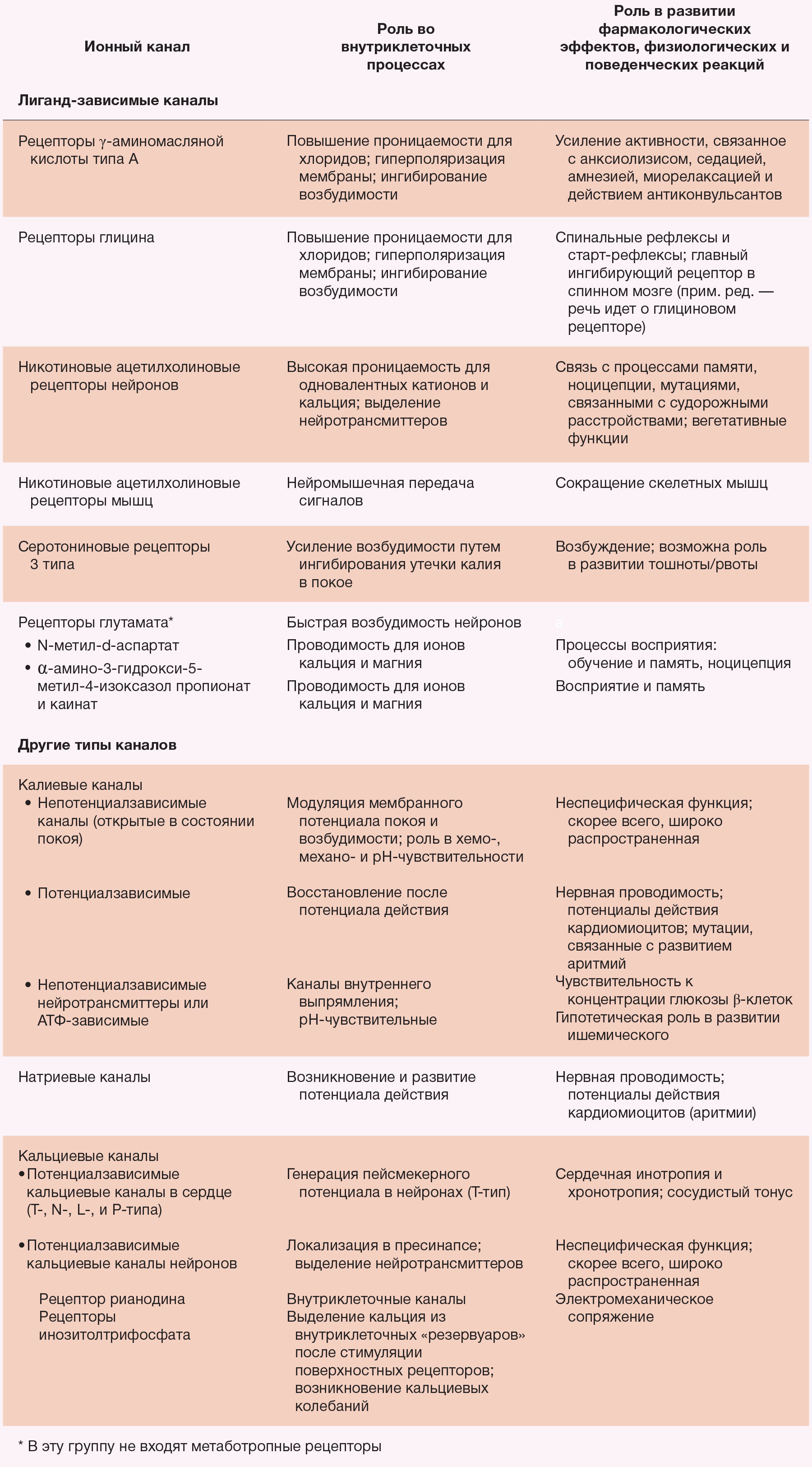
Таблица 3. Функциональные эффекты различных классов ингаляционных анестетиков на ионные каналы*.
Сайты связывания анестетиков на белках ионных каналов
Поскольку ионные каналы функционируют в составе липидных мембран, трудно определить каким образом анестетики модулируют их работу: косвенно — т.е. изменениями в структуре мембраны или непосредственно — связываясь с белками каналов. Детальнее всего удалось локализовать белковый сайт на периферическом н-холинорецепторе, структурном гомологе никотиновых ацетилхолиновых и ГАМКА-рецепторов нейронов (рис. 3). Обратимое связывание общего анестетика с радиоактивной меткой удалось продемонстрировать на примере высокоочищенных периферических н-холинорецепторов [100]. Прерывание анестетиками открытия единичных каналов н-холиновых рецепторов согласуется с прямым блокирующим механизмом, но не с непрямым механизмом (например, опосредованным липидами) [66]. Также была продемонстрирована конкуренция между двумя анестетиками за ингибирующий сайт связывания на открытых каналах н-холиновых рецепторов [101]. В экспериментах, посвященных мутагенезу, электрофизиологическим механизмам и фотомечению, удалось выяснить пространственное расположение ингибирующего сайта связывания и поры никотинового ацетилхолинового рецептора [102,103]. Для гомологичного рецептора ГАМКА также были определены сайты связывания, которые, похоже, являются критически важными для модуляции эффекта летучих анестетиков [104,105]. Они расположены в нескольких трансмембранных доменах, которые могут образовывать один карман связывания (рис. 3).
КОМПЛЕКСНЫЕ МОДЕЛИ МЕХАНИЗМОВ АНЕСТЕЗИИ
Связь влияния ингаляционных анестетиков на специфические ионные каналы с физиологическими (в т.ч. и поведенческими) эффектами общей анестезии — сложная задача, поскольку влияние нейронных биологических сетей на поведение остается неизвестным. В основе интеграции этих сетей лежит сложная пространственная организация, разнообразие синаптических нейротрансмиттеров и других сигнальных путей, а также динамические варианты возбудимости и частотности отклика на стимулы. Следовательно, роль определенного класса ионных каналов в поведении животного, как целостного организма, предсказать чрезвычайно трудно. Действие ингаляционных анестетиков исследовано на нескольких уровнях нервных сетей мозга — от простых до сложных.
Синаптические механизмы
Основа активности всей сети нервных клеток заключается в двух функциях: аксональной проводимости и синаптической передаче. Ингаляционные анестетики в клинических концентрациях влияют на последнюю гораздо сильнее, чем на первую. Ингаляционные анестетики как угнетают возбуждающие синапсы, так и усиливают тормозные [106]. Исследования количественной оценки пресинаптических и постсинаптических эффектов анестетиков продемонстрировали влияние как на выделение нейротрансмиттеров, так и на функцию их рецепторов, где анестетики действовали более выраженно [106]. Кроме того, некоторые летучие анестетики вызывают гиперполяризацию и снижение возбудимости нейронов за счет усиления фоновой активности калиевых каналов [107,108].
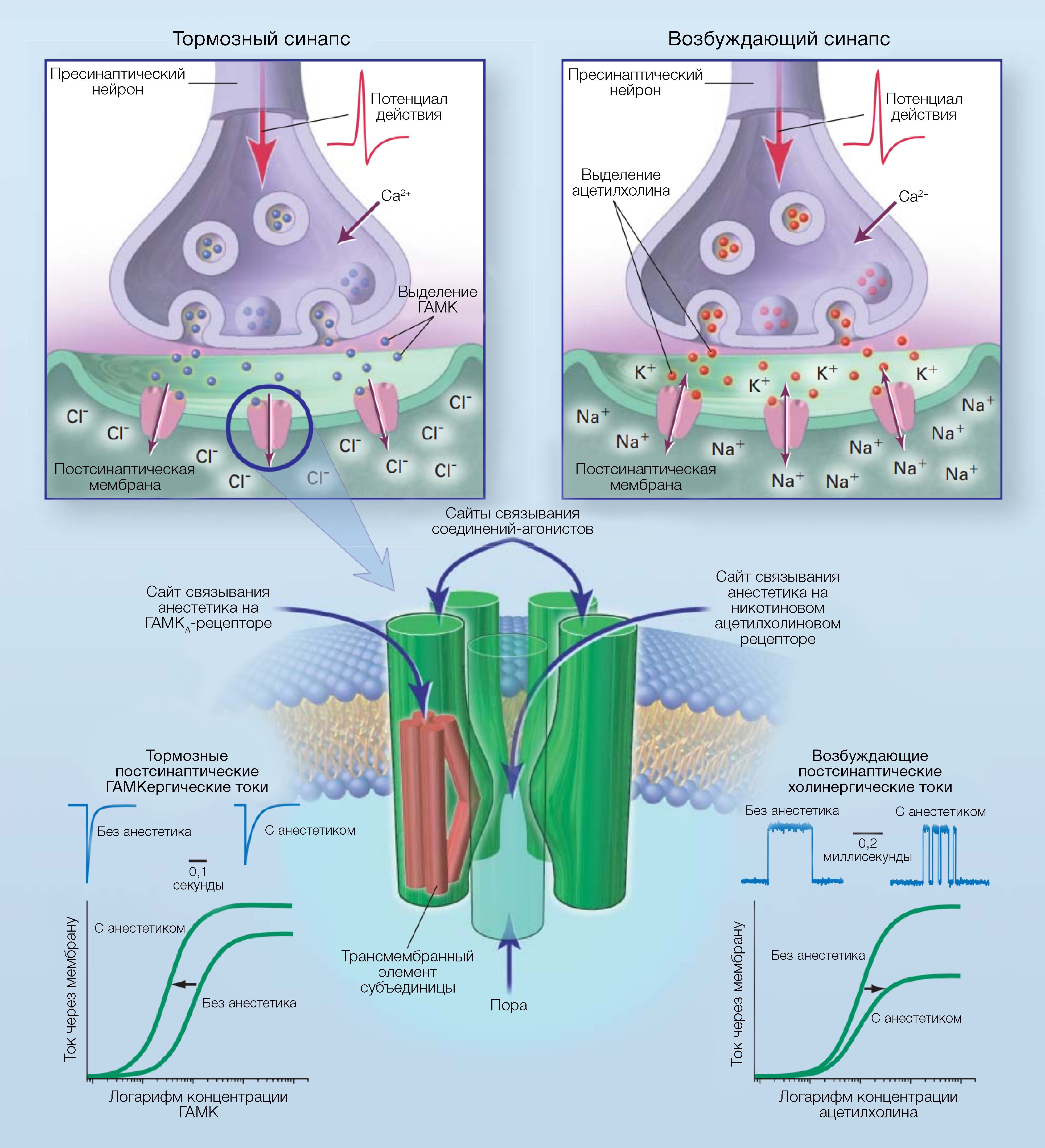
Рисунок 3 | Сайты связывания анестетиков на лиганд-зависимых ионных каналах.Два структурно родственных, однако функционально противоположных друг другу постсинаптических канала реагируют на анестетики противоположным образом и, по всей видимости, обладают сайтами связывания анестетиков, расположенными в разных областях. На центральном рисунке показаны структурные особенности гомологичного рецептора гамма-аминомасляной кислоты типа А (ГАМКА) и н-холинорецептора. Каждый рецептор содержит пять субъединиц (на рисунке, передняя удалена для ясности), которые пересекают липидный бислой мембраны и располагаются вокруг центрального ионного канала. Считается, что каждая субъединица имеет четыре трансмембранных элемента, как показано на примере самой левой субъединицы на рисунке. Полагают, что сайты связывания агонистов находятся на границах раздела субъединиц во внеклеточных частях рецепторов. На верхней правой части рисунка изображены н-холинорецепторы: это — возбуждающие каналы, проницаемые для катионов. Вследствие их активации происходит деполяризация нейронов и миоцитов, повышая вероятность образования потенциалов действия. На нижней правой части рисунка изображены возбуждающие постсинаптические токи, активируемые ацетилхолином, которые неконкурентно ингибируются анестетиками. Также анестетики вызывают частое закрытие или блокирование открытия каналов (в случае одноканальных токов ионов). Мутации, которые приводят к изменению гидрофобности порообразующих областей н-холинорецепторов мышц, изменяют чувствительность к ингибированию данной группы препаратов, и фотоактивируемые анестетики способны ковалентно связываться с этой областью. На верхней левой части рисунка изображены ГАМКА-рецепторы. Они представляют собой ингибирующие каналы, проницаемые для анионов хлора. Их активация приводит к гиперполяризации нейронов, снижая вероятность генерации потенциалов действия. На нижней левой части рисунка изображены тормозные постсинаптические токи, активируемые ГАМК, и функционирование которых продлевается анестетиками, что приводит к избыточному притоку хлоридов и снижению возбудимости. Кривые зависимости между концентрацией ГАМК и реакцией смещаются влево, так что сниженные концентрации ГАМК в спинномозговой жидкости могут приводить к утечке хлоридов посредством внесинаптических ГАМК-рецепторов, подавляющих возбуждение нейронов. Исследования на химерных моделях и на примере организмов с аминокислотными мутациями позволяют предположить, что между анестетиками на ГАМКА-рецепторах происходит некое взаимодействие на сайтах связывания, образуемых между несколькими трансмембранными элементами.
Нейронные сети in vivo и in vitro
Технически сложно определить влияние ингаляционных анестетиков на нервные сети in vivo, потому что для надежной электрофизиологической регистрации у животных часто требуется седация другими анестетиками [109]. Во многих исследованиях in vitro регистрировалась электрическая активность в срезах головного или спинного мозга, за счет которой поддерживались локальные синаптические взаимодействия. Небольшие срезы коры с интактными локальными нервными сетями демонстрируют синхронизацию электрических ритмов. Последние могут быть замедлены либо усилением ГАМК-опосредованной передачи, либо ингибированием глутамат-опосредованной передачи общими анестетиками [110]. Вероятно, влияние анестетиков на частоты [передачи импульсов] локальных корковых сетей напрямую замедляет электроэнцефалографическую активность. С другой стороны, длинные (например, таламокортикальные) цепи координируют ритмическую активность между отдаленными областями мозга [41]. Влияние анестетиков на ритмическую частоту работы этих сетей может зависеть от скорости затухания ингибирующих потенциалов, опосредованных ГАМКА-рецепторами [111]. А ингаляционные анестетики продляют эти потенциалы (табл. 3). Гиппокамп и спинной мозг также содержат цепи, которые, по всей видимости, играют свою роль в амнестическом и иммобилизационном эффектах общих анестетиков [69,110].
Анализировать сильно упрощенные нейронные схемы оказалось удобнее. Влияние ингаляционных анестетиков на дыхание исследовалось путем регистрации активности каудально-вентральных дыхательных нейронов продолговатого мозга у собак, подвергнутых децеребрации [112,113]. Клинически эффективные концентрации ингаляционных анестетиков изменяют как глутамат-опосредованные, так и ГАМК-опосредованные сигналы, идущие к стимулирующим нейронам; севофлуран снижает выходную активность двигательных нейронов в большей степени, чем галотан [112]. Это соответствует клиническим наблюдениям: севофлуран угнетает дыхание в большей степени, чем галотан [114].
ГЕНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ ЭФФЕКТОВ ИНГАЛЯЦИОННЫХ АНЕСТЕТИКОВ
Генетические эксперименты с животными моделями — еще один метод исследования связей между потенциальными мишенями анестетиков и их поведенческими эффектами. Применяются два подхода: скрининг мутаций в селективно выведенных популяциях и создание животных с мутациями в предполагаемых целевых участках [115].
Генетический скрининг
В ходе селекционного размножения и крупномасштабного скрининга мутаций плодовых мушек (Drosophila melanogaster) и нематод (Caenorhabditis elegans) удалось выявить штаммы с измененной чувствительностью к анестетикам [116–120], однако релевантность этих данных в контексте людей сомнительна, поскольку для достижения некоторых физиологических (поведенческих) конечных точек требуются концентрации анестетиков, которые сильно превышают значения МАК у млекопитающих. Селекционное разведение и скрининг устойчивых к анестезии популяций мышей — многообещающий подход, однако идентифицировать специфические гены-мишени в ходе экспериментов до сих пор не удалось [121-123].
Исследования на генетически модифицированных млекопитающих
Исследования нокаута генов
Для оценки роли двух лиганд-зависимых ионных каналов в развитии анестезирующих эффектов применялись животные, у которых специфические гены были подвергнуты нокауту. Этими ионными каналами являются: AMPA-чувствительный рецептор глутамата и ГАМКА-рецептор. Для исследования была выбрана субъединица GluR2 AMPA-рецепторов, поскольку это наиболее распространенная субъединица, определяющая чувствительность к анестетикам in vitro [93,124]. У мышей с нокаутом гена GluR2 МАК летучих соединений не изменялась, чувствительность к потере установочных рефлексов оказалась умеренно повышена, а ноцицепция была усилена [125]. Гены субъединиц b3 и a6 ГАМКА-рецепторов были взяты в качестве объектов изучения из-за их паттернов экспрессии в головном мозге и чувствительности к анестезии, которая формируется у рецепторов, содержащих различные типы субъединиц, in vitro [126]. У мышей с нокаутом гена b3 ГАМКА-рецептора МАК энфлурана оказалась снижена, однако чувствительность к утрате рефлекса выпрямления не изменялась [127-129]. У животных с нокаутом гена а6 ГАМКА-рецептора не было каких-либо изменений МАК ингаляционных анестетиков и чувствительности к потере рефлекса выпрямления [130].
Возникают различные вопросы при исследованиях на таких мышах с генетическим нокаутом. Во-первых, чувствительность к анестетикам, определяющаяся на основе утраты рефлексов выпрямления и MAК-иммобилизации, по-разному влияла на генетические изменения. Это свидетельствует о том, что различные формы поведенческие реакции [или отсутствие таковых], вызванные анестезией, опосредуются различными механизмами. Во-вторых, механизмы, которые опосредуют даже одну конечную точку, например, иммобилизацию, являются комплексными и зависят от самого соединения. Нокаут гена b3 ГАМКА-рецептора снижает МАК энфлурана, однако гораздо меньше влияет на МАК галотана и вообще не влияет на индуцированную энфлураном депрессию вызванных потенциалов спинальных двигательных нейронов [127,129]. Данные о мышах с нокаутом генов ГАМКА-рецепторов также указывают на то, что специфические типы рецепторных субъединиц, особенно b3, могут играть ведущую роль в развитии некоторых анестетических эффектов. Были выведены генетические линии мышей, у которых субъединицы a1, b2 и d ГАМКА-рецепторов были инактивированы, однако о чувствительности этих животных к ингаляционным анестетикам пока не сообщалось.
Исследования по «включению» генов
Выключение экспрессии гена субъединицы ионного канала может вызвать изменения в составе субъединиц, всей сети нейронов или и того, и другого [131]. Появление специфичных мутаций в нативных генах (т.н. животные с «включенными генами») позволяет избежать таких нежелательных эффектов и оценить физиологическую и фармакологическую роль конкретных белков и даже небольших фрагментов внутри самих белков. Успех данного подхода стал очевиден после недавних открытий роли специфических субъединиц ГАМКА-рецепторов в развитии механизма действия бензодиазепинов, некоторые эффекты которых вполне сходны с поведенческими реакциями от общих анестетиков [132]. Животные модели с «включенными» генами также применялись для изучения роли ГАМКА-рецепторов в развитии эффектов наркоза. При внутривенном введении мышам этомидата индуцировалась мутация в гене субъединицы b3 рецептора ГАМКА, которая ослабила модуляцию синаптической передачи in vitro. У этих животных чувствительность к этомидату была резко снижена относительно конечных точек прекращения передачи ноцицептивных сигналов и потери установочных рефлексов, в то время как чувствительность к летучим анестетикам оказалась лишь умеренно снижена (по МАК) или же изменений не было (относительно утраты установочных рефлексов) [133]. Это свидетельствует о роли субъединицы b3 в определении MAК и согласуется с исследованиями in vitro, где мутации в субъединицах a оказывают большее влияние на чувствительность ГАМКА-рецепторов к ингаляционным анестетикам, чем мутации в субъединицах b [104]. Ожидается, что исследования с использованием животных с нокаутом специфичных генов и с мутациями субъединицы а выведут на новый уровень наше представление роли ГАМКА-рецепторов в механизмах действия ингаляционных анестетиков.
ЗАКЛЮЧЕНИЕ
Упрощение концепций, как например, унитарная гипотеза, привело к тому, что фокусом ранних исследований анестезии были неспецифические биофизические механизмы. Пересмотр действия анестетиков на различных уровнях нейробиологических систем выявил новые важные аспекты механизмов, которые противоречат ранним «неспецифическим» гипотезам. Таким образом, хотя все ингаляционные общие анестетики вызывают амнезию и подавляют двигательные реакции на болевые стимулы, их действие на другие поведенческие и физиологические реакции разнится. Подавление ноцицептивных двигательных реакций этой группой препаратов опосредуется в спинном мозге, тогда как гипноз и амнезия в головном. Также эти эффекты могут быть связаны с отдельными молекулярными мишенями. Важные действия ингаляционных анестетиков связаны с изменением активности ионных каналов нейронов, особенно рецепторов быстрых синаптических нейротрансмиттеров (никотиновых ацетилхолиновых, ГАМКА— и глутаматных рецепторов). Растет доказательная база того, как анестетики влияют на ионные каналы нейронов, взаимодействуя с сайтами связывания на белках. Различные ионные каналы демонстрируют поразительно уникальную чувствительность к ингаляционным анестетикам, что свидетельствует об их участии в разных физиологических и поведенческих эффектах препаратов, и что многие молекулярные механизмы действия характеризуются конвергентностью, что и приводит к сходным состояниям наркоза. Различия в распределении ионных каналов и их специфических субъединиц, по всей видимости, влияют на специфические поведенческие эффекты ингаляционных анестетиков. Такой новый взгляд на нейробиологические эффекты ингаляционных анестетиков предполагает, что эти широко используемые препараты должны совершенствоваться путем рационализации их химической структуры.





