Резюме: В последние годы антикоагулянты и антиагреганты все чаще применяются для профилактики и лечения ряда сердечно-сосудистых заболеваний. Вследствие роста использования антитромботических препаратов и сложности конкретных клинических случаев, требующих такой терапии, кровотечения остаются основной проблемой у данной группы пациентов. К прямым пероральным антикоагулянтам (ППАК) относятся ривароксабан, апиксабан, эдоксабан и бетриксабан (не зарегистрирован в России). К прямым ингибиторам тромбина (ПИТ) относятся дабигатран, аргатробан (не зарегистрирован в России) и бивалирудин (в настоящее время государственная регистрация препарата в России отменена). По сравнению с варфарином ППАК связаны с более низкими рисками летального исхода, опасных для жизни состояний и значительных кровотечений. В условиях неотложной помощи может быть показана немедленная отмена этих препаратов. Рекомендации по отмене антитромботической терапии все еще находятся в разработке. Для отмены действия варфарина можно использовать витамин К и концентраты протромбинового комплекса (КПК). Андексанет-альфа (не зарегистрирован в России) и идаруцизумаб представляют собой специфические препараты для отмены ППАК и ПИТ соответственно. Протамина сульфат является единственным утвержденным средством при отмене нефракционированного гепарина (НФГ) и низкомолекулярных гепаринов (НМГ). Однако специфических реверсивных агентов для антиагрегантной терапии не существует. Цель этой статьи — предоставить практическое руководство для врачей по отмене антикоагулянтов и антиагрегантов на основе последних исследований.
1. Введение
В последние годы антиагреганты и антикоагулянты все чаще применяются для профилактики и лечения ряда осложнений сердечно-сосудистых заболеваний, таких как тромбоэмболия легочной артерии, тромбоз глубоких вен, фибрилляция предсердий, тромбоз механического клапана сердца и острый коронарный синдром [1]. Более того, за последние несколько лет расширилась роль антиагрегантной терапии в качестве первичной или вторичной профилактической стратегии; теперь она, помимо пациентов с острым коронарным синдромом и заболеваниями периферических артерий, охватывает лиц с ишемическими инсультами легкой степени тяжести. Широкое использование антикоагулянтов и антиагрегантов сопряжено с предотвратимым риском незначительных и больших кровотечений [2]. Кроме того, увеличивается число госпитализаций и обращений в отделения неотложной помощи из-за кровотечений, вызванных антикоагулянтной терапией [2]. Такой риск кровотечения может значительно увеличивается у отдельных групп пациентов, у которых есть убедительные показания к комбинированной терапии, состоящей из антикоагулянта плюс антиагрегантного средства или двойной антиагрегантной терапии [3]. При применении таких препаратов в качестве монотерапии наибольший риск кровотечения несет прием варфарина или аспирина [3].
Варфарин представляет собой антикоагулянт непрямого действия — это антагонист витамина К, который ингибирует комплекс 1 эпоксидредуктазы витамина К (VKORC1), снижающей активность зависимых от витамина K факторов свертывания крови. Ривароксабан, апиксабан и эдоксабан проявляют антикоагулянтный эффект за счет ингибирования фактора Ха.
Низкомолекулярные гепарины (НМГ; первого поколения — эноксапарин, надропарин и дальтепарин; второе поколение — бемипарин) и нефракционированный гепарин (НФГ) инактивируют тромбин и фактор Ха через антитромбин-зависимые механизмы. Фондапаринукс служит ингибитором фактора Ха. Аргатробан, бивалирудин и дабигатран являются ингибиторами тромбина [4, 5].
Читайте также: антикоагулянты (плакат)
Антиагреганты подразделяются на две основные категории в зависимости от механизма ингибирования агрегации тромбоцитов: необратимое ингибирование осуществляют прасугрел, клопидогрел и аспирин, а обратимое — тикагрелор.
Для предотвращения смертельных исходов из-за жизнеугрожающих массивных кровотечений очень важно устранить антикоагулянтный и антиагрегантный эффект препаратов при необходимости [3]. Глубокое понимание влияния антитромботических препаратов на результаты различных тестов свертываемости крови важно для мониторинга реверсивной терапии (таблица 1) [3].
Таблица 1 | Влияние антикоагулянтов на результаты анализов свертываемости крови
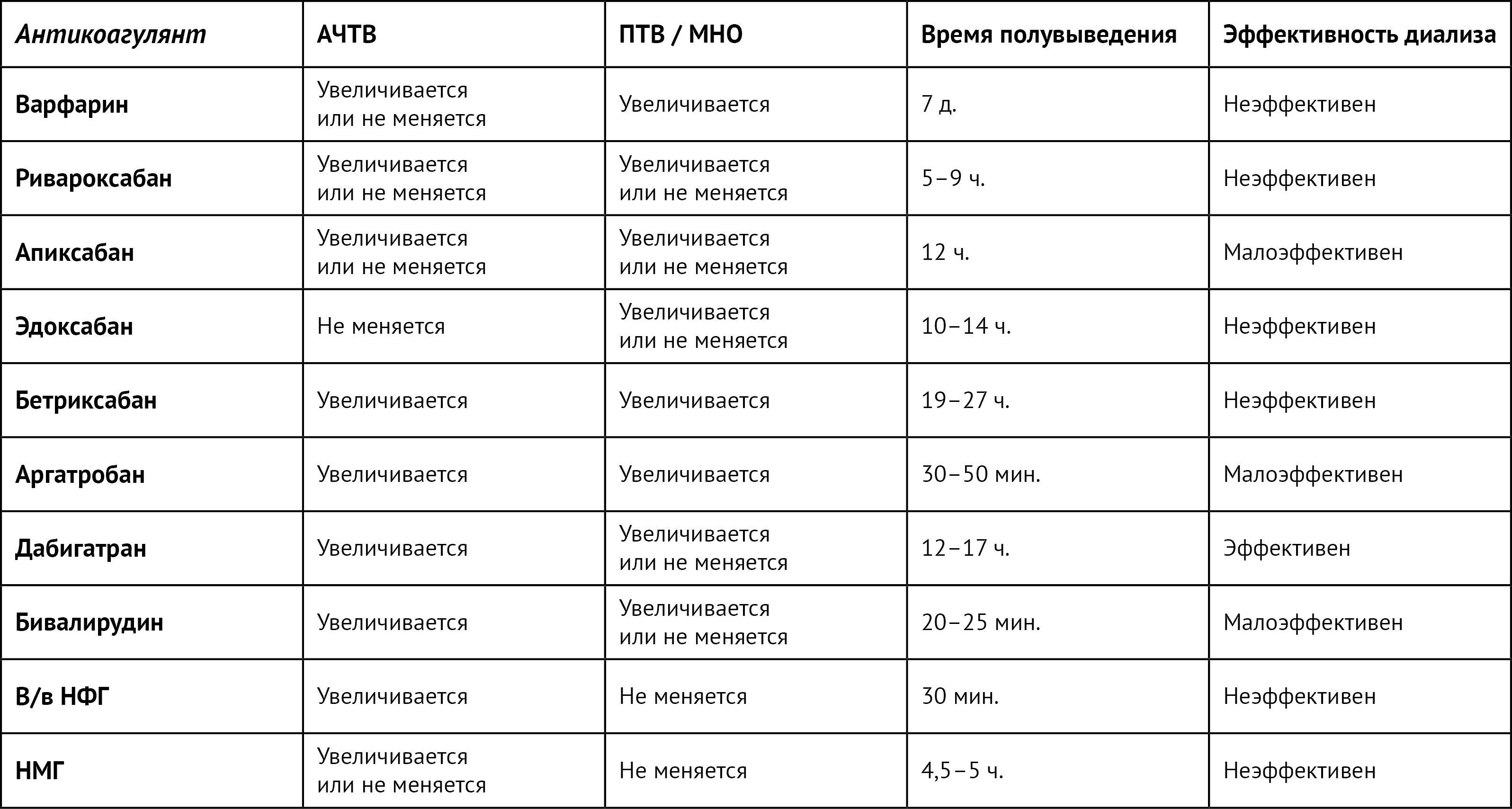
В/в — внутривенно; НФГ — нефракционированный гепарин;
НМГ — низкомолекулярный гепарин; АЧТВ — активированное частичное время свертывания тромбопластина;
ПТВ — протромбиновое время; МНО — международное нормализованное отношение.
Применяемые в настоящее время тесты для оценки свертывающей системы крови имеют ряд ограничений: например, они могут быть недостоверными при критических состояниях, не позволяют оценить функцию тромбоцитов и активность компонентов каскада свертывания крови; кроме того, требуется длительное время, чтобы фармакологическое действие препаратов повлияло на результаты тестов [6]. Вискоэластография (ВЭ), включая тромбоэластографию (TЭГ) и ротационную тромбоэластометрию (РОТЭМ), в настоящее время широко используются в клинической практике для преодоления этих практических проблем, связанных с применяемыми в настоящее время тестами на свертываемость крови [6]. ВЭ включает тромбоэластографию (ТЭГ) и ротационную тромбоэластометрию (РОТЭМ) [6]. Оба метода позволяют проводить качественную и количественную оценку коагулопатий и измерять степень фибринолиза [6]. ВЭ может облегчить выбор направленного подхода к стратегиям отмены антитромботических средств [6]. Тем не менее, при ВЭ происходит только оценка свертывания крови in vitro, и не учитываются другие сопутствующие факторы, такие как свойства кровотока, размер поврежденного сосуда и анатомия его стенки, которые определяют мембраносвязанные про- и антикоагулянтные факторы. Кроме того, ВЭ требует дополнительных ресурсов и квалифицированного персонала для проведения и интерпретации всех анализов. Цель этой статьи — предоставить практическое руководство для клиницистов по отмене действия антикоагулянтов и антиагрегантных средств на основе новейших исследований (рис. 1).
2. Специфические стратегии отмены
2.1. Антиагрегантные препараты
Время восстановления агрегации тромбоцитов (после последней дозы препарата, принятой пациентом) варьируется в зависимости от антиагрегантных препаратов. Как правило, для аспирина, клопидогрела и тикагрелора оно составляет примерно четыре-пять дней, однако для прасугрела это около семи дней [7]. Хотя данные ограничены и противоречивы, сообщалось об использовании нескольких реверсивных агентов при больших и малых кровотечениях у пациентов, получавших антиагрегантную терапию. К таким средствам относятся десмопрессин, антифибринолитическая терапия и переливание тромбоцитарной массы. Режимы дозирования реверсивных агентов обобщены в таблице 2.
2.1.1. Десмопрессин
Десмопрессин вызывает высвобождение фактора VIII и фактора фон Виллебранда, что приводит к последующему улучшению адгезии тромбоцитов к дефектам эндотелия [8]. Это препарат с относительно безопасным лекарственным профилем. Однако после повторного приема десмопрессин может привести к отекам [8]. Применение десмопрессина при отмене антиагрегантной терапии вызывает вопросы (следует помнить, что на на территории России такое показание не указано в инструкции по применению десмопрессина). Небольшое ретроспективное исследование (n = 14) в группе пациентов с внутримозговым кровоизлиянием (ВМК), которые принимали аспирин, показало, что десмопрессин приводил к статистически значимому уменьшению времени агрегации тромбоцитов в пробе с адреналином (со 192 ± 18 до 124 ± 15 с) [9]. Кроме того, активность антигена к фактору фон Виллебранда увеличилась с 242 ± 96 % до 289 ± 103 % (p = 0,004), и только у двух пациентов развились гематомы [9]. В более крупном исследовании с участием 55 пациентов, получавших десмопрессин, отмечалось, что препарат значительно снижал частоту возникновения ВМК (10,9 % по сравнению с 36,2 %) [10]. Сходные результаты были получены у пациентов с черепно-мозговой травмой (ЧМТ) [11]. В другом исследовании прием десмопрессина до операции аортокоронарного шунтирования у пациентов, получающих аспирин, значительно уменьшил объем крови, отделяемой по плевральным дренажам, и общей кровопотери [12].
Читайте также: Клиническая химия: гемостазиология
2.1.2. Переливание тромбоцитарной массы
Введение в систему кровообращения дополнительных и неингибированных тромбоцитов с помощью переливания имеет теоретическое преимущество для реверсии антиагрегантной терапии [13]. Переливание тромбоцитарной массы сопряжено с риском возникновения гиперволемии, анафилактических и гемолитических реакций, острого посттрансфузионного повреждения легких (TRALI-синдрома) [13].
Одно из ключевых исследований исходов геморрагических инсультов у пациентов, принимавших антиагреганты (PATCH trial), показало, что вероятность смерти или необходимости в уходе через три месяца была статистически значимо выше в группе переливания тромбоцитарной массы, чем контрольной группе (здесь мы исправили ошибку авторов обзора, которые указали, что у пациентов вероятность смерти или необходимости в уходе была статистически значимо ниже в группе переливания тромбоцитарной массы, см. оригинальное исследование. — Прим. ред.) [14]. Однако пациентам, включенным в исследование, не проводились нейрохирургические вмешательства. Кроме того, в данном исследовании среди пациентов, которым проводили трансфузию тромбоцитарной массы, чаще встречались тяжелые нежелательные явления, в том числе распространение ВМК или пневмонии и инфекции мочевыводящих путей [14]. Другой ретроспективный анализ показал, что у пациентов с нетравматическим ВМК, которым переливали тромбоцитарную массу, был более высокий риск хирургического вмешательства, инвалидности и смерти (тут так же была исправлена ошибка авторов, которые указали на «более высокую вероятность снижения риска», что противоречит данным исходного исследования. — Прим. ред.) [15]. Наоборот, в небольшом обсервационном исследовании переливание тромбоцитарной массы в течение 12 часов после появления симптомов у пациентов с ВМК было связано с уменьшением объема гематомы и более низкой степенью инвалидности через три месяца [16]. Наконец, большой ретроспективный анализ показал, что пациенты с ЧМТ, которым переливали тромбоцитарную массу, имели статистически значимо более низкую частоту прогрессирования ВМК (т.е. увеличение объема гематомы и появление новых ВМК на КТ), меньшую частоту нейрохирургических вмешательств и меньшие шансы быть выписанными в учреждение квалифицированного сестринского ухода [17].
2.1.3. Транексамовая и аминокапроновая кислота
Транексамовая (ТК) и аминокапроновая кислота (АКК) действуют как средства антифибринолитической терапии, присоединяясь к лизин-связывающему участку плазминогена и стабилизируя предварительно сформированную фибриновую сеть, что предотвращает превращение плазминогена в плазмин (таблица 2) [18]. В двух крупных проспективных исследованиях оценивали реверсию антиагрегантной терапии у кардиохирургических пациентов с применением ТК (болюсная доза с последующей поддерживающей дозой) [19, 20]. Доза назначалась независимо от веса пациента: в первом исследовании 1 г ТК вводили в/в болюсно, затем 200 мг/ч в виде непрерывной внутривенной инфузии, во втором исследовании — однократно в/в болюсно 2 г соответственно [19, 20]. В первом исследовании сообщалось, что пациенты в группе ТК значительно реже получали эритроцитарную массу [19]. Во втором исследовании не изучались какие-либо клинические исходы; однако сообщалось о статистически значимом увеличении АДФ-индуцированной агрегации тромбоцитов у пациентов, получавших ТК [20]. И наоборот, в трех других исследованиях доза ТК рассчитывалась на основе массы тела при отмене антитромбоцитарной терапии у пациентов перед кардиохирургическими вмешательствами. Назначались: в первом исследовании — 10 мг/кг в/в болюсно и поддерживающая доза 10 мг/кг, во втором — однократно 10 мг/кг в/в болюсно, а в третьем исследовании — однократно 30 мг/кг в/в болюсно [21–23]. Во всех трех исследованиях сообщалось о статистически значимом снижении объема кровопотери при использовании транексамовой кислоты [21–23]. Польза аминокапроновой кислоты для реверсии антитромбоцитарной терапии отмечается в очень ограниченном наборе данных. Небольшое проспективное исследование, напротив, показало восьмикратное увеличение частоты тромбоза глубоких вен при ее введении (в данном исследовании частота повторных кровотечений снизилась с 11,4 % до 2,7 % в группе аминокапроновой кислоты — прим. ред.) [24]. Среди пациентов, получавших аминокапроновую кислоту, было обнаружено статистически незначимое снижение летальности от кровотечения [24].
Читать также: гемостатические средств
2.2. Варфарин
Прекращение приема варфарина в качестве единственной стратегии может быть достаточным у бессимптомных пациентов с повышенным МНО и низким геморрагическим риском [25]. Если требуется фармакологическое вмешательство, можно использовать несколько агентов, включая витамин К, концентраты протромбинового комплекса и свежезамороженную плазму (СЗП) [25].
Читайте также: Антикоагулянты непрямого действия: варфарин
2.2.1. Витамин К (фитонадион, филлохинон)
Экзогенный витамин К может продолжать восстанавливаться и превращаться в активную форму (КН2), что приводит к функционированию факторов свертывания крови, несмотря на недавнее введение варфарина (дозы приведены в таблице 2) [25]. При применении витамина К сообщалось об анафилактических реакциях и временной резистентности к варфарину [25]. Витамин К, введенный внутривенно и перорально, через 24 часа оказывает сходное влияние на МНО. Однако внутривенное введение витамина К вызывает более быстрое снижение МНО, чем при пероральном приеме [26]. Хотя внутривенное введение быстрее снижало МНО, у всех пациентов значение МНО достигало более 4 через 4 ч как после внутривенного, так и после перорального введения витамина К [26]. В другом исследовании были получены аналогичные результаты, поскольку только у 50 % пациентов МНО было менее 2 через 24 ч, когда витамин К вводили внутривенно в качестве монотерапии [27]. Таким образом, если требуется немедленная коррекция коагулопатии, должна проводиться комбинированная терапия. Отсутствие тромбоэмболического риска после введения витамина К делает его безопасным вариантом, особенно в случае, если пациент стабилен [25].
2.2.2. Концентраты протромбинового комплекса (КПК)
Концентраты протромбинового комплекса (КПК) содержат факторы свертывания крови, которые выделяют из плазмы [5]. Эти факторы свертывания в 25 раз более концентрированы по сравнению с их уровнем в крови [5]. Доза концентрата определяется в зависимости от показателей активности факторов, входящих в концентрат [25]. КПК можно дозировать двумя способами: применяя постоянную дозу или в зависимости от МНО, как показано в таблице 2 [25]. Клинический гемостатический эффект был обнаружен у 40 из 44 (93 %) пациентов, когда КПК дозировали на основе МНО в дополнение к витамину К [28]. При этом нормальные (или близкие к нормальным) концентрации всех четырех факторов свертывания крови (IX, II, VII и X) сохранялись на протяжении 48-часового периода наблюдения, а тромбоэмболические осложнения были выявлены только у двух (4,5 %) пациентов [28]. Другое исследование, в котором использовалось дозирование, основанное на МНО, показало, что у пациентов, получавших КПК, было статистически значимое снижение МНО после терапии (2,3 по сравнению с 1,4) [29]. Два рандомизированных клинических испытания, сравнивающих КПК в комбинации с витамином К со свежезамороженной плазмой (СЗП), показали, что комбинированная терапия приводит к статистически значимому гемостазу и быстрому снижению МНО [30, 31]. Применение КПК было связано с риском тромбоза и гепарин-индуцированной тромбоцитопении [5]. По сравнению с СЗП, КПК применяется в уменьшенном разведенном объеме для введения (примерно 20 мл по сравнению с 30 мл/кг СЗП) и с более низкой вероятностью вызывает гиперволемию, поскольку он вводится в течение 15–30 мин. Кроме того, КПК, в отличие от СЗП, не требует времени для размораживания [5, 25].
2.2.3. Свежезамороженная плазма (СЗП)
СЗП содержит все факторы свертывания крови, включая факторы II, VII, IX и X, в разбавленной неактивной форме, а также фибриноген и тромбоциты [25]. Благодаря своей доступности СЗП как альтернатива КПК является разумной заменой факторов свертывания крови в случае угрожающего для жизни кровотечения. Однако использование СЗП сопряжено с риском инфекций и гиперволемии (1 единица СЗП имеет объем 250 мл) [25]. Таким образом, у пациентов с опасным для жизни кровотечением и сопутствующим применением варфарина КПК может быть предпочтительнее СЗП. Крупное клиническое исследование показало, что у 12 пациентов, получавших СЗП, значения МНО отклонялись от нормы, в то время как у 28 из 29 пациентов, получавших КПК, были достигнуты целевые значения МНО [32]. Сходные результаты были получены у пациентов, перенесших операцию в условиях искусственного кровообращения и другие кардиохирургические вмешательства [33].
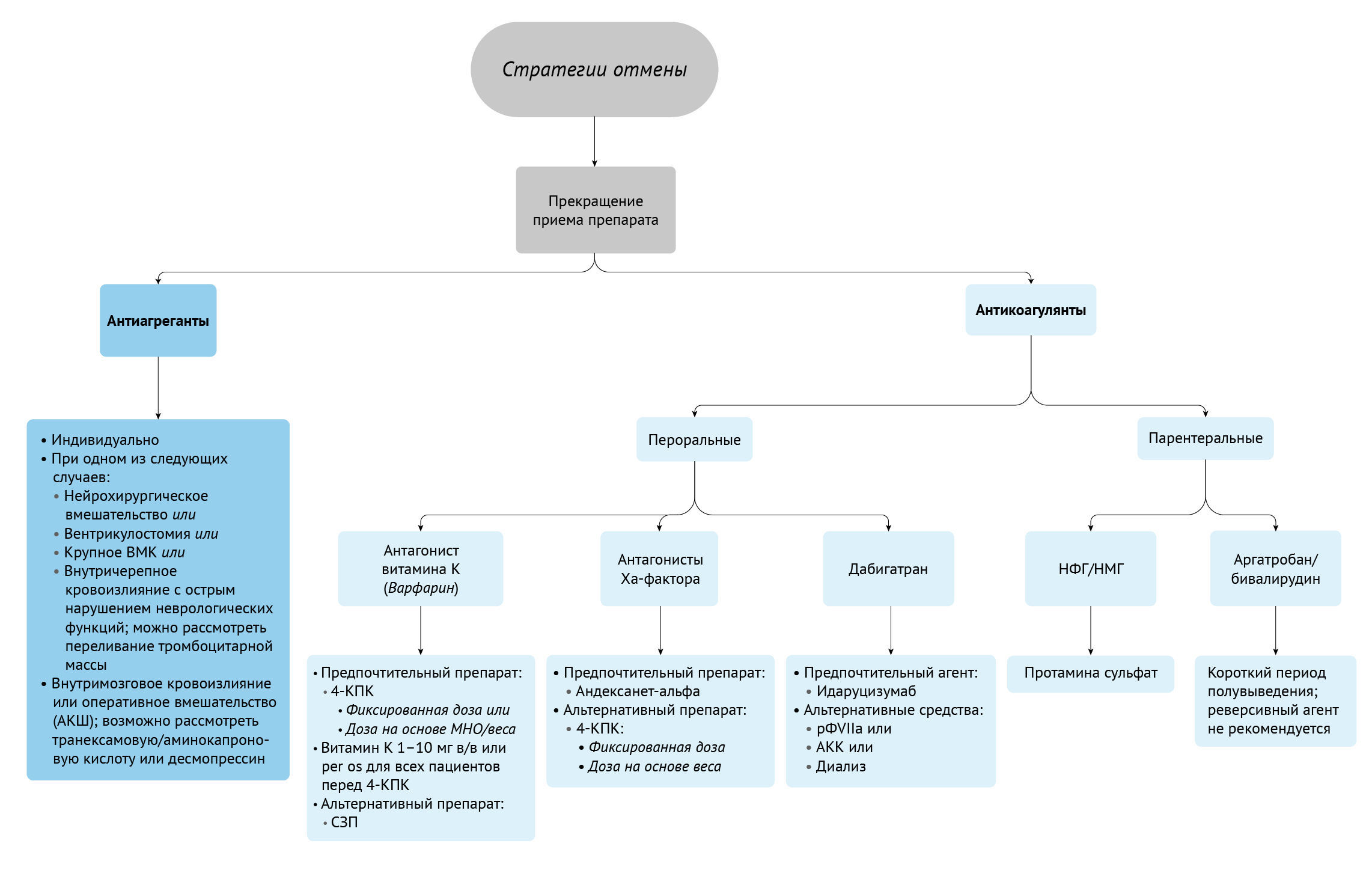
Рисунок 1 | Стратегии отмены различных пероральных и парентеральных антикоагулянтов и антиагрегантовВМК — внутримозговое кровоизлияние;
АКШ — аорто-коронарное шунтирование;
4Ф-КПК — концентрат четырехфакторного протромбинового комплекса;
МНО — международное нормализованное отношение;
В/в — внутривенно; per os — перорально;
СЗП — свежезамороженная плазма;
рФVIIa — рекомбинантный фактор VIIa;
АКК — антиингибиторный коагулянтный комплекс;
НФГ — нефракционированный гепарин;
НМГ — низкомолекулярный гепарин.
2.3. Прямые пероральные антикоагулянты (ППАК)
Прекращение антикоагулянтной терапии в качестве начального шага следует проводить после подтверждения факта кровотечения. Для отмены действия ППАК широко применяются концентраты протромбинового комплекса, а за рубежом — андексанет-альфа [34].
2.3.1. Инактивированный рекомбинантный Ха фактор свертывания (андексанет-альфа)
Андексанет-альфа представляет собой рекомбинантный модифицированный фактор Ха человека, который конкурентно и специфически связывается с антагонистами фактора Ха, в конечном итоге восстанавливая активность фактора Ха и соответственно устраняя антикоагулянтный эффект [34]. Андексанет-альфа одобрен в США для реверсии антикоагулянтной терапии апиксабаном и ривароксабаном при угрожающих жизни или неконтролируемых крупных кровотечениях (таблица 2) [34]. Наиболее распространенные побочные эффекты андексанета-альфа включают приливы, пирексию, тромбоэмболию, инфаркт миокарда и ишемический инсульт [34]. Одобрение андексанета-альфа основано на результатах двух крупных рандомизированных клинических исследований, ANNEXA-A и ANNEXA-R [35]. Всем здоровым добровольцам вводили 5 мг апиксабана два раза в день (ANNEXA-А) или 20 мг ривароксабана один раз в день (ANNEXA-R). Андексанет-альфа снижал активность антагониста фактора Ха в течение 2–5 мин на 94 % и 92 % после внутривенного болюсного введения ANNEXA-A и ANNEXA-R соответственно [35]. Через четыре часа после введения апиксабана и ривароксабана было выявлено восстановление уровня активного препарата в крови [35]. ANNEXA-4 включало пациентов, получавших апиксабан, ривароксабан или НМГ в течение предшествующих 18 часов [36]. В этом исследовании отличный или хороший гемостаз был выявлен у 204 из 249 (82 %) пациентов в этой когорте, при этом летальный исход наступил у 49 (20 %) пациентов через 30 дней, а тромботические явления были выявлены у 34 (14 %) пациентов [36].
2.3.2. Концентраты протромбинового комплекса
На основании рекомендаций руководств была оценена возможность применения концентратов протромбинового комплекса для отмены действия прямых пероральных антикоагулянтов; многочисленные исследования продемонстрировали их потенциальную роль в качестве стратегии реверсии для ППАК [37–39]. В частности, четырехфакторный КПК (содержит II, VII, IX и X факторы) исследовался в качестве средства для реверсии терапии ривароксабаном/апиксабаном с различными стратегиями дозирования и применением подходов с фиксированной дозой и дозировкой на основе массы тела [37–39]. Медианная доза, применяемая в таких исследованиях, находилась в диапазоне 25–50 ед/кг, а частота тромбоэмболических осложнений составляла 2–11 % [37–39].
2.4. Нефракционированный гепарин (НФГ) и низкомолекулярный гепарин (НМГ)
Протамина сульфат полностью устраняет действие НФГ, однако он отменяет только 50 % от терапевтического эффекта НМГ [40]. Для нейтрализации 100 единиц гепарина требуется приблизительно 1 мг протамина сульфата [40]. Доза протамина сульфата варьируется в зависимости от выбранного пути введения гепарина, а также от времени, прошедшего с момента последнего введения [40, 41]. Его рекомендуется вводить в дозе 1 мг на 100 единиц в/в НФГ при применении в течение 2–4 ч после последнего воздействия НФГ с максимальной дозой протамина 50 мг [40, 41]. Когда для реверсии НМГ используется протамин, доза обычно составляет 1 мг протамина на 1 мг НМГ, если с последнего введения НМГ прошло менее восьми часов, и 0,5 мг протамина на 1 мг НМГ — если более восьми часов [40]. Обычно сообщают о таких побочных эффектах протамина, как анафилактические реакции, которые могут привести к гемодинамической нестабильности (шоку) [41]. Важно избегать передозировки протамина, так как это может вызывать вторичную коагулопатию с последующим нарушением функции тромбоцитов или ингибированием факторов крови [40, 41]. Пациенты с подтвержденной аллергией на рыбные продукты, препараты из группы НПХ-инсулинов и те, кто перенес вазэктомию, не должны получать протамин [40, 41]. Основываясь на ограниченных клинических данных, можно утверждать, что рФVIIa и активированный КПК способны частично отменять действие фондапаринукса [42–44].
2.5. Прямые ингибиторы тромбина (аргатробан, бивалирудин и дабигатран)
Идаруцизумаб одобрен для реверсии терапии дабигатраном [45]. В исследовании REVEREAD оценивалась эффективность идаруцизумаба при назначении 5 мг 503 пациентам с кровотечением, получавшим дабигатран [45]. Показатели тестов на свертываемость крови (тест с экарином, измерение протромбинового времени) выявили снижение на 50 % по сравнению с исходным уровнем. В общей сложности у 68 % (134/203) пациентов кровотечение прекратилось в течение 24 часов — медианное время составило 2,5 часа [45]. Для бивалирудина и аргатробана специфического реверсивного агента нет [43]. Тем не менее, одно исследование ex vivo выявило, что рекомбинантный фактор VIIa значимо снижает протромбиновое время по сравнению с плацебо; антикоагулянтный эффект измеряли с помощью тромбоэластографии [43]. В другом исследовании изучалась реверсивная способность идаруцизумаба в условиях терапии бивалирудином, и оказалось, что идаруцизумаб обладает высокой специфичностью исключительно к дабигатрану и, следовательно, не может устранять действие бивалирудина [46].
Таблица 2 | Стратегии дозирования реверсивных агентов
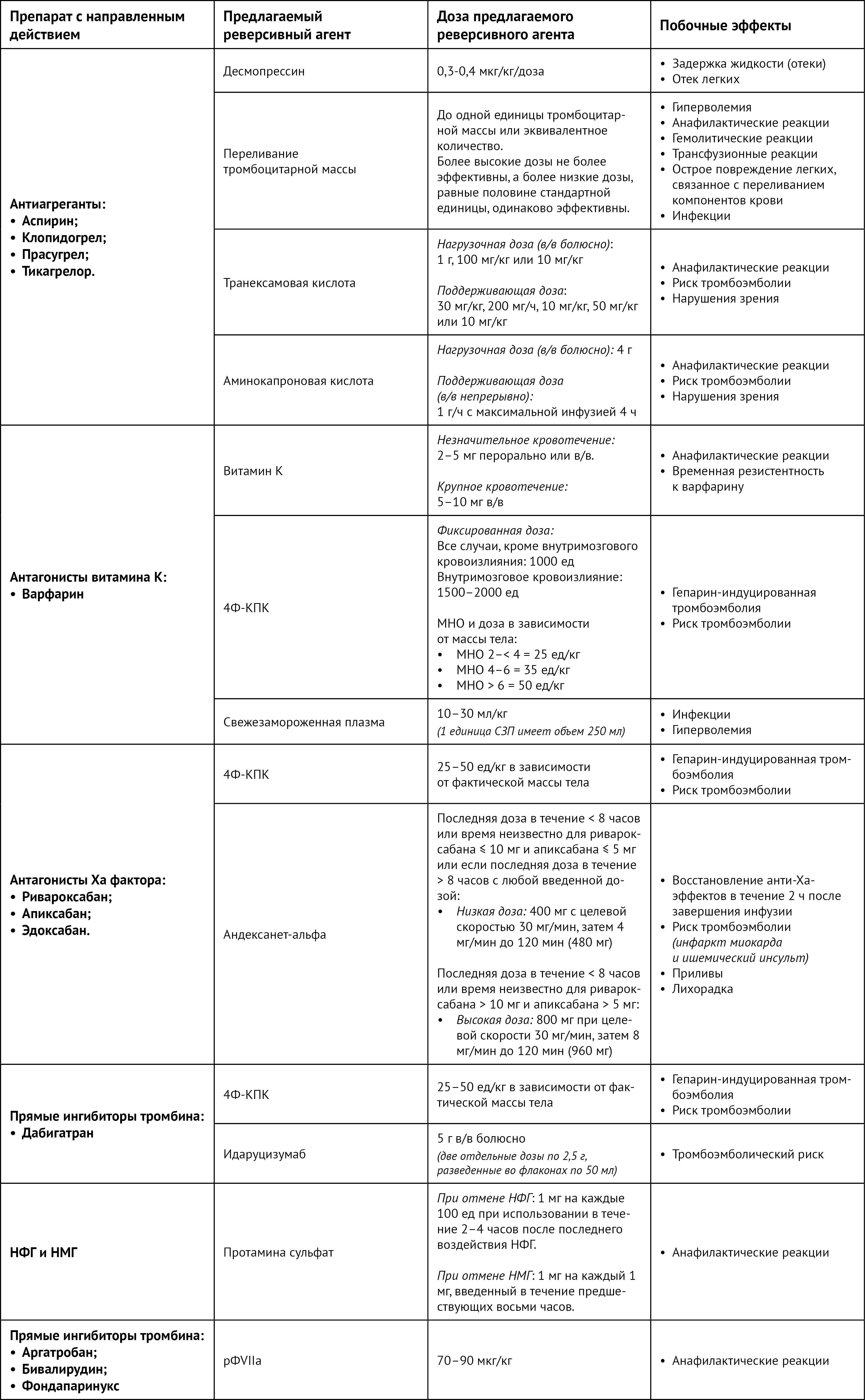
4Ф-КПК — концентраты четырехфакторного протромбинового комплекса;
ГИТ — гепарин-индуцированная тромбоцитопения;
НФГ — нефракционированный гепарин; НМГ — низкомолекулярный гепарин;
рФVIIa — рекомбинантный фактор VIIa.
3. Будущие направления
Кровотечения остаются основным осложнением пероральной антитромботической терапии. Учитывая повышенную летальность от опасных для жизни кровотечений, связанных с терапией антитромботическими препаратами, и растущее число принимающих их пациентов, в настоящее время разрабатываются несколько новых реверсивных агентов. Цирапарантаг (арипазин/PER-997) представляет собой небольшой водорастворимый синтетический катион, который связывается с ППАК, НФГ и НМГ с помощью нековалентных водородных связей и электростатических взаимодействий [47]. На крысах показано, что в течение 30 минут после введения PER-977 уменьшает кровотечение после передозировки ривароксабана, апиксабана, эдоксабана и дабигатрана [47]. Болюсное в/в введение 300 мг PER-977 добровольцам, которые либо не получали, либо предварительно получали 60 мг эдоксабана в рамках исследования фармакокинетики/фармакодинамики с повышением дозы (100–300 мг), восстановило нормальное время свертывания цельной крови за 10–30 минут, и эффект сохранялся в течение более 24 часов [48]. Ожидается, что в ближайшем будущем два крупных исследования (NCT02207257 и NCT01826266) позволят лучше изучить дозирование, эффективность и безопасность PER-977.
4. Заключение
Применение антикоагулянтов и антиагрегантных препаратов для лечения и профилактики ряда сердечно-сосудистых заболеваний становится все более широким. Основным побочным эффектом этих препаратов остается возникновение кровотечений. В случае жизнеугрожающего кровотечения в условиях неотложной помощи показана их немедленная отмена. Стратегии и препараты для такой отмены в дальнейшем будут продолжать развиваться.





