РНК-зависимая РНК-полимераза (RdRp), также известная как nsp12, является ключевым компонентом в синтезе вирусной рибонуклеиновой кислоты (РНК) и считается основной мишенью нуклеозидных ингибиторов обратной транскриптазы (НИОТ). В недавней публикации Кобинджера и соавт. сообщается об уникальных молекулярных механизмах молнупиравира относительно индукции мутаций РНК при репликации SARS-CoV-2 посредством RdRp [1]. Доказано, что молнупиравир обладает значительным потенциалом для профилактики и лечения новой коронавирусной инфекции 2019 года (COVID-19) в качестве перорального противовирусного средства широкого спектра действия, относящегося к группе НИОТ (рис. 1). 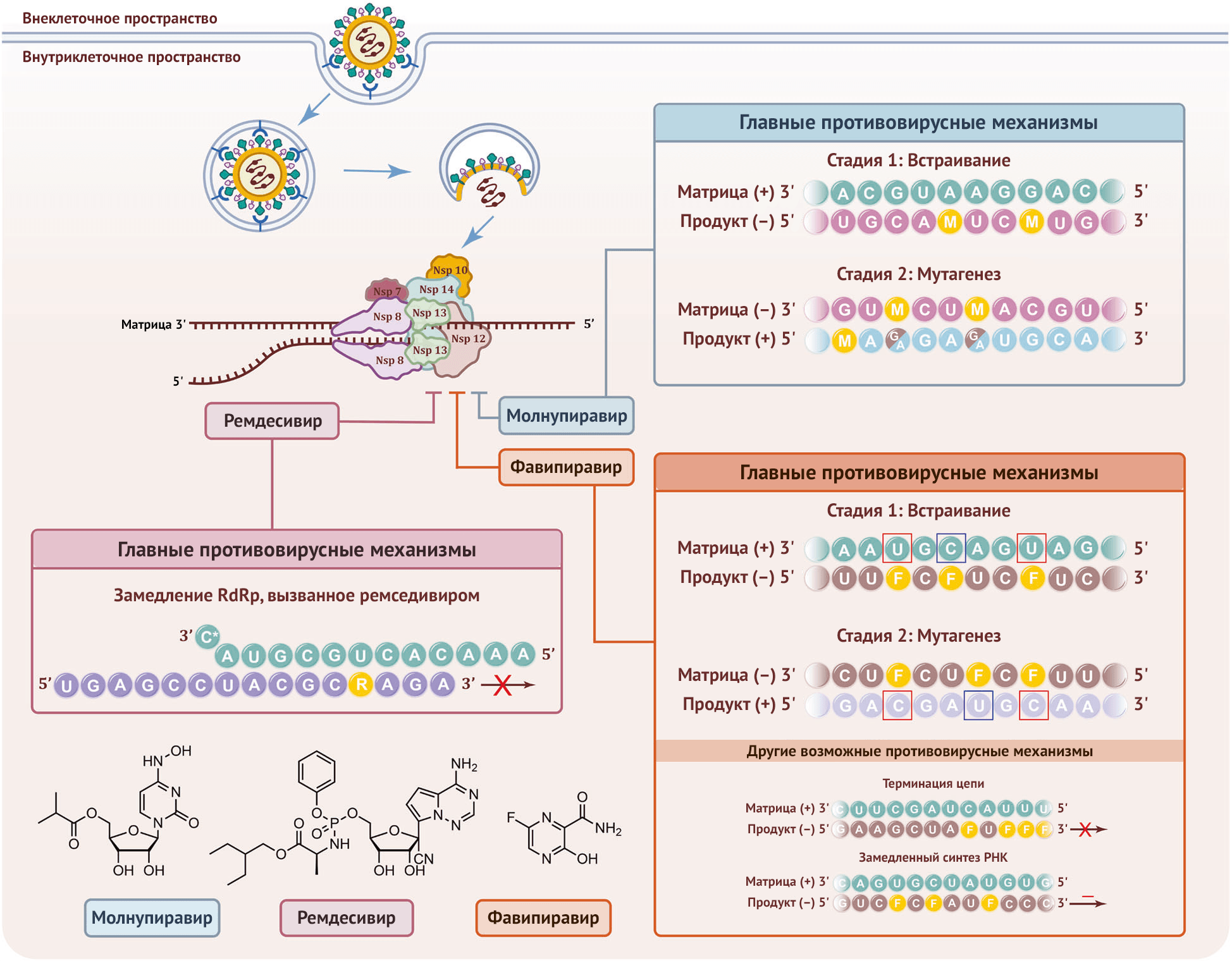 Рисунок 1 | Механизмы действия молнупиравира, ремседивира и фавипиравира против SARS-CoV-2
Рисунок 1 | Механизмы действия молнупиравира, ремседивира и фавипиравира против SARS-CoV-2
Вирус связывается с рецептором АПФ2 клетки-хозяина, а затем интернализуется. Мембрана вакуоли объединяется с вирусной оболочкой и высвобождает его геном в цитоплазму клетки-хозяина. Геном вируса транслируется и продуцирует репликазо-транскриптазный комплекс, который содержит 16 NSP. Один из NSP, неструктурный белок 12 (Nsp12), выполняет функцию RdRp и вместе с другими репликазами может запускать репликацию вирусного генома. Молнупиравир, ремдесивир и фавипиравир способны подавлять функцию RdRp. Были представлены следующие механизмы: (1) Молнупиравир индуцирует мутагенез РНК в два этапа: нуклеотиды M включаются RdRp в отрицательно-цепочечный геном (–) во время копирования положительно-цепочечной матрицы (+) вместо C или U. Полученные отрицательно-цепочечные РНК, содержащие нуклеотиды M, впоследствии могут быть использованы в качестве матрицы для получения мутагенизированной положительной цепи. Предполагается, что РНК-продукты мутируют и приводят к образованию неактивных вирусов. Показана РНК со случайной последовательностью, причем М и мутировавшие остатки обозначены желтыми и коричневыми буквами соответственно. (2) Ремдесивир действует как аналог нуклеозида и может быть включен в растущую цепочку РНК с помощью RdRp. Показана РНК со случайной последовательностью, где R обозначен желтым цветом. (3) Фавипиравир, аналог пуринов нуклеиновых кислот, может имитировать пурины G и A для образования неканонических пар оснований, а также, как было обнаружено, действует против коронавируса с помощью других механизмов, включая необязательный обрыв цепи и замедление синтеза РНК. Показана РНК со случайной последовательностью, где F обозначен желтым цветом. Мутировавшие остатки помечены синими или красными прямоугольниками. Вспышка пандемии COVID-19 побудила исследователей и врачей-клиницистов изменить назначение существующих противовирусных НИОТ для борьбы с SARS-CoV-2. Поскольку RdRp играет ключевую роль в репликации и транскрипции вируса, НИОТ широкого спектра действия использовались для воздействия на вышеуказанный фермент, который в свою очередь распознает и включает активную форму НИОТ в растущую цепочку РНК, тем самым прекращая ее удлинение. Однако 3’–5′ экзонуклеаза (ExoN) SARS-CoV-2 может ограничивать противовирусные эффекты НИОТ, встраивающихся в синтезируемую РНК [3]. На сегодняшний день некоторые НИОТ, которые могут избежать проверки ExoN, продемонстрировали мощную антикоронавирусную активность в доклинических исследованиях и прошли клинические испытания для лечения COVID-19, благодаря чему молнупиравир был одобрен в Австралии 9 августа 2021 года. Молнупиравир представляет собой неактивную форму лекарства на основе изопропилового эфира β-D-N4-гидроксицитидина (NHC), первого мутагенного НИОТ, который, как было показано, позволяет обойти проверку ExoN и который описан как мощный ингибитор вируса гепатита мышей (MHV), респираторно-синцитиального вируса (RSV), вирусов гриппа А и В и коронавируса ближневосточного респираторного синдрома (MERS-CoV). Хотя молнупиравир может подавлять репликацию SARS-CoV-2 в легочной ткани человека [1], основные механизмы действия препарата еще не выяснены. В данной статье обсуждаются результаты недавнего систематического биохимического анализа, в котором был предложен двухэтапный механизм мутагенеза РНК коронавируса, индуцированного молнупиравиром [2]. Анализ удлинения РНК был впервые проведен с использованием рекомбинантной RdRp SARS-CoV-2 и четырех синтетических дуплексов РНК «матрица — продукт». Включение трифосфата NHC (MTP) с помощью RdRp SARS-CoV-2 количественно определяли с использованием флуоресцентной метки на 5′-конце цепочки РНК-продукта. Результаты показали, что RdRp может легко встраивать монофосфат NHC (M) вместо цитидинов цитозина (C) или урацила (U), и он способен образовывать пары оснований c гуанином (G) или аденином (A), что соответствует факту, наблюдавшемуся ранее в MERS-CoV. Это сходно с эффектом фавипиравира, который индуцирует мутагенез РНК SARS-CoV-2 [1]. Тем не менее, вирусная RdRp включает М в цепочку РНК менее эффективно, чем правильные нуклеотиды C или U. После встраивания NHC RdRp смогла удлинить растущую нить РНК на 4 или 11 нуклеотидов до конца. Таким образом, молнупиравир демонстрирует совершенно иной механизм, чем НИОТ типа ремседивира, обрывающие цепь [4]. Чтобы уточнить роль М-содержащей РНК на следующем этапе синтеза, РНК, включающая М-нуклеотид в матричном положении +1, была получена путем последовательного твердофазного синтеза с использованием в качестве субстрата N4-гидрокси-N4-бензоилцитидина 3′-(2-цианоэтил)диизопропилфосфорамидита. Чистоту синтезированного олигонуклеотида РНК оценивали с помощью денатурирующей высокоэффективной жидкостной хроматографии и масс-спектрометрии с ионизацией электрораспылением высокого разрешения. Остаток M в положении +1 эффективно направлял включение G или A в формирующуюся РНК, образуя пары оснований M-GTP или M-АТP в активном сайте RdRp. Эксперименты по термическому плавлению показали, что стабильность РНК-дуплексов, содержащих пары оснований M–G или M–A, была немного ниже, чем у дуплексов, содержащих C–G, что может объяснить избегание механизма проверки. Результаты показывают, что при использовании RdRp М-содержащей РНК в качестве матрицы фермент может впоследствии вcтроить правильный или неправильный нуклеотид в растущую цепочку РНК, что приведет к мутагенезу. Этот процесс известен как катастрофа ошибок [1]. Для выяснения механизма индуцированного NHC мутагенеза РНК были получены мутагенные комплексы RdRp–РНК, которые были проанализированы с помощью криоэлектронной микроскопии [2]. В частности, M-содержащие комплексы RdRp–РНК с G или A на 3’–конце цепи были подготовлены для образования структур RdRp–РНК, содержащих пару оснований M–G или M–A в положении –1. Соответствующие структуры были определены с общим разрешением 3,3 или 3,2 Å, в то время как активный сайт был определен с разрешением ~ 2,9 Å, что позволяет охарактеризовать состояние после транслокации со свободным сайтом связывания нуклеозидтрифосфата (NTP) в положении +1. Конформации белка и нуклеиновой кислоты существенно не отличались между двумя структурами или от соответствующих конформаций в структурах RdRp, связанных с РНК дикого типа или содержащей ремдесивир. Моделирование пар оснований M–A или M–G в электронной плотности в положении –1 показало, что аминотаутомер NHC может имитировать C для образования водородной связи с G, в то время как иминотаутомер может имитировать U для образования водородной связи с A. В совокупности эти эксперименты предполагают двухэтапный механизм, в котором молнупиравир индуцирует мутагенез РНК SARS-CoV-2 путем образования стабильных пар оснований M–G и M–A в активном сайте RdRp. На данный момент ремдесивир, фавипиравир и молнупиравир являются единственными одобренными препаратами НИОТ для лечения COVID-19, и все они могут избежать проверяющей функции ExoN. В частности, встраивание ремдесивира позволяет добавить три нуклеотида и останавливает RdRp посредством конкурентного ингибирования, в то время как фавипиравир и молнупиравир участвуют в синтезе РНК, индуцируя мутагенез [4]. Молнупиравир имитирует цитидин C и U, тогда как фавипиравир имитирует пурины G и A, образуя неканонические пары оснований [3]. Было также обнаружено, что фавипиравир действует против коронавируса с помощью других механизмов, включая необязательный обрыв цепи и замедление синтеза РНК [3]. Основываясь на известной трехмерной структуре RdRp SARS-CoV-2 [5], исследования механизмов действия этих препаратов должны внести значительный вклад в открытие перспективных лекарств-кандидатов против SARS-CoV-2. Таким образом, механизм, выявленный в обсуждаемом в настоящее время исследовании группы Хебартнера и Крамера, может помочь объяснить и оптимизировать лекарства против нынешних и будущих пандемий коронавирусов. В то же время препараты, которые основаны на индукции мутаций РНК, могут оказывать генотоксическое действие: сообщалось, что в клетках млекопитающих происходит мутагенез, вызванный молнупиравиром; это указывает на возможность того, что молнупиравир и сходные препараты могут потерпеть неудачу из-за мутагенных эффектов [5], поэтому в предстоящих исследованиях следует оценить потенциальные долгосрочные генотоксические побочные эффекты молнупиравира, а также изучить клиническую эффективность мольнупиравира против COVID-19, особенно относительно новых штаммов — даже несмотря на то, что препарат доказал свою эффективность против нескольких вариантов in vivo.