Почему одни люди переносят COVID-19 в более тяжелой форме, чем другие? Возможно, такое различие может объясняться воздействием особенно высокой дозы вируса SARS-CoV-2, различиями в рационе, физической нагрузке или режиме сна. Хотя многие факторы влияют на то, как заболевают люди, по-видимому, ключевым фактором тяжести COVID-19 служит генетический, что является общей чертой инфицирования как в случае других вирусов человека, так и иных инфекционных агентов в целом [1]. Своей работой в этом выпуске Science Викенхаген с соавт. [2] демонстрируют, что предрасположенность к развитию тяжелой формы COVID-19 связана с однонуклеотидным полиморфизмом (ОНП) в человеческом гене фермента 2′-5′-олигоаденилатсинтетазы 1 (OAS1).
Авторы пришли к выводу, что SARS-CoV-2 должен подавляться опосредованными интерфероном противовирусными реакциями, которые представляют собой один из первых механизмов клеточной защиты, возникающих в ответ на вирусную инфекцию. Интерфероны — это группа цитокинов, запускающие транскрипцию большого количества генов, многие из которых кодируют белки, способные напрямую ингибировать вторгающийся вирус. Викенхаген с соавт. исследовали многие сотни этих предполагаемых противовирусных белков на предмет их способности подавлять развитие SARS-CoV-2 в культурах клеток и обнаружили, что OAS1 особенно эффективен против SARS-CoV-2.
OAS1 — это фермент, активирующийся в присутствии двухцепочечной РНК, которая находится в различных местах вдоль генома SARS-CoV-2 (представляющего собой одноцепочечную структуру) — в т.н. РНК-шпильках и других вторичных структурах. Активируясь, OAS1 катализирует полимеризацию аденозинтрифосфата (АТФ) в молекулу вторичного мессенджера — 2′-5′-олигоаденилата. Последний, в свою очередь, запускает переход рибонуклеазы L (РНКазы L) в ее активную форму для расщепления вирусной РНК, что приводит к эффективному подавлению репликации вируса [3]. Викенхаген с соавт. обнаружили, что OAS1 экспрессируется в тканях органов дыхательной системы здоровых людей и пациентов с COVID-19 и взаимодействует с той областью генома SARS-CoV-2, которая содержит двухцепочечную РНК в виде вторичных структур (см. рисунок).
). 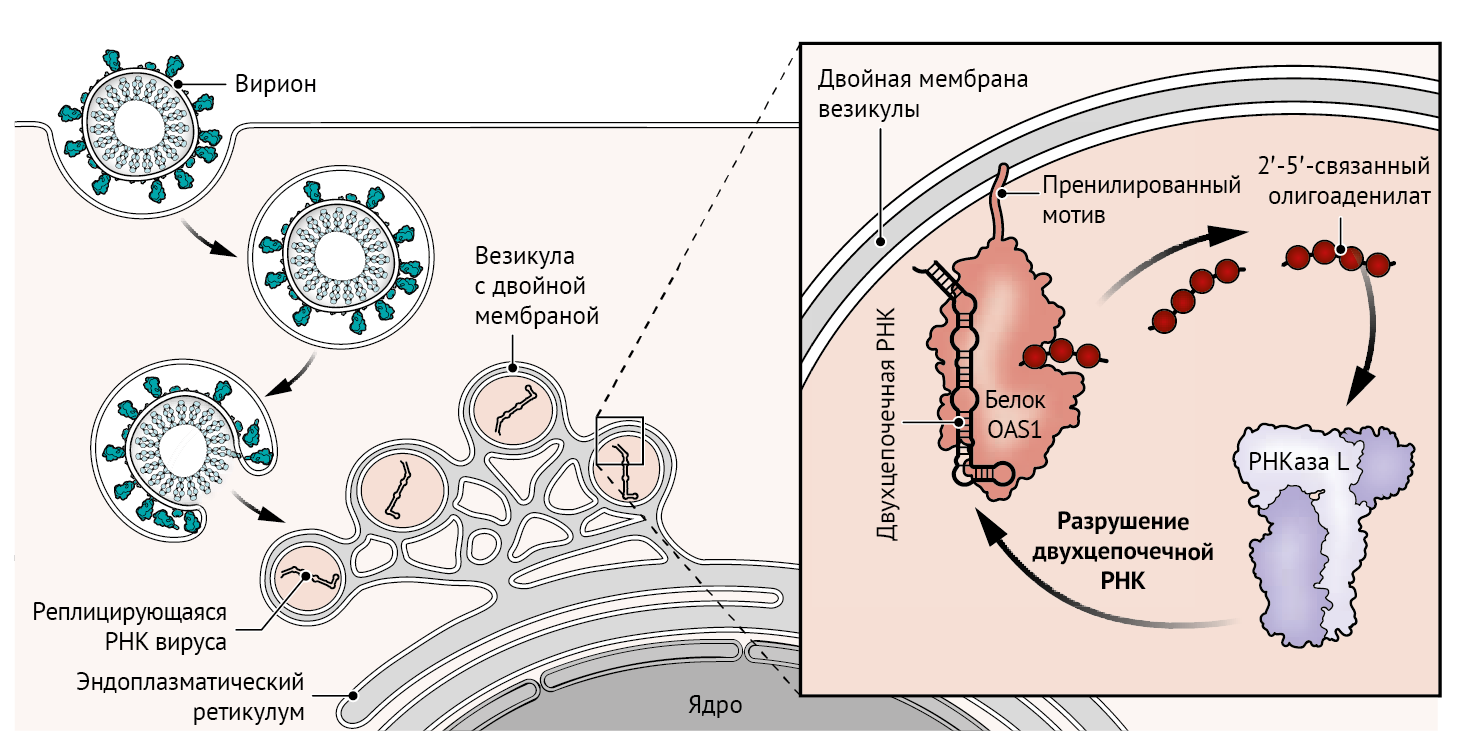 Рисунок 1 | Разрушая вирусную РНК
Рисунок 1 | Разрушая вирусную РНК
Внутри клетки-хозяина коронавирусы образуют везикулы с двойной мембраной для репликации своего РНК-генома. Закрепляясь на мембране, фермент 2′-5′-олигоаденилатсинтетаза 1 (OAS1) детектирует вторичную структуру двухцепочечной РНК и активирует рибонуклеазу L (РНКазу L), которая разрушает вирусную РНК. В изоформе p42 белка OAS1 отсутствует пренилированная последовательность аминокислот, поэтому она не связывается с мембраной и активации РНКазы L не происходит, что приводит к неограниченной репликации вируса и коррелирует с развитием тяжелой формы COVID-19.
OAS1 существует у человека преимущественно в виде двух изоформ — более длинной (p46) и более короткой (p42). То, какая изоформа будет экспрессироваться, определяется генетической изменчивостью. р46 экспрессируется у людей, у которых обнаруживается однонуклеотидный полиморфизм, ведущий к альтернативному сплайсингу информационной РНК (мРНК) гена OAS1. Это приводит к использованию концевого экзона, который не задействуется для трансляции p42. Таким образом, карбоксильный конец изоформы p46 белка OAS1 содержит отдельный мотив из четырех аминокислот, который формирует сайт пренилирования. Пренилирование — это посттрансляционная модификация, направляющая белки на мембраны. В экспериментах на клеточных культурах Викенхаген с соавт. продемонстрировали, что только изоформа p46 белка OAS1 может ингибировать SARS-CoV-2, а p42 такой способностью не обладает. Однако, когда методами генной инженерии сайт пренилирования p46 был превращен в p42, такой химерный белок p42 оказался способен ингибировать SARS-CoV-2, что еще больше подчеркивает роль изоформ OAS1, специфичных для мембран.
Почему ученые так сфокусировались на мембранах? SARS-CoV-2, как и все коронавирусы, использует клеточные мембраны в эндоплазматическом ретикулуме для образования везикул с двойной мембраной, в которых вирус может реплицировать свой геном. Таким образом, связанная с мембраной изоформа p46 белка OAS1 может специфически активироваться РНК-вирусами, которые образуют мембраносвязанные везикулы для репликации. Действительно, активность кардиовируса А (не относится к семейству коронавирусов), который также способен образовывать везикулярные мембранные структуры, ингибировалась OAS1. Напротив, активность других респираторных РНК-вирусов, таких как вирус парагриппа человека 3-го типа и респираторно-синцитиальный вирус человека, которые не используют мембраносвязанные везикулы для репликации, не подавлялась изоформой p46.
Викенхаген с соавт. исследовали группу из 499 пациентов с COVID-19, госпитализированных в Великобритании. У всех пациентов экспрессировался белок OAS1, однако у 42,5 % из них не было экспрессии противовирусной изоформы p46. Согласно статистике, эти пациенты оказались более склонны к развитию тяжелой формы COVID-19 (попадали в отделение интенсивной терапии). Это позволяет предположить, что OAS1 является важным противовирусным фактором, контролирующим течение инфекции SARS-CoV-2, а неспособность этого белка активировать РНКазу L ведет к длительному и тяжелому течению заболевания, хотя, вероятно, этому способствуют и иные факторы. Также авторы исследовали животных — известных носителей различных коронавирусов. Они обнаружили пренилирование белков OAS1 у мышей, коров и верблюдов. Примечательно, что у подковоносых летучих мышей, которые рассматриваются как потенциальный природный резервуар для коронавирусов SARS [4], повторяющиеся последовательности пренилированных аминокислот в белках OAS1 отсутствуют вследствие геномных изменений, способствовавших устранению критически важного мотива из четырех аминокислот. Белок OAS1 подковоносых летучих мышей (Rhinolophus ferrumequinum) не подавлял развитие инфекции SARS-CoV-2 в культуре клеток. И наоборот, у черной летучей лисицы (Pteropus alecto) — рукокрылого из семейства крыланов, являющейся резервуаром вирусов Нипах и Хендра, которые также могут заражать людей, — обнаруживаются пренилированные белки OAS1, которые способны ингибировать SARS-CoV-2. Эти результаты указывают, что подковоносы могут быть генетически и эволюционно адаптированы к тому, чтобы быть оптимальными резервуарными хозяевами для определенных коронавирусов, таких как SARS-CoV-2.
Согласно результатам других исследований, наличие изоформы p46 белка OAS1, который находится в геномном локусе, унаследованном от неандертальцев [5–7], коррелирует с возможностью организма противостоять развитию тяжелой формы COVID-19 в различных популяциях [8, 9]. Эти результаты отражают данные предыдущих работ, согласно которым различные исходы инфекций вируса Западного Нила [10] и вируса гепатита С [11] (оба возбудителя также используют мембранные везикулы для своей репликации) также связаны с генетической изменчивостью в локусе OAS1 человека. Результаты другого функционального исследования дополняют выводы Викенхагена с соавт.: пренилированный белок OAS1 способен ингибировать несколько вирусов, в том числе и SARS-CoV-2, а также связан с резистентностью организма к развитию тяжелой формы COVID-19 [12].
Увеличивается количество данных, формирующих критическое понимание того, как генетическая изменчивость человека влияет на исход инфекционных заболеваний, таких как COVID-19. Помимо белка OAS1, с тяжелой формой COVID-19 связана генетическая изменчивость другого вирусного РНК-сенсора, Toll-подобного рецептора 7 (TLR7) [13–15]. Его влияние, по-видимому, прослеживается исключительно у мужчин, поскольку ген TLR7 находится в X-хромосоме, поэтому наследственные вредоносные мутации в TLR7 приводят к тому, что иммунокомпетентные клетки не могут производить адекватное количество интерферона, что коррелирует с более тяжелым течением COVID-19. Понимание взаимодействия клеточных факторов макроорганизма, которые контролируют развитие вируса SARS-CoV-2 внутри клеток, быстро возрастает. Несомненно, эти результаты откроют новые возможности для формирования противовирусного иммунитета к SARS-CoV-2 и для разработки стратегий лечения и профилактики тяжелой формы COVID-19.